Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Con óvulos de
En este artículo
Resumen
Huevos de Schistosoma mansoni son potentes estimuladores del tipo T helper 2 (Th2) la respuesta inmune, característico de la infección por el parásito, el asma y la inflamación alérgica. Este protocolo utiliza S. mansoni de inyección de huevos para generar un recuento de CD4 Th2 citoquinas inducida por la respuesta inflamatoria en el pulmón, caracterizada por la formación de un granuloma pulmonar alrededor del huevo, la eosinofilia y la activación de los macrófagos alternativa.
Resumen
Parásitos Schistosoma son trematodos de la sangre que infecta a un estimado de 200 millones de personas en todo el mundo 1. En la infección crónica por Schistosoma, la patología severa, incluyendo la fibrosis hepática y esplenomegalia, es causada por la respuesta inmune a los huevos del parásito en lugar del propio parásito 2. Huevos de parásitos inducir una respuesta Th2 caracterizada por la producción de IL-4, IL-5 e IL-13, la activación alternativa de macrófagos y el reclutamiento de eosinófilos. A continuación, describimos la inyección de huevos de Schistosoma mansoni como un modelo para examinar los parásitos específicos de las respuestas de citocinas Th2 en el pulmón y los ganglios linfáticos de drenaje, la formación de granulomas pulmonares que rodean el huevo, y la inflamación de las vías respiratorias.
Tras la sensibilización intraperitoneal y desafío intravenosa, S. huevos mansoni son transportados a los pulmones a través de las arterias pulmonares donde están atrapadas dentro del parénquima pulmonarpor granulomas compuestos por linfocitos, eosinófilos y macrófagos activados alternativamente 3-6. Asociado con formación de granulomas, inflamación en los espacios bronco-alveolares, la expansión de los ganglios linfáticos de drenaje y activación de células T CD4 puede ser observado. A continuación le detallamos el protocolo para el aislamiento de huevos de Schistosoma mansoni a partir de hígados infectados (modificado a partir de 7), la sensibilización y desafiar los ratones, y la recuperación de los órganos (lavado broncoalveolar (LBA), pulmón y ganglios linfáticos de drenaje) para su análisis. También se incluyen histológica representativa y los datos inmunológicos y sugerencias para el análisis inmunológico adicional.
En general, este método proporciona un modelo in vivo para investigar helmintos inducidos por las respuestas inmunológicas en el pulmón, el cual es ampliamente aplicable al estudio de las enfermedades inflamatorias Th2, incluyendo la infección por helmintos, enfermedades fibróticas, la inflamación alérgica y el asma. Las ventajas de este modelo para el estudio de típicoe 2 inflamación en el pulmón incluyen la reproducibilidad de un potente respuesta Th2 inflamatoria en el pulmón y ganglios linfáticos de drenaje, la facilidad de evaluación de la inflamación mediante el examen histológico de los granulomas que rodean el óvulo, y la posibilidad de almacenamiento a largo plazo del parásito huevos.
Protocolo
1. Depuradora Schistosoma mansoni Huevos
- Infect ratones Swiss-Webster con cercarias de esquistosomas, que es la etapa infecciosa en el ciclo de vida del Schistosoma 8. Por otra parte, obtener ratones infectados con esquistosomas del NIAID Centro de Recursos de la esquistosomiasis ( http://www.schisto-resource.org/~~V ). Deja ratones para 6-7 semanas después de la infección, momento en el cual punto, los huevos están presentes en el hígado y puede ser recuperado como se describe a continuación (ver fig. 1).
- La eutanasia de los ratones con el CO 2, y mojar con el 70% de etanol. Coloca el ratón sobre la espalda. Use unas pinzas y tijeras romas para cortar la piel y el peritoneo subyacente. Impuestos Especiales en el hígado, que se encuentra por debajo de la caja torácica y el diafragma.
- Finamente picada hígados y añadir 20 ml por el hígado de la mezcla de digestión, compuesto de colagenasa / dispasa (0,5 mg / ml), penicilina (100 U / ml) y estreptomicina (100 ug / ml) en PBS. Ponga mixtoUre en un tubo Falcon de 50 ml y se incuba durante la noche en un agitador de 37 ° C.
- Centrifugar mezcla a 400 xg / 3 min / 20 ° C. Verter suavemente el exceso de líquido y el tubo de llenado con PBS. Se centrifuga de nuevo y repita el lavado con PBS. Tras la centrifugación pasado, volver a suspender el pellet en 25 ml de PBS.
- Cuele el precipitado resuspendido a través de un estándar de cocina metálico colador (utilice un émbolo de jeringa de 50 ml para triturar las piezas del hígado a través de en un vaso de precipitados de vidrio), seguido por hacer pasar la mezcla a través de un tamiz fino (utilizar 10 ml jeringa para empujar la mezcla a través del tamiz fino en un segundo vaso de vidrio).
- Ponga la mezcla colada en un tubo de 50 ml Falcon. Se centrifuga a 400 xg / 5 min / 20 ° C. Vierta cuidadosamente el sobrenadante sin perder de pellets. Resuspender el sedimento en 3 ml de PBS.
- Superposición mezclar suavemente sobre un Percoll 20%, 40 ml de gradiente 8 ml de Percoll y 32 ml de sacarosa 0,25 M (FW = 342,3 así 8,56 g sucrose/100 ml de H 2 0).
- Centrifugar 10 min / 800 ug / 20 ° C. Pipetear fuera unad descartar capa gelatinosa parte superior de las células del hígado. Retire del huevo de pellets en la parte inferior con una pipeta de transferencia y poner en un tubo Falcon de 15 ml.
- Lavado de pellets 3X en 10 ml de PBS / EDTA 1 mM / EGTA 1 mM utilizando la configuración de centrífuga: 3 min / 30 ug / 20 ° C. Resuspender en 500 l de PBS.
- Superposición mezcla en un nuevo Percoll 25%, 10 ml de gradiente (2,5 ml de Percoll y 7,5 ml de sacarosa 0,25 M) utilizando la configuración de centrífuga: 10 min / 800 ug / 20 ° C.
- Lavar 3X en 10 ml de PBS utilizando la configuración de centrífuga: 3 min / 30 ug / 20 ° C.
- En los últimos 10 ml de lavado, remover el 100 l para contar los huevos. Los huevos se depositan rápidamente, por lo que el tubo Falcon deben mezclarse bien antes de extraer la muestra. Diluir la muestra de 100 l con 900 l de PBS. 100 L de la mezcla debe ser contado en forma de gotas sobre un portaobjetos de microscopio utilizando un microscopio de disección (dilución 1:10). De grueso calibre puntas de pipeta debe ser utilizado.
- Resuspender los huevos a 50.000 huevos / ml en PBS. Los huevos se pueden almacenar durante varios meses a -80 ° C y se descongeló una o TWICe para su uso. Antes del uso, inspeccionar bajo un microscopio para asegurar que los huevos son todavía intacta (ver fig. 1).
2. La sensibilización por vía intraperitoneal con S. mansoni Huevos: Día 0
- Prepare los huevos a 5.000 individuos/100 l de PBS en un tubo de 5 ml snapcap. Para la inyección, estiman los huevos un 50% más de lo necesario.
- Coloque una aguja de calibre 23 y una 3/4inch jeringa de 1 ml con 100 l de suspensión de huevos por ratón. Huevos resolver, por lo que la aguja de carga con los huevos inmediatamente antes de usar.
- Roca jeringa de un lado a otro para mezclar los huevos antes de cada inyección, y se inyecta por vía intraperitoneal 100 L de la suspensión por ratón.
3. Retro-orbital desafío por vía intravenosa con S. mansoni Huevos: Día 14
- Prepare los huevos que el anterior en 5.000 individuos/100 l.
- Anestesie ratones en una cámara especializada con isoflurano (4%), o por vía intraperitoneal con xilacina (10 mg / kg) y ketamina (120 mg / kg). La profundidad de Anesthesia está determinada por pinzamiento de la almohadilla plantar y la garantía de respuesta física.
- Después de la carga de la jeringa de 1 ml y aguja de calibre 23 3/4inch con huevos, utilizar pinzas para doblar la aguja en un ángulo de 90 ° con el bisel hacia abajo en el ángulo. Asegúrese de que no hay burbujas.
- Coloque el ratón sobre un lado. Retirar la piel para que los ojos sobresalgan, e inyectar 100 l en los vasos detrás del globo ocular en un ángulo de 45 ° a la nariz.
- Retire la aguja y aplicar una ligera presión para controlar el sangrado.
Todos estos procedimientos deben llevarse a cabo con cuidado, y los ratones deben ser monitoreados hasta que se recuperen de la anestesia. Estos protocolos fueron aprobados por la Universidad de Pennsylvania Cuidado de Animales institucional y el empleo Comisión (IACUC).
4. Experimental de cosecha: Día 22
- La eutanasia de los ratones con el CO 2.
- Del ratón mojado con etanol al 70%, y el lugar en la parte posterior.
- Usando contundente FORCeps, sujete el abdomen del ratón y hacer una pequeña incisión en la piel. Retire con cuidado la piel con unas tijeras y exponer la caja torácica y el peritoneo.
- Cortar el peritoneo. Cortar la aorta abdominal para recuperar la sangre con una pipeta Pasteur. Guarde en el hielo.
- Mueva el hígado para exponer el diafragma. Con unas tijeras finas para cortar el diafragma. Con cuidado, corte abierto la caja torácica para exponer el tejido pulmonar.
- Recuperar los ganglios linfáticos que drenan el paratímico de pulmón con unas pinzas finas. Estos están metidos debajo de la caja torácica, a ambos lados del timo 9. Tienda en hielo en 1 ml de medios estériles (DMEM suplementado con inactivado por calor 10% de suero fetal de ternero, 100 U / ml de penicilina, 100 mg / mL de estreptomicina, 2 mM de L-glutamina, 50 mM 2-mercaptoetanol, todos disponibles de Invitrogen).
- Para recuperar el BAL, e inflar los pulmones para su análisis histológico, la intubación endotraqueal se debe realizar. Exponer la tráquea moviendo las glándulas salivales a un lado, y placing unas pinzas finas bajo la tráquea. Con unas tijeras finas, cortar un agujero en el centro de la tráquea e insertar el tubo en los pulmones. Asegure la tubería mediante la vinculación con hilo quirúrgico.
- Adjuntar PBS-lleno de jeringa de 1 ml al tubo e inflar los pulmones con 1 ml de PBS. Con cuidado, lavado recuperar BAL con la jeringa. Guarde en el hielo.
- Coloque 4% paraformaldehído (PFA) en PBS-jeringa precargada de 1 ml a los tubos y se inflan los pulmones.
- Retire el tubo y apriete el hilo quirúrgico para evitar la filtración de la PFA.
- Diseccionar cuidadosamente el tejido pulmonar y el lugar en un tubo de 50 ml con 5 ml Falcon 4% PFA.
5. Preparación de tejidos recuperados
- Suero: Después del almacenamiento en hielo durante h 30 min a 2 coagulación de la sangre, suero, se recupera de la sangre por centrifugación (13000 xg / 10 min / 4 ° C). El suero se almacenó a -20 ° C y puede ser utilizado para ELISA de citoquinas o S. mansoni huevos antígenos específicos de isotipo IgG ELISA 6, 10.
- Los nodos linfáticos: suspensiones de células individuales se preparan y los recuentos de células utilizado para evaluar la magnitud de la respuesta inmune. Para examinar la polarización de las células Th2, las células se vuelven a estimulado con S. mansoni antígeno de huevos durante 72 horas. Tinción de citoquinas intracelulares pueden ser examinadas por citometría de flujo, y los sobrenadantes se puede recuperar y se almacenó a -20 ° C para ELISA de citocinas Th2 (IL-4, IL-5, IL-13) 6.
- BAL: Las células se sedimentan (400 ug / 5 min / 4 ° C). BAL líquido se recupera y se almacenó a -20 ° C para el análisis de las citocinas Th2 por ELISA. Recuentos de células BAL se utilizan como una lectura de inflamación de las vías. Preparaciones cytocentrifuge de 10.000-100.000 células (500 rpm / 5 min / 4 ° C), seguido por tinción Diffquik permitirá enumeración de infiltrado inflamatorio 4, 6. Alternativamente, las células BAL puede ser examinado por citometría de flujo 6.
- El tejido pulmonar: El tejido pulmonar es almacenamientonoche a la mañana ed a 4 ° C. Tejido fijado es incluido en parafina, seccionadas y montadas sobre portaobjetos para el análisis histológico e inmunofluorescencia.
6. Los resultados representativos
Este protocolo de todos los detalles de los pasos necesarios para (i) preparar huevos de Schistosoma mansoni purificada para su uso in vivo (Fig. 1), (ii) sensibilizar y desafiar a los ratones con estos huevos y (iii) recuperar los órganos para el examen de la respuesta inflamatoria de los pulmones. Este modelo in vivo de forma reproducible impulsa una potente respuesta inflamatoria de los pulmones Th2. Esto se muestra por inflamación de las vías y eosinofilia como se visualizó por los recuentos de células BAL y preparados cytocentrifuge (Fig. 2). H & E-manchado secciones de pulmón puede ser examinado para el huevo inducida por granulomas (Figura 3a), y la tinción de inmunofluorescencia de secciones de pulmón permite la visualización de los macrófagos activados alternativamente y Th2 inducida por citoquinas, tales como los genes Resisestaño molécula similar a (RELM) α (Fig. 3b). La respuesta antígeno-específica CD4 citocinas Th2 es examinado por ELISA para la IL-5, IL-4 e IL-13 de antígeno-estimulados células de ganglios linfáticos paratímico (fig. 4).
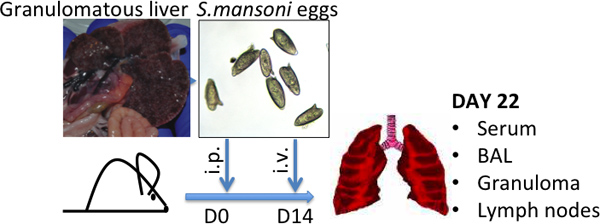
Figura 1 Schistosoma mansoni modelo de inyección de huevo imágenes representativas de los hígados granulomatosas, características de alta huevo S.mansoni-cargas y de los huevos S.mansoni se indica -.. De tamaño medio (L) 120 m (al W) 50 micras.
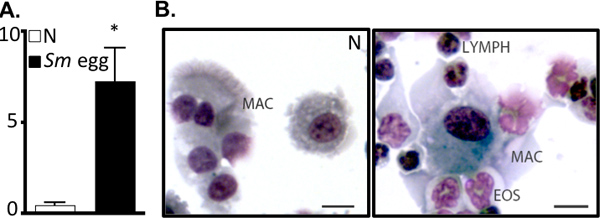
Figura 2. S. mansoni inyección de huevos impulsa inflamación de las vías. A. BAL número de células (x10 5) de ingenuos (N) o S.mansoni (SM) de huevo ratones inyectados. * P <0,05. B. Preparación citocentrífuga de células BAL. Mac, los macrófagos; Eos, eosinófilos, los nódulos linfáticos, los linfocitos. Bar, 10 micras.
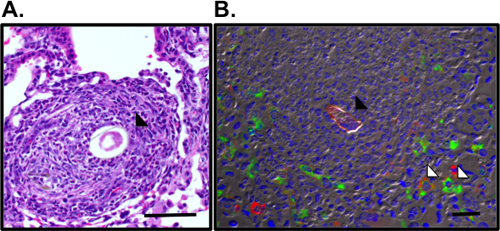
Figura 3. La observación de granulomas pulmonares y macrófagos activados alternativamente rodean el óvulo S.mansoni. A. Granuloma pulmonar que rodea el huevo Sm (negro flecha) se visualizó en H & E-manchado secciones de pulmón. B. La tinción de inmunofluorescencia para la RELMα (verde), receptor de manosa (rojo) y DAPI (azul) revela los macrófagos activados alternativamente (flecha blanca) en el granuloma que rodea al óvulo autofluorescente Sm (flecha negro). Bar, 50 micras.
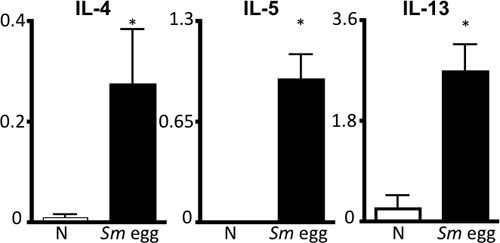
Figura 4. S.mansoni huevo antígeno específico de la respuesta de citoquinas Th2. Drenaje paratímico células de nódulos linfáticos de los ratones no tratados previamente (N) o Sm huevo inyectado fueron estimulados con SM </ Em> antígeno huevo durante 72 horas, seguido por ELISA de los sobrenadantes para la IL-4, IL-5 e IL-13. Escala, ng / ml. * P <0,05.
Discusión
Aquí, un modelo que emplea Schistosoma mansoni huevos para inducir inflamación pulmonar tipo 2 se describe. Los rasgos característicos de este modelo incluyen la potente respuesta inmune tipo Th2, inflamación de las vías y la formación de granulomas pulmonares. Desde estos parámetros dependen de las respuestas de células CD4 + Th2 11, este es un modelo útil para investigar los efectos de las supresiones específicas de proteínas o de linaje específico-en respuestas de las células Th2. Aqu...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por los Institutos Nacionales de Salud (NIH) AI091759 y la enfermedad de Crohn y Colitis Foundation of America y William Shelby Familia Modell Premio de Investigación Fundación (a MN). Esquistosomosis ratones infectados fueron suministrados por el Centro de Recursos del NIAID esquistosomosis (NIAID N01 Contrato A130026).
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo | Tamaño / Descripción | Empresa | Catálogo # |
| Colagenasa / dispasa | 500 mg | Roche Ciencias Aplicadas | 11 097 113 001 |
| Diff Quik Stain Hema 3 | Empacar | Fisher Scientific Co. LLC | 122-911 |
| DMEM | Líquido | Gibco | 11965 |
| Falcon 50 ml | Empacar | Halcón | 352070 |
| Intramedic PE Tubo | 0,58 mm | Becton Dickinson and Co. | 427410 |
| El isoflurano | 250 ml | Abad de Sanidad Animal | 52600405 |
| La ketamina | 100 mg / ml | Fort Dodge, de Sanidad Animal | N / A |
| Anticuerpo del receptor de manosa | Biotina | AbD Serotec | MCA2235B |
| Filtro metálico | Colador de cocina estándar | Objetivo | Laurentiis |
| Paraformaldehído | 16% | Electron Microsc. Ciencias de la | 15710 |
| La penicilina / estreptomicina | 100x | Gibco | 15070 |
| Percoll | 1 Litro | GE Healthcare Biosciences | 17 01 0891 |
| Anticuerpos RELMα | 50 ug | Peprotech | 500-P214 |
| Hilo quirúrgico | 2,0 USP 100 yardas | Surgical Corp. Especialidades | SP118 |
| Aguja de la jeringa | 23g, 3/4 pulgada | BD Vacutainer laboratorio. Med. | 305143 |
| EE.UU. estándar de pruebas tamiz | 150 micras, 0,0059 " | WS Tyler, Inc. | ASTME-11, Especificaciones. N º 100 |
| Xilacina | 20 mg / ml | Mayordomo | N / A |
Referencias
- World Health Organization. Prevention and control of schistosomiasis and soil-transmitted helminthiasis: report of a WHO expert committee. WHO Technical Report Series 912. , (2002).
- Pearce, E. J., MacDonald, A. S. The immunobiology of schistosomiasis. Nat. Rev. Immunol. 2, 499-511 (2002).
- Sandler, N. G. Global gene expression profiles during acute pathogen-induced pulmonary inflammation reveal divergent roles for Th1 and th2 responses in tissue repair. J. Immunol. 171, 3655-3667 (2003).
- Perrigoue, J. G. IL-31-IL-31R interactions negatively regulate type 2 inflammation in the lung. J. Exp. Med. 204, 481-487 (2007).
- Sandor, M., Weinstock, J. V., Wynn, T. A. Granulomas in schistosome and mycobacterial infections: a model of local immune responses. Trends Immunol. 24, 44-52 (2003).
- Nair, M. G. Alternatively activated macrophage-derived RELM-{alpha} is a negative regulator of type 2 inflammation in the lung. J. Exp. Med. 206, 937-952 (2009).
- Dalton, J. P. A method for the isolation of schistosome eggs and miracidia free of contaminating host tissues. Parasitology. 115, 29-32 (1997).
- Lewis, F. A. Large-scale laboratory maintenance of Schistosoma mansoni, with observations on three schistosome/snail host combinations. J. Parasitol. 72, 813-829 (1986).
- Tilney, N. L. Patterns of lymphatic drainage in the adult laboratory rat. J. Anat. 109 (Pt. 3), 369-383 (1971).
- Lewis, F., Coligan, J. E. Schistosomiasis. Current protocols in immunology. Chapter 19, Unit 19 (2001).
- Kaplan, M. H. Th2 cells are required for the Schistosoma mansoni egg-induced granulomatous response. J. Immunol. 160, 1850-1856 (1998).
- Wynn, T. A. Fibrotic disease and the T(H)1/T(H)2 paradigm. Nat. Rev. Immunol. 4, 583-594 (2004).
- Cheever, A. W. Variation of hepatic fibrosis and granuloma size among mouse strains infected with Schistosoma mansoni. Am. J. Trop. Med. Hyg. 37, 85-97 (1987).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados