JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
에서 계란을 사용하여
요약
Schistosoma mansoni 달걀은 T 도우미 유형 2 (Th2) 면역 반응, 기생충 감염의 특징, 천식과 알레르기 염증의 강력한 stimulators 있습니다. 이 프로토콜은 S.을 활용 CD4 Th2 시토킨 유도된 염증성 계란 주위에 폐 granuloma 형성을 특징으로 폐에 반응, eosinophilia와 대식 세포 대안 활성화를 생성하는 mansoni 계란 분사.
초록
Schistosoma의 기생충은 전세계 약 2억명 1 감염 혈액 flukes입니다. Schistosoma, 간 섬유증 및 splenomegaly 포함한 심각한 병리,과 만성 감염에 오히려 기생충 자체가 2보다 기생충 달걀에 대한 면역 반응 때문에 발생합니다. 기생충 알은 IL-4의 생산, IL-5 및 IL-13, macrophages의 대안 활성화 및 호산구의 채용 특징으로 Th2 반응을 유도. 여기서는 기생충 특정 폐에 Th2 시토킨 반응 및 배수 림프절, 계란을 둘러싼 폐 granulomas의 형성과기도 염증을 검사하기위한 모델로 Schistosoma mansoni 달걀의 주입을 설명합니다.
intraperitoneal sensitization과 정맥 도전, S. 따라 mansoni 달걀은 그들이 폐 실질 조직 내에 갇혀있다 폐의 동맥을 통해 폐로 이송된다lymphocytes, 호산구 및 또는 활성화 macrophages 3-6로 구성되어 granulomas에 의해. 야생마 - 폐포 공간에서 granuloma 형성, 염증과 연관된, 배수 림프절과 CD4의 확장은 T 세포 활성을 관찰할 수있다. 여기서 우리가 세부 사항, 감염된 간은 (7에서 변경)에서 Schistosoma mansoni 달걀을 분리 쥐를 sensitizing과 도전, 그리고 분석을위한 기관 (야생마 - 폐포 세척 (BAL), 폐 및 배수 림프절)를 복구하는 프로토콜. 우리는 또한 대표 histologic 및 추가 immunologic 분석을위한 immunologic 데이터 및 제안을 포함합니다.
전반적으로,이 방법은 생체내 모델에서이 기생충 감염, fibrotic 질환, 알레르기 염증과 천식을 포함한 Th2 염증 질환의 연구에 광범위하게 적용하는 폐 안에 기생충 유발 immunologic 응답을 조사합니다. 일반의 연구에 대해이 모델의 장점폐에서 전자이 염증은 폐에 유력한 Th2 염증 반응의 재현성 및 배수 림프절, 계란을 둘러싼 granulomas의 histologic 심사에 의한 염증의 평가의 용이성, 그리고 기생충의 장기 보관의 가능성을 포함 계란.
프로토콜
1. Schistosoma mansoni 달걀을 정화
- Schistosoma 수명주기 8 전염성 무대 schistosome cercariae와 스위스 웹스터 쥐를 감염. 양자 택일로, NIAID Schistosomiasis 리소스 센터 (에서 schistosome에 감염된 생쥐를 얻을 http://www.schisto-resource.org/~~V ). 그 시간을 포인트로, 계란은 간장에 존재하며 아래 설명에 따라 (그림을 참조하십시오. 1) 복구할 수, 감염 다음 6-7주 위해 생쥐를 남겨주세요.
- CO 2와 쥐를 안락사시켜야하고, 70 % 에탄올로 젖었어. 뒷면에 마우스를 놓습니다. 피부와 기본 복막 버려야하는 무딘 집게와 가위를 사용하십시오. ribcage 및 격막 아래에있는 소비세 간,.
- 잘게 간은를 말하다 및 collagenase / dispase (0.5 밀리그램 / ML), 페니실린 (100 U / ML)과 PBS의 스트렙토 마이신 (100 μg / ml) 쇼핑 구성되어 소화 혼합물의 간 당 20 ML을 추가합니다. mixt 넣고50 ML 팔콘 튜브의 우레와 37 ° C 흔드는에서 하룻밤 사이에 알을 품다.
- 400 XG / 3 분 / 20 ° C.에 혼합물을 원심 분리기 부드럽게 과잉 액체를 부어하고 PBS로 튜브를 입력하십시오. 다시 원심 분리기와 PBS에 세차를 반복하십시오. resuspend 펠렛 25 ML PBS에 마지막으로 원심 분리에 따라.
- 좋은 체 (미세 체를 통해 혼합물을 강요하는 10 ML의 주사기를 사용하여 혼합물을 통과하여 다음 기준 부엌 금속 스트레이너 (유리 비커에를 통해 매쉬 간 조각 50 ML 주사기 플런저를 사용)를 통해 resuspended 펠릿 스트레인 두 번째 유리 비커에).
- 50 ML 팔콘 튜브에 무한 섞어 넣고. 400 XG / 5에서 원심 분 / 20 ° C. 펠렛을 없애지 않고 뜨는을 자세히 쏟아야. 3 ML PBS에서 Resuspend 펠릿.
- 오버레이는 20 % Percoll에 부드럽게 섞어, 8 ML Percoll과 32 ML 0.25M 자당 (FW = 342.3 그래서 8.56 g sucrose/100 ML H 2 0)의 40 ML 기울기.
- 10 분 / 800 XG / 20 ° C를 원심 분리기 를 피펫D 간 세포의 젤라틴 상위 계층을 버리고. 트랜스퍼 피펫과 하단에 계란 펠릿를 제거하고 15 ML 팔콘 튜브에 넣어.
- 10 ML PBS / 1 밀리미터 EDTA (에틸렌 다이아 민 테트라 초산) / 1 MM EGTA 사용하는 원심 분리기 설정에서 워시 펠릿 배 : 3 분 / 30 XG / 20 ° C. 500 μL PBS에 Resuspend.
- 10 분 / 800 XG / 20 ° C. : 새 25 % Percoll, 원심 설정을 사용하여 10 ML 기울기 (2.5 ML Percoll과 7.5 ML 0.25M 자당)에서 오버레이 믹스
- 원심 설정을 사용하여 10 ML PBS로 3 배 씻으 : 3 분 / 30 XG / 20 ° C.
- 지난 10 ML 세척에는 달걀을 계산하여 100 μL를 제거합니다. 계란 빠르게 정착, 팔콘 튜브가 샘플을 제거하기 전에 잘 혼합되어야하므로. 900 μL PBS로 100 μL 시료를 희석. 믹스 100 μL은 해부 현미경 (1시 10분 희석)를 사용하여 현미경 슬라이드에 방울로 간주되어야합니다. 넓은 구멍 피펫 팁을 사용해야합니다.
- 50,000 계란 / PBS에 ML에서 계란 Resuspend. 계란은 -80 ° C에 몇 개월 동안 저장되고 한 twic 해동 수사용을위한 전자. 사용하기 전에, 달걀 (그림을 참조하십시오. 1) 아직도 건재한지 현미경으로 검사한다.
2. S로 Intraperitoneal Sensitization mansoni 달걀 : 주 영
- 5 ML의 snapcap 관에서 5000 eggs/100 μL PBS에서 계란을 준비합니다. 주사의 경우 필요한 50 % 이상 더 많은 알을 예상됩니다.
- 23 게이지 바늘 3/4inch와 마우스 당 계란 서스펜션의 100 μL로 한 ML의 주사기를로드합니다. 달걀은 사용하기 바로 전에 계란과 함께, 그래서 부하 바늘을 해결.
- 전에 각 주사에 알을 섞어 및 마우스 당 정지 intraperitoneally 100 μL를 삽입할 앞뒤 락 주사기.
3. S.와 레트로 - 궤도 정맥 도전 mansoni 달걀 : 주 14
- 5000 eggs/100 μL에서 위의 계란을 준비합니다.
- xylazine (10 밀리그램 / ㎏)와 케타민 (120 밀리그램 / ㎏)과 (4 %) isoflurane, 또는 intraperitoneally와 전문 챔버의 생쥐를 마취. anest 심도hesia는 노상 강도의 곤란과 더 물리적인 응답을 확보하지 의해 결정됩니다.
- 달걀 한 ML의 주사기 23 게이지 바늘 3/4inch의로드에 따라 각도로 아래로 향하게 베벨과 90 ° 각도로 바늘을 구부하는 포셉를 사용합니다. 아무런 거품이 존재하지 있는지 확인합니다.
- 한쪽에 마우스를 놓습니다. 눈이 내다, 그리고 코에 45 ° 각도로 안구 뒤쪽 혈관에 100 μL를 주입 않도록 피부를 철회.
- 바늘을 철회하고 출혈을 조절하기위한 가벼운 압력을 적용합니다.
이러한 절차들은 모두 세심하게 실시해야하며 그들이 마취에서 회복하기 전까지 마우스는 모니터링되어야한다. 이러한 프로토콜은 펜실베니아 기관 동물 관리 및 사용위원회 (IACUC)의 대학에 의해 승인되었다.
4. 실험 하베스트 : 주 22
- CO 2와 함께 쥐를 안락사.
- 뒷면의 70 % 에탄올, 장소와 젖은 생쥐.
- 무딘 그렇게해야 사용EPS는 마우스 복부를 파악하고 피부에 작은 절개를합니다. 조심스럽게 가위로 피부를 제거하고 흉곽 및 복막을 폭로.
- 복막을 열 컷. 파스퇴르 피펫으로 혈액을 복구하는 복부 대동맥을 절단. 얼음을 저장합니다.
- 다이어프램을 폭로 간이 아래로 이동합니다. 피임기구를 잘라 미세 가위를 사용합니다. 조심스럽게 폐 조직을 노출하는 갈빗대 오픈 했네요.
- 미세 집게로 폐를 드레인 parathymic 림프절을 복구할 수 있습니다. 이러한 thymus 9의 양쪽에, 흉곽 아래에 자리잡고있다. 1mL 멸균 미디어 얼음 저장소 (DMEM은 Invitrogen에서 사용 가능한 모든 10% 열 inactivated 소태아 혈청, 100 U / ML 페니실린, 100 μg / ML 스트렙토 마이신, 2 밀리미터 L-글루타민, 50 μm의 2 - 메르 캅 토 에탄올과 보충).
- BAL을 복구하고, histologic 분석을 위해 폐가 팽창하기 intratracheal 삽관법이 수행되어야합니다. 측면으로 침샘을 이동하여 호흡 관을 폭로하고, placi호흡 관 밑에 NG 벌금 포셉. 미세 가위를 사용하여, 호흡 관의 중앙에 구멍을 절단하고, 폐 속에 튜브를 삽입합니다. 수술용 실로 묶는로 튜브를 고정합니다.
- 튜빙에 PBS-가득한 한 ML의 주사기를 첨부하고 1 ML PBS로 폐를 부풀려. 조심스럽게 주사기로 BAL 세차를 검색합니다. 얼음을 저장합니다.
- 튜빙에 PBS-가득한 한 ML의 주사기에 4 % paraformaldehyde (PFA)를 첨부하고 폐를 부풀려.
- 튜브를 제거하고, PFA의 누출 방지하기 위해 수술 스레드를 조입니다.
- 조심스럽게 5 ML 4퍼센트 PFA로 50 ML 팔콘 튜브의 폐 조직과 장소를 해부.
5. 복구된 조직의 준비
- 세럼 : 응고 혈액을 위해 30 분 ~ 2 H 위해 얼음 같은 스토리지, 혈청은 (13,000 XG / 10 분 / 4 ℃) 원심 분리에 의해 혈액에서 발견됩니다. 혈청은 -20 ° C에서 저장되고 시토킨 ELISAs 또는 S. 사용할 수 있습니다 mansoni 계란 항원에 특정한 IgG isotype ELISAs 6, 10.
- 림프절 : 단일 세포 현탁액 준비와 셀 카운트는 면역 반응의 정도를 평가하는 데 사용됩니다. Th2 세포 분극을 검토하기 위해 세포는 S로 다시 자극하고 72 시간 mansoni의 달걀 항원. Intracellar 시토킨 염색법은 유동세포계측법 검사를받을 수 있으며, supernatants은 Th2 크린 시토킨의 엘리사 (IL-4, IL-5, IL-13) 6에 대한 복구 및 -20 ° C에 저장할 수 있습니다.
- BAL : 세포 (400 XG / 5 분 / 4 ℃) pelleted 있습니다. BAL 액은 엘리사에 의해 Th2 크린 시토킨의 분석을위한 복구 및 -20 ° C에 저장됩니다. BAL 세포 카운트는기도 염증에 대한 판독으로 사용됩니다. 10,000-100,000 세포 (500 RPM / 5 분 / 4 ℃)의 Cytocentrifuge의 준비는 Diffquik의 염색법 뒤에 것은 염증의 열거는 4, 6에 침투해 수 있습니다. 또는 BAL 세포 유동세포계측법 6 시까지 심사를 할 수 있습니다.
- 폐 조직 : 폐 조직이 stor입니다4에 하룻밤 에드 ° C. 고정 조직은 파라핀 - 임베디드, sectioned 및 histological 및 immunofluorescence 분석을 위해 슬라이드에 마운트됩니다.
6. 대표 결과
이 프로토콜 세부 정보는 (i) 생체내 사용에 대한 Schistosoma mansoni 달걀 (그림 1), (2) 감광성 이러한 계란과 생쥐에 도전 투석을 그리고 (iii) 폐 염증 반응의 시험 기관을 복구 준비에 필요한 모든 단계. 생체내 모델이 reproducibly 적정량 Th2 폐 염증 반응을 조절합니다. 이것은 같은 BAL 셀 카운트 및 cytocentrifuge의 준비 (그림 2)에 의해 시각기도 염증과 eosinophilia에 의해 표시됩니다. H & E-스테인드 폐 부분은 달걀 유발 granulomas (그림 3A)에 대한 검사 및 폐 섹션 immunofluorescent 염색법은 또한 활성화 macrophages와 같은 Resis 같은 Th2 시토킨 유도된 유전자의 시각화을 허용하실 수 있습니다주석과 같은 분자 (RELM) α (그림 3B). 항원에 특정한 CD4 Th2 시토킨 반응은 IL-5 ELISAs을 면밀히 검토, IL-4 및 항원 자극 parathymic 림프절 세포의 IL-13 (그림 4). 있습니다
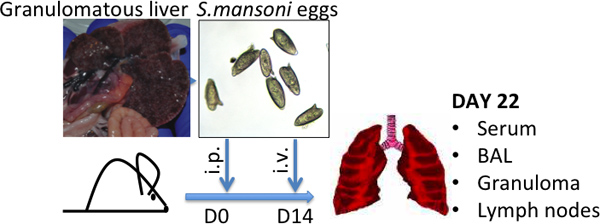
그림 1 Schistosoma mansoni 계란 분사 모델 대표 높은 S.mansoni - 달걀 부담의 특징 granulomatous 간은 사진, 그리고 S.mansoni 달걀의가 표시됩니다 -.. 평균 크기 (L) (W) 50 μm의 작품 120 μm의.
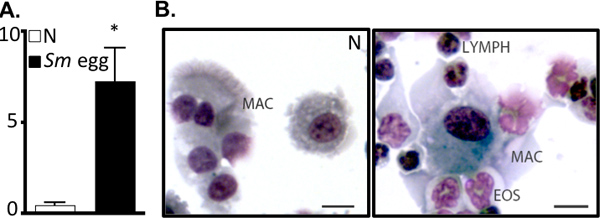
그림 2. S. mansoni 달걀 주입은기도 염증을 조절합니다. A. 나이브 (N) 또는 S.mansoni (SM) 달걀 주입 생쥐에서 BAL 세포 숫자 (x10 5). * P <0.05. BAL 세포의 바실러스 Cytocentrifuge 준비. 맥, 대식 세포, EO초, EOSINOPHIL, 림프, 림프구. 바, 10 μm의.
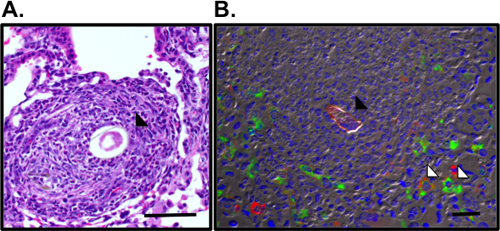
그림 3. 폐 granulomas 및 S.mansoni 달걀을 둘러싸고 또는 활성 macrophages의 시각화. A. SM 계란 (검은색 화살표)를 둘러싼 폐 granuloma는 H & E-스테인드 폐 부분의 시각이었다. RELMα위한 B. Immunofluorescence의 염색법 (녹색), mannose 수용체 (적색) 및 DAPI (파란색) autofluorescent SM 계란 (검은색 화살표)를 둘러싼 granuloma에 또는 활성 macrophages (흰색 화살표)를 보여준다. 바, 50 μm의.
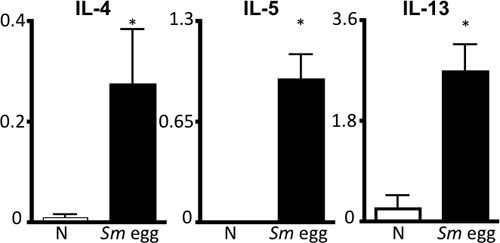
그림 4. S.mansoni 계란 항원에 특정한 Th2 시토킨 반응. 달걀 주입 나이브 (N) 또는 SM 생쥐에서 parathymic 림프절 세포를 배수가 SM과 자극했다 </ 그들 IL-4, IL-5 및 IL-13에 대한 supernatants의 엘리사 다음에 72 시간> 계란 항원. 규모, NG / ML. * P <0.05.
토론
여기에 2를 입력 폐 염증을 유발해서 Schistosoma mansoni 달걀을 고용 모델이 설명되어 있습니다. 이 모델의 특징 특징은 강력한 Th2 면역 반응,기도 염증과 폐의 granuloma 형성을 포함합니다. 이러한 매개 변수가 CD4 Th2 세포 반응 11 의존 때문에, 이것은 Th2 세포 반응에 대한 단백질의 특정 또는 혈통 고유의 삭제 효과를 조사하기위한 유용한 모델입니다. 여기에 설치 했어요는 항원에 특정?...
공개
관심의 어떠한 충돌 선언 없습니다.
감사의 말
이 작품은 건강 (NIH) AI091759과 Crohn의와 미국의 윌리엄과 셀비 모델이란 가족 재단 연구 수상 (MN까지)의 대장염 재단의 국립 연구소에 의해 지원되었다. Schistosome에 감염된 생쥐는 NIAID Schistosome 리소스 센터 (NIAID 계약 N01 A130026)가 제공되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약 | 크기 / 설명 | 회사 | # 카탈로그 |
| Collagenase / Dispase | 500 MG | 로슈 응용 과학 | 11 097 113 001 |
| 비교 Quik Hema 3 청바지 | 짐 | 피셔 과학 (주) LLC | 122-911 |
| DMEM | 액체 | Gibco | 11,965 |
| 팔콘 50mL | 짐 | 매 | 352,070 |
| Intramedic PE 관 | 0.58 mm | Becton 디킨슨과 (주) | 427,410 |
| Isoflurane | 250 ML | 원장 동물 건강 | 52600405 |
| 케타민을 | 100 MG / ML | 포트 닷지, 동물 건강 | N / A |
| Mannose 수용체 항체 | 비오틴 | AbD Serotec | MCA2235B |
| 메탈릭 스트레이너 | 표준 부엌 스트레이너 | 목표 | Laurentiis |
| Paraformaldehyde | 16% | 전자 Microsc. 과학 | 15,710 |
| 페니실린 / 스트렙토 마이신 | 100x | Gibco | 15,070 |
| Percoll | 1 리터 | GE 헬스케어 Biosciences | 17 0,891 01 |
| RELMα 항체 | 50 μg | Peprotech | 500-P214 |
| 외과 스레드 | 2.0 USP 100 yds | 외과 특산품 주식 회사 | SP118 |
| 주사기 바늘 | 23g, 4분의 3 인치 | BD Vacutainer 연구소. 메드. | 305,143 |
| 미국 표준 시험 체 | 150 μm의, 0.0059 " | WS 타일러 주식 회사 | ASTME-11, 사양. 번호 100 |
| Xylazine | 20 MG / ML | 집사 | N / A |
참고문헌
- World Health Organization. Prevention and control of schistosomiasis and soil-transmitted helminthiasis: report of a WHO expert committee. WHO Technical Report Series 912. , (2002).
- Pearce, E. J., MacDonald, A. S. The immunobiology of schistosomiasis. Nat. Rev. Immunol. 2, 499-511 (2002).
- Sandler, N. G. Global gene expression profiles during acute pathogen-induced pulmonary inflammation reveal divergent roles for Th1 and th2 responses in tissue repair. J. Immunol. 171, 3655-3667 (2003).
- Perrigoue, J. G. IL-31-IL-31R interactions negatively regulate type 2 inflammation in the lung. J. Exp. Med. 204, 481-487 (2007).
- Sandor, M., Weinstock, J. V., Wynn, T. A. Granulomas in schistosome and mycobacterial infections: a model of local immune responses. Trends Immunol. 24, 44-52 (2003).
- Nair, M. G. Alternatively activated macrophage-derived RELM-{alpha} is a negative regulator of type 2 inflammation in the lung. J. Exp. Med. 206, 937-952 (2009).
- Dalton, J. P. A method for the isolation of schistosome eggs and miracidia free of contaminating host tissues. Parasitology. 115, 29-32 (1997).
- Lewis, F. A. Large-scale laboratory maintenance of Schistosoma mansoni, with observations on three schistosome/snail host combinations. J. Parasitol. 72, 813-829 (1986).
- Tilney, N. L. Patterns of lymphatic drainage in the adult laboratory rat. J. Anat. 109 (Pt. 3), 369-383 (1971).
- Lewis, F., Coligan, J. E. Schistosomiasis. Current protocols in immunology. Chapter 19, Unit 19 (2001).
- Kaplan, M. H. Th2 cells are required for the Schistosoma mansoni egg-induced granulomatous response. J. Immunol. 160, 1850-1856 (1998).
- Wynn, T. A. Fibrotic disease and the T(H)1/T(H)2 paradigm. Nat. Rev. Immunol. 4, 583-594 (2004).
- Cheever, A. W. Variation of hepatic fibrosis and granuloma size among mouse strains infected with Schistosoma mansoni. Am. J. Trop. Med. Hyg. 37, 85-97 (1987).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유