Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование Яйца
В этой статье
Резюме
Schistosoma mansoni яйца являются мощными стимуляторами типа Т-хелперов 2 (Th2) иммунного ответа, характерно заражение паразитом, астмы и аллергического воспаления. Этот протокол используется С. mansoni яйцо инъекции для создания CD4 Th2 цитокин-индуцированного воспалительной реакции в легких, характеризующееся легкое образование гранулемы вокруг яйца, эозинофилия и макрофагов альтернативной активации.
Аннотация
Schistosoma паразиты кровяных сосальщиков, которые заражают примерно 200 миллионов человек во всем мире 1. При хронической инфекции Schistosoma, тяжелая патология, в том числе фиброзом печени и селезенки, вызывает иммунный ответ на яйца паразита, а не паразита 2. Яйца паразита вызывает Th2 ответ характеризуется продукцией ИЛ-4, IL-5 и IL-13, альтернативная активация макрофагов и набор эозинофилов. Здесь мы описываем введения яйца Schistosoma mansoni в качестве модели для изучения паразитов конкретного ответа Th2 цитокинов в легких и лимфатических узлах слива, формирования легких гранулем окружающие яйцеклетку, и воспаления дыхательных путей.
После внутрибрюшинного и внутривенного сенсибилизации проблемы, С. mansoni яйца транспортируется в легкие через легочную артерию, где они оказались в ловушке в легочной паренхимыпо гранулемы состоит из лимфоцитов, эозинофилов и альтернативы активированные макрофаги 3-6. Связанные с формированием гранулемы, воспаления в бронхо-альвеолярной пространства, расширение осушения лимфатических узлов и CD4 активацию Т-клеток может наблюдаться. Здесь мы подробно протокол выделения Schistosoma mansoni яйца от зараженных печени (изменение от 7), информирование и сложных мышей и восстановления органов (бронхо-альвеолярной лаважа (БАЛ), легких и дренаж лимфатических узлов) для анализа. Мы также гистологические и иммунологические представитель данные и предложения для дополнительного анализа иммунологических.
В целом, этот метод обеспечивает в естественных условиях модель для исследования гельминтов вызванного ответа иммунологическая в легких, которая широко применяется для изучения Th2 воспалительных заболеваний, включая инфекции гельминтов, фиброзных заболевания, аллергические воспаления и бронхиальной астмы. Преимущества данной модели для изучения типе 2 воспаление в легких включает воспроизводимость мощным Th2 воспалительных реакций в легких и лимфатических узлах слива, простота оценки воспаления гистологического исследования гранулемы окружающие яйцеклетку, и потенциал для длительного хранения паразитов яиц.
протокол
1. Очищающий Schistosoma mansoni яйца
- Инфекция швейцарской-Webster мышей с шистосом церкарии, который является инфекционной стадии в цикле жизни Schistosoma 8. Кроме того, получить шистосом-инфицированных мышей из NIAID Шистосомоз ресурсный центр ( http://www.schisto-resource.org/~~V ). Оставьте мышей в течение 6-7 недель после заражения, к тому времени точки, яйца находятся в печени и могут быть восстановлены, как описано ниже (см. рис. 1).
- Усыпить мышей с CO 2, и влажный с 70% этанола. Поместите мышь на спине. Используйте тупой пинцет и ножницы, чтобы отрезать кожи и подлежащих брюшины. Акцизные печени, расположенных ниже грудной клетки и диафрагмы.
- Мелко фарша печень и добавить 20 мл в печени пищеварения смесь, состоящую из коллагеназы / dispase (0,5 мг / мл), пенициллин (100 ЕД / мл) и стрептомицин (100 мкг / мл) в PBS. Положите микстЮр в 50 мл трубку Сокол и инкубировать в течение ночи в 37 ° С шейкер.
- Центрифуга смеси на 400 мкг / 3 мин / 20 ° C. Аккуратно слейте лишнюю жидкость и заполнить трубу с PBS. Центрифуга и повторите PBS стирки. После последнего центрифугирования, ресуспендируют осадок в 25 мл PBS.
- Процедить ресуспендированного гранул через стандартный кухонный металлический фильтр (использование 50 мл шприца с пюре печени части через в стеклянном стакане), а затем путем пропускания смеси через мелкое сито (используется 10 мл шприц толкать смесь через мелкое сито во второй стакан стекло).
- Положите смесь в напряженном 50-трубка мл Falcon. Центрифуга 400 мкг / 5 мин / 20 ° C. Осторожно вылить надосадочную без потери гранул. Ресуспендируют осадок в 3 мл PBS.
- Наложение аккуратно перемешать на 20% Перколла, 40 мл градиент 8 мл Перколла и 32 мл 0,25 М сахарозы (FW = 342,3 таким 8,56 г sucrose/100 мл H 2 0).
- Центрифуга 10 мин / 800 мкг / 20 ° C. Пипетки сг отказаться от желатиновой верхний слой клеток печени. Удалить яйцо гранул на дне с передачей пипетки и введен в 15 мл трубку Falcon.
- Wash гранул 3 раза в 10 мл PBS / 1 мМ ЭДТА / 1 мм EGTA помощью параметров центрифуги: 3 мин / 30 мкг / 20 ° C. Ресуспендируйте в 500 мкл PBS.
- Наложение смеси на новый 25% Перколла, 10 мл градиент (2,5 мл Перколла и 7,5 мл 0,25 М сахарозы) с помощью центрифуги параметры: 10 мин / 800 мкг / 20 ° C.
- Вымойте 3X в 10 мл PBS использованием центрифуг настройки: 3 мин / 30 мкг / 20 ° C.
- За последние 10 мл стирки, удаление 100 мкл считать яйца. Яйца решить быстро, так что труба Сокола должно быть тщательно перемешивают до удаления образца. Развести 100 мкл образца 900 мкл PBS. 100 мкл смеси должны учитываться в виде капель на предметное стекло микроскопа помощью рассечения микроскоп (1:10 разведение). Широкий диаметра наконечники должны быть использованы.
- Ресуспендируйте яйца на 50 000 яиц / мл в PBS. Яйца можно хранить в течение нескольких месяцев при температуре -80 ° C и талых один или TWICе для использования. Перед использованием следует осмотреть под микроскопом, чтобы гарантировать, что яйца остаются нетронутыми (см. рис. 1).
2. Внутрибрюшинное сенсибилизация с С. mansoni яйца: День 0
- Подготовка яиц в 5000 eggs/100 мкл PBS в 5 трубка snapcap мл. Для инъекций, оценить 50% больше яиц, чем это необходимо.
- Загрузить 23 калибра 3/4inch иглы и 1 мл шприц с 100 мкл яйца подвески на мышь. Яйца решить, поэтому нагрузка иглы с яйцами непосредственно перед использованием.
- Рок шприц и обратно смешать яйца до каждой инъекции и вводят внутрибрюшинно 100 мкл суспензии в мышь.
3. Ретро-орбитальный внутривенного Проблемы с С. mansoni Яйца: 14 день
- Подготовка яйца, как указано выше в 5000 eggs/100 мкл.
- Обезболить мышей специализированные камеры с ИФ (4%), или внутрибрюшинно ксилазина (10 мг / кг) и кетамин (120 мг / кг). Глубина ANESThesia определяется, зажимая в подушечку и гарантируя, что ни физические реакции.
- После загрузки в 1 мл шприц и 23 калибра 3/4inch игла с яйцами, использование щипцов, чтобы согнуть иглу под углом 90 ° с конической вниз в угол. Убедитесь, что нет пузырьков присутствуют.
- Поместите мышь на одной стороне. Уберите кожу, глаза будут выступать, и вводят 100 мкл в судах за глазное яблоко на угол 45 ° к носу.
- Снять иглу и применить легкое давление, чтобы остановить кровотечение.
Все эти процедуры должны проводиться с осторожностью, и мышь должны быть проверены, пока они оправиться от наркоза. Эти протоколы были одобрены в Университете штата Пенсильвания по Уходу за животными и использованию комитета (IACUC).
4. Экспериментальные Урожай: 22-й день
- Усыпить мышей с CO 2.
- Мокрая мышь с 70% этанола, и место на спине.
- Использование тупым НЦВОEPS, схватить мышью живот и сделайте небольшой надрез в коже. Осторожно снимите кожу с помощью ножниц и подвергать грудной клетки и брюшной полости.
- Разрезать брюшины. Сокращение брюшной аорты, чтобы восстановить кровь пипетки Пастера. Хранить на льду.
- Перемещение печени вниз, чтобы выставить диафрагму. Используйте тонкий ножницы, чтобы вырезать диафрагмы. Аккуратно разрезать грудную клетку, чтобы разоблачить легочной ткани.
- Восстановление parathymic лимфатические узлы, которые истощают легких с мелким пинцетом. Они скрываются под грудной клеткой, по обе стороны вилочковой железы 9. Магазин на льду в 1 мл стерильной среды (DMEM с добавлением 10% тепла инактивированной эмбриональной телячьей сыворотки, 100 ед / мл пенициллина, 100 мкг / мл стрептомицина, 2 мМ L-глутамина, 50 мкМ 2-меркаптоэтанола, все имеющиеся в Invitrogen).
- Чтобы восстановить БАЛ, и раздувать легкие для гистологического анализа, трахею интубации должны быть выполнены. Вынести трахеи путем перемещения слюнных желез в сторону, и placiнг прекрасно щипцы под трахеи. Использование тонких ножниц, вырезать отверстие в середине трахеи и вставить трубку в легкие. Закрепите трубы, связывая с хирургической нитью.
- Прикрепить PBS заполненных 1 мл шприц с трубкой и раздувать легкие с 1 мл PBS. Тщательно получить БАЛ промыть шприц. Хранить на льду.
- Приложите 4% параформальдегид (PFA) в PBS заполненных 1 мл шприц с трубкой и раздувать легкие.
- Снимите трубку и затяните нить хирургическая, чтобы предотвратить утечку PFA.
- Осторожно рассекают из легочной ткани и поместите в 50 мл Сокол трубки с 5 мл 4% PFA.
5. Подготовка Восстановленные тканей
- Сыворотка: После хранения на льду в течение 30 мин до 2 ч для свертывания крови, сыворотки выделяется из крови путем центрифугирования (13000 мкг / 10 мин / 4 ° C). Сыворотка хранится при температуре -20 ° С и может быть использован для ИФА цитокинов или S. mansoni яйцо антиген-специфические IgG изотипа ИФА 6, 10.
- Лимфатические узлы: Single суспензий готовят и клеток используется для оценки величины иммунного ответа. Для изучения поляризации Th2 клетки, клетки повторно стимулировали С. mansoni яйцо антигена в течение 72 часов. Intracellar окрашивания цитокинов может быть рассмотрен с помощью проточной цитометрии и супернатантах может быть восстановлена и хранится при температуре -20 ° С для ИФА на Th2 цитокинов (IL-4, IL-5, IL-13) 6.
- BAL: Клетки осаждали (400 мкг / 5 мин / 4 ° C). БАЛ извлекается и хранится при температуре -20 ° C для анализа Th2 цитокинов методом ИФА. BAL рассчитывает клетки используются как индикатор для воспаления дыхательных путей. Cytocentrifuge препаратов 10000-100000 клеток (500 мин / 5 мин / 4 ° C), последующим окрашиванием Diffquik позволит перечисление воспалительный инфильтрат 4, 6. Кроме того, клеток БАЛ может быть рассмотрен с помощью проточной цитометрии 6.
- Легкие ткани: Легкие ткани хранениемред ночи при 4 ° C. Исправлена ткани парафин, секционные и установлены на салазках для гистологического анализа и иммунофлюоресценции.
6. Представитель Результаты
Этот протокол описывает все шаги, необходимые для (я) подготовки очищенной Schistosoma mansoni яйца для использования в естественных условиях (рис. 1), (II), внимания и оспаривать мышей с этими яйцами и (III), восстановление органов для обследования легких воспалительной реакции. Эта модель в естественных условиях воспроизводимо диски мощным Th2 легких воспалительной реакции. Об этом свидетельствует воспаление дыхательных путей и эозинофилия как визуализация на BAL форменных элементов и cytocentrifuge препаратов (рис. 2). H & E-окрашенные срезы легких может быть рассмотрен на яйцо вызванных гранулемы (рис. 3а), и иммунофлуоресцентного окрашивания легких секций позволяет визуализировать альтернативы активированными макрофагами и Th2 цитокин-индуцированного генов, таких как сопротивлениеолова, как молекулы (RELM) α (рис. 3б). Антиген-специфических CD4 Th2 ответа цитокинов изучается ИФА для ИЛ-5, IL-4 и IL-13 антиген-стимулированных parathymic лимфатических узлов (рис. 4).
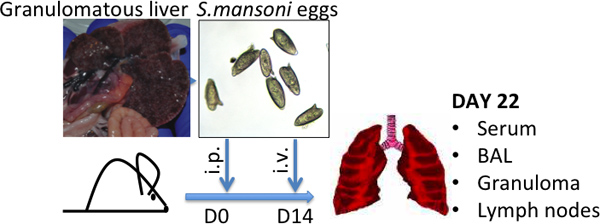
Рисунок 1 Schistosoma mansoni яйцо инъекции модель Представитель фотографии гранулематозный печени, характерных для высоких S.mansoni яйца бремени, и S.mansoni яйца показаны -.. Средний размер (L) 120 мкм (Вт) 50 мкм.
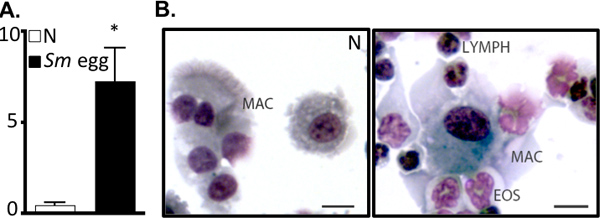
Рисунок 2. С. mansoni яйцо инъекции диски воспаления дыхательных путей. А. BAL номера ячейки (x10 5) с наивной (N) или S.mansoni (Sm) яйцо впрыском мышей. * P <0,05. Б. Cytocentrifuge подготовки клеток БАЛ. Mac, макрофагов, Еос, эозинофилов, лимфы, лимфоциты. Бар, 10 мкм.
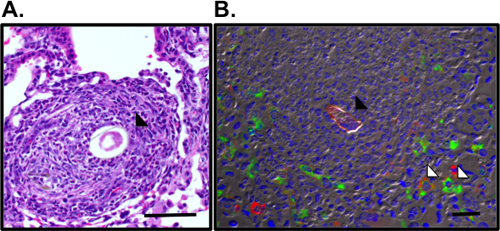
Рисунок 3. Визуализация легких гранулемы и наоборот активированными макрофагами окружающие яйцо S.mansoni. А. Легочная гранулемы окружающих Sm яйцо (черная стрелка) было визуализировать в H & E-окрашенные срезы легких. Б. иммунофлуоресценции для окрашивания RELMα (зеленый), маннозы рецепторов (красный) и DAPI (синий) показывает альтернативы активированными макрофагами (белая стрелка) в гранулемы окружающих autofluorescent Sm яйцо (черная стрелка). Бар, 50 мкм.
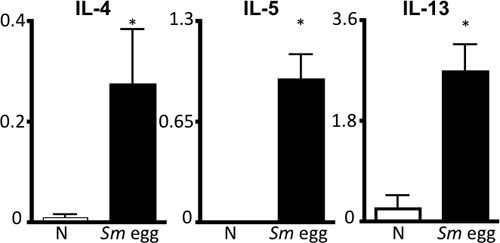
Рисунок 4. S.mansoni яйцо антиген-специфических Th2 ответа цитокинов. Слив parathymic лимфатических узлов с наивной (N) и Sm яйцо введенный мышам стимулировали Sm </ EM> яйцо антигена в течение 72 часов, а затем с помощью ИФА супернатантов для Ил-4, ИЛ-5 и ИЛ-13. Масштаб, нг / мл. * P <0,05.
Обсуждение
Здесь модель использования Schistosoma mansoni яйца, чтобы побудить 2 типа воспаления легких описано. Характерные особенности этой модели можно отнести мощный Th2 иммунного ответа, воспаления дыхательных путей и легочной формирования гранулемы. Так как эти параметры зависят от CD4 Th2 ответа ?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Работа выполнена при поддержке Национального института здоровья (NIH) AI091759 и Крона и колит Фонд Уильяма Америки и Шелби Modell Family Foundation премию исследований (М. Н.). Шистосом-инфицированных мышей были поставлены NIAID шистосом ресурсный центр (NIAID контракт N01 A130026).
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент | Размер / Описание | Компания | Каталог # |
| Коллагеназы / Dispase | 500 мг | Roche Applied Science | 11 097 113 001 |
| Разница Quik Хема 3 пятна | Упаковка | Fisher Scientific Компания ООО | 122-911 |
| DMEM | Жидкость | Гибко | 11965 |
| Сокол 50 мл | Упаковка | Сокол | 352070 |
| Intramedic ПЭ труб | 0,58 мм | Becton Dickinson и Ко | 427410 |
| Изофлюран | 250 мл | Аббат здоровья животных | 52600405 |
| Кетамин | 100 мг / мл | Форт Додж, здоровья животных | N / A |
| Маннозы антител рецептора | Биотин | Абд Serotec | MCA2235B |
| Металлический фильтр | Стандартный фильтр кухня | Цель | Лаурентис |
| Параформальдегид | 16% | Электронная Microsc. Наук | 15710 |
| Пенициллина / стрептомицина | 100x | Гибко | 15070 |
| Перколла | 1 литр | GE Healthcare Biosciences | 17 01 0891 |
| RELMα антител | 50 мкг | Peprotech | 500-P214 |
| Хирургическое тему | 2,0 USP 100 ярдов | Хирургических специальностей корпорации | SP118 |
| Шприца | 23г, 3/4 дюйма | BD Vacutainer Lab. Медицина | 305143 |
| США Стандартное тестирование сито | 150 мкм, 0,0059 " | WS Tyler, Inc | ASTME-11, Спец. № 100 |
| Ксилазин | 20 мг / мл | Дворецкий | N / A |
Ссылки
- World Health Organization. Prevention and control of schistosomiasis and soil-transmitted helminthiasis: report of a WHO expert committee. WHO Technical Report Series 912. , (2002).
- Pearce, E. J., MacDonald, A. S. The immunobiology of schistosomiasis. Nat. Rev. Immunol. 2, 499-511 (2002).
- Sandler, N. G. Global gene expression profiles during acute pathogen-induced pulmonary inflammation reveal divergent roles for Th1 and th2 responses in tissue repair. J. Immunol. 171, 3655-3667 (2003).
- Perrigoue, J. G. IL-31-IL-31R interactions negatively regulate type 2 inflammation in the lung. J. Exp. Med. 204, 481-487 (2007).
- Sandor, M., Weinstock, J. V., Wynn, T. A. Granulomas in schistosome and mycobacterial infections: a model of local immune responses. Trends Immunol. 24, 44-52 (2003).
- Nair, M. G. Alternatively activated macrophage-derived RELM-{alpha} is a negative regulator of type 2 inflammation in the lung. J. Exp. Med. 206, 937-952 (2009).
- Dalton, J. P. A method for the isolation of schistosome eggs and miracidia free of contaminating host tissues. Parasitology. 115, 29-32 (1997).
- Lewis, F. A. Large-scale laboratory maintenance of Schistosoma mansoni, with observations on three schistosome/snail host combinations. J. Parasitol. 72, 813-829 (1986).
- Tilney, N. L. Patterns of lymphatic drainage in the adult laboratory rat. J. Anat. 109 (Pt. 3), 369-383 (1971).
- Lewis, F., Coligan, J. E. Schistosomiasis. Current protocols in immunology. Chapter 19, Unit 19 (2001).
- Kaplan, M. H. Th2 cells are required for the Schistosoma mansoni egg-induced granulomatous response. J. Immunol. 160, 1850-1856 (1998).
- Wynn, T. A. Fibrotic disease and the T(H)1/T(H)2 paradigm. Nat. Rev. Immunol. 4, 583-594 (2004).
- Cheever, A. W. Variation of hepatic fibrosis and granuloma size among mouse strains infected with Schistosoma mansoni. Am. J. Trop. Med. Hyg. 37, 85-97 (1987).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены