Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
En utilisant des oeufs de
Dans cet article
Résumé
Schistosoma mansoni oeufs sont des stimulateurs efficaces du type T auxiliaire 2 (Th2) la réponse immunitaire, caractéristique d'une infection parasitaire, l'asthme et l'inflammation allergique. Ce protocole utilise S. mansoni œuf d'injection afin de générer un taux de CD4 Th2 induite par les cytokines réponse inflammatoire dans les poumons, caractérisée par la formation de granulomes pulmonaires autour de l'oeuf, l'éosinophilie et l'activation des macrophages alternative.
Résumé
Schistosomes sont schistosomes qui infectent environ 200 millions de personnes dans le monde 1. Dans l'infection chronique à Schistosoma, l'une pathologie grave, y compris la fibrose du foie et de la splénomégalie, est causée par la réponse immunitaire à des œufs de parasites plutôt que le parasite lui-même 2. Œufs de parasites induisent une réponse Th2 caractérisée par la production d'IL-4, IL-5 et IL-13, l'activation alternative des macrophages et le recrutement des éosinophiles. Ici, nous décrivons l'injection d'œufs de Schistosoma mansoni en tant que modèle pour examiner les réponses spécifiques du parasite cytokines Th2 dans les poumons et les ganglions lymphatiques drainant, la formation de granulomes pulmonaires entourant l'oeuf et l'inflammation des voies respiratoires.
Après une sensibilisation par voie intrapéritonéale et intraveineuse défi, S. oeufs mansoni sont transportés à travers le poumon des artères pulmonaires où ils sont piégés dans le parenchyme du poumonpar les granulomes composés de lymphocytes, les éosinophiles et les macrophages activés alternativement 3-6. Associé à la formation de granulomes, de l'inflammation dans les espaces broncho-alvéolaires, l'expansion des ganglions lymphatiques drainant et l'activation des cellules CD4 T peut être observée. Ici, nous détaillons le protocole pour isoler Schistosoma mansoni oeufs à partir de foies infectés (modifié à partir de 7), la sensibilisation et difficile souris, et la récupération des organes (lavage broncho-alvéolaire (LBA), du poumon et les ganglions lymphatiques drainant) pour l'analyse. Nous incluons également histologique des données représentatives et immunologiques et des suggestions pour l'analyse immunologique supplémentaire.
Dans l'ensemble, cette méthode fournit un modèle in vivo pour étudier les réponses immunologiques induites par les helminthes dans le poumon, qui est largement applicable à l'étude des maladies inflammatoires, y compris Th2 infestation par les helminthes, les maladies fibrotiques, l'inflammation allergique et l'asthme. Avantages de ce modèle pour l'étude de type 2 l'inflammation dans les poumons comprennent la reproductibilité d'une puissante réponse inflammatoire Th2 dans les poumons et les ganglions lymphatiques drainant, la facilité de l'évaluation de l'inflammation par l'examen histologique des granulomes entourant l'œuf, et le potentiel de stockage à long terme du parasite oeufs.
Protocole
1. Purifiant œufs de Schistosoma mansoni
- Infect suisse-Webster souris avec des cercaires de schistosomes, qui est le stade infectieux dans le cycle de vie Schistosoma 8. Sinon, procurez-schistosome-souris infectées par le NIAID ressources schistosomiase Centre ( http://www.schisto-resource.org/~~V ). Laissez la souris pour 6-7 semaines après l'infection, par lequel point dans le temps, les oeufs sont présents dans le foie et peut être récupéré tel que décrit ci-dessous (voir fig. 1).
- Euthanasier les souris avec le CO 2, et mouiller avec de l'éthanol 70%. Placez la souris sur le dos. Utilisez le forceps émoussé et ciseaux pour couper la peau et le péritoine sous-jacent. D'accise du foie, située en dessous de la cage thoracique et le diaphragme.
- Émincer finement les foies et ajouter 20 ml par le foie de mélange de digestion, composée de la collagénase / dispase (0,5 mg / ml), la pénicilline (100 U / ml) et de la streptomycine (100 ug / ml) dans du PBS. Mettez mixture dans un tube Falcon de 50 ml et incuber pendant une nuit dans un shaker à 37 ° C.
- Centrifuger le mélange à 400 xg / 3 min / 20 ° C. Verser délicatement l'excès de liquide et le tube de remplissage avec du PBS. Centrifuger de nouveau et répéter de lavage PBS. Après centrifugation dernier, remettre en suspension le culot dans 25 mL du PBS.
- Passer le culot remis en suspension à travers un standard de cuisine métallique crépine (utiliser un piston de la seringue de 50 ml pour écraser les morceaux de foie dans un récipient en verre), suivi par le passage du mélange à travers une passoire fine (utiliser une seringue de 10 ml pour pousser le mélange à travers la passoire fine dans un bécher seconde).
- Mettez le mélange dans un tube tendues Falcon de 50 ml. Centrifuger à 400 xg / 5 min / 20 ° C. Verser délicatement sur surnageant sans perdre de granules. Resuspendre le culot dans 3 ml de PBS.
- Overlay mélanger doucement sur un Percoll 20%, 40 ml de gradient de 8 ml de Percoll et 32 ml de saccharose 0,25 M (FW = 342,3 donc 8,56 g sucrose/100 ml H 2 0).
- Centrifuger 10 min / 800 xg / 20 ° C. Introduire à la pipette à pied und jetez gélatineuse couche supérieure des cellules du foie. Retirez l'œuf culot en bas avec une pipette de transfert et de mettre dans un tube de 15 ml Falcon.
- Laver à granulés 3X dans 10 ml de PBS / EDTA 1 mM / 1 mM EGTA paramètres de centrifugation à l'aide: 3 min / 30 xg / 20 ° C. Remettre en suspension dans 500 ul de PBS.
- Mélange de superposition sur un nouveau Percoll 25%, 10 ml de gradient (2,5 ml de Percoll et 7,5 mL 0,25 M de saccharose) en utilisant les paramètres de centrifugation: 10 min / 800 xg / 20 ° C.
- Laver 3X dans 10 ml de PBS en utilisant les paramètres de centrifugation: 3 min / 30 xg / 20 ° C.
- Dans les derniers 10 ml de lavage, retirez 100 pi à compter les œufs. Oeufs de régler rapidement, de sorte que le tube Falcon doit être bien mélangé avant de retirer l'échantillon. Diluer l'échantillon de 100 ul avec 900 ul de PBS. 100 uL du mélange doit être compté sous forme de gouttelettes sur une lame de microscope en utilisant un microscope à dissection (dilution 1:10). Wide-bore des pointes de pipette doit être utilisée.
- Remettre en suspension les oeufs à 50.000 œufs / ml dans PBS. Les œufs peuvent être stockés pendant plusieurs mois à -80 ° C et décongelés une fois ou TWICe pour une utilisation. Avant utilisation, vérifier sous un microscope pour s'assurer que les œufs sont toujours intacts (voir Fig. 1).
2. Sensibilisation par voie intrapéritonéale avec S. Oeufs mansoni: Jour 0
- Préparez les œufs à 5000 oeufs/100 ul de PBS dans un tube de 5 ml snapcap. Pour l'injection, d'estimer les œufs de 50% de plus que nécessaire.
- Chargez une aiguille de calibre 23 et un 3/4inch seringue de 1 ml avec 100 uL de suspension d'oeufs par souris. Oeufs de régler, l'aiguille charge alors avec des œufs immédiatement avant utilisation.
- Seringue rock d'avant en arrière pour mélanger les oeufs avant chaque injection, et d'injecter par voie intrapéritonéale 100 pi de suspension par la souris.
3. Rétro-orbitaire Défi intraveineuse avec S. Oeufs mansoni: Jour 14
- Préparer les œufs comme ci-dessus à 5.000 oeufs/100 ul.
- Anesthésier souris dans la chambre spécialisée à l'isoflurane (4%), ou par voie intrapéritonéale avec la xylazine (10 mg / kg) et la kétamine (120 mg / kg). Profondeur de anesthesia est déterminé par le pincement de la patte et en veillant pas de réponse physique.
- Après chargement de la seringue de 1 ml et 23 aiguille de la jauge 3/4inch avec des œufs, d'utiliser des pinces pour plier l'aiguille à un angle de 90 ° avec le biseau vers le bas dans l'angle. Assurez-vous qu'aucun des bulles sont présentes.
- Placer la souris sur un côté. Rentrer la peau de sorte œil saillie, et injecter 100 ml dans les vaisseaux derrière le globe oculaire à un angle de 45 ° sur le nez.
- Retirer l'aiguille et appliquer une légère pression pour contrôler le saignement.
Toutes ces procédures doivent être effectuées avec soin, et la souris doivent être surveillés jusqu'à ce qu'ils récupèrent de l'anesthésie. Ces protocoles ont été approuvés par l'Université de Pennsylvanie soins des animaux et le Comité institutionnel d'utilisation (IACUC).
4. Récolte expérimentale: Jour 22
- Euthanasier les souris avec du CO 2.
- La souris par voie humide avec de l'éthanol 70%, et le lieu sur le dos.
- Utilisation de mousse forceps, saisir l'abdomen de la souris et faire une petite incision dans la peau. Retirez soigneusement la peau avec des ciseaux et d'exposer la cage thoracique et du péritoine.
- Couper le péritoine. Coupez l'aorte abdominale pour récupérer le sang avec une pipette Pasteur. Conservez-le sur la glace.
- Déplacez le foie vers le bas pour exposer le diaphragme. Utilisez des ciseaux fins de couper le diaphragme. Découpez soigneusement ouvert la cage thoracique afin d'exposer le tissu pulmonaire.
- Récupérer les ganglions lymphatiques qui drainent parathymic du poumon avec des pinces fines. Ceux-ci sont caché sous la cage thoracique, de chaque côté du thymus 9. Magasin sur la glace dans 1mL milieux stériles (DMEM supplémenté avec 10% inactivé par la chaleur sérum de veau foetal, 100 U / ml de pénicilline, 100 pg / mL de streptomycine, 2 mM de L-glutamine, 50 uM de 2-mercaptoéthanol, tous disponibles chez Invitrogen).
- Pour récupérer la BAL, et gonfler les poumons pour l'analyse histologique, l'intubation trachéale doit être effectuée. Exposer la trachée en déplaçant les glandes salivaires sur le côté, et Placing pinces fines sous la trachée. L'aide de ciseaux fins, découpez un trou dans le milieu de la trachée, et insérer le tube dans les poumons. Fixer la tuyauterie en attachant avec un fil chirurgical.
- Fixez PBS-remplie seringue de 1 ml à la tubulure et gonfler les poumons avec 1 ml de PBS. Soigneusement récupérer lavage BAL avec une seringue. Conservez-le sur la glace.
- Fixez paraformaldéhyde à 4% (PFA) dans du PBS-remplie seringue de 1 ml à la tubulure et gonfler les poumons.
- Retirez le tube, et serrer le fil chirurgical pour éviter les fuites de la PFA.
- Soigneusement disséquer les tissus pulmonaires et les placer dans un tube Falcon de 50 ml avec 5 ml de 4% PFA.
5. Préparation des tissus récupérés
- Sérum: Après le stockage sur de la glace pendant 30 min à 2 h pour le sang à coaguler, le sérum est récupéré à partir du sang par centrifugation (13000 xg / 10 min / 4 ° C). Le sérum est conservé à -20 ° C et peut être utilisé pour les tests ELISA des cytokines ou S. mansoni œuf spécifique de l'antigène isotype IgG ELISA 6, 10.
- Les nœuds lymphatiques: des suspensions cellulaires simples sont préparés et nombre de cellules utilisées pour évaluer l'ampleur de la réponse immunitaire. Pour examiner la polarisation des cellules Th2, les cellules sont stimulées avec re-S. antigène oeuf mansoni pendant 72 heures. Coloration des cytokines Intracellar peuvent être examinés par cytométrie de flux, et les surnageants peut être récupéré et stocké à -20 ° C pour le test ELISA de cytokines Th2 (IL-4, IL-5, IL-13) 6.
- BAL: Les cellules sont granulés (400 ug / 5 min / 4 ° C). Le liquide de LBA est récupéré et stocké à -20 ° C pour l'analyse des cytokines Th2 par ELISA. BAL chiffres cellules sont utilisées comme une lecture pour l'inflammation des voies aériennes. Préparations de cytocentrifugeuse 10,000-100,000 cellules (500 tours par minute / 5 min / 4 ° C), suivie d'une coloration Diffquik permettra énumération de infiltration inflammatoire 4, 6. Alternativement, les cellules BAL peut être examinée par 6 cytométrie en flux.
- Le tissu pulmonaire: tissu pulmonaire sont stockagenuit ed à 4 ° C. Tissus fixe est inclus en paraffine, sectionnés et montées sur des lames pour l'analyse histologique et immunofluorescence.
6. Les résultats représentatifs
Ce protocole décrit toutes les étapes nécessaires pour (i) la purification de Schistosoma mansoni oeufs pour utilisation in vivo (Fig. 1), (ii) sensibiliser et de contester la souris avec ces œufs et (iii) récupérer les organes d'examen de la réponse inflammatoire des poumons. Ce modèle in vivo entraîne une réponse reproductible du poumon puissant Th2 inflammatoire. Ceci est illustré par une inflammation des voies respiratoires et éosinophilie tels que révélés par les numérations cellulaires BAL et préparations cytocentrifugeuse (Fig. 2). H & sections du poumon E-tachés peuvent être examinées pour les oeufs induite par des granulomes (Fig. 3a), et la coloration par immunofluorescence de sections du poumon permet de visualiser les macrophages activés alternativement et Th2 induite par les cytokines telles que les gènes Résisd'étain-comme molécule (RELM) α (Fig. 3b). La réponse spécifique de l'antigène CD4 cytokine Th2 est examiné par ELISA pour l'IL-5, IL-4 et IL-13 de l'antigène-stimulées parathymic cellules des ganglions lymphatiques (fig. 4).
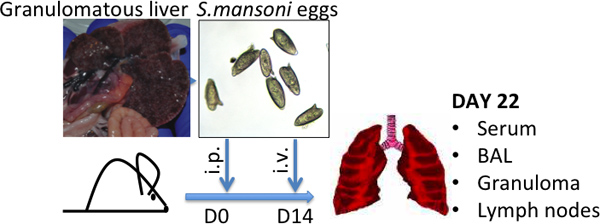
Figure 1 Schistosoma mansoni modèle d'injection pour oeufs images représentatives de foies granulomateuses, caractéristiques de haute S.mansoni-oeufs charges et d'œufs S.mansoni sont présentés -.. Taille moyenne (L) 120 um par (W) 50 um.
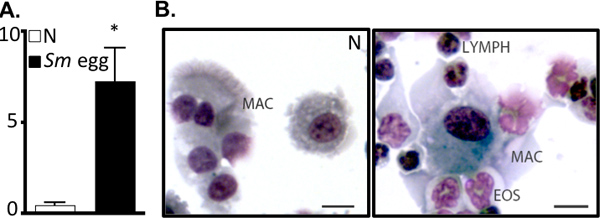
Figure 2. S. mansoni œuf d'injection entraîne une inflammation des voies respiratoires. A. Le nombre de cellules BAL (x10 5) de naïfs (N) ou S. mansoni (Sm) oeuf-souris injectées. * P <0,05. La préparation des cellules B. cytocentrifugeuse BAL. Mac, MACROPHAGES; Eos, EOSINOPHILES; LYMPHATIQUE, lymphocytes. Bar, 10 um.
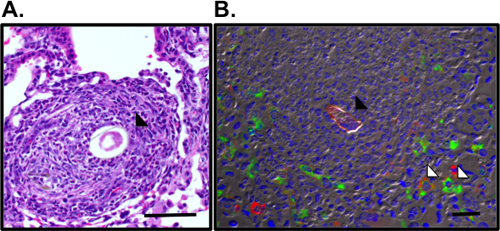
Figure 3. Visualisation des granulomes pulmonaires et les macrophages activés alternativement autour de l'œuf S.mansoni. A. Granulome pulmonaire qui entoure l'œuf Sm (flèche noire) a été visualisé dans les sections H & E-pulmonaires colorées. B. Immunofluorescence coloration pour RELMα (vert), le récepteur du mannose (rouge) et DAPI (bleu) révèle encore des macrophages activés (flèche blanche) dans le granulome entourant le autofluorescente Sm oeuf (flèche noire). Bar, 50 um.
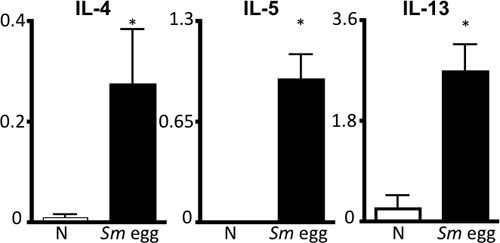
Figure 4. S.mansoni oeuf spécifique de l'antigène réponse des cytokines Th2. Vidange parathymic cellules ganglionnaires de souris naïves (N) ou Sm-oeuf injecté ont été stimulées avec Sm </ Em antigène oeuf> pendant 72 heures, suivie par la méthode ELISA de surnageants de l'IL-4, IL-5 et IL-13. Échelle, ng / mL. * P <0,05.
Discussion
Ici, un modèle utilisant de Schistosoma mansoni oeufs à induire une inflammation du poumon de type 2 est décrite. Les traits caractéristiques de ce modèle incluent le puissant réponse immunitaire de type Th2, inflammation des voies respiratoires et la formation de granulomes pulmonaires. Étant donné que ces paramètres dépendent des réponses des lymphocytes CD4 Th2 11, il s'agit d'un modèle utile pour étudier les effets des suppressions de protéines spécifiques ou de la lignée ...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par le National Institutes of Health (NIH) AI091759 et la maladie de Crohn et la colite Fondation de William de l'Amérique et Shelby Modell famille Bourse de recherche Fondation (à MN). Schistosome-souris infectées ont été fournis par le Centre de ressources Schistosome NIAID (NIAID contrat N01 A130026).
matériels
| Name | Company | Catalog Number | Comments |
| Réactif | Taille / Description | Entreprise | Catalogue # |
| Collagénase / dispase | 500 mg | Roche Applied Science | 11 097 113 001 |
| Diff Quik Hema 3 Stain | Emballer | Fisher Scientific Co. LLC | 122-911 |
| DMEM | Liquide | Gibco | 11965 |
| Falcon de 50 ml | Emballer | Faucon | 352070 |
| Intramedic PE tubes | 0,58 mm | Becton Dickinson and Co. | 427410 |
| L'isoflurane | 250 ml | De la santé animale abbé | 52600405 |
| La kétamine | 100 mg / ml | Fort Dodge, la santé animale | N / A |
| Anticorps anti-récepteur du mannose | La biotine | AbD Serotec | MCA2235B |
| Metallic Crépine | Passoire de cuisine standard | Cible | Laurentiis |
| Paraformaldéhyde | 16% | Electron Microsc. Sciences | 15710 |
| Pénicilline / streptomycine | 100x | Gibco | 15070 |
| Percoll | 1 Litre | GE Healthcare Biosciences | 17 0891 01 |
| Anticorps RELMα | 50 pg | Peprotech | 500-P214 |
| Fil chirurgical | 2,0 USP 100 yds | Spécialités chirurgicales Corp | SP118 |
| Aiguille de la seringue | 23g, 3/4 pouce | BD Vacutainer Lab. Med. | 305143 |
| Normes pour les essais aux Etats-Unis Sieve | 150 um, 0,0059 " | WS Tyler, Inc | ASTME-11, Spec. N ° 100 |
| La xylazine | 20 mg / ml | Majordome | N / A |
Références
- World Health Organization. Prevention and control of schistosomiasis and soil-transmitted helminthiasis: report of a WHO expert committee. WHO Technical Report Series 912. , (2002).
- Pearce, E. J., MacDonald, A. S. The immunobiology of schistosomiasis. Nat. Rev. Immunol. 2, 499-511 (2002).
- Sandler, N. G. Global gene expression profiles during acute pathogen-induced pulmonary inflammation reveal divergent roles for Th1 and th2 responses in tissue repair. J. Immunol. 171, 3655-3667 (2003).
- Perrigoue, J. G. IL-31-IL-31R interactions negatively regulate type 2 inflammation in the lung. J. Exp. Med. 204, 481-487 (2007).
- Sandor, M., Weinstock, J. V., Wynn, T. A. Granulomas in schistosome and mycobacterial infections: a model of local immune responses. Trends Immunol. 24, 44-52 (2003).
- Nair, M. G. Alternatively activated macrophage-derived RELM-{alpha} is a negative regulator of type 2 inflammation in the lung. J. Exp. Med. 206, 937-952 (2009).
- Dalton, J. P. A method for the isolation of schistosome eggs and miracidia free of contaminating host tissues. Parasitology. 115, 29-32 (1997).
- Lewis, F. A. Large-scale laboratory maintenance of Schistosoma mansoni, with observations on three schistosome/snail host combinations. J. Parasitol. 72, 813-829 (1986).
- Tilney, N. L. Patterns of lymphatic drainage in the adult laboratory rat. J. Anat. 109 (Pt. 3), 369-383 (1971).
- Lewis, F., Coligan, J. E. Schistosomiasis. Current protocols in immunology. Chapter 19, Unit 19 (2001).
- Kaplan, M. H. Th2 cells are required for the Schistosoma mansoni egg-induced granulomatous response. J. Immunol. 160, 1850-1856 (1998).
- Wynn, T. A. Fibrotic disease and the T(H)1/T(H)2 paradigm. Nat. Rev. Immunol. 4, 583-594 (2004).
- Cheever, A. W. Variation of hepatic fibrosis and granuloma size among mouse strains infected with Schistosoma mansoni. Am. J. Trop. Med. Hyg. 37, 85-97 (1987).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon