Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Crónica a largo plazo
En este artículo
Resumen
Se describe el método de agar-perlas para establecer la infección de las vías respiratorias persistente a largo plazo crónica de Pseudomonas aeruginosa en el modelo de ratón.
Resumen
Un modelo de ratón de la infección crónica de la vía aérea es un activo clave en la fibrosis quística (FQ) de investigación, aunque hay una serie de preocupaciones con respecto al modelo en sí. Fases tempranas de la inflamación y la infección han sido ampliamente estudiados utilizando el modelo de agar-perlas de ratón Pseudomonas aeruginosa, mientras que sólo pocos informes se han centrado en la infección crónica a largo plazo in vivo. El reto principal para la infección crónica a largo plazo sigue siendo la baja carga bacteriana de P. aeruginosa y el bajo porcentaje de semana ratones infectados después de la exposición, lo que indica que las células bacterianas se borran progresivamente por el anfitrión.
En este trabajo se presenta un método para la obtención de la infección crónica eficiente a largo plazo en ratones. Este método se basa en la incorporación de la P. cepas clínicas aeruginosa en el agar-perlas in vitro, seguido de la instilación intratraqueal en ratones C57Bl/6NCrl. Infección pulmonar bilateral se asocia a sevrales medibles de lectura-outs, incluyendo la pérdida de peso, la mortalidad, la infección crónica, y la respuesta inflamatoria. El P. Se prefirió aeruginosa RP73 cepa clínica sobre la cepa de laboratorio de referencia PAO1 ya que resultó en una mortalidad relativamente baja, las lesiones más graves y mayor infección crónica. P. aeruginosa colonización puede persistir en el pulmón durante más de tres meses. Patología pulmonar murino se asemeja a la de los pacientes con FQ con enfermedad pulmonar crónica avanzada.
Este modelo murino imita más estrechamente el curso de la enfermedad humana y puede ser utilizado tanto para los estudios sobre la patogénesis y para la evaluación de nuevas terapias.
Introducción
La fibrosis quística (FQ) es una enfermedad genética causada por mutaciones en el quística regulador de la conductancia transmembrana de la fibrosis gen (CFTR). Este gen codifica para un canal de cloruro expresado en la membrana de la mayoría de las células epiteliales. Bronquiectasia, tapones mucosos y parénquima destrucción causada principalmente por infecciones por Pseudomonas aeruginosa conducen progresivamente a la enfermedad pulmonar grave y la mortalidad en la mayoría de los pacientes con FQ 1. Patogénesis CF entendimiento y el desarrollo de nuevas terapias se basan en el modelo animal con rasgos característicos de la CF. Varios ratones, genéticamente modificados para el gen CFTR, se han generado, pero las limitaciones en la capacidad de estas especies de recapitular la enfermedad de pulmón con FQ como-y varias otras anomalías de órganos observados en los pacientes con FQ han sido ampliamente documentado 2.
Desarrollo de la infección es uno de los principales retos en modelo animal CF. Las cl literaturatemprano sugiere que una infección crónica que dura más de un mes sólo puede lograrse si los ratones se inocularon con bacterias incrustadas en un agente de inmovilización tales como agar, agarosa, alginato o algas 3-5. Estos agentes de inmovilización proporcionan las condiciones microaeróbica / anaerobias que permiten que las bacterias crezcan en forma de microcolonias, al igual que el crecimiento de la mucosa de los pacientes con FQ 6. Este modelo de la infección crónica conduce a la persistencia de la bacteria en los pulmones y causar inflamación de las vías respiratorias y daños 7. Sin embargo, dependiendo del método utilizado, la cepa bacteriana y la dosis inoculada en los pulmones, el porcentaje de los ratones infectados crónicos y la carga bacteriana recuperado en los pulmones en diferentes puntos de tiempo pueden diferir considerablemente. En particular, el principal desafío para la infección crónica a largo plazo sigue siendo la baja carga bacteriana de P. aeruginosa y el bajo porcentaje de semana ratones infectados después de la exposición, lo que indica thacélulas bacterianas camisetas se borran progresivamente por el anfitrión. Mediante la selección de la P. aeruginosa RP73 cepa clínica de una colección de cepas CF 8 recabamos baja mortalidad, las lesiones más graves, y un alto porcentaje de infección crónica con una carga bacteriana estable hasta un mes en ratones C57Bl/6NCrl.
En este trabajo se detalla la metodología para incluir P. aeruginosa en las perlas de agar; hemos ratones infectados por instilación intratraqueal, se mide la carga bacteriana y citoquinas en los pulmones, se recogió el líquido de BAL y realizado el examen histológico. En general, este protocolo ayudará a los investigadores para abordar cuestiones de importancia fundamental en la patogénesis de 8,9 y probando nuevas terapias contra P. aeruginosa infección crónica 10,11.
Protocolo
1. Las bacterias Preparación para la infección crónica (de tres y dos días antes de Ratón Challenge)
- Seleccione el P. apropiada cepa aeruginosa a probar.
- Inocular un asa de siembra de P. aeruginosa de un -80 ° C cultivo madre a una placa de agar de soja Trypticase (TSA) y se incuba a 37 ° C durante la noche.
- Elige una sola colonia e inocular en 5 ml de caldo de soja Trypticase (TSB) en un complemento capsulado tubo de 15 ml y se incuba a 37 ° C durante la noche en una incubadora de agitación a 200 rpm.
2. Incorporación de bacterias en perlas de agar para la infección crónica (un día antes de la infección)
- Tomar una pequeña alícuota de cultivo de una noche de bacterias, diluidas 1:50 en tampón fosfato salino (PBS) y medir la densidad óptica (DO) a 600 nm.
- Diluir el cultivo bacteriano durante la noche mediante la adición de 2 OD en un nuevo tubo a presión con tapa que contenga 20 ml de TSB fresco.
- Incubar a 37 ° C durante aproximadamente 3 -4 h hasta la fase logarítmica en una incubadora de agitación a 200 rpm, hasta que se alcanza un total de 10-15 OD.
- Mientras tanto, preparar el TSA, hecha de TSB con 1,5% de agar, autoclave y equilibrar a 50 ° C en un baño de agua. Equilibre 150 ml de aceite mineral pesado preautoclaved en un matraz Erlenmeyer a 50 ° C en un baño de agua.
- Una vez que P. aeruginosa llega a la fase de registro, recoger las células bacterianas por centrifugación a 2700 xg durante 15 min a 4 ° C y descartar el sobrenadante.
- Resuspender el sedimento bacteriano en 1 ml de PBS estéril y mezclar bien para resuspender completamente el sedimento.
- Mezclar 1 ml de suspensión bacteriana con 9 ml de TSA líquido pre-equilibradas a 50 º C.
- Añadir los 10 ml TSA-p mezcla aeruginosa a aceite mineral pesado (precalentado a 50 ° C) e inmediatamente se agita durante 6 min a temperatura ambiente. La agitación debe producir un vórtice visible en el aceite.
- Enfriar la mezcla a 4 ° C, agitando a la mínima speed durante 35 min (Figura 1).
- Coloque la mezcla de agar-cuentas-petróleo en hielo durante 20 min.
- Transfiera las agar-cuentas en 50 ml tubos Falcon y centrifugar a 2700 xg durante 15 min a 4 ° C.
- Eliminar con precisión el aceite mineral y lavar con PBS estéril seis veces, tal como se describe en el paso 2.11. Después de tres lavados, las perlas pueden ser sedimentan por gravedad en lugar de utilizar la centrífuga. Después del último lavado, volver a suspender las agar-cuentas en ml PBS 20-30.
- Tomar una alícuota de las perlas (aproximadamente 0,5 ml) y asépticamente homogeneizar.
- Tomar 100 l de las perlas homogeneizadas y se diluye en 900 l de PBS estéril. En serie diluir 1:10 a 10 -6.
- Placa de dilución en serie en placas de TSA, incluyendo la muestra sin diluir hasta 10 -6 e incubar las placas a 37 ° C.
- Mida el diámetro del grano usando un microscopio de luz invertido en varios campos. El diámetro del grano debe estar entre 100-200 micras ( Figura 1).
- Guarde las perlas de la noche a 4 ° C.
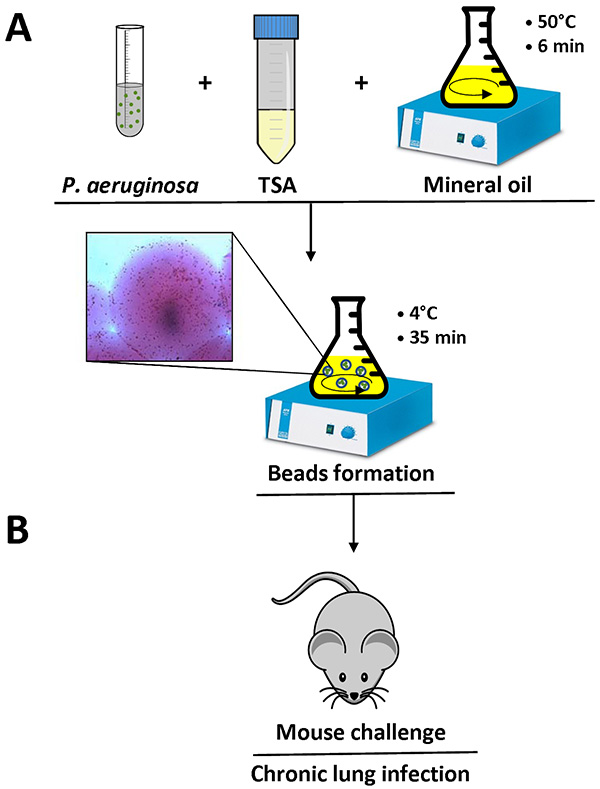
Figura 1. Descripción general de la preparación y el ratón cuentas infección agar. P. aeruginosa células se resuspenden en 1 ml de PBS y se añadieron a 9 ml de TSA líquido (50 ° C). Esta mezcla se añade a 150 ml de aceite mineral pesado a 50 ° C en un matraz y se agitó a alta velocidad durante 6 min a temperatura ambiente. Cuando el matraz se enfrió a 4 ° C con una agitación lenta durante 35 min, el agar se solidifica la creación de cuentas, y las bacterias presentes en la mezcla están incrustados en las perlas de agar. Se muestra Detalle de una perla de agar que contiene células bacterianas (A). Después de retirar el aceite mineral con varios lavados con PBS estéril, la suspensión de agar-perlas está listo fo la inoculación en los pulmones de los ratones mediante una inyección intratraqueal (B). Haga clic aquí para ver la imagen más grande .
3. Ratones Challenge con Agar-cuentas
Declaración de Ética: Este protocolo y experimentación siguen las directrices del comité de cuidado de los animales y la ética del Instituto Científico San Raffaele.
- Contar el número de unidades formadoras de colonias (UFC) en las placas de TSA para determinar el número de CFU / ml en la suspensión de agar-perlas. Diluir el agar-perlas con PBS estéril a 2-4 x 10 7 UFC / ml para llegar a un inóculo óptimo de 1-2 x 10 6 en 50 l.
- Anestesie C57Bl/6NCr (20-22 g, 6-8 semanas de edad) ratones macho con ketamina (50 mg / ml) y xilazina (5 mg / ml) en NaCl al 0,9% administrado en un volumen de 0,002 ml / g de peso corporal por inyección intraperitoneal.
NOTA: La anestesia se considera adeqluar cuando el animal se queda quieto en silencio, no responde a los estímulos externos, y tiene corazón constante y la frecuencia respiratoria. - Coloque el ratón en la posición supina. Desinfectar el pelaje del ratón con etanol al 70%.
- Exponer la tráquea por un corte vertical de la piel y intubar la tráquea con un catéter flexible mm IV estéril, 22 G 0,9 mm x 25, mantener la atención para retirar el estilete mientras se mueve hacia abajo dentro de la tráquea. Inserte el catéter no demasiado profundamente en la tráquea. Pare antes de llegar a la carina (bifurcación).
- Inmediatamente tomar un volumen de 50 l de agar suspensión de cuentas por una jeringa de 1 ml y adjuntarlo al catéter. Empuje suavemente el émbolo de la jeringa, permitiendo que las perlas se pueden implantar en el pulmón. Cerrar la incisión con clips de sutura.
- Colocar el animal sobre una almohadilla caliente hasta que esté completamente despierto.
4. Evaluación Ratones
- Observar los ratones diariamente para detectar signos clínicos que incluyen la calidad del pelaje, la postura,deambulación, y el estado de hidratación. Vigilar el peso corporal al día. Los ratones que pierden ≥ 20% del peso corporal deben ser sacrificados.
- Siga el punto 5 para la recogida del líquido de lavado broncoalveolar (BAL) y Puntos de 6 o 7 para la recogida de los pulmones y el análisis de UFC totales, el análisis histológico, la respuesta inflamatoria en términos de recuento total y diferencial de células en el BAL, el análisis de citoquinas, y actividad de mieloperoxidasa (MPO).
5. BAL fluido de recogida y análisis
- La eutanasia a los ratones por inhalación de CO2.
- Coloque el ratón en la posición supina. Desinfectar el pelaje del ratón con etanol al 70%.
- Exponer la tráquea y la caja torácica por un corte vertical de la piel. Exponer los pulmones cortando el diafragma.
- Inserte un hilo de sutura debajo de la tráquea con unas pinzas y intubar la traquea con un flexible 22 g 0,9 mm x 25 mm sonda estéril, IV. Tire de los dos extremos del hilo de sutura para unir el catheter a la tráquea y anudar el hilo alrededor de la tráquea.
- Tome un volumen de 1 ml de RPMI 1640 utilizando una jeringa de 1 ml y adjuntarlo al catéter. Empuje el émbolo de la jeringa para lavar los pulmones e inmediatamente recuperar el líquido, almacenándolo en un tubo de 15 ml.
NOTA: Si citoquinas se van a analizar, agregar inhibidores de la proteasa de RPMI 1640. - Repita este paso tres veces con un total de 3 ml de RPMI. A partir de ahora, almacenar el líquido de BAL en hielo. Ve a paso 6 de la recolección y analizar pulmones.
NOTA: Tenga en cuenta que no todo el líquido se va a recibir (2,8 ml máximo). - Para la cuantificación de las bacterias presentes en el líquido de BAL, muestrear una pequeña alícuota (300 l), en serie diluir 1:10 en PBS estéril, placa en placas de TSA y se incuba a 37 ° C durante la noche.
- Cuente el total de células usando un microscopio óptico de luz invertida diluyendo una alícuota de la BAL fluido 1:2 con solución Tuerk en una cámara de recuento de células Burker.
- Centrifugar la remaining BAL líquido a 330 xg durante 8 minutos a 4 ° C. Tome el sobrenadante para el análisis de citoquinas ELISA, almacenándolo a -80 ° C. Siga los pasos del 5.10 a 5.13 para el recuento celular diferencial por cytospin.
- Si el sedimento es rojo, lisar los eritrocitos resuspendiendo el sedimento en 250-300 l de tampón de lisis de RBC se diluyeron 1:10 en agua destilada ultra pura durante 3 min. Neutralizar con 2 ml de PBS y centrifugar a 330 xg durante 8 min a 4 ° C.
- Desechar el sobrenadante y resuspender el sedimento en medio RPMI 10% de suero bovino fetal (FBS). Utilice un volumen que proporcionará 1 x 10 6 células / ml, basado en el recuento total de células.
- Colocar los portaobjetos de microscopio y filtros en las ranuras apropiadas en el citocentrifugado con los filtros de cartón que se enfrenta el centro de la citospina. Pipetear 150 l de cada muestra en los pocillos apropiados de la cytospin y centrifugar en una citocentrífuga a 300 xg durante 5 min.
- Teñir diapositivas por la tinción de Romanowsky utilizando un kit comercial, de acuerdo con la maciones del fabricante y las instrucciones de como se ha descrito anteriormente 12. Siga los pasos del 05.14 a 05.17 para el análisis de la actividad de MPO.
- Centrifugar el volumen restante de BAL a 380 xg durante 5 min a 4 ° C. Desechar el sobrenadante y resuspender el sedimento en 250 l de cloruro de hexadeciltrimetilamonio 0,5% en agua destilada ultra pura para lisar las células. La suspensión puede ser congelada a -20 ° C durante varios días antes de realizar el ensayo.
- Centrifugar a 16.000 xg durante 30 min a 4 ° C y utilizar el sobrenadante para realizar el ensayo de MPO en placas de 96 pocillos, la adición de la muestra por duplicado a cada pocillo y si es necesario, también diluciones adecuadas de la muestra.
- Añadir a cada muestra en los pocillos un volumen igual de 3,3 ', 5,5'-tetrametilbenzidina (TMB) como sustrato para la peroxidasa. Deje que la reacción se lleve a cabo en la oscuridad durante al menos 5 minutos y hasta que no haya un mayor desarrollo en el color.
- Detener la reacción añadiendo 2 MH 2 SO 4 unND medir la DO a 450 nm. El valor de DO será directamente proporcional a la actividad de peroxidasa.
6. La medición de la carga bacteriana en el Análisis de pulmón y de citoquinas
- Inmediatamente después de la recolección de fluidos BAL, pulmones especiales del ratón, se enjuagan con PBS estéril, lóbulos separados, los pusieron en un tubo de fondo redondo con 2 ml de PBS estéril y se almacenan en hielo.
NOTA: Si citoquinas se van a analizar, añadir inhibidores de la proteasa de PBS a los tubos. - Asépticamente homogeneizar pulmones, tomar una pequeña alícuota (300 l) del homogeneizado, en serie se diluye 1:10 en PBS, placa en placas de TSA y se incuba a 37 ° C durante la noche. Tenga en cuenta que la carga total de bacterias de las vías respiratorias será la suma de las UFC se encuentran en el líquido de BAL y pulmón.
- Centrifugar el homogeneizado restante a 16.000 xg durante 30 min a 4 ° C. Tome el sobrenadante para el análisis de citoquinas ELISA, y se almacena a -80 ° C.
7. El examen histológico
- Realizar el análisis histológico sólo en los pulmones en la que no ha sido cobrado el LBA, para preservar los aspectos y propiedades de pulmón.
- La eutanasia a los ratones por inhalación de CO2.
- Exponer la caja torácica por un corte vertical de la piel, exponer a los pulmones por el corte de la membrana.
- Pulmones Impuestos Especiales, se enjuagan con PBS, se separan los lóbulos, los pusieron en un tubo que contiene formol 5-10 ml 10% tamponada neutra (4% de formaldehído) y se almacena a 4 ° C protegido de la luz.
- Pulmones Insertar en parafina, utilizando procedimientos estándar.
- Cortar 5 micras de espesor secciones usando un microtomo.
- Diapositivas mancha con hematoxilina y eosina y cubren los portaobjetos con un cubreobjetos, de acuerdo con procedimientos estándar.
- Examinar los portaobjetos usando un microscopio de campo claro invertida y adquirir imágenes conectando el microscopio a una cámara.
Resultados
Cuando el protocolo se hace correctamente, el P. aeruginosa agar-cuentas medirán entre 100-200 micras y pueden ser observados con un microscopio de luz invertida con la pipeta un pequeño volumen de la suspensión de agar-cuentas en una diapositiva. Células bacterianas individuales son visibles en las perlas de agar, como se muestra en detalle en la figura 1.
La elección de P. aeruginosa cepa utilizada en la preparación de agar-perlas es crítica.
Discusión
Los pasos críticos en la P. preparación aeruginosa-cuentas y el desafío del ratón se presentan a continuación.
La cepa de P. aeruginosa se utiliza para el desafío ratones es crítico. La mortalidad, la infección crónica o aclaramiento pueden diferir significativamente dependiendo de la cepa bacteriana utilizada para el desafío. El P. Se prefirió aeruginosa RP73 cepa clínica sobre la cepa de laboratorio de referencia PAO1 ...
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
La investigación en el laboratorio de Bragonzi ha sido financiado por la Fundación de Fibrosis Quística italiana (CFaCore) y UE-F7-2009-223670. Parte de este trabajo se llevó a cabo en ALAMBIQUE, un laboratorio de microscopía avanzada, y la histopatología del ratón se llevó a cabo en la Unidad de Anatomía Patológica (Instituto Científico San Raffaele).
Materiales
| Name | Company | Catalog Number | Comments |
| Bacto Tryptic Soy Broth | Becton Dickinson | 211823 | |
| Difco Agar, granulated | Becton Dickinson | 214510 | |
| Heavy mineral oil | Sigma-Aldrich | 330760-1L | |
| S-(+)-Ketamine hydrochloride | Sigma-Aldrich | K1884 | |
| Xylazine hydrochloride | Sigma-Aldrich | X1251 | |
| 1 ml Syringe 25 G 5/8 in 0.5 mm x 16 mm | PIC | 3071250300350 | |
| Catheter 22 G 0.9 mm x 25 mm | Becton Dickinson | 381223 | |
| Graefe Forceps - 0.5 mm Tips Curved | Fine Science Tools | 11152-10 | |
| Scissors, Iris, 11 cm, straight | World Precision Instruments | 501758 | |
| Suture clips | Fine Science Tools | 12040-01 | |
| Suture thread | Fine Science Tools | 18020-40 | |
| RPMI 1640 | Lonza | BE12-167F | |
| Complete protease inhibitor cocktail | Roche | 11836145001 | |
| Fast-Read 102 Burker disposable chamber | Biosigma | 390497 | |
| Tuerk solution | Fluka | 93770 | |
| RBC lysis buffer | Biolegend | 420301 | |
| Fetal bovine serum | Lonza | DE14-801F | |
| EZ cytofunnel | Thermo Scientific | A78710021 | |
| Superfrost ultra plus microscope slides | Thermo Scientific | J3800AMNZ | |
| Diff-Quik Romanowsky staining set | Medion Diagnostics | 130832 | |
| Hexadecyltrimethylammonium chloride | Sigma-Aldrich | 52366-10G | |
| 96-well EIA/RIA plate | Costar | 3590 | |
| 3,3’,5,5’- Tetramethylbenzidine | Sigma-Aldrich | T8665-1L | |
| Sulfuric acid | Sigma-Aldrich | 320501-1L | |
| 10% Neutral buffered formalin | Bio-Optica | 05-01005Q | |
| Harris hematoxylin non Papanicolau | Bio-Optica | 05-M06004 | |
| Eosin plus alcoholic solution | Bio-Optica | 05-M11007 | |
| Equipment | |||
| Shaking incubator | Amerex Instruments | Steady Shake 757 | |
| Water bath | Grant | SUB14 | |
| Homogenizer | Ystral | ||
| Precision balance | KERN | 440-47N | |
| Cytocentrifuge | Thermo Scientific | A78300003 | |
| Low Cost Heating Pad | 2biol | LCHP | |
| Homogenization probe | Ystral | 2366925(small) | |
| Inverted optical microscope | Zeiss | Axioplan2 | |
| Camera (microscope) | Zeiss | Axiocam MRc5 | |
| Rotary microtome | Leica | RM2255 | |
Referencias
- Gibson, R., Burns, J. L., Ramsey, B. W. Pathophysiology and management of pulmonary infections in cystic fibrosis. Am. J. Respir. Crit. Care. 168, 918-951 (2003).
- Bragonzi, A. Murine models of acute and chronic lung infection with cystic fibrosis pathogens. IJMM. 300, 584-593 (2010).
- Cash, H. A., McCullough, B., Johanson, W. G., Bass, J. A. A rat model of chronic respiratory infection with Pseudomonas aeruginosa. Am. Rev. Respir. Dis. 119, 453-459 (1979).
- Starke, J. R., Langston, C., Baker, C. J. A mouse model of chronic pulmonary infection with Pseudomonas aeruginosa and Pseudomonas cepacia. Pediatr. Res. 22, 698-702 (1987).
- Pedersen, S. S., Hansen, B. L., Hansen, G. N. Induction of experimental chronic Pseudomonas aeruginosa lung infection with P. aeruginosa entrapped in alginate microspheres. APMIS. 98, 203-211 (1990).
- Bragonzi, A., et al. Nonmucoid Pseudomonas aeruginosa expresses alginate in the lungs of patients with cystic fibrosis and in a mouse model. J. Infect. Dis. 192, 410-419 (2005).
- van Heeckeren, A. M. Murine models of chronic Pseudomonas aeruginosa lung infection. Lab. Anim. 36, 291-312 (2002).
- Bragonzi, A., et al. Pseudomonas aeruginosa microevolution during cystic fibrosis lung infection establishes clones with adapted virulence AJRCCM. 180, 138-145 (2009).
- Kukavica-Ibrulj, I., Facchini, M., Cigana, C., Levesque, R. C., Bragonzi, A., Filloux, S., Ramos, J. L. Assessing Pseudomonas aeruginosa virulence and the host response using murine models of acute and chronic lung infection. Methods in Pseudomonas aeruginosa: Humana Press. , (2014).
- Moalli, F., et al. The Therapeutic Potential of the Humoral Pattern Recognition Molecule PTX3 in Chronic Lung Infection Caused by Pseudomonas aeruginosa. J. Immunol. 186, 5425-5534 .
- Paroni, M. Response of CFTR-deficient mice to long-term Pseudomonas aeruginosa chronic infection and PTX3 therapeutic treatment. J. Infect. Dis. In press, .
- Maxeiner, J., Karwot, R., Hausding, M., Sauer, K. A., Scholtes, P., Finotto, S. A method to enable the investigation of murine bronchial immune cells, their cytokines and mediators. Nat. Protoc. 2, 105-112 (2007).
- Bragonzi, A., et al. Pseudomonas aeruginosa microevolution during cystic fibrosis lung infection establishes clones with adapted virulence.. AJRCCM. In press, (2009).
- Pirone, L., et al. Burkholderia cenocepacia strains isolated from cystic fibrosis patients are apparently more invasive and more virulent than rhizosphere strains. Environ. Microbiol. 10, 2773-2784 (2008).
- Bragonzi, A., et al. Modelling co-infection of the cystic fibrosis lung by Pseudomonas aeruginosa and Burkholderia cenocepacia reveals influences on biofilm formation and host response. PLoS One. 7, .
- Bianconi, I., et al. Positive signature-tagged mutagenesis in Pseudomonas aeruginosa: tracking patho-adaptive mutations promoting long-term airways chronic infection. PLoS Pathog.. 7, (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados