É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Crônica de Longo Prazo
Neste Artigo
Resumo
Descreve-se o método de ágar-esferas de estabelecer infecção das vias aéreas persistente a longo prazo crônica Pseudomonas aeruginosa no modelo de mouse.
Resumo
Um modelo do rato de infecção crônica das vias aéreas é um elemento essencial na fibrose cística (FC) de pesquisa, embora haja uma série de preocupações sobre o próprio modelo. Fases precoces da infecção e inflamação tem sido amplamente estudado utilizando o modelo de rato de agar-grânulos de Pseudomonas aeruginosa, embora apenas alguns relatórios têm-se centrado na infecção crónica a longo prazo in vivo. O principal desafio para a infecção crónica a longo prazo continua a ser a baixa carga bacteriana por P. aeruginosa e o baixo percentual de semanas ratos infectados após o desafio, indicando que as células bacterianas são progressivamente apuradas pelo anfitrião.
Este artigo apresenta um método para a obtenção de infecção crônica eficiente a longo prazo em camundongos. Este método baseia-se na incorporação do p estirpes clínicas aeruginosa no agar-beads in vitro, seguida por instilação endotraqueal em ratos C57Bl/6NCrl. Infecção pulmonar bilateral está associada a SEVeral mensuráveis de leitura-outs incluindo perda de peso, mortalidade, infecção crônica, e na resposta inflamatória. O P. aeruginosa RP73 tensão clínico foi preferido em relação a cepa de laboratório de referência PAO1 uma vez que resultou em uma taxa de mortalidade mais baixa comparativamente, as lesões mais graves, e infecção crônica superior. P. colonização aeruginosa pode persistir no pulmão por mais de três meses. Patologia do pulmão murino se assemelha ao de pacientes com FC com doença pulmonar crônica avançada.
Este modelo murino imita mais de perto o curso da doença humana e pode ser utilizado tanto para os estudos sobre a patogénese e para a avaliação de novas terapias.
Introdução
A fibrose cística (FC) é uma doença genética causada por mutações no transmembrana da fibrose cística condutância gene regulador (CFTR). Este gene codifica para um canal de cloreto expressa na membrana da maior parte das células epiteliais. Destruição bronquiectasia, o entupimento do muco e do parênquima causada principalmente por infecções por Pseudomonas aeruginosa, progressivamente, induzir doença pulmonar grave e mortalidade na maioria dos pacientes com FC 1. Entendimento patogênese CF e um maior desenvolvimento de novas terapias confiar em modelo animal com traços característicos da CF. Vários ratinhos geneticamente modificados, para o gene de CFTR, foram gerados, mas limitações na capacidade destas espécies para recapitular doença pulmonar CF-like e várias outras alterações de órgãos observados em pacientes com FC foi amplamente documentado 2.
Desenvolvimento de infecção é um dos principais desafios na CF modelo animal. Os cl literaturainiciais sugerem que uma infecção crónica que durou mais do que um mês pode ser conseguido somente se os ratinhos são inoculados com bactérias incorporados num agente imobilizante tais como agar, agarose, ou algas alginato 3-5. Estes agentes imobilizantes proporcionar as condições microaeróbico / anaeróbias, que permitem que as bactérias crescem na forma de microcolónias, de forma semelhante para o crescimento no muco de doentes CF 6. Este modelo de infecção crônica leva à persistência da bactéria nos pulmões, causando inflamação das vias respiratórias e danos 7. No entanto, dependendo do método utilizado, a estirpe bacteriana e da dose inoculada nos pulmões, a percentagem de ratinhos infectados crónicas e a carga bacteriana nos pulmões recuperado em diferentes pontos de tempo pode variar consideravelmente. Em particular, o principal desafio para a infecção crônica a longo prazo continua a ser a baixa carga bacteriana por P. aeruginosa e o baixo percentual de semanas ratos infectados após o desafio, indicando that células bacterianas são progressivamente apuradas pelo anfitrião. Ao selecionar o P. aeruginosa RP73 tensão clínico de uma coleção de CF isola 8 obtivemos êxito baixa mortalidade, as lesões mais graves, e alta porcentagem de infecção crônica com uma carga bacteriana estável até um mês em ratos C57Bl/6NCrl.
Este artigo detalha a metodologia para a incorporação de P. aeruginosa nos grânulos de agar; temos de camundongos infectados por instilação intratraqueal, medido a carga bacteriana nos pulmões e citocinas, recolhidos do fluido BAL e realizado o exame histológico. No geral, este protocolo vai ajudar os pesquisadores na abordagem de questões fundamentalmente importantes na patogênese 8,9 e teste de novas terapias contra o P. aeruginosa infecção crônica 10,11.
Protocolo
1. As bactérias que se preparam para a infecção crônica (três e dois dias antes Rato Challenge)
- Selecione o P. apropriado aeruginosa para ser testado.
- Inocule uma ansa de P. aeruginosa a partir de uma -80 ° C a uma cultura de placa de agar de tripticase de soja (TSA) e incubar a 37 ° C durante a noite.
- Escolha de uma única colónia e inocular em 5 ml de Caldo de Soja Trypticase (TSB) num encaixe de casquilho tubo de 15 ml e incubar a 37 ° C durante a noite numa incubadora com agitação a 200 rpm.
2. Incorporação bactérias em ágar Beads para a infecção crônica (um dia antes da infecção)
- Tomar uma pequena alíquota da cultura bacteriana durante a noite, dilui-se a 1:50 em tampão fosfato salino (PBS) e medir a densidade óptica (DO) a 600 nm.
- Dilui-se a cultura durante a noite de bactérias por adição de 2 OD em um novo tubo de pressão com tampa contendo 20 ml de TSB fresco.
- Incubar a 37 ° C durante cerca de 3 -4 h até à fase logarítmica em uma incubadora com agitação a 200 rpm, até um total de 10-15 OD é atingido.
- No entanto, preparar o TSA, feito de TSB com 1,5% de ágar, autoclave e equilibrar-se a 50 ° C em um banho de água. Equilibrar a 150 ml de óleo mineral pesado preautoclaved em um balão de Erlenmeyer a 50 ° C em um banho de água.
- Uma vez que P. aeruginosa alcança a fase log, recolher as células bacterianas por centrifugação a 2.700 xg durante 15 min a 4 ° C e desprezar o sobrenadante.
- Ressuspender o sedimento de bactérias em 1 ml de PBS estéril e vórtice completamente para ressuspender completamente o sedimento.
- Misturar 1 ml de suspensão bacteriana com 9 ml de líquido de TSA pré-equilibradas a 50 ° C.
- Adicionar 10 ml TSA-p aeruginosa mistura de óleo mineral pesado (pré-aquecida a 50 ° C) e agita-se imediatamente, durante 6 minutos à temperatura ambiente. A agitação deve produzir um vórtice visível no óleo.
- Arrefece-se a mistura a 4 ° C, agitou-se à sp mínimoeed durante 35 minutos (Figura 1).
- Repousar a mistura de ágar-esferas de óleo em gelo durante mais 20 min.
- Transferir os grânulos de agar-em 50 ml de tubos Falcon e centrifugar a 2700 x g durante 15 min a 4 ° C.
- Exacta remover o óleo mineral e lavagem com PBS estéril, seis vezes, tal como descrito no passo 2.11. Depois de três lavagens, os grânulos podem ser peletizadas por gravidade em vez de usar a centrífuga. Após a última lavagem, ressuspender as contas em ágar-20-30 ml PBS.
- Tomar uma aliquota de pérolas (cerca de 0,5 ml) e assepticamente homogeneizar.
- Tomar 100 ul dos grânulos homogeneizados e diluídos em 900 ul de PBS estéril. Diluir em série 1:10 até 10 -6.
- Placa de diluição em série em placas de TSA, incluindo a amostra não diluída até 10 -6 e incubar as placas a 37 ° C.
- Meça o diâmetro do talão usando um microscópio de luz invertida em vários campos. O diâmetro do grânulo deve estar entre 100-200 mM ( Figura 1).
- Armazenar as pérolas durante a noite a 4 ° C.
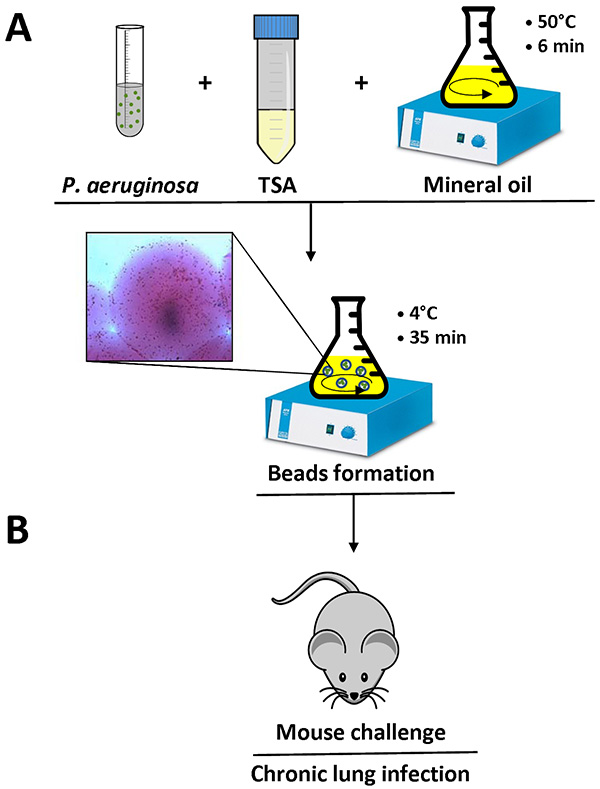
Figura 1. Visão geral da infecção preparação e mouse contas agar. P. aeruginosa células são ressuspensas em 1 ml de PBS e adicionado a 9 ml de líquido de TSA (50 ° C). Esta mistura é adicionada a 150 ml de óleo mineral pesado a 50 ° C num balão e agitou-se a alta velocidade durante 6 min à temperatura ambiente. Quando o frasco é arrefecido a 4 ° C com uma agitação lenta durante 35 min, o agar solidifica criação de grânulos, e bactérias presentes na mistura são incorporados os grânulos de agar. Detalhe de um grânulo de agar contendo as células bacterianas é mostrado (A). Depois de remover o óleo mineral com várias lavagens utilizando PBS esterilizado, a suspensão de agar-esferas está pronto fou inoculação nos pulmões de camundongos por uma injeção intratraqueal (B). Clique aqui para ver a imagem ampliada .
3. Ratos Challenge com ágar-contas
Declaração de Ética: Este protocolo e experimentação siga as orientações do cuidado com os animais e comitê de ética do Instituto Científico San Raffaele.
- Contar o número de unidades formadoras de colónias (CFU) nas placas de TSA para determinar o número de UFC / ml na suspensão de agar-esferas. Dilui-se os grânulos de agar-com PBS esterilizado a 2-4 x 10 7 UFC / ml para atingir um inoculo óptimo de 1-2 x 10 6 em 50 ul.
- Anestesiar C57Bl/6NCr (20-22 g, 6-8 semanas de idade) com cetamina ratos macho (50 mg / ml) e xilazina (5 mg / ml) em 0,9% de NaCl administrada a um volume de 0,002 ml / g de peso corporal pela injecção intraperitoneal.
NOTA: A anestesia é considerada adeqliação formal quando o animal permanece ainda em silêncio, não responde a estímulos externos, e tem coração constante e as taxas respiratórias. - Posicione o mouse na posição supina. Desinfetar o brasão do mouse com etanol 70%.
- Expor a traqueia por um corte vertical da pele e entubar a traqueia com uma agulha estéril, flexível 22 L 0,9 milímetros x 25 mm IV cateter, mantendo a atenção para remover o estilete, enquanto se deslocam para dentro da traqueia. Insira o cateter não muito profundo na traquéia. Pare antes de chegar à carina (bifurcação).
- Tomar imediatamente um volume de 50 mL de suspensão de esferas agar por uma seringa de 1 ml e anexá-lo ao cateter. Empurrar suavemente o êmbolo da seringa, permitindo que os grânulos a serem implantados no pulmão. Feche a incisão usando clipes de sutura.
- Colocar o animal em uma almofada de aquecimento até que esteja totalmente acordado.
4. Ratos Avaliação
- Observe os ratos diariamente para sinais clínicos, incluindo qualidade da pelagem, postura,deambulação e estado de hidratação. Monitorar o peso corporal por dia. Ratos que perdem ≥ 20% do peso corporal devem ser sacrificados.
- Siga o ponto 5 para coleta de lavado broncoalveolar (LBA) e Pontos de 6 ou 7 para a recolha de pulmões ea análise da CFU total, a análise histológica, a resposta inflamatória em termos de contagem total e diferencial de células no LBA, análise de citocinas e mieloperoxidase (MPO) atividade.
5. Coleção LBA e Análise
- Eutanásia dos ratos por inalação de CO2.
- Posicione o mouse na posição supina. Desinfetar o brasão do mouse com etanol 70%.
- Expor a traquéia e caixa torácica por um corte vertical da pele. Expor os pulmões, cortando o diafragma.
- Insira um fio de sutura sob a traquéia usando uma pinça e entubar a traqueia com uma estéril, flexível 22 g 0,9 milímetros x 25 mm cateter IV. Puxe as duas pontas do fio de sutura para vincular o cacath para a traquéia e nó a linha ao redor da traquéia.
- Tome um volume de 1 ml de RPMI 1640, utilizando uma seringa de 1 ml e anexá-lo ao cateter. Empurrar o êmbolo da seringa, para lavar os pulmões e imediatamente recuperar o líquido, armazenando-o num tubo de 15 ml.
NOTA: Se as citocinas estão a ser analisadas, adicionar inibidores da protease para RPMI 1640. - Repita este passo três vezes com um total de 3 ml de RPMI. A partir de agora, guarde o LBA no gelo. Vá para a etapa 6 para a coleta e análise dos pulmões.
NOTA: Por favor, note que nem todos o líquido será recuperado (2,8 ml no máximo). - Para a quantificação de bactérias presentes no fluido BAL, a amostra numa pequena alíquota (300 ul), diluído em série 1:10 em PBS estéril, a placa em placas de TSA e incubar a 37 ° C durante a noite.
- Contagem total de células utilizando um microscópio óptico de luz invertido diluindo uma alíquota do fluido de BAL de 1:2 com solução Tuerk numa câmara de contagem de células Burker.
- Centrifugar a remaining LBA a 330 xg durante 8 minutos a 4 ° C. Tome-se o sobrenadante para análise de citocinas ELISA, armazenando-se a -80 ° C. Siga os passos de 5,10-5,13 para contagem celular diferencial por cytospin.
- Se o sedimento é vermelho, a lise dos eritrócitos ressuspensão do sedimento em 250-300 mL de tampão de lise de RBC diluído 1:10 em água destilada ultra-puro durante 3 minutos. Neutraliza-se com 2 ml de PBS e centrifugar a 330 xg durante 8 minutos a 4 ° C.
- Descartar o sobrenadante e ressuspender o pellet em RPMI 10% de soro fetal bovino (FBS). Utilizar um volume que vai proporcionar 1 x 10 6 células / ml, com base no número total de células.
- Colocar as lâminas de microscópio e os filtros em ranhuras apropriadas no cytospin com os filtros de cartão de frente para o centro do cytospin. Pipetar 150 l de cada amostra para os poços apropriados de citospina e centrifugar numa citocentrífuga a 300 xg durante 5 min.
- Mancha slides Romanowsky coloração utilizando um kit comercial, de acordo com a mainstruções de nufacturer e 12 como descrito anteriormente. Siga os passos de 5,14-5,17 para análise da atividade da MPO.
- Centrifuga-se o volume restante de BAL a 380 xg por 5 min a 4 ° C. Descartar o sobrenadante e ressuspender o sedimento em 250 ul de cloreto de hexadeciltrimetilamônio 0,5% em água destilada ultra-pura a lisar as células. A suspensão pode ser congelada a -20 ° C durante vários dias antes da realização do ensaio.
- Centrifugar a 16.000 xg durante 30 min a 4 ° C e usa-se o sobrenadante para realizar ensaio de MPO em placas de 96 poços, adicionando a amostra em duplicado a cada poço e, se necessário, também diluições adequadas da amostra.
- Adicionar a cada amostra nos poços num volume igual de 3,3 ', 5,5'-tetrametilbenzidina (TMB) como um substrato para a peroxidase. Permitir que a reação ocorra no escuro por pelo menos 5 minutos e até que não haja um maior desenvolvimento na cor.
- Parar a reacção por adição de 2 MH 2 SO 4 umª medir o OD a 450 nm. O valor OD será diretamente proporcional à atividade da peroxidase.
6. Medição da carga bacteriana no pulmão e citocinas Análise
- Imediatamente após a coleta de LBA, pulmões especiais de consumo a partir do mouse, lavá-los em PBS estéril, lóbulos separados, colocá-los em um tubo de fundo redondo com 2 ml de PBS estéril e armazenar no gelo.
NOTA: Se as citocinas estão a ser analisadas, adicionar inibidores da protease a PBS, para os tubos. - Assepticamente homogeneizar pulmões, levar uma pequena alíquota (300 ul) do homogenato, serialmente diluídas 1:10 em PBS, em placas de TSA placa e incubar a 37 ° C durante a noite. Por favor note que a carga total das vias aéreas bacteriana será a soma dos UFCs encontrados em amostras de LBA e pulmão.
- Centrifuga-se o homogeneizado a 16.000 xg, permanecendo durante 30 min a 4 ° C. Leve o sobrenadante para análise de citocinas ELISA, e armazenar a -80 ° C.
7. O exame histológico
- Realizar análise histológica somente nos pulmões em que LBA não foi coletado, para preservar aspecto de pulmão e propriedades.
- Eutanásia o mouse por inalação de CO 2.
- Expor a cavidade torácica de um corte vertical da pele, expor os pulmões, cortando o diafragma.
- Pulmões Especiais de Consumo, lavá-los em PBS, separe os lobos, colocá-los em um tubo contendo formol 5-10 ml a 10% neutro tamponado (formaldeído 4%) e armazenar a 4 ° C ao abrigo da luz.
- Pulmões Incorporar em parafina, usando procedimentos padrão.
- Corte 5 mm de espessura utilizando um micrótomo.
- Stain lâminas com hematoxilina e eosina e cobrir as lâminas com uma lamela, de acordo com os procedimentos padrão.
- Examinar as lâminas usando um microscópio de campo claro invertido e adquirir imagens ligando o microscópio para uma câmera.
Resultados
Quando o protocolo é feito corretamente, o P. aeruginosa ágar-contas vai medir entre 100-200 mM e podem ser observados com um microscópio de luz invertida pipetando um pequeno volume da suspensão de ágar-esferas em um slide. Células bacterianas individuais são visíveis nos grânulos de agar, como mostrado em detalhe na Figura 1.
A escolha de P. aeruginosa estirpe utilizada na preparação de agar-pérolas é crítica. Figura 2 e
Discussão
As etapas críticas do P. preparação aeruginosa-esferas e desafio do mouse são relatados abaixo.
A cepa P. aeruginosa utilizado para ratos desafio é crítica. A mortalidade, infecção crônica ou depuração podem diferir significativamente dependendo da cepa bacteriana utilizada para o desafio. O P. aeruginosa RP73 tensão clínico foi preferido em relação a cepa de laboratório de referência PAO1 uma vez que resultou em uma taxa de morta...
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Pesquisa no laboratório de Bragonzi foi financiado pela Fundação de Fibrose Cística italiano (CFaCore) e UE-F7-2009-223670. Parte deste trabalho foi realizado em ALEMBIC, um laboratório de microscopia avançada, e mouse histopatologia foi realizada na Unidade de Anatomia Patológica (Instituto Científico San Raffaele).
Materiais
| Name | Company | Catalog Number | Comments |
| Bacto Tryptic Soy Broth | Becton Dickinson | 211823 | |
| Difco Agar, granulated | Becton Dickinson | 214510 | |
| Heavy mineral oil | Sigma-Aldrich | 330760-1L | |
| S-(+)-Ketamine hydrochloride | Sigma-Aldrich | K1884 | |
| Xylazine hydrochloride | Sigma-Aldrich | X1251 | |
| 1 ml Syringe 25 G 5/8 in 0.5 mm x 16 mm | PIC | 3071250300350 | |
| Catheter 22 G 0.9 mm x 25 mm | Becton Dickinson | 381223 | |
| Graefe Forceps - 0.5 mm Tips Curved | Fine Science Tools | 11152-10 | |
| Scissors, Iris, 11 cm, straight | World Precision Instruments | 501758 | |
| Suture clips | Fine Science Tools | 12040-01 | |
| Suture thread | Fine Science Tools | 18020-40 | |
| RPMI 1640 | Lonza | BE12-167F | |
| Complete protease inhibitor cocktail | Roche | 11836145001 | |
| Fast-Read 102 Burker disposable chamber | Biosigma | 390497 | |
| Tuerk solution | Fluka | 93770 | |
| RBC lysis buffer | Biolegend | 420301 | |
| Fetal bovine serum | Lonza | DE14-801F | |
| EZ cytofunnel | Thermo Scientific | A78710021 | |
| Superfrost ultra plus microscope slides | Thermo Scientific | J3800AMNZ | |
| Diff-Quik Romanowsky staining set | Medion Diagnostics | 130832 | |
| Hexadecyltrimethylammonium chloride | Sigma-Aldrich | 52366-10G | |
| 96-well EIA/RIA plate | Costar | 3590 | |
| 3,3’,5,5’- Tetramethylbenzidine | Sigma-Aldrich | T8665-1L | |
| Sulfuric acid | Sigma-Aldrich | 320501-1L | |
| 10% Neutral buffered formalin | Bio-Optica | 05-01005Q | |
| Harris hematoxylin non Papanicolau | Bio-Optica | 05-M06004 | |
| Eosin plus alcoholic solution | Bio-Optica | 05-M11007 | |
| Equipment | |||
| Shaking incubator | Amerex Instruments | Steady Shake 757 | |
| Water bath | Grant | SUB14 | |
| Homogenizer | Ystral | ||
| Precision balance | KERN | 440-47N | |
| Cytocentrifuge | Thermo Scientific | A78300003 | |
| Low Cost Heating Pad | 2biol | LCHP | |
| Homogenization probe | Ystral | 2366925(small) | |
| Inverted optical microscope | Zeiss | Axioplan2 | |
| Camera (microscope) | Zeiss | Axiocam MRc5 | |
| Rotary microtome | Leica | RM2255 | |
Referências
- Gibson, R., Burns, J. L., Ramsey, B. W. Pathophysiology and management of pulmonary infections in cystic fibrosis. Am. J. Respir. Crit. Care. 168, 918-951 (2003).
- Bragonzi, A. Murine models of acute and chronic lung infection with cystic fibrosis pathogens. IJMM. 300, 584-593 (2010).
- Cash, H. A., McCullough, B., Johanson, W. G., Bass, J. A. A rat model of chronic respiratory infection with Pseudomonas aeruginosa. Am. Rev. Respir. Dis. 119, 453-459 (1979).
- Starke, J. R., Langston, C., Baker, C. J. A mouse model of chronic pulmonary infection with Pseudomonas aeruginosa and Pseudomonas cepacia. Pediatr. Res. 22, 698-702 (1987).
- Pedersen, S. S., Hansen, B. L., Hansen, G. N. Induction of experimental chronic Pseudomonas aeruginosa lung infection with P. aeruginosa entrapped in alginate microspheres. APMIS. 98, 203-211 (1990).
- Bragonzi, A., et al. Nonmucoid Pseudomonas aeruginosa expresses alginate in the lungs of patients with cystic fibrosis and in a mouse model. J. Infect. Dis. 192, 410-419 (2005).
- van Heeckeren, A. M. Murine models of chronic Pseudomonas aeruginosa lung infection. Lab. Anim. 36, 291-312 (2002).
- Bragonzi, A., et al. Pseudomonas aeruginosa microevolution during cystic fibrosis lung infection establishes clones with adapted virulence AJRCCM. 180, 138-145 (2009).
- Kukavica-Ibrulj, I., Facchini, M., Cigana, C., Levesque, R. C., Bragonzi, A., Filloux, S., Ramos, J. L. Assessing Pseudomonas aeruginosa virulence and the host response using murine models of acute and chronic lung infection. Methods in Pseudomonas aeruginosa: Humana Press. , (2014).
- Moalli, F., et al. The Therapeutic Potential of the Humoral Pattern Recognition Molecule PTX3 in Chronic Lung Infection Caused by Pseudomonas aeruginosa. J. Immunol. 186, 5425-5534 .
- Paroni, M. Response of CFTR-deficient mice to long-term Pseudomonas aeruginosa chronic infection and PTX3 therapeutic treatment. J. Infect. Dis. In press, .
- Maxeiner, J., Karwot, R., Hausding, M., Sauer, K. A., Scholtes, P., Finotto, S. A method to enable the investigation of murine bronchial immune cells, their cytokines and mediators. Nat. Protoc. 2, 105-112 (2007).
- Bragonzi, A., et al. Pseudomonas aeruginosa microevolution during cystic fibrosis lung infection establishes clones with adapted virulence.. AJRCCM. In press, (2009).
- Pirone, L., et al. Burkholderia cenocepacia strains isolated from cystic fibrosis patients are apparently more invasive and more virulent than rhizosphere strains. Environ. Microbiol. 10, 2773-2784 (2008).
- Bragonzi, A., et al. Modelling co-infection of the cystic fibrosis lung by Pseudomonas aeruginosa and Burkholderia cenocepacia reveals influences on biofilm formation and host response. PLoS One. 7, .
- Bianconi, I., et al. Positive signature-tagged mutagenesis in Pseudomonas aeruginosa: tracking patho-adaptive mutations promoting long-term airways chronic infection. PLoS Pathog.. 7, (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados