È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Long Term cronica
In questo articolo
Riepilogo
Descriviamo il metodo di agar-perle di stabilire persistente a lungo termine infezione delle vie respiratorie Pseudomonas aeruginosa cronica nel modello di topo.
Abstract
Un modello murino di infezione cronica delle vie aeree è un asset fondamentale nella fibrosi cistica (CF) di ricerca, anche se ci sono una serie di preoccupazioni per quanto riguarda il modello stesso. Prime fasi di infiammazione e infezione sono stati ampiamente studiati utilizzando il modello di agar-perle del mouse Pseudomonas aeruginosa, mentre solo pochi studi si sono concentrati sulla infezione cronica a lungo termine in vivo. La sfida principale per l'infezione cronica a lungo termine rimane la bassa carica batterica da P. aeruginosa e la bassa percentuale di infetti settimane topi dopo sfida, indicando che le cellule batteriche vengono progressivamente cancellati dall'host.
Questo articolo presenta un metodo per ottenere efficiente infezione cronica a lungo termine in topi. Questo metodo si basa sul radicamento del P. aeruginosa ceppi clinici nei agar-perle in vitro, seguita da instillazione nei topi C57Bl/6NCrl. Infezione polmonare bilaterale è associato SEVrali misurabili read-out, tra cui la perdita di peso, la mortalità, infezione cronica, e la risposta infiammatoria. Il P. aeruginosa RP73 ceppo clinico è stato preferito rispetto al ceppo di laboratorio di riferimento PAO1 quanto ha determinato una mortalità relativamente bassa, le lesioni più gravi, e l'infezione cronica più elevata. P. colonizzazione aeruginosa può persistere nel polmone per oltre tre mesi. Murini patologia polmonare assomiglia a quella di pazienti CF con malattia avanzata cronica polmonare.
Questo modello murino imita più da vicino il corso della malattia umana e può essere utilizzato sia per studi sulla patogenesi e per la valutazione di nuove terapie.
Introduzione
La fibrosi cistica (CF) è una malattia genetica causata da mutazioni nel transmembrana della fibrosi cistica regolatore della conduttanza (CFTR). Questo gene codifica per un canale del cloro espressi sulla membrana della maggior parte delle cellule epiteliali. Bronchiectasia, muco tamponamento e parenchimale distruzione causata principalmente da infezioni da Pseudomonas aeruginosa progressivamente portare a grave malattia polmonare e la mortalità nella maggior parte dei pazienti CF 1. Capire patogenesi CF e l'ulteriore sviluppo di nuove terapie si basano su modello animale con le caratteristiche di CF. Diversi topi, geneticamente modificati per il gene CFTR, sono stati generati, ma limitazioni nella capacità di queste specie di ricapitolare malattia polmonare CF-simili e diverse altre anomalie di organi visto in pazienti CF sono stati ampiamente documentati 2.
Sviluppo di infezione è una delle principali sfide CF modello animale. I cl letteraturasuggerisce presto che una infezione cronica che dura più di un mese può essere raggiunto solo se i topi vengono inoculati con i batteri incorporati in un agente di immobilizzazione come agar, agarosio, o alghe alginato 3-5. Questi agenti immobilizzanti forniscono le condizioni microaerobica / anaerobiche che permettono ai batteri di crescere in forma di microcolonie, analogamente alla crescita nel muco dei pazienti FC 6. Questo modello di infezione cronica porta alla persistenza dei batteri nei polmoni causando infiammazione delle vie respiratorie e danni 7. Tuttavia, a seconda del metodo utilizzato, il ceppo batterico e la dose inoculato nei polmoni, la percentuale di topi infettati croniche e la carica batterica recuperato nei polmoni a differenti tempi possono differire considerevolmente. In particolare, la sfida principale per l'infezione cronica a lungo termine rimane la bassa carica batterica da P. aeruginosa e la bassa percentuale di infetti settimane topi dopo sfida, indicando that cellule batteriche vengono progressivamente cancellati dall'host. Selezionando il P. aeruginosa RP73 ceppo clinico da una raccolta di CF isolati 8 abbiamo ottenuto con successo una bassa mortalità, le lesioni più gravi, e l'alta percentuale di infezione cronica con una carica batterica stabile fino a un mese nei topi C57Bl/6NCrl.
Dettagli Questo documento metodologia per l'incorporamento P. aeruginosa nelle perle di agar, abbiamo infettato topi mediante instillazione, misurata la carica batterica e citochine nei polmoni, raccolta BAL ed eseguito un esame istologico. Nel complesso, questo protocollo sarà di aiuto ai ricercatori per affrontare questioni di fondamentale importanza sulla patogenesi 8,9 e testare nuove terapie contro il P. aeruginosa infezione cronica 10,11.
Protocollo
1. Batteri Preparazione per l'infezione cronica (tre e due giorni prima del mouse Challenge)
- Selezionare l'appropriato P. ceppo aeruginosa da testare.
- Seminare un'ansata di P. aeruginosa da -80 ° C delle colture per un piatto Trypticase Soy Agar (TSA) e incubare a 37 ° C durante la notte.
- Scegli una singola colonia e inoculare in 5 ml Trypticase Soy Broth (TSB) in una provetta snap-capped 15 ml ed incubare a 37 ° C per una notte in un incubatore agitazione a 200 rpm.
2. Incorporare batteri in Beads Agar per l'infezione cronica (un giorno prima infezione)
- Prendere una piccola aliquota della coltura batterica durante la notte, diluire 1:50 in tampone fosfato (PBS) e misurare la densità ottica (OD) a 600 nm.
- Diluire la coltura batterica overnight aggiungendo 2 OD in una nuova provetta con tappo a scatto contenente 20 ml di TSB fresca.
- Incubare a 37 ° C per circa 3 -4 ore di fase di login in un incubatore agitazione a 200 rpm, fino a raggiungere un totale di 10-15 OD.
- Nel frattempo, preparare la TSA, fatta di TSB con 1,5% agar, autoclave ed equilibrare a 50 ° C in un bagno d'acqua. Equilibrare 150 ml di olio minerale pesante preautoclaved in un matraccio di Erlenmeyer a 50 ° C in un bagno d'acqua.
- Una volta P. aeruginosa raggiunge la fase log, raccogliere le cellule batteriche mediante centrifugazione a 2700 xg per 15 min a 4 ° C e scartare il surnatante.
- Risospendere il pellet batterico in 1 ml di PBS sterile e vortice accuratamente per risospendere completamente il pellet.
- Miscelare 1 ml di sospensione batterica con 9 ml di TSA liquido pre-equilibrata a 50 ° C.
- Aggiungere 10 ml TSA-P. aeruginosa miscela di olio minerale pesante (preriscaldata a 50 ° C) e subito mescolare per 6 minuti a temperatura ambiente. L'agitazione deve produrre un vortice visibile nell'olio.
- Raffreddare la miscela a 4 ° C, agitando alla sp minimoeed per 35 min (Figura 1).
- Appoggiare la miscela agar-perle di olio in ghiaccio per altri 20 min.
- Trasferire l'agar-perle in 50 ml provette Falcon e centrifugare a 2.700 xg per 15 min a 4 ° C.
- Accuratamente rimuovere l'olio minerale e lavare con PBS sterile sei volte, come descritto nel passaggio 2.11. Dopo tre lavaggi, le sfere possono essere pellet per gravità invece di utilizzare la centrifuga. Dopo l'ultimo lavaggio, risospendere l'agar-perle in 20-30 ml di PBS.
- Prelevare un 'aliquota delle perle (circa 0,5 ml) e asettico omogeneizzare.
- Prendete 100 ml di perline omogeneizzati e diluire in 900 ml di PBS sterile. Serie diluire 01:10 fino al 10 -6.
- Diluizione seriale piastra su piastre di TSA, compreso campione non diluito fino a 10 -6 e incubare le piastre a 37 ° C.
- Misurare il diametro tallone utilizzando un microscopio ottico invertito in vari campi. Il diametro cordone deve essere compreso tra 100-200 micron ( Figura 1).
- Conservare le perle di una notte a 4 ° C.
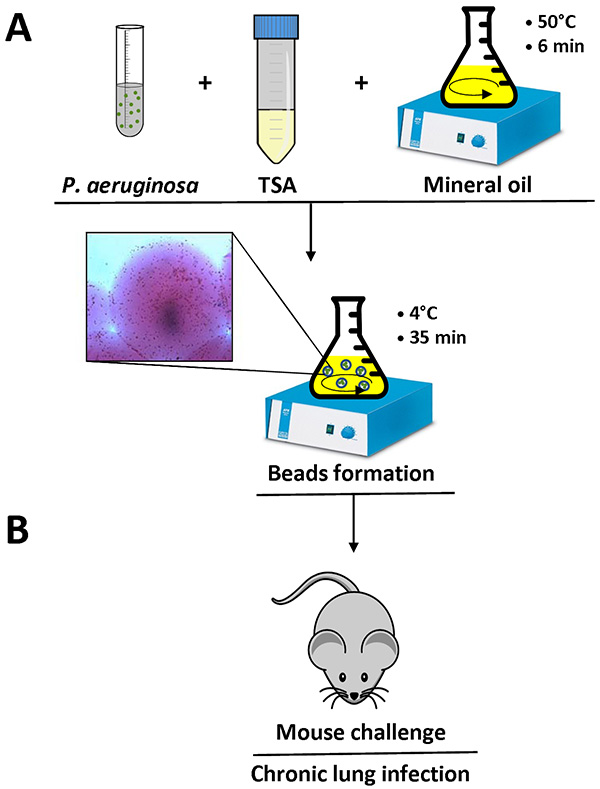
Figura 1. Panoramica della preparazione e del mouse perline infezione agar. P. aeruginosa cellule sono risospese in 1 ml di PBS e aggiunti 9 ml di liquido TSA (50 ° C). Questa miscela viene aggiunta a 150 ml di olio minerale pesante a 50 ° C in un pallone e agitata ad alta velocità per 6 minuti a temperatura ambiente. Quando il pallone viene raffreddato a 4 ° C con agitazione lenta per 35 min, l'agar solidifica creando perline, e batteri presenti nella miscela sono incorporati nei branelli agar. Particolare di un cordone agar contenente cellule batteriche è (A) indicato. Dopo aver rimosso l'olio minerale con diversi lavaggi con PBS sterile, la sospensione di agar-perline è pronto fo inoculazione nei polmoni dei topi da un'iniezione endotracheale (B). Clicca qui per vedere l'immagine ingrandita .
3. Topi sfida con Agar-perle
Etica Dichiarazione: Questo protocollo e sperimentazione seguono le linee guida della cura degli animali e il comitato etico di Istituto Scientifico San Raffaele.
- Contare il numero di Unità Formanti Colonie (CFU) sulle piastre di TSA per determinare il numero di CFU / ml nella sospensione agar-perline. Diluire l'agar-perline con PBS sterile per 2-4 x 10 7 UFC / ml per raggiungere un inoculo ottimale di 1-2 x 10 6 in 50 microlitri.
- Anestetizzare C57Bl/6NCr (20-22 g, 6-8 settimane) topi maschi con ketamina (50 mg / ml) e xilazina (5 mg / ml) in 0,9% NaCl somministrata ad un volume di 0,002 ml / g di peso corporeo da iniezione intraperitoneale.
NOTA: L'anestesia è considerato adeqlutare quando l'animale rimane ancora in silenzio, non risponde agli stimoli esterni, ed è costante il cuore e la frequenza respiratoria. - Posizionare il mouse in posizione supina. Disinfettare il cappotto del mouse con il 70% di etanolo.
- Esporre la trachea da un taglio verticale della pelle e intubare la trachea con una sterile, flessibile 22 G 0,9 millimetri x 25 mm catetere IV, mantenendo attenzione per rimuovere il stylette mentre si muove verso il basso nella trachea. Inserire il catetere non troppo in profondità nella trachea. Arrestare prima di raggiungere la carena (biforcazione).
- Immediatamente prendere un volume di 50 ml di sospensione di sferette agar da una siringa da 1 ml e collegarlo al catetere. Premere delicatamente il pistone della siringa, permettendo alle sfere di essere impiantati nel polmone. Chiudere l'incisione utilizzando clip di sutura.
- Posizionare l'animale su una piastra elettrica fino a completamente sveglio.
4. Valutazione Mice
- Osservare i topi al giorno per segni clinici tra cui la qualità del cappotto, la postura,deambulazione, e lo stato di idratazione. Controllo del peso corporeo al giorno. I topi che perdono ≥ 20% del peso corporeo devono essere eutanasia.
- Seguire il punto 5 per la raccolta del liquido di lavaggio broncoalveolare (BAL) e dei punti 6 e 7 per la raccolta dei polmoni e l'analisi di totale CFU, l'analisi istologica, la risposta infiammatoria in termini di numero totale e differenziale delle cellule nel BAL, analisi di citochine, e mieloperossidasi (MPO) attività.
5. BAL Fluid Raccolta e analisi
- Euthanize i topi da CO 2 inalazione.
- Posizionare il mouse nella posizione supina. Disinfettare il cappotto del mouse con il 70% di etanolo.
- Esporre la trachea e la gabbia toracica da un taglio verticale della pelle. Esporre i polmoni tagliando il diaframma.
- Inserire un filo di sutura sotto la trachea utilizzando una pinzetta e intubare la trachea con una sterile, flessibile 22 g 0,9 millimetri x 25 mm catetere IV. Tirare le due estremità del filo di sutura di impegnare la catheter alla trachea e annodare il filo attorno alla trachea.
- Prendere un volume di 1 ml di RPMI 1640 utilizzando una siringa da 1 ml e fissarlo al catetere. Spingere lo stantuffo della siringa per lavare i polmoni e immediatamente recuperare il liquido, riporlo in una provetta da 15 ml.
NOTA: Se le citochine sono da analizzare, aggiungere inibitori della proteasi per RPMI 1640. - Ripetere questa operazione tre volte per un totale di 3 ml di RPMI. Da ora in poi, conservare il liquido BAL su ghiaccio. Andare al punto 6 per la raccolta e l'analisi dei polmoni.
NOTA: Si prega di notare che non tutto il liquido sarà recuperato (2,8 ml al massimo). - Per la quantificazione dei batteri presenti nel BAL, campionare una piccola aliquota (300 microlitri), serialmente diluire 1:10 in PBS sterile, piastra su piastre di TSA e incubare a 37 ° C per una notte.
- Contare le cellule totali utilizzando un microscopio ottico invertito luce diluendo un'aliquota del BAL 1:2 con Tuerk in una camera di conta cellulare Burker.
- Centrifugare la remaining BAL a 330 xg per 8 minuti a 4 ° C. Prendere il surnatante per l'analisi di citochine ELISA, riporlo a -80 ° C. Seguire i passaggi 5,10-5,13 per la conta cellulare differenziale cytospin.
- Se il pellet è rosso, lisare gli eritrociti risospendere il pellet in 250-300 ml di tampone di lisi diluito 1:10 in acqua distillata ultrapura per 3 min. Neutralizzare con 2 ml di PBS e centrifugare a 330 xg per 8 minuti a 4 ° C.
- Eliminare il surnatante e risospendere il pellet in RPMI 10% di siero fetale bovino (FBS). Utilizzare un volume che fornirà 1 x 10 6 cellule / ml, in base al numero di celle totale.
- Posizionare vetrini da microscopio e dei filtri in apposite cave nel cytospin con i filtri di cartone di fronte al centro del cytospin. Pipettare 150 ml di ciascun campione nei pozzetti appropriati del cytospin e centrifugare in una citocentrifuga a 300 xg per 5 min.
- Colorare i vetrini da Romanowsky colorazione utilizzando un kit commerciale, secondo la maistruzioni di nufacturer e come descritto in precedenza 12. Seguire i passaggi 5,14-5,17 per l'analisi delle attività MPO.
- Centrifugare la rimanente quantità di BAL a 380 xg per 5 minuti a 4 ° C. Eliminare il supernatante e risospendere il pellet in 250 ml di cloruro di esadeciltrimetilammonio 0,5% in acqua distillata ultrapura per lisare le cellule. La sospensione può essere congelato a -20 ° C per diversi giorni prima dell'esecuzione del test.
- Centrifugare a 16.000 xg per 30 min a 4 ° C e utilizzare il surnatante effettuare test MPO in piastre a 96 pozzetti, aggiungere il campione in duplicato a ciascun pozzetto e, se necessario, anche vere diluizioni del campione.
- Aggiungere a ciascun campione nei pozzetti un volume uguale di 3,3 ', 5,5'-tetrametilbenzidina (TMB) come substrato per la perossidasi. Lasciare che la reazione abbia luogo al buio per almeno 5 minuti e fino a quando non vi è un ulteriore sviluppo nel colore.
- Arrestare la reazione aggiungendo 2 MH 2 SO 4 unand misurare la densità ottica a 450 nm. Il valore di assorbanza sarà direttamente proporzionale all'attività perossidasi.
6. Misurazione della carica batterica nei polmoni e citochine analisi
- Subito dopo la raccolta BAL, polmoni accise del topo, li lavare in PBS sterile, lobi distinti, metterli in un tubo a fondo rotondo con 2 ml di PBS sterile e memorizzare sul ghiaccio.
NOTA: Se citochine sono da analizzare, aggiungi inibitori della proteasi di PBS ai tubi. - Asetticamente omogeneizzare i polmoni, prendere una piccola aliquota (300 microlitri) dall'omogenato, serie diluire 1:10 in PBS, la piastra su piastre di TSA e incubare a 37 ° C durante la notte. Si prega di notare che il carico totale delle vie aeree batterica sarà la somma dei CFU trovati in BAL e del polmone.
- Centrifugare l'omogeneizzato rimanendo a 16.000 xg per 30 min a 4 ° C. Prendete il surnatante per l'analisi di citochine ELISA, e conservare a -80 ° C.
7. Esame istologico
- Effettuare analisi istologica solo sui polmoni in cui BAL non sono stati raccolti, per preservare aspetto e le proprietà del polmone.
- Euthanize il mouse CO 2 inalazione.
- Esporre la gabbia toracica da un taglio verticale della pelle, esporre i polmoni tagliando il diaframma.
- Accise polmoni, li lavare in PBS, separano i lobi, metterli in una provetta contenente formalina 5-10 ml 10% neutra tamponata (4% formaldeide) e conservare a 4 ° C al riparo dalla luce.
- Polmoni Incorpora in paraffina, utilizzando le procedure standard.
- Tagliare 5 sezioni micron di spessore utilizzando un microtomo.
- Diapositive macchia con ematossilina e eosina e coprire le diapositive con un coprioggetto, secondo le procedure standard.
- Esaminare vetrini utilizzando un microscopio invertito campo chiaro e acquisire le immagini collegando al microscopio una telecamera.
Risultati
Quando il protocollo è fatto correttamente, il P. aeruginosa agar-perle misureranno tra 100-200 micron e può essere osservato con un microscopio ottico invertito pipettando un piccolo volume della sospensione di agar-perline su un vetrino. Singole cellule batteriche sono visibili nelle perline agar, come mostrato in dettaglio in figura 1.
La scelta di P. ceppo aeruginosa usati nella preparazione agar-perline è critica. Figura 2 ...
Discussione
Le fasi critiche del P. aeruginosa-perline preparazione e la sfida del mouse sono riportati di seguito.
Il ceppo P. aeruginosa utilizzato per i topi sfida è critica. Mortalità, infezione cronica o di liquidazione potrebbero differire significativamente a seconda del ceppo batterico utilizzato per la sfida. Il P. aeruginosa RP73 ceppo clinico è stato preferito rispetto al ceppo di laboratorio di riferimento PAO1 quanto ha determinato una mortalità relat...
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari in competizione.
Riconoscimenti
La ricerca nel laboratorio di Bragonzi è stato finanziato dalla Fondazione Italiana Fibrosi Cistica (CFaCore) e UE-F7-2009-223.670. Parte di questo lavoro è stato svolto in ALEMBIC, un laboratorio di microscopia avanzata, e il mouse istopatologia è stato eseguito presso l'Unità di Anatomia Patologica (Istituto Scientifico San Raffaele).
Materiali
| Name | Company | Catalog Number | Comments |
| Bacto Tryptic Soy Broth | Becton Dickinson | 211823 | |
| Difco Agar, granulated | Becton Dickinson | 214510 | |
| Heavy mineral oil | Sigma-Aldrich | 330760-1L | |
| S-(+)-Ketamine hydrochloride | Sigma-Aldrich | K1884 | |
| Xylazine hydrochloride | Sigma-Aldrich | X1251 | |
| 1 ml Syringe 25 G 5/8 in 0.5 mm x 16 mm | PIC | 3071250300350 | |
| Catheter 22 G 0.9 mm x 25 mm | Becton Dickinson | 381223 | |
| Graefe Forceps - 0.5 mm Tips Curved | Fine Science Tools | 11152-10 | |
| Scissors, Iris, 11 cm, straight | World Precision Instruments | 501758 | |
| Suture clips | Fine Science Tools | 12040-01 | |
| Suture thread | Fine Science Tools | 18020-40 | |
| RPMI 1640 | Lonza | BE12-167F | |
| Complete protease inhibitor cocktail | Roche | 11836145001 | |
| Fast-Read 102 Burker disposable chamber | Biosigma | 390497 | |
| Tuerk solution | Fluka | 93770 | |
| RBC lysis buffer | Biolegend | 420301 | |
| Fetal bovine serum | Lonza | DE14-801F | |
| EZ cytofunnel | Thermo Scientific | A78710021 | |
| Superfrost ultra plus microscope slides | Thermo Scientific | J3800AMNZ | |
| Diff-Quik Romanowsky staining set | Medion Diagnostics | 130832 | |
| Hexadecyltrimethylammonium chloride | Sigma-Aldrich | 52366-10G | |
| 96-well EIA/RIA plate | Costar | 3590 | |
| 3,3’,5,5’- Tetramethylbenzidine | Sigma-Aldrich | T8665-1L | |
| Sulfuric acid | Sigma-Aldrich | 320501-1L | |
| 10% Neutral buffered formalin | Bio-Optica | 05-01005Q | |
| Harris hematoxylin non Papanicolau | Bio-Optica | 05-M06004 | |
| Eosin plus alcoholic solution | Bio-Optica | 05-M11007 | |
| Equipment | |||
| Shaking incubator | Amerex Instruments | Steady Shake 757 | |
| Water bath | Grant | SUB14 | |
| Homogenizer | Ystral | ||
| Precision balance | KERN | 440-47N | |
| Cytocentrifuge | Thermo Scientific | A78300003 | |
| Low Cost Heating Pad | 2biol | LCHP | |
| Homogenization probe | Ystral | 2366925(small) | |
| Inverted optical microscope | Zeiss | Axioplan2 | |
| Camera (microscope) | Zeiss | Axiocam MRc5 | |
| Rotary microtome | Leica | RM2255 | |
Riferimenti
- Gibson, R., Burns, J. L., Ramsey, B. W. Pathophysiology and management of pulmonary infections in cystic fibrosis. Am. J. Respir. Crit. Care. 168, 918-951 (2003).
- Bragonzi, A. Murine models of acute and chronic lung infection with cystic fibrosis pathogens. IJMM. 300, 584-593 (2010).
- Cash, H. A., McCullough, B., Johanson, W. G., Bass, J. A. A rat model of chronic respiratory infection with Pseudomonas aeruginosa. Am. Rev. Respir. Dis. 119, 453-459 (1979).
- Starke, J. R., Langston, C., Baker, C. J. A mouse model of chronic pulmonary infection with Pseudomonas aeruginosa and Pseudomonas cepacia. Pediatr. Res. 22, 698-702 (1987).
- Pedersen, S. S., Hansen, B. L., Hansen, G. N. Induction of experimental chronic Pseudomonas aeruginosa lung infection with P. aeruginosa entrapped in alginate microspheres. APMIS. 98, 203-211 (1990).
- Bragonzi, A., et al. Nonmucoid Pseudomonas aeruginosa expresses alginate in the lungs of patients with cystic fibrosis and in a mouse model. J. Infect. Dis. 192, 410-419 (2005).
- van Heeckeren, A. M. Murine models of chronic Pseudomonas aeruginosa lung infection. Lab. Anim. 36, 291-312 (2002).
- Bragonzi, A., et al. Pseudomonas aeruginosa microevolution during cystic fibrosis lung infection establishes clones with adapted virulence AJRCCM. 180, 138-145 (2009).
- Kukavica-Ibrulj, I., Facchini, M., Cigana, C., Levesque, R. C., Bragonzi, A., Filloux, S., Ramos, J. L. Assessing Pseudomonas aeruginosa virulence and the host response using murine models of acute and chronic lung infection. Methods in Pseudomonas aeruginosa: Humana Press. , (2014).
- Moalli, F., et al. The Therapeutic Potential of the Humoral Pattern Recognition Molecule PTX3 in Chronic Lung Infection Caused by Pseudomonas aeruginosa. J. Immunol. 186, 5425-5534 .
- Paroni, M. Response of CFTR-deficient mice to long-term Pseudomonas aeruginosa chronic infection and PTX3 therapeutic treatment. J. Infect. Dis. In press, .
- Maxeiner, J., Karwot, R., Hausding, M., Sauer, K. A., Scholtes, P., Finotto, S. A method to enable the investigation of murine bronchial immune cells, their cytokines and mediators. Nat. Protoc. 2, 105-112 (2007).
- Bragonzi, A., et al. Pseudomonas aeruginosa microevolution during cystic fibrosis lung infection establishes clones with adapted virulence.. AJRCCM. In press, (2009).
- Pirone, L., et al. Burkholderia cenocepacia strains isolated from cystic fibrosis patients are apparently more invasive and more virulent than rhizosphere strains. Environ. Microbiol. 10, 2773-2784 (2008).
- Bragonzi, A., et al. Modelling co-infection of the cystic fibrosis lung by Pseudomonas aeruginosa and Burkholderia cenocepacia reveals influences on biofilm formation and host response. PLoS One. 7, .
- Bianconi, I., et al. Positive signature-tagged mutagenesis in Pseudomonas aeruginosa: tracking patho-adaptive mutations promoting long-term airways chronic infection. PLoS Pathog.. 7, (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon