JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
장기 만성
요약
우리는 마우스 모델에서 지속적인 장기 만성 녹농균기도 감염을 확립하는 한천 비즈 방법을 서술.
초록
모델 자체에 관한 관심의 개수가 있지만 만성기도 감염의 마우스 모델은 낭포 성 섬유증 (CF)의 연구에서 중요한 자산이다. 단지 소수의보고가 생체 내에서 장기간의 만성 감염에 집중 반면 염증과 감염의 초기 단계는 광범위하게, 녹농균 한천 비즈 마우스 모델을 이용하여 연구 하였다. 장기 만성 감염의 주요 과제는 P.에 의해 낮은 세균 부담이 남아있다 녹농균이라는 박테리아 세포가 점진적으로 호스트에 의해 취소 된 것을 나타내는 공격 후 감염된 쥐 주의 낮은 비율.
이 논문은 생쥐에서 효율적으로 장기 만성 감염을 얻기위한 방법을 제시한다. 이 방법은 P.의 매립에 기초 C57Bl/6NCrl 마우스에서 기관 내 점적 한 다음 체외 한천 구슬 녹농균 임상 균주. 양측 폐 감염 SEV와 관련된체중 감소, 사망률, 만성 감염 및 염증 반응 등의 ERAL 측정 판독을. P. 그것은 비교적 낮은 사망률, 더 심한 병변, 높은 만성 감염의 결과 때문에 녹농균 RP73 임상 균주 PAO1 참조 실험실 변형 선호했다. P. 녹농균의 식민지 세 개월 이상 폐에 지속될 수 있습니다. 쥐의 폐 병리 고급 만성 폐 질환을 가진 CF 환자의 그것과 유사합니다.
이 뮤린 모델은 가장 밀접 인간 질병의 과정을 모방 및 병인에 대한 연구 및 신규 한 치료의 평가를 모두 사용할 수있다.
서문
낭포 성 섬유증 (CF)는 낭성 섬유증의 transmembrane의 전도성 조정기 (CFTR) 유전자의 돌연변이에 의해 발생하는 유전 질환이다. 이 유전자는 대부분의 상피 세포의 세포막에 발현 클로라이드 채널 인코딩한다. 기관지 확장증, 점액 플러그 및 실질 파괴는 점진적으로 심각한 폐병과 CF 환자 1의 대부분의 사망으로 이어질 녹농균 감염에 의해 주로 일으키는 원인이되었다. 이해 CF의 발병 기전과 새로운 치료법의 발전은 CF의 특징적인 기능을 동물 모델에 의존하고 있습니다. 유전자 CFTR 유전자에 대해 수정 몇몇 마우스는 생성되었지만, CF와 같은 폐 질환과 CF의 환자에서 본 여러 가지 다른 장기의 이상을 요점을 되풀이하는이 종의 능력에 한계가 널리 2 문서화되었습니다.
감염의 개발은 CF의 동물 모델에서 가장 중요한 문제 중 하나입니다. 문학 CL이른 쥐가 이러한 한천, 아가로 오스, 또는 해조류 알긴산 3-5로 고정 화제에 매립 균을 접종 한 경우에만 한 달 이상 지속되는 만성 감염이 달성 될 수 있다는 것을 시사한다. These 고정화 제제 박테리아 마찬가지로 CF 환자 6의 점액 성장에, microcolonies 형태 성장에 허용 호기성 / 혐기성 상태 제공. 만성 감염이 모델은기도 염증 손상 7을 일으키는 원인이되는 폐의 박테리아의 지속성에 이르게한다. 그러나, 사용 된 방법, 균주 및 폐 식균 복용량에 따라 서로 다른 시점에서 폐에서 회수 만성 감염된 마우스의 백분율 및 세균 부하는 상당히 다를 수있다. 특히, 장기 만성 감염의 주요 과제는 P.에 의해 낮은 세균 부담이 남아있다 녹농균 및 공격 후 감염된 쥐 주 동안의 낮은 비율을 나타내는 그쪽으로T 박테리아 세포는 점차적으로 호스트에 의해 삭제됩니다. P.를 선택함에 CF의 수집에서 녹농균 RP73 임상 균주는 우리가 성공적으로 C57Bl/6NCrl 쥐 한 달 안정적인 세균 부하쪽으로 낮은 사망률, 더 심한 병변, 만성 감염의 높은 비율을 얻은 8 분리합니다.
본 논문에서는 P.를 포함에 대한 방법을 자세히 설명 한천 구슬 녹농균, 우리는, 기관 내 점적으로 쥐를 감염 폐에 세균 하중과 사이토 카인을 측정, BAL 유체를 수집하고 조직 학적 검사를 수행했습니다. 전반적으로,이 프로토콜은 병인의 8,9에 근본적으로 중요한 문제를 해결하고 P.에 대한 새로운 치료법을 테스트하는 연구자 도움이됩니다 녹농균 만성 감염 10, 11.
프로토콜
1. 만성 감염에 대한 준비 박테리아 (이전 마우스 도전에 세 이틀)
- 해당 P.에게 선택 루기 노자 균주는 시험한다.
- P.의 백금이를 접종한다 Trypticase 간장 한천 (TSA) 플레이트에 -80 ° C 주식 문화에서 녹농균과 하룻밤 37 ° C에서 알을 품다.
- 하나의 식민지를 선택하고 15 ML 스냅 덮인 관에 5 ㎖ Trypticase 간장 국물 (TSB)에 접종, 200 rpm에서 진탕 배양기에서 하룻밤 37 ° C에서 알을 품다.
2. 만성 감염에 대한 한천 구슬에 박테리아를 포함 (이전의 감염에 한 일)
- 세균의 하룻밤 문화의 작은 나누어지는을 인산염 완충 생리 식염수 (PBS)에 1:50 희석 및 600 nm에서 광학 밀도 (OD)를 측정한다.
- 신선한 TSB 20 ㎖를 포함하는 새로운 스냅 덮인 관에서 2 OD를 추가하여 밤새 세균성 문화를 희석.
- 약 3 ~ 37 ° C에서 알을 품다 -10-15 OD의 전체가 도달 될 때까지, 200 rpm에서 진탕 배양기에서 위상을 기록하는 4 시간.
- 한편, 1.5 % 한천, 오토 클레이브와 수조에서 50 ° C로 평형화와 TSB 이루어지는 TSA를 준비한다. 물을 욕조에 50 ° C에서 삼각 플라스크에 preautoclaved 무거운 미네랄 오일 150 ㎖를 평형.
- 일단 P. 녹농균은 4 ° C에서 15 분 동안 2,700 XG에서 원심 분리하여 박테리아 세포를 수집하고 상층 액을 버린다, 로그 단계에 도달한다.
- 철저하게 완전히 펠렛을 재현 탁 할 1 멸균 PBS ㎖의 소용돌이에 박테리아 펠렛을 재현 탁.
- 액체 TSA 9 ㎖를 50 ℃에서 사전 평형과 혼합 1 ㎖의 세균 현탁액
- 10 ㎖ TSA-P를 추가 바로 녹농균 (50 ° C에서 데워진) 중광 오일 혼합물은 실온에서 6 분 동안 교반 하였다. 교반은 기름에 보이는 소용돌이를 생성한다.
- 최소 SP에서 교반, 4 ° C에 혼합물을 냉각35 분 (그림 1)에 대한 EED.
- 추가로 20 분 동안 얼음에 한천 비즈 - 오일 혼합물을 휴식.
- 4 ℃에서 15 분 동안 2,700 XG에서 (50) ML 팔콘 튜브와 원심 분리기에 한천 구슬로 이동
- 정확히 미네랄 오일을 제거하고 단계 2.11에 설명 된대로, 멸균 PBS로 여섯 번 씻는다. 세 세척 후, 비드 대신 원심 분리기를 사용하여 중력에 의해 펠릿 화 될 수있다. 마지막으로 세척 한 후, 20 ~ 30 ㎖의 PBS에서 한천 구슬을 재현 탁.
- 구슬 (약 0.5 ㎖)의 분취 량을 가지고 무균 균질화.
- 균질화 된 구슬의 100 μl를 타고 멸균 PBS 900 μL로 희석. 직렬 10-6까지 1:10 희석.
- 아래로 10-6, 37 ° C에서 접시를 배양 원액 샘플을 포함 TSA 플레이트 접시에 시리얼 희석,
- 여러 분야에 거꾸로 광학 현미경을 사용하여 구슬의 직경을 측정합니다. 구슬의 직경 (100 ~ 200 μm의 사이에 있어야합니다 그림 1).
- 4 ℃에서 밤새 구슬을 저장
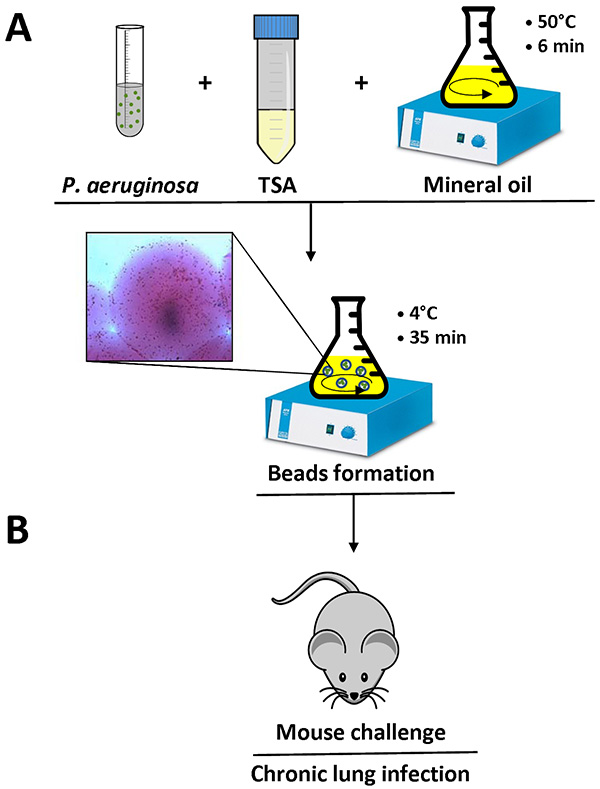
그림 1. 한천 비즈 준비와 마우스 감염의 개요. P. 녹농균이라는 박테리아 세포는 PBS 1 ㎖에 재현 탁 액체 TSA (50 ° C)의 9 ML에 추가됩니다. 이 혼합물을 플라스크에서 50 ° C에서 150 ㎖의 무거운 미네랄 오일에 첨가하고 실온에서 10 분 동안 고속으로 교반 하였다. 플라스크를 35 분 동안 천천히 교반하면서 4 ° C로 냉각 될 때, 한천 비즈를 만들어 고화하고, 혼합물에 존재하는 박테리아 한천 비드에 포함된다. 박테리아 세포를 포함하는 한천 비드의 세부 사항은 (A) 표시됩니다. 멸균 PBS를 사용하여 몇 개의 세척하여 광유를 제거한 후, 한천 비드 현탁액 F 준비또는 기관 내 주사 (B)로 쥐의 허파 접종은. 큰 이미지를 보려면 여기를 클릭 .
3. 한천 구슬 마우스 도전
윤리 성명 :이 프로토콜과 실험은 산 라파엘 과학 연구소의 동물 관리 및 윤리위원회의 지침을 따르십시오.
- 한천 비즈 서스펜션에 CFU / ㎖의 수를 결정하기 위해 TSA 플레이트에 콜로니 형성 단위의 수 (CFU)를 계산합니다. 50 ㎕의 1 ~ 2 × 10 6의 최적 접종 도달하는 2 ~ 4 × 10 7 CFU / ml로 멸균 PBS로 한천 구슬을 희석.
- C57Bl/6NCr에게 (6-8 주령 20~22g) 0.002 ㎖ / g 체중의 볼륨 관리 0.9 % 염화나트륨의 케타민 (50 ㎎ / ㎖) 및 자일 라진 (5 ㎎ / ㎖)와 수컷 마우스를 마취 복강 내 주사.
참고 : 마취는 adeq 간주됩니다uate 동물이 조용히 계속 유지하면, 외부 자극에 응답하지 않는, 일정한 심장과 호흡 속도를 가지고 있습니다. - 앙와위에서 마우스를 놓습니다. 70 % 에탄올로 마우스의 코트를 소독.
- 피부의 수직 절단하여 기관을 노출하고 기관에 아래로 이동하는 동안 stylette을 제거하기 위해 관심을 유지, 살균, 유연한 22 G 0.9 mm X 25mm의 IV 카테터와 기관을 삽관. 너무 깊은 기관에 카테터를 삽입합니다. 융기 (분기점)에 도달하기 전에 중지합니다.
- 즉시 1 ML의 주사기에 의해 한천 구슬 현탁액 50 μL의 볼륨을 가지고 카테터에 연결합니다. 부드럽게 구슬이 폐에 이식 할 수 있도록, 주사기의 플런저를 밀어 넣습니다. 봉합 클립을 사용하여 절개를 닫습니다.
- 잠에서 깨어 때까지 가열 패드에 동물을 배치합니다.
4. 쥐 평가
- 코트 품질, 자세 등의 임상 증상 매일 쥐를 관찰,보행 및 수화 상태. 매일 체중을 모니터링합니다. ≥ 20 %의 체중을 잃게 마우스는 안락사해야합니다.
- 기관지 세척액 (BAL)과 폐의 수집 및 총 CFU의 분석, 조직 학적 분석, BAL, 사이토 카인 분석의 전체 및 차등 세포 수의 측면에서 염증 반응 및 포인트 6 또는 7의 수집을 위해 포인트 5에 따라 폐장 내 myeloperoxidase (MPO) 활동.
5. BAL 유체 수집 및 분석
- CO 2 흡입 쥐를 안락사.
- 앙와위에서 마우스를 놓습니다. 70 % 에탄올로 마우스의 코트를 소독.
- 피부의 수직 컷으로 기관과 흉곽을 노출합니다. 다이어프램을 절단하여 폐를 노출합니다.
- 핀셋을 사용하여 기관에서 봉합 나사를 삽입하고 멸균, 유연한 22g 0.9 mm X 25mm의 IV 카테터와 기관을 삽관. CA를 바인딩 할 봉합 실의 두 끝을 당겨기관에 theter 및 기관의 주위에 실을 매듭.
- 1 ML의 주사기를 사용하여 RPMI 1640 1 ㎖의 볼륨을 가지고 카테터에 연결합니다. 폐를 씻어 낸 후 액체를 복구, 15 ML 튜브에 저장하기 위해 주사기의 플런저를 밀어 넣습니다.
참고 : 사이토 카인 분석 할 경우, RPMI 1640 프로테아제 억제제를 추가합니다. - RPMI 3 ㎖의 총이 과정을 세 번 반복합니다. 지금부터, 얼음 BAL 액을 저장합니다. 폐의 수집 및 분석을위한 6 단계로 이동합니다.
참고 : 모든 액체가 (2.8 ㎖의 최대) 검색됩니다주의하시기 바랍니다. - BAL 액에 존재하는 박테리아의 부량, 작은 나누어지는 (300 μl를) 샘플, 직렬 TSA 판에, 멸균 PBS에서 판을 1:10로 희석 밤새 37 ° C에서 알을 품다.
- Burker 세포 수 실 Tuerk 솔루션 BAL 유체 1:2 나누어지는 희석 거꾸로 빛을 광학 현미경을 사용하여 전체 세포를 계산합니다.
- R을 원심 분리기4 ℃에서 8 분 330 XG에서 BAL 액을 emaining -80 ° C.에 그것을 저장, ELISA 사이토 카인 분석을위한 상층 액을 cytospin에 의해 차등 세포 수에 대한 5.10-5.13 단계를 따릅니다.
- 펠릿이 빨간색 인 경우, RBC의 용해 버퍼의 250-300 μL에 펠렛을 재현 탁 적혈구가 3 분 동안 초순수 증류수에 1:10으로 희석 용해. 4 ℃에서 8 분 330 XG에 2 ㎖ PBS와 원심 분리기으로 중화
- 상등액을 버리고 RPMI 10 % 소 태아 혈청 (FBS)에서 펠렛을 재현 탁. 총 세포 수에 따라 1 × 10 6 세포 / ml을 제공하는 볼륨을 사용합니다.
- cytospin의 중심을 향하도록 종이 필터를 cytospin에 해당 슬롯에 현미경 슬라이드 및 필터를 놓습니다. 5 분 300 XG에 cytocentrifuge의 cytospin 원심 분리기의 적절한 우물에 각 시료 150 μl를 피펫.
- 엄마에 따르면, Romanowsky 상용 키트를 사용하여 염색하여 슬라이드를 얼룩nufacturer의 지시 이전 12 설명 된대로. 단계 MPO 활동 분석을위한 5.14-5.17을 따르십시오.
- 4 ℃에서 5 분 380 XG에서 BAL의 남은 양을 원심 분리기 뜨는을 취소하고 세포를 용해하는 초 고순도 증류수 헥사 클로라이드 0.5 %의 250 μL에 펠렛을 재현 탁. 서스펜션은 분석을 수행하기 전에 몇 일 동안 -20 ° C에서 얼 수있다.
- 30 4 ° C에서 최소 및 샘플도 적절한 희석, 잘 경우 필요에 각각 중복에서 샘플을 추가, 96 - 웰 플레이트에 MPO 분석을 수행하는 상층 액을 사용하여 16,000 XG에 원심 분리기.
- 우물의 각 샘플에 추가 3,3 동량 ', 5,5'퍼 옥시다아제에 대한 기질로서 - 테트라 메틸 벤지딘 (TMB). 컬러에 대한 발전이 없을 때까지 반응이 적어도 5 분 동안 어두운 데에서 일어날 수 있도록 허용하고.
- 이 MH 2 SO 4를 첨가하여 반응을 정지ND 450 nm에서 OD를 측정합니다. OD 값은 퍼 옥시 다제 활성에 직접적으로 비례한다.
6. 폐 및 사이토 카인 분석에 세균 부하 측정
- 즉시 BAL 유체 수집 한 후, 마우스에서 소비세 폐,,, 멸균 PBS에 별도의 엽 (叶)을 헹구어 멸균 PBS의 2 ㎖의 둥근 바닥 튜브에 넣어 얼음에 저장합니다.
주 : 사이토킨 분석 할 경우에, 튜브를 PBS로 프로테아제 억제제를 추가한다. - 무균 폐를 균질화, 균질에서 작은 나누어지는 (300 μL)를 가지고, 직렬 TSA 판에, PBS 접시 1:10 희석 밤새 37 ° C에서 알을 품다. 총기도 세균 부하가 BAL 액과 폐에서 발견 된 CFUs의 합이되므로주의하시기 바랍니다.
- 4 ℃에서 30 분 동안 16,000 XG에서 나머지 균질를 원심 분리기 -80 ° C에서 ELISA 사이토 카인 분석을위한 뜨는 및 저장을
7. 조직 학적 검사
<올>결과
프로토콜은 P. 제대로 완료되면 녹농균 한천 - 구슬은 100 ~ 200 사이의 μm의를 측정하고 슬라이드에 한천 비즈 현탁액의 작은 볼륨을 피펫 팅에 의해 거꾸로 광학 현미경으로 관찰 할 수있다. 도 1에 상세히 도시 된 바와 같이 하나의 균체는, 한천 구슬에 표시됩니다.
P.의 선택 한천 비즈 제조에 사용 루기 노자 균주가 중요하다.도 2...
토론
P.에있는 중요한 단계 녹농균 비즈 준비 및 마우스 문제는 아래에보고됩니다.
마우스 도전에 사용되는 녹농균 변형이 중요합니다. 사망, 만성 감염 또는 통관 도전에 사용되는 균주에 따라 크게 다를 수 있습니다. P. 그것은 비교적 낮은 사망률, 더 심한 병변, 높은 만성 감염의 결과 때문에 녹농균 RP73 임상 균주 PAO1 참조 실험실 변형 선호했?...
공개
저자는 더 경쟁 재정적 이익이 없다는 것을 선언합니다.
감사의 말
Bragonzi의 실험실에서 연구는 이탈리아 낭포 성 섬유증 재단 (CFaCore) 및 EU-F7-2009-223670에 의해 투자되었다. 이 작품의 일부는 증류기, 고급 현미경 실험실에서 실시하고, 마우스의 조직 병리학은 병리학 해부학 (산 라파엘 과학 연구소) 단위로 수행되었다.
자료
| Name | Company | Catalog Number | Comments |
| Bacto Tryptic Soy Broth | Becton Dickinson | 211823 | |
| Difco Agar, granulated | Becton Dickinson | 214510 | |
| Heavy mineral oil | Sigma-Aldrich | 330760-1L | |
| S-(+)-Ketamine hydrochloride | Sigma-Aldrich | K1884 | |
| Xylazine hydrochloride | Sigma-Aldrich | X1251 | |
| 1 ml Syringe 25 G 5/8 in 0.5 mm x 16 mm | PIC | 3071250300350 | |
| Catheter 22 G 0.9 mm x 25 mm | Becton Dickinson | 381223 | |
| Graefe Forceps - 0.5 mm Tips Curved | Fine Science Tools | 11152-10 | |
| Scissors, Iris, 11 cm, straight | World Precision Instruments | 501758 | |
| Suture clips | Fine Science Tools | 12040-01 | |
| Suture thread | Fine Science Tools | 18020-40 | |
| RPMI 1640 | Lonza | BE12-167F | |
| Complete protease inhibitor cocktail | Roche | 11836145001 | |
| Fast-Read 102 Burker disposable chamber | Biosigma | 390497 | |
| Tuerk solution | Fluka | 93770 | |
| RBC lysis buffer | Biolegend | 420301 | |
| Fetal bovine serum | Lonza | DE14-801F | |
| EZ cytofunnel | Thermo Scientific | A78710021 | |
| Superfrost ultra plus microscope slides | Thermo Scientific | J3800AMNZ | |
| Diff-Quik Romanowsky staining set | Medion Diagnostics | 130832 | |
| Hexadecyltrimethylammonium chloride | Sigma-Aldrich | 52366-10G | |
| 96-well EIA/RIA plate | Costar | 3590 | |
| 3,3’,5,5’- Tetramethylbenzidine | Sigma-Aldrich | T8665-1L | |
| Sulfuric acid | Sigma-Aldrich | 320501-1L | |
| 10% Neutral buffered formalin | Bio-Optica | 05-01005Q | |
| Harris hematoxylin non Papanicolau | Bio-Optica | 05-M06004 | |
| Eosin plus alcoholic solution | Bio-Optica | 05-M11007 | |
| Equipment | |||
| Shaking incubator | Amerex Instruments | Steady Shake 757 | |
| Water bath | Grant | SUB14 | |
| Homogenizer | Ystral | ||
| Precision balance | KERN | 440-47N | |
| Cytocentrifuge | Thermo Scientific | A78300003 | |
| Low Cost Heating Pad | 2biol | LCHP | |
| Homogenization probe | Ystral | 2366925(small) | |
| Inverted optical microscope | Zeiss | Axioplan2 | |
| Camera (microscope) | Zeiss | Axiocam MRc5 | |
| Rotary microtome | Leica | RM2255 | |
참고문헌
- Gibson, R., Burns, J. L., Ramsey, B. W. Pathophysiology and management of pulmonary infections in cystic fibrosis. Am. J. Respir. Crit. Care. 168, 918-951 (2003).
- Bragonzi, A. Murine models of acute and chronic lung infection with cystic fibrosis pathogens. IJMM. 300, 584-593 (2010).
- Cash, H. A., McCullough, B., Johanson, W. G., Bass, J. A. A rat model of chronic respiratory infection with Pseudomonas aeruginosa. Am. Rev. Respir. Dis. 119, 453-459 (1979).
- Starke, J. R., Langston, C., Baker, C. J. A mouse model of chronic pulmonary infection with Pseudomonas aeruginosa and Pseudomonas cepacia. Pediatr. Res. 22, 698-702 (1987).
- Pedersen, S. S., Hansen, B. L., Hansen, G. N. Induction of experimental chronic Pseudomonas aeruginosa lung infection with P. aeruginosa entrapped in alginate microspheres. APMIS. 98, 203-211 (1990).
- Bragonzi, A., et al. Nonmucoid Pseudomonas aeruginosa expresses alginate in the lungs of patients with cystic fibrosis and in a mouse model. J. Infect. Dis. 192, 410-419 (2005).
- van Heeckeren, A. M. Murine models of chronic Pseudomonas aeruginosa lung infection. Lab. Anim. 36, 291-312 (2002).
- Bragonzi, A., et al. Pseudomonas aeruginosa microevolution during cystic fibrosis lung infection establishes clones with adapted virulence AJRCCM. 180, 138-145 (2009).
- Kukavica-Ibrulj, I., Facchini, M., Cigana, C., Levesque, R. C., Bragonzi, A., Filloux, S., Ramos, J. L. Assessing Pseudomonas aeruginosa virulence and the host response using murine models of acute and chronic lung infection. Methods in Pseudomonas aeruginosa: Humana Press. , (2014).
- Moalli, F., et al. The Therapeutic Potential of the Humoral Pattern Recognition Molecule PTX3 in Chronic Lung Infection Caused by Pseudomonas aeruginosa. J. Immunol. 186, 5425-5534 .
- Paroni, M. Response of CFTR-deficient mice to long-term Pseudomonas aeruginosa chronic infection and PTX3 therapeutic treatment. J. Infect. Dis. In press, .
- Maxeiner, J., Karwot, R., Hausding, M., Sauer, K. A., Scholtes, P., Finotto, S. A method to enable the investigation of murine bronchial immune cells, their cytokines and mediators. Nat. Protoc. 2, 105-112 (2007).
- Bragonzi, A., et al. Pseudomonas aeruginosa microevolution during cystic fibrosis lung infection establishes clones with adapted virulence.. AJRCCM. In press, (2009).
- Pirone, L., et al. Burkholderia cenocepacia strains isolated from cystic fibrosis patients are apparently more invasive and more virulent than rhizosphere strains. Environ. Microbiol. 10, 2773-2784 (2008).
- Bragonzi, A., et al. Modelling co-infection of the cystic fibrosis lung by Pseudomonas aeruginosa and Burkholderia cenocepacia reveals influences on biofilm formation and host response. PLoS One. 7, .
- Bianconi, I., et al. Positive signature-tagged mutagenesis in Pseudomonas aeruginosa: tracking patho-adaptive mutations promoting long-term airways chronic infection. PLoS Pathog.. 7, (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유