Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Chronique à long terme
Dans cet article
Résumé
Nous décrivons la méthode agar-perles d'établir une infection persistante chronique des voies respiratoires à Pseudomonas aeruginosa à long terme dans le modèle de la souris.
Résumé
Un modèle de souris de l'infection chronique des voies respiratoires est un atout majeur dans la fibrose kystique (FK) la recherche, mais il ya un certain nombre de préoccupations concernant le modèle lui-même. Les premières phases de l'inflammation et de l'infection ont été largement étudiés en utilisant le modèle d'agar-perles souris Pseudomonas aeruginosa, tandis que peu de rapports ont mis l'accent sur l'infection chronique à long terme in vivo. Le principal défi pour l'infection chronique à long terme reste la faible charge bactérienne par P. aeruginosa et le faible pourcentage de semaines de souris infectées après l'épreuve, ce qui indique que les cellules bactériennes sont progressivement effacés par l'hôte.
Cet article présente une méthode pour obtenir une infection chronique efficace à long terme chez la souris. Cette méthode est basée sur l'incorporation de la P. souches cliniques aeruginosa dans l'agar-perles in vitro, suivie par instillation intratrachéale chez les souris C57Bl/6NCrl. Infection pulmonaire bilatérale est associée à plusieurs mesurables lecture-out, y compris la perte de poids, la mortalité, l'infection chronique, et la réponse inflammatoire. Le P. souche clinique aeruginosa RP73 a été préférée à la souche de laboratoire de référence de PAO1 car elle a entraîné une mortalité relativement bas, des lésions plus sévères, et l'infection chronique plus élevé. P. aeruginosa colonisation peut persister dans le poumon pendant plus de trois mois. Pathologie pulmonaire murin ressemble à celle de patients atteints de mucoviscidose avec une maladie pulmonaire chronique avancée.
Ce modèle murin imite plus étroitement le cours de la maladie chez l'homme et peut être utilisé à la fois pour des études sur la pathogenèse et pour l'évaluation de nouvelles thérapies.
Introduction
La fibrose kystique (FK) est une maladie génétique causée par des mutations dans le régulateur de la conductance transmembranaire de la fibrose kystique (CFTR) de gène. Ce gène code pour un canal chlorure exprimé sur la membrane de la plupart des cellules épithéliales. Dilatation des bronches, quantité de mucus et parenchymateuse destruction causée principalement par des infections à Pseudomonas aeruginosa conduit progressivement à une maladie pulmonaire grave et de mortalité dans la plupart des patients atteints de mucoviscidose 1. Comprendre la pathogenèse de la CF et le développement de nouvelles thérapies reposent sur un modèle animal avec caractéristiques de FC. Plusieurs souris, génétiquement modifiées pour le gène CFTR ont été générés, mais limites dans la capacité de ces espèces de récapituler les maladies pulmonaires CF-comme et plusieurs autres anomalies des organes observés chez les patients CF ont été largement documentés 2.
Développement de l'infection est l'un des défis majeurs dans le modèle animal FC. Les cl de la littératuresuggère que tôt une infection chronique durant plus d'un mois peut être atteint que si les souris sont inoculés avec des bactéries incorporées dans un agent d'immobilisation tels que l'agar, agarose, ou algues alginate 3-5. Ces agents immobilisants fournissent les conditions microaérobie / anaérobies qui permettent aux bactéries de se développer sous la forme de microcolonies, de façon similaire à la croissance dans le mucus de patients atteints de mucoviscidose 6. Ce modèle de l'infection chronique conduit à la persistance de la bactérie dans les poumons, causant une inflammation des voies respiratoires et des dommages 7. Toutefois, en fonction de la méthode utilisée, la souche bactérienne et la dose inoculée dans les poumons, le pourcentage de souris infectées chroniques et la charge bactérienne dans les poumons récupéré à différents points dans le temps peuvent varier considérablement. En particulier, le principal défi pour l'infection chronique à long terme reste la faible charge bactérienne par P. aeruginosa et le faible pourcentage de semaines de souris infectées après l'épreuve, indiquant thacellules bactériennes sont progressivement effacés t par l'hôte. En sélectionnant le P. aeruginosa RP73 souche clinique d'une collection de FC isole 8 nous avons obtenu avec succès une faible mortalité, des lésions plus sévères, et le pourcentage élevé d'infection chronique avec une charge bactérienne stable jusqu'à un mois chez la souris C57Bl/6NCrl.
Ce document détaille la méthodologie pour intégrer P. aeruginosa dans les billes d'agar-agar, nous avons des souris infectées par instillation intratrachéale, mesuré la charge bactérienne et des cytokines dans les poumons, recueillies LBA et effectué un examen histologique. Dans l'ensemble, ce protocole aidera les chercheurs à répondre à des questions d'une importance fondamentale sur la pathogenèse 8,9 et de tester de nouvelles thérapies contre P. aeruginosa infection chronique 10,11.
Protocole
Une. Préparer les bactéries Infection chronique (trois et deux jours avant souris Challenge)
- Sélectionnez le P. approprié aeruginosa souche à tester.
- Inoculer une anse de P. aeruginosa d'un -80 ° C culture mère à une plaque Trypticase Soy Agar (TSA) et incuber à 37 ° C pendant la nuit.
- Choisissez une seule colonie et inoculer dans 5 ml Trypticase Soy Broth (TSB) dans un tube de 15 ml enfichable plafonné et incuber à 37 ° C pendant une nuit dans un incubateur à agitation à 200 rpm.
2. Intégrer les bactéries dans les perles Agar pour l'infection chronique (un jour avant l'infection)
- Prendre une petite aliquote de culture d'une nuit de bactéries, dilué à 1:50 dans du tampon phosphate salin (PBS) et mesurer la densité optique (DO) à 600 nm.
- Diluer la culture bactérienne nuit en ajoutant 2 OD dans un nouveau tube de pression coiffé contenant 20 ml de TSB frais.
- Incuber à 37 ° C pendant environ 3 -4 h à identifier la phase dans un incubateur à agitation à 200 rpm, jusqu'à un total de 10-15 OD est atteint.
- Entre-temps, préparer la TSA, TSB faite avec de 1,5% d'agar, dans un autoclave et équilibrer à 50 ° C dans un bain d'eau. Equilibrer 150 ml de preautoclaved huile minérale lourde dans un erlenmeyer à 50 ° C dans un bain d'eau.
- Une fois P. aeruginosa atteint la phase de journal, de recueillir les cellules bactériennes par centrifugation à 2700 g pendant 15 min à 4 ° C et jeter le surnageant.
- Remettre en suspension le culot bactérien dans 1 ml de PBS stérile et à fond vortex pour remettre en suspension le culot totalement.
- Mélanger 1 ml de suspension bactérienne avec 9 ml de TSA liquide pré-équilibré à 50 ° C.
- Ajouter les 10 ml TSA-P. aeruginosa mélange à l'huile minérale lourde (préchauffé à 50 ° C) et immédiatement en remuant pendant 6 min à température ambiante. L'agitation doit produire un vortex visible dans l'huile.
- Refroidir le mélange à 4 ° C, sous agitation au minimum spEED pendant 35 min (Figure 1).
- Placez le mélange agar-perles d'huile dans la glace pendant 20 minutes supplémentaires.
- Transférer l'agar-perles en tubes de 50 ml Falcon et centrifuger à 2700 g pendant 15 min à 4 ° C.
- Enlever précision huile minérale et laver avec du PBS stérile six fois, comme décrit à l'étape 2.11. Après trois lavages, les billes peuvent être rassemblées en un culot par gravité au lieu d'utiliser la centrifugeuse. Après le dernier lavage, remettre en suspension les perles d'agar-20 à 30 ml dans du PBS.
- Prélever une partie aliquote des billes (environ 0,5 ml) et d'homogénéiser de façon aseptique.
- Prenez 100 pi de perles homogénéisés et diluer dans 900 pi de PBS stérile. Diluer en série 01:10 jusqu'à 10 -6.
- Plate dilution en série sur des plaques de TSA, y compris un échantillon non dilué jusqu'à 10 -6 et incuber les plaques à 37 ° C.
- Mesurer le diamètre de bourrelet à l'aide d'un microscope optique inversé dans plusieurs domaines. Le diamètre du cordon doit être comprise entre 100-200 um ( Figure 1).
- Stocker les perles nuit à 4 ° C.
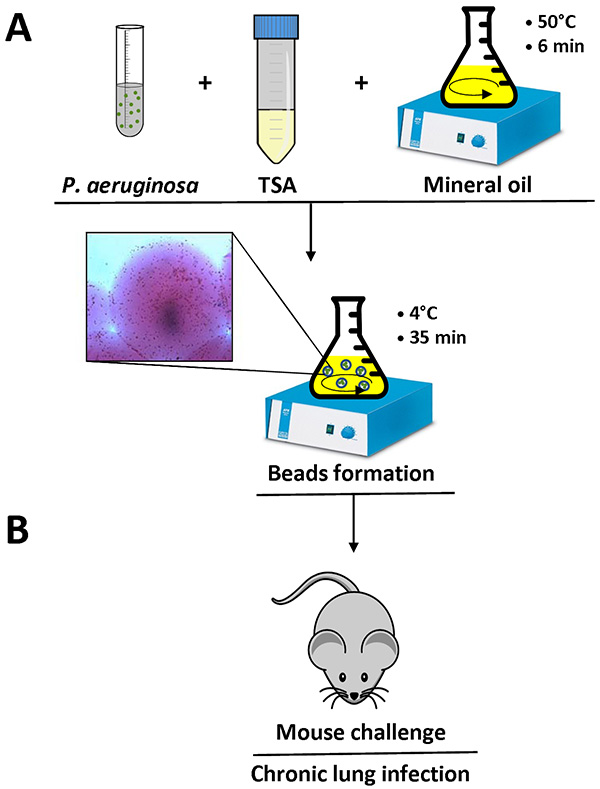
Figure 1. Vue d'ensemble de la préparation de billes et de la souris infection agar. P. aeruginosa cellules sont remises en suspension dans 1 ml de PBS et on a ajouté à 9 ml de TSA liquide (50 ° C). Ce mélange est ajouté à 150 ml d'huile minérale lourde, à 50 ° C dans un ballon et on agite à grande vitesse pendant 6 min à température ambiante. Lorsque le ballon est refroidi à 4 ° C avec une agitation lente pendant 35 min, la gélose se solidifie créer des perles, et les bactéries présentes dans le mélange sont incorporés dans les perles d'agar-agar. Détail d'un bourrelet de gélose contenant des cellules bactériennes est signalée (A). Après avoir retiré l'huile minérale avec plusieurs lavages à l'aide de PBS stérile, la suspension d'agar-perles est prêt fou l'inoculation dans les poumons de souris par une injection intra-trachéale (B). Cliquez ici pour agrandir l'image .
3. Souris Défi avec l'agar-perles
Déclaration éthique: ce protocole et d'expérimentation suivent les directives du comité de protection des animaux et de l'éthique de l'Institut scientifique San Raffaele.
- Comptez le nombre d'unités formant colonie (UFC) sur les plaques de TSA pour déterminer le nombre de CFU / ml dans la suspension d'agar-billes. Diluer l'agar-perles avec du PBS stérile à 2-4 x 10 7 UFC / ml pour atteindre un inoculum optimale de 1-2 x 10 6 à 50 pi.
- Anesthésier C57Bl/6NCr (20 à 22 g, âgées de 6-8 semaines) chez la souris mâle avec de la kétamine (50 mg / ml) et de xylazine (5 mg / ml) dans du NaCl à 0,9% sont administrés à un volume de 0,002 ml / g de poids corporel par injection intra-péritonéale.
NOTE: L'anesthésie est considérée ADEQluer lorsque l'animal reste toujours tranquillement, est insensible aux stimuli externes, et a coeur et taux respiratoires. - Placez la souris en position couchée. Désinfecter le manteau de la souris avec 70% d'éthanol.
- Exposer la trachée par une coupe verticale de la peau et intuber la trachée avec un stérile, souple 22 G 0,9 mm x 25 mm cathéter IV, maintenir l'attention de retirer le stylet tout en se déplaçant vers le bas dans la trachée. Insérer le cathéter n'est pas trop profondément dans la trachée. S'arrêter avant de la carène (bifurcation).
- Prendre immédiatement un volume de 50 ul de la suspension de billes d'agar par une seringue de 1 ml et l'attacher au cathéter. Poussez doucement le piston de la seringue, permettant aux perles à implanter dans le poumon. Fermer l'incision en utilisant des agrafes.
- Placez l'animal sur un coussin chauffant jusqu'à ce que complètement réveillé.
4. Évaluation de souris
- Respecter les souris quotidiennement les signes cliniques, y compris la qualité de la robe, de la posture,marche, et l'état d'hydratation. Surveiller le poids corporel par jour. Les souris qui perdent ≥ 20% du poids corporel doivent être euthanasiés.
- Suivez le point 5 de la collecte de fluide lavage broncho-alvéolaire (LBA) et les points 6 ou 7 pour la collecte des poumons et de l'analyse sur un total de CFU, l'analyse histologique, la réponse inflammatoire en termes de nombre total et différencié cellule de la BAL, l'analyse des cytokines, et la myéloperoxydase (MPO).
5. BAL Collecte et analyse des fluides
- Euthanasier les souris par inhalation de CO 2.
- Placez la souris en position couchée. Désinfecter le manteau de la souris avec 70% d'éthanol.
- Exposer la trachée et de la cage thoracique par une coupe verticale de la peau. Exposer les poumons en coupant le diaphragme.
- Insérez un fil de suture dans la trachée en utilisant des pinces et intuber la trachée avec un stérile, souple 22 g 0,9 mm x 25 mm cathéter IV. Tirez les deux extrémités du fil de suture pour lier le catheter de la trachée et de nouer le fil autour de la trachée.
- Prélever un volume de 1 ml de RPMI 1640 en utilisant une seringue de 1 ml et l'attacher au cathéter. Poussez le piston de la seringue pour laver les poumons et récupérer immédiatement le liquide, le stocker dans un tube de 15 ml.
NOTE: Si les cytokines doivent être analysés, ajouter des inhibiteurs de protéase à RPMI 1640. - Répéter cette étape trois fois avec un total de 3 ml de milieu RPMI. A partir de maintenant, stocker le liquide de LBA sur la glace. Passez à l'étape 6 pour la collecte et l'analyse des poumons.
NOTE: S'il vous plaît noter que pas tout le liquide seront récupérés (2,8 ml maximum). - Pour la quantification des bactéries présentes dans le fluide de BAL, prélever une petite aliquote (300 pi), en série, diluer 1:10 dans du PBS stérile, plaque sur des plaques de TSA et incuber à 37 ° C pendant une nuit.
- Compter les cellules totales en utilisant un microscope optique inversé lumière diluant une partie aliquote du fluide BAL 1:02 avec une solution Tuerk dans une chambre de comptage de cellules Burker.
- Centrifuger le remaining LBA à 330 g pendant 8 min à 4 ° C. Prendre le surnageant pour l'analyse ELISA de cytokines, stocker à -80 ° C. Suivez les étapes 5.10 à 5.13 pour le nombre de cellules écart par cytospin.
- Si la pastille est rouge, lyser les erythrocytes de remettre en suspension le culot dans 250 à 300 pi de tampon de lyse RBC dilués à 1:10 dans de l'eau distillée ultra pure pendant 3 min. Neutraliser avec 2 ml de PBS et centrifuger à 330 g pendant 8 min à 4 ° C.
- Jeter le surnageant et remettre en suspension le culot dans du milieu RPMI 10% de sérum bovin fœtal (FBS). Utiliser un volume qui fournira 1 x 10 6 cellules / ml, sur la base du nombre total de cellules.
- Placer des lames de microscope et des filtres dans des fentes appropriées dans la cytospin avec les filtres en carton faisant face au centre de la cytospin. Introduire à la pipette 150 ul de chaque échantillon dans les puits appropriés de la cytospin et centrifuger dans un cytocentrifugeuse à 300 g pendant 5 min.
- Colorer les lames par Romanowsky coloration utilisant un kit commercial, selon le males instructions tion du fabricant et comme décrit précédemment 12. Suivez les étapes 5.14 à 5.17 pour MPO analyse de l'activité.
- Centrifuger le volume restant de BAL à 380 xg pendant 5 min à 4 ° C. Jeter le surnageant et remettre en suspension le culot dans 250 pl de chlorure Hexadecyltrimethylammonium à 0,5% dans de l'eau distillée ultra pure pour lyser les cellules. La suspension peut être congelé à -20 ° C pendant plusieurs jours avant de réaliser le dosage.
- Centrifuger à 16 000 g pendant 30 min à 4 ° C et en utilisant le surnageant pour effectuer dosage MPO dans des plaques à 96 puits, ajouter l'échantillon en double exemplaire dans chaque puits et, si nécessaire, également des dilutions appropriées de l'échantillon.
- Ajouter à chaque échantillon dans les puits un volume égal de 3,3 ', 5,5'-tétraméthylbenzidine (TMB) comme substrat pour la peroxydase. Laisser la réaction doit se faire dans l'obscurité pendant au moins 5 minutes et jusqu'à ce que il n'y a plus développement de la couleur.
- Arrêter la réaction en ajoutant 2 MH 2 SO 4 and mesurer la DO à 450 nm. La valeur de DO sera directement proportionnelle à l'activité de la peroxydase.
6. Mesure de la charge bactérienne dans les poumons et de cytokines analyse
- Immédiatement après le prélèvement de fluide BAL, poumons d'accise de la souris, les rincer dans du PBS stérile, lobes distincts, les mettre dans un tube à fond rond avec 2 ml de PBS stérile et stocker sur la glace.
NOTE: Si cytokines sont à analyser, ajouter des inhibiteurs de protease à du PBS pour les tubes. - Homogénéiser aseptique poumons, prendre une petite aliquote (300 pi) de l'homogénat, série diluer 1:10 dans PBS, plaque sur des plaques de TSA et incuber à 37 ° C pendant la nuit. S'il vous plaît noter que la charge bactérienne des voies aériennes totale sera la somme des CFU trouvés dans le fluide BAL et les poumons.
- Centrifuger l'homogénat à 16 000 xg restant pendant 30 min à 4 ° C. Prenez le surnageant pour ELISA analyse des cytokines, et conserver à -80 ° C.
7. L'examen histologique
- Effectuer une analyse histologique seulement sur les poumons dans lequel le liquide de LBA n'a pas été recueillies, afin de préserver l'aspect et les propriétés du poumon.
- Euthanasier la souris par inhalation de CO 2.
- Exposer la cage thoracique par une coupe verticale de la peau, les poumons exposer en coupant le diaphragme.
- poumons d'accise, les rincer dans du PBS, séparent les lobes, les mettre dans un tube contenant du formol 5-10 ml 10% neutre tamponné (4% de formaldéhyde) et conserver à 4 ° C à l'abri de la lumière.
- Intégrer poumons en paraffine, en utilisant des procédures standard.
- Couper 5 sections um d'épaisseur à l'aide d'un microtome.
- diapositives de coloration à l'hématoxyline et de l'éosine et couvrent les lames avec une lamelle, selon les procédures standard.
- Examiner les lames à l'aide d'un microscope inversé à fond clair et à acquérir des images en connectant le microscope à un appareil photo.
Résultats
Lorsque le protocole est fait correctement, le P. aeruginosa agar-perles mesurent entre 100-200 um et peuvent être observés avec un microscope optique inversé par aspiration un petit volume de la suspension d'agar-perles sur une diapositive. Des cellules bactériennes individuelles peuvent être consultées dans les perles d'agar-agar, comme représenté en détail sur la figure 1.
Le choix de P. aeruginosa souche utilisée dans la préparation d...
Discussion
Les étapes essentielles de la P. aeruginosa-perles préparation et le défi de la souris sont présentés ci-dessous.
La souche de P. aeruginosa utilisé pour les souris défi est critique. La mortalité, une infection chronique ou clairance peuvent différer sensiblement en fonction de la souche bactérienne utilisée pour le défi. Le P. souche clinique aeruginosa RP73 a été préférée à la souche de laboratoire de référence de PAO1 car e...
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont aucun intérêt financier concurrents.
Remerciements
Recherche dans le laboratoire de Bragonzi a été financé par la Fondation italienne de la fibrose kystique (CFaCore) et de l'UE-F7-2009-223670. Une partie de ce travail a été réalisé dans ALEMBIC, un laboratoire de microscopie de pointe, et l'histopathologie de la souris a été réalisée dans l'Unité d'anatomie pathologique (San Raffaele Scientific Institute).
matériels
| Name | Company | Catalog Number | Comments |
| Bacto Tryptic Soy Broth | Becton Dickinson | 211823 | |
| Difco Agar, granulated | Becton Dickinson | 214510 | |
| Heavy mineral oil | Sigma-Aldrich | 330760-1L | |
| S-(+)-Ketamine hydrochloride | Sigma-Aldrich | K1884 | |
| Xylazine hydrochloride | Sigma-Aldrich | X1251 | |
| 1 ml Syringe 25 G 5/8 in 0.5 mm x 16 mm | PIC | 3071250300350 | |
| Catheter 22 G 0.9 mm x 25 mm | Becton Dickinson | 381223 | |
| Graefe Forceps - 0.5 mm Tips Curved | Fine Science Tools | 11152-10 | |
| Scissors, Iris, 11 cm, straight | World Precision Instruments | 501758 | |
| Suture clips | Fine Science Tools | 12040-01 | |
| Suture thread | Fine Science Tools | 18020-40 | |
| RPMI 1640 | Lonza | BE12-167F | |
| Complete protease inhibitor cocktail | Roche | 11836145001 | |
| Fast-Read 102 Burker disposable chamber | Biosigma | 390497 | |
| Tuerk solution | Fluka | 93770 | |
| RBC lysis buffer | Biolegend | 420301 | |
| Fetal bovine serum | Lonza | DE14-801F | |
| EZ cytofunnel | Thermo Scientific | A78710021 | |
| Superfrost ultra plus microscope slides | Thermo Scientific | J3800AMNZ | |
| Diff-Quik Romanowsky staining set | Medion Diagnostics | 130832 | |
| Hexadecyltrimethylammonium chloride | Sigma-Aldrich | 52366-10G | |
| 96-well EIA/RIA plate | Costar | 3590 | |
| 3,3’,5,5’- Tetramethylbenzidine | Sigma-Aldrich | T8665-1L | |
| Sulfuric acid | Sigma-Aldrich | 320501-1L | |
| 10% Neutral buffered formalin | Bio-Optica | 05-01005Q | |
| Harris hematoxylin non Papanicolau | Bio-Optica | 05-M06004 | |
| Eosin plus alcoholic solution | Bio-Optica | 05-M11007 | |
| Equipment | |||
| Shaking incubator | Amerex Instruments | Steady Shake 757 | |
| Water bath | Grant | SUB14 | |
| Homogenizer | Ystral | ||
| Precision balance | KERN | 440-47N | |
| Cytocentrifuge | Thermo Scientific | A78300003 | |
| Low Cost Heating Pad | 2biol | LCHP | |
| Homogenization probe | Ystral | 2366925(small) | |
| Inverted optical microscope | Zeiss | Axioplan2 | |
| Camera (microscope) | Zeiss | Axiocam MRc5 | |
| Rotary microtome | Leica | RM2255 | |
Références
- Gibson, R., Burns, J. L., Ramsey, B. W. Pathophysiology and management of pulmonary infections in cystic fibrosis. Am. J. Respir. Crit. Care. 168, 918-951 (2003).
- Bragonzi, A. Murine models of acute and chronic lung infection with cystic fibrosis pathogens. IJMM. 300, 584-593 (2010).
- Cash, H. A., McCullough, B., Johanson, W. G., Bass, J. A. A rat model of chronic respiratory infection with Pseudomonas aeruginosa. Am. Rev. Respir. Dis. 119, 453-459 (1979).
- Starke, J. R., Langston, C., Baker, C. J. A mouse model of chronic pulmonary infection with Pseudomonas aeruginosa and Pseudomonas cepacia. Pediatr. Res. 22, 698-702 (1987).
- Pedersen, S. S., Hansen, B. L., Hansen, G. N. Induction of experimental chronic Pseudomonas aeruginosa lung infection with P. aeruginosa entrapped in alginate microspheres. APMIS. 98, 203-211 (1990).
- Bragonzi, A., et al. Nonmucoid Pseudomonas aeruginosa expresses alginate in the lungs of patients with cystic fibrosis and in a mouse model. J. Infect. Dis. 192, 410-419 (2005).
- van Heeckeren, A. M. Murine models of chronic Pseudomonas aeruginosa lung infection. Lab. Anim. 36, 291-312 (2002).
- Bragonzi, A., et al. Pseudomonas aeruginosa microevolution during cystic fibrosis lung infection establishes clones with adapted virulence AJRCCM. 180, 138-145 (2009).
- Kukavica-Ibrulj, I., Facchini, M., Cigana, C., Levesque, R. C., Bragonzi, A., Filloux, S., Ramos, J. L. Assessing Pseudomonas aeruginosa virulence and the host response using murine models of acute and chronic lung infection. Methods in Pseudomonas aeruginosa: Humana Press. , (2014).
- Moalli, F., et al. The Therapeutic Potential of the Humoral Pattern Recognition Molecule PTX3 in Chronic Lung Infection Caused by Pseudomonas aeruginosa. J. Immunol. 186, 5425-5534 .
- Paroni, M. Response of CFTR-deficient mice to long-term Pseudomonas aeruginosa chronic infection and PTX3 therapeutic treatment. J. Infect. Dis. In press, .
- Maxeiner, J., Karwot, R., Hausding, M., Sauer, K. A., Scholtes, P., Finotto, S. A method to enable the investigation of murine bronchial immune cells, their cytokines and mediators. Nat. Protoc. 2, 105-112 (2007).
- Bragonzi, A., et al. Pseudomonas aeruginosa microevolution during cystic fibrosis lung infection establishes clones with adapted virulence.. AJRCCM. In press, (2009).
- Pirone, L., et al. Burkholderia cenocepacia strains isolated from cystic fibrosis patients are apparently more invasive and more virulent than rhizosphere strains. Environ. Microbiol. 10, 2773-2784 (2008).
- Bragonzi, A., et al. Modelling co-infection of the cystic fibrosis lung by Pseudomonas aeruginosa and Burkholderia cenocepacia reveals influences on biofilm formation and host response. PLoS One. 7, .
- Bianconi, I., et al. Positive signature-tagged mutagenesis in Pseudomonas aeruginosa: tracking patho-adaptive mutations promoting long-term airways chronic infection. PLoS Pathog.. 7, (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon