Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Langzeitchronik
In diesem Artikel
Zusammenfassung
Wir beschreiben die Agar-Perlen Methode, um anhaltende langfristige chronische Pseudomonas aeruginosa-Infektion der Atemwege im Mausmodell zu etablieren.
Zusammenfassung
Ein Maus-Modell der chronischen Atemwegsinfektion ist ein Schlüsselfaktor bei zystischer Fibrose (CF)-Forschung, obwohl es eine Reihe von Bedenken in Bezug auf das Modell selbst. Frühen Phasen der Entzündung und Infektion wurden weitgehend mit Hilfe der Pseudomonas aeruginosa-Agar-Perlen Maus-Modell untersucht, während nur wenige Berichte über die langfristige chronische Infektion in vivo konzentriert. Die größte Herausforderung für langfristige chronische Infektion bleibt die geringe Keimbelastung von P. aeruginosa und der geringe Anteil der infizierten Mäuse Wochen nach der Herausforderung, die anzeigt, dass Bakterienzellen werden nach und nach durch den Host gelöscht.
Dieser Beitrag stellt eine effiziente Methode zur Gewinnung von langfristigen chronischen Infektion bei Mäusen. Dieses Verfahren basiert auf der Einbettung des P. basierend aeruginosa klinischen Stämmen in den Agar-Perlen in vitro, gefolgt von Intratrachealbiopersistenztest in C57Bl/6NCrl Mäusen. Bilaterale Lungenentzündung ist mit meh verbundenBundes messbare Lese-outs einschließlich Gewichtsverlust, Sterblichkeit, chronische Infektion und entzündliche Reaktion. Die P. aeruginosa RP73 klinischen Stamm wurde über die PAO1 Referenzlaborstamm bevorzugt, da es zu einer vergleichsweise niedrigeren Sterblichkeit, mehr schwere Läsionen und höher chronischen Infektion. P. aeruginosa Besiedlung kann in der Lunge mehr als drei Monate andauern. Murine Lungenpathologie ähnelt dem von CF-Patienten mit fortgeschrittener chronischer Lungenerkrankung.
Dieses Mausmodell meisten imitiert den Verlauf der Krankheit beim Menschen und kann sowohl für Studien über die Pathogenese und für die Bewertung neuer Therapien verwendet werden.
Einleitung
Cystische Fibrose (CF) ist eine genetische Erkrankung, die durch Mutationen in der Mukoviszidose-Transmembran-Leitfähigkeitsregulator (CFTR)-Gen verursacht. Dieses Gen kodiert für ein Chlorid-Kanal auf der Membran der meisten Epithelzellen exprimiert. Bronchiektasen, Schleim-Plugging und Parenchymdestruktion hauptsächlich verursacht durch Pseudomonas aeruginosa-Infektionen zunehmend zu schweren Lungenerkrankungen und Sterblichkeit in den meisten CF-Patienten ein zu führen. Understanding CF Pathogenese und Weiterentwicklung neuer Therapien stützen sich auf Tiermodell mit charakteristischen Merkmalen des CF. Mehrere Mäuse, die genetisch für das CFTR-Gen modifiziert wird, erzeugt worden sind, aber Einschränkungen in der Fähigkeit dieser Spezies CF artige Lungenerkrankungen und mehrere andere Organ Anomalien bei CF-Patienten gesehen rekapitulieren wurden weitgehend dokumentiert 2.
Entwicklung der Infektion ist eine der großen Herausforderungen in der CF-Tiermodell. Die Literatur clfrühen legt nahe, dass eine chronische Infektion, die länger als einen Monat kann nur erreicht werden, wenn Mäuse mit Bakterien in einem Immobilisierungsmittel eingebettet, wie Agar, Agarose, Alginat oder Algen 3-5 geimpft werden. Diese Immobilisierungsmittel bieten die mikroaerobe / anaeroben Bedingungen, die Bakterien in der Form von Mikrokolonien ähnlich dem Wachstum in den Schleim von CF-Patienten 6 zu halten, zu erlauben. Dieses Modell der chronischen Infektion führt zur Persistenz der Bakterien in den Lungen verursacht Atemwegsentzündung und Schäden 7. Abhängig von der verwendeten Methode, der Bakterienstamm und die Dosis in die Lunge eingeimpft, der Prozentsatz der chronischen infizierten Mäusen und die Keimbelastung in der Lunge zu verschiedenen Zeitpunkten gewonnen erheblich abweichen. Insbesondere die größte Herausforderung für die langfristige chronische Infektion bleibt die geringe Keimbelastung von P. aeruginosa und der geringe Anteil der infizierten Mäuse Wochen nach dem Challenge, was that Bakterienzellen werden nach und nach durch den Host gelöscht. Durch die Auswahl der P. aeruginosa RP73 klinischen Belastung aus einer Sammlung von CF-Isolate 8 wir niedrige Sterblichkeit, mehr schwere Läsionen und hoher Prozentsatz der chronischen Infektion erfolgreich erhalten mit einer stabilen Bakterienbelastung bis zu einem Monat in C57Bl/6NCrl Mäusen.
Dieses Papier beschreibt die Methode für die Einbettung von P. aeruginosa in den Agar-Perlen, wir haben Mäusen durch Intratrachealbiopersistenztest infiziert, die bakterielle Belastung gemessen und Zytokine in Lunge, gesammelt BAL und histologische Untersuchung durchgeführt. Insgesamt wird dieses Protokoll Forscher bei der Behandlung grundlegend wichtige Fragen zur Pathogenese 8,9 und Prüfung neuer Therapien gegen P. unterstützen aeruginosa chronische Infektion 10,11.
Protokoll
1. Vorbereiten Bakterien für chronische Infektion (drei und zwei Tage vor der Challenge-Maus)
- Wählen Sie die entsprechende P. aeruginosa-Stamm getestet werden.
- Impfen eine Öse P. aeruginosa von einer -80 ° C lager Kultur zu einer Trypticase Soy Agar (TSA) Platte und bei 37 ° C über Nacht.
- Wählen Sie eine einzelne Kolonie und impfen zu 5 ml Trypticasesojabrühe (TSB) in einem 15 ml-Snap-Röhrchen und bei 37 ° C über Nacht in einem Schüttelinkubator bei 200 Umdrehungen pro Minute.
2. Einbetten Bakterien in Agar-Perlen für chronische Infektion (einen Tag vor der Infektion)
- Einen kleinen Aliquot der bakteriellen Übernachtkultur, verdünnt 1:50 phosphatgepufferter Salzlösung (PBS) und Messen der optischen Dichte (OD) bei 600 nm auf.
- Verdünnt das Nacht-Bakterienkultur durch Zugabe von 2 OD in einer neuen Rast Röhrchen mit 20 ml frischem TSB.
- Inkubieren bei 37 ° C für ca. 3 -4 h auf Phase in einem Schüttelinkubator bei 200 UpM einloggen, bis insgesamt 10-15 OD erreicht wird.
- In der Zwischenzeit bereiten die TSA, TSB mit 1,5% Agar, Autoklaven und ins Gleichgewicht bei 50 ° C in einem Wasserbad. Ins Gleichgewicht 150 ml preautoclaved schweres Mineralöl in einem Erlenmeyerkolben bei 50 ° C in einem Wasserbad.
- Nachdem P. aeruginosa erreicht die Log-Phase, sammeln die Bakterienzellen durch Zentrifugation bei 2.700 g für 15 min bei 4 ° C und den Überstand verwerfen.
- Resuspendieren Sie das Bakterienpellet in 1 ml steriler PBS und gründlich vortexen, um das Pellet vollständig zu suspendieren.
- Mischen 1 ml Bakteriensuspension mit 9 ml flüssiger TSA bei 50 º C voräquilibriert
- Fügen Sie die 10 ml TSA-P. aeruginosa Mischung auf schweres Mineralöl (bei 50 ° C vorgewärmt) und sofort rühren für 6 min bei Raumtemperatur. Die Bewegung muss einen sichtbaren Wirbel in der Öl zu produzieren.
- Die Mischung wurde auf 4 ° C, Rühren bei minimalen spEED für 35 min (Abbildung 1).
- Legen Sie das Agar-Perlen-Öl-Gemisch in Eis für weitere 20 min.
- Übertragen Sie die Agar-Perlen in 50 ml Falcon-Röhrchen und-Zentrifuge bei 2700 g für 15 min bei 4 ° C
- Genau zu entfernen Mineralöl und Waschen mit sterilem PBS sechsmal, wie in Schritt 2.11 beschrieben. Nach drei Waschschritten, können die Kügelchen durch Schwerkraft statt der Verwendung der Zentrifuge pelletiert werden. Nach dem letzten Wasch, resuspendieren Agar-Perlen in 20-30 ml PBS.
- Einen aliquoten der Perlen (ca. 0,5 ml) und aseptisch homogenisieren.
- Nehmen Sie 100 ul der homogenisierten Perlen und in 900 ul sterilem PBS verdünnen. Serienmäßig 1:10 verdünnen auf 10 -6.
- Plattenverdünnungs auf TSA-Platten, einschließlich unverdünnten Probe auf 10 -6 und Inkubation Platten bei 37 ° C
- Messen Sie den Kugeldurchmesser mit einem inversen Lichtmikroskop in mehreren Bereichen. Der Kugeldurchmesser muss zwischen 100-200 um sein ( Abbildung 1).
- Bewahren Sie die Perlen über Nacht bei 4 ° C
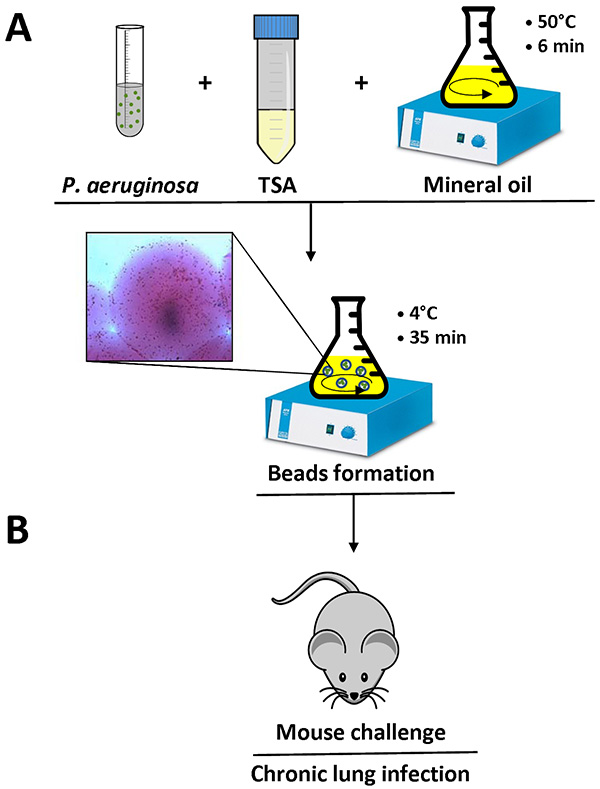
Fig. 1 ist. Übersicht der Agar Perlen Vorbereitung und Maus-Infektion. P. aeruginosa-Zellen werden in 1 ml PBS resuspendiert und zu 9 ml Flüssigkeit TSA (50 ° C). Diese Mischung wird auf 150 ml schweres Mineralöl bei 50 ° C in einen Kolben gegeben und bei hoher Geschwindigkeit für 6 min bei Raumtemperatur gerührt. Wenn der Kolben wird auf 4 ° C mit einer langsamen Rühren für 35 min abgekühlt, verfestigt sich das Agar Schaffung Perlen, und in der Mischung vorhandenen Bakterien werden in den Agar-Kügelchen eingebettet. Detail einer Agar Wulst enthält Bakterienzellen (A) gezeigt. Nach Entfernen des Mineralöls mit mehrmaligem Waschen mit sterilem PBS, bereit f die Agar-Kügelchen-Suspensionoder Impfung in den Lungen von Mäusen eine intratracheale Injektion (B). Klicken Sie hier für eine größere Ansicht .
3. Mäuse Herausforderung mit Agar-Perlen
Ethikerklärung: Dieses Protokoll und Experimentieren an die Richtlinien von der Tierpflege und-Ethik-Kommission von San Raffaele Scientific Institute.
- Die Anzahl der Kolonie bildenden Einheiten (CFU) auf die TSA-Platten, die Anzahl der CFU / ml in dem Agar-Kügelchen-Suspension zu bestimmen. Verdünnen Sie die Agar-Perlen mit sterilem PBS auf 2-4 x 10 7 CFU / ml, um eine optimale Inokulum von 1-2 x 10 6 in 50 ul erreichen.
- Betäuben C57Bl/6NCr (20-22 g, 6-8 Wochen alt) männliche Mäuse mit Ketamin (50 mg / ml) und Xylazin (5 mg / ml) in 0,9% NaCl zu einem Volumen von 0,002 ml / g Körpergewicht verabreicht intraperitoneale Injektion.
HINWEIS: Anästhesie wird als ADEQUate, wenn das Tier bleibt immer noch ruhig, reagiert nicht auf äußere Reize, und eine konstant Herz-und Atemfrequenz. - Platzieren Sie die Maus in Rückenlage. Desinfizieren Sie den Mantel der Maus mit 70% Ethanol.
- Setzen Sie die Luftröhre durch einen vertikalen Schnitt der Haut und Intubation der Luftröhre mit einer sterilen, flexible 22 G 0,9 mm x 25 mm IV-Katheter, halten die Aufmerksamkeit auf das Stilett entfernen während der Bewegung nach unten in die Luftröhre. Legen Sie den Katheter nicht zu tief in die Luftröhre. Stopp vor dem Erreichen der carina (Bifurkation).
- Nehmen Sie sofort ein Volumen von 50 ul Agar-Bead-Suspension mit einer 1-ml-Spritze und befestigen es an dem Katheter. Schieben Sie den Kolben der Spritze, so dass die Perlen in die Lunge implantiert werden. Schließen Sie den Schnitt mit Wundklammern.
- Legen Sie das Tier auf einem Heizkissen, bis ganz wach.
4. Mäuse Bewertung
- Beachten Sie die Mäuse täglich auf klinische Zeichen einschließlich der Fellqualität, Körperhaltung,Gehfähigkeit und Flüssigkeitsstatus. Überwachung der täglichen Körpergewicht. Mäuse, die ≥ 20% des Körpergewichts verlieren, müssen eingeschläfert werden.
- Folgen Sie Punkt 5 für die Sammlung der bronchoalveolären Lavage (BAL) und 6 oder 7 Punkte für die Sammlung der Lunge und der Analyse der Gesamt CFU, histologische Analyse, entzündliche Reaktion im Bereich der Gesamt-und Differential-Zellzahl in der BAL, Zytokin-Analyse und Myeloperoxidase (MPO)-Aktivität.
5. BAL Fluid-Sammlung und Analyse
- Euthanize die Mäuse durch CO 2-Inhalation.
- Platzieren Sie die Maus in der Rückenlage. Desinfizieren Sie den Mantel der Maus mit 70% Ethanol.
- Aussetzen sowie die Trachea Brustkorbs durch einen vertikalen Schnitt der Haut. Expose der Lunge durch Schneiden der Membran.
- Setzen Sie einen Faden unter der Luftröhre mit einer Pinzette und Intubation der Luftröhre mit einer sterilen, flexible 22 g 0,9 mm x 25 mm IV-Katheter. Ziehen Sie die beiden Enden des Fadens Thread, um die ca. bindentheter zu der Trachea und verknoten den Faden um die Luftröhre.
- Nehmen Sie ein Volumen von 1 ml RPMI 1640 mit einer 1-ml-Spritze und befestigen es an dem Katheter. Drücken Sie den Kolben der Spritze, um die Lungen zu waschen und sofort wieder die Flüssigkeit, Speichern in einer 15 ml Tube.
HINWEIS: Wenn Zytokine analysiert werden sollen, fügen Sie Protease-Inhibitoren zu RPMI 1640. - Wiederholen Sie diesen Schritt dreimal mit insgesamt 3 ml RPMI. Von nun an, speichern Sie die BAL-Flüssigkeit auf Eis. Zum für die Sammlung und Analyse von Lungen Schritt 6 weiter.
HINWEIS: Bitte beachten Sie, dass nicht alle der Flüssigkeit abgerufen werden (2,8 ml Maximum). - Zur Quantifizierung der in der BAL-Flüssigkeit Bakterien, probieren Sie eine kleine Teilmenge (300 ul) seriell verdünnt 1:10 in sterilem PBS, Platte auf TSA-Platten und Inkubation bei 37 ° C über Nacht.
- Graf gesamten Zellen mit einem inversen Lichtmikroskop Verdünnung einen aliquoten Teil der BAL-Flüssigkeit 1:2 mit Tuerk Lösung in einer Burker Zellzahl Kammer.
- Zentrifugieren Sie die remaining BAL-Flüssigkeit bei 330 × g für 8 min bei 4 ° C. Mit der Überstand für ELISA Zytokin-Analyse, Lagerung bei -80 ° C. Folgen Sie den Schritten von 5,10 bis 5,13 für Differential-Zellzahl von Zytospin.
- Wenn die Pellets ist rot, lysieren die Erythrozyten Resuspendieren des Pellets in 250 bis 300 ul von RBC Lyse-Puffer 1:10 verdünnt in ultra-reinem destilliertem Wasser für 3 min. Neutralisiert mit 2 ml PBS und Zentrifugation bei 330 g für 8 min bei 4 ° C.
- Überstand verwerfen und das Pellet in RPMI 10% fetales Rinderserum (FBS). Verwenden ein Volumen, das 1 x 10 6 Zellen / ml, bezogen auf die Gesamtzellzahl zur Verfügung stellt.
- Zeigen Mikroskop-Objektträger und Filter in entsprechende Schlitze in der Zytospin Karton mit den Filter vor der Mitte des Zytospin. Pipettieren Sie 150 ul jeder Probe in die entsprechenden Wells der Zytospin und in einer Zentrifuge Zytozentrifuge bei 300 g für 5 min.
- Stain Dias von Romanowsky Färbung mit einem kommerziellen Kit nach der masteller Anweisungen und 12, wie zuvor beschrieben. Folgen Sie den Schritten von 5,14 bis 5,17 für die MPO-Aktivität Analyse.
- Zentrifugieren des verbleibenden Volumens der BAL bei 380 × g für 5 min bei 4 ° C. Überstand verwerfen und das Pellet in 250 ul 0,5% Hexadecyltrimethylammoniumchlorid in ultra-reinem destilliertem Wasser, um die Zellen zu lysieren. Die Suspension kann bei -20 ° C für mehrere Tage vor dem Test eingefroren.
- Zentrifuge bei 16.000 × g für 30 min bei 4 ° C lagern und den Überstand zu MPO-Assay in 96-Well-Platten durchzuführen, indem die Probe in Doppelbestimmung in jedes Loch und, wenn nötig, auch die richtige Verdünnungen der Probe.
- In den jeder Probe in die Vertiefungen ein gleiches Volumen von 3,3 ', 5,5'-Tetramethylbenzidin (TMB) als Substrat für Peroxidase. Die Reaktion kann im Dunkeln für mindestens 5 Minuten dauern, und, bis keine weitere Entwicklung in der Farbe.
- Stoppen der Reaktion durch Zugabe von 2 MH 2 SO 4 and messen die OD bei 450 nm auf. Der OD-Wert wird direkt proportional zur Peroxidase-Aktivität.
6. Messung der bakterielle Belastung in Lungen-und Zytokin-Analyse
- Unmittelbar nach der BAL-Flüssigkeit Sammlung, Verbrauch Lungen von der Maus, spülen Sie sie in sterilem PBS, separate Lappen, legte sie in einem Rundrohr mit 2 ml sterilem PBS und Lagerung auf Eis.
HINWEIS: Wenn Cytokine untersucht werden sollen, hinzuzufügen Proteaseinhibitoren PBS zu den Rohren. - Aseptisch homogenisiert Lunge, nehmen Sie eine kleine Teilmenge (300 ul) aus dem Homogenat, seriell verdünnt 1:10 in PBS, Platte auf TSA-Platten und bei 37 ° C über Nacht. Bitte beachten Sie, dass die Gesamtatemwege bakterielle Belastung wird die Summe der KBE in BAL und Lunge sein.
- Zentrifugieren des verbleibenden Homogenat bei 16.000 × g für 30 min bei 4 ° C. Nehmen Sie den Überstand für ELISA Zytokin-Analyse und bei -80 ° C
7. Die histologische Untersuchung
- Führen Sie die histologische Analyse nur auf die Lunge, in der BAL-Flüssigkeit wurde nicht gesammelt wurden, an Lungenkrebs zu Aspekt und Eigenschaften zu bewahren.
- Euthanize der Maus durch CO 2-Inhalation.
- Expose der Brustkorb durch einen vertikalen Schnitt der Haut, die Lunge aussetzen, indem das Zwerchfell.
- Verbrauch Lunge, spülen Sie sie in PBS, trennen Sie die Lappen, legte sie in ein Röhrchen mit 5-10 ml 10% neutral gepuffertem Formalin (4% Formaldehyd) und bei 4 ° C vor Licht geschützt.
- Einbettung in Paraffin Lunge, Verwendung von Standardverfahren.
- Cut 5 um dicke Schnitte mit einem Mikrotom.
- Stain Folien mit Hämatoxylin und Eosin und decken die Objektträger mit einem Deckglas, nach Standardverfahren.
- Untersuchen Sie gleitet mit einem inversen Mikroskop-Hell und Bilder zu erwerben, indem Sie das Mikroskop mit einer Kamera.
Ergebnisse
Wenn das Protokoll richtig gemacht wird, wird die P. aeruginosa Agar-Perlen zwischen 100-200 um zu messen und kann mit einem invertierten Lichtmikroskop durch Pipettieren ein kleines Volumen des Agar-Kügelchen-Suspension auf einen Objektträger beobachtet werden. Einzelnen bakteriellen Zellen sichtbar sind in den Agar-Perlen, wie im Detail in Fig. 1 gezeigt.
Die Wahl von P. im Agar-Kügelchen Herstellung verwendet aeruginosa Stamm ist kritisch.
Diskussion
Die kritischen Schritte in der P. aeruginosa-Perlen Vorbereitung und Maus Herausforderung sind nachstehend angegeben.
Die P. aeruginosa Stamm für Mäuse verwendet Herausforderung ist kritisch. Sterblichkeit, chronische Infektion oder Freiraum kann, abhängig von der Bakterienstamm für die Herausforderung unterscheiden. Die P. aeruginosa RP73 klinischen Stamm wurde über die PAO1 Referenzlaborstamm bevorzugt, da es zu einer vergleichsweise niedrigeren Sterblichkei...
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen konkurrieren.
Danksagungen
Research in Bragonzi Labor wurde von der italienischen Cystic Fibrosis Foundation (CFaCore) und der EU-F7-2009-223670 finanziert. Ein Teil dieser Arbeit wurde in Alembic, einem fortgeschrittenen Mikroskopie Labor durchgeführt, Histopathologie und Maus wurde in der Abteilung für Pathologische Anatomie (San Raffaele Scientific Institute) durchgeführt.
Materialien
| Name | Company | Catalog Number | Comments |
| Bacto Tryptic Soy Broth | Becton Dickinson | 211823 | |
| Difco Agar, granulated | Becton Dickinson | 214510 | |
| Heavy mineral oil | Sigma-Aldrich | 330760-1L | |
| S-(+)-Ketamine hydrochloride | Sigma-Aldrich | K1884 | |
| Xylazine hydrochloride | Sigma-Aldrich | X1251 | |
| 1 ml Syringe 25 G 5/8 in 0.5 mm x 16 mm | PIC | 3071250300350 | |
| Catheter 22 G 0.9 mm x 25 mm | Becton Dickinson | 381223 | |
| Graefe Forceps - 0.5 mm Tips Curved | Fine Science Tools | 11152-10 | |
| Scissors, Iris, 11 cm, straight | World Precision Instruments | 501758 | |
| Suture clips | Fine Science Tools | 12040-01 | |
| Suture thread | Fine Science Tools | 18020-40 | |
| RPMI 1640 | Lonza | BE12-167F | |
| Complete protease inhibitor cocktail | Roche | 11836145001 | |
| Fast-Read 102 Burker disposable chamber | Biosigma | 390497 | |
| Tuerk solution | Fluka | 93770 | |
| RBC lysis buffer | Biolegend | 420301 | |
| Fetal bovine serum | Lonza | DE14-801F | |
| EZ cytofunnel | Thermo Scientific | A78710021 | |
| Superfrost ultra plus microscope slides | Thermo Scientific | J3800AMNZ | |
| Diff-Quik Romanowsky staining set | Medion Diagnostics | 130832 | |
| Hexadecyltrimethylammonium chloride | Sigma-Aldrich | 52366-10G | |
| 96-well EIA/RIA plate | Costar | 3590 | |
| 3,3’,5,5’- Tetramethylbenzidine | Sigma-Aldrich | T8665-1L | |
| Sulfuric acid | Sigma-Aldrich | 320501-1L | |
| 10% Neutral buffered formalin | Bio-Optica | 05-01005Q | |
| Harris hematoxylin non Papanicolau | Bio-Optica | 05-M06004 | |
| Eosin plus alcoholic solution | Bio-Optica | 05-M11007 | |
| Equipment | |||
| Shaking incubator | Amerex Instruments | Steady Shake 757 | |
| Water bath | Grant | SUB14 | |
| Homogenizer | Ystral | ||
| Precision balance | KERN | 440-47N | |
| Cytocentrifuge | Thermo Scientific | A78300003 | |
| Low Cost Heating Pad | 2biol | LCHP | |
| Homogenization probe | Ystral | 2366925(small) | |
| Inverted optical microscope | Zeiss | Axioplan2 | |
| Camera (microscope) | Zeiss | Axiocam MRc5 | |
| Rotary microtome | Leica | RM2255 | |
Referenzen
- Gibson, R., Burns, J. L., Ramsey, B. W. Pathophysiology and management of pulmonary infections in cystic fibrosis. Am. J. Respir. Crit. Care. 168, 918-951 (2003).
- Bragonzi, A. Murine models of acute and chronic lung infection with cystic fibrosis pathogens. IJMM. 300, 584-593 (2010).
- Cash, H. A., McCullough, B., Johanson, W. G., Bass, J. A. A rat model of chronic respiratory infection with Pseudomonas aeruginosa. Am. Rev. Respir. Dis. 119, 453-459 (1979).
- Starke, J. R., Langston, C., Baker, C. J. A mouse model of chronic pulmonary infection with Pseudomonas aeruginosa and Pseudomonas cepacia. Pediatr. Res. 22, 698-702 (1987).
- Pedersen, S. S., Hansen, B. L., Hansen, G. N. Induction of experimental chronic Pseudomonas aeruginosa lung infection with P. aeruginosa entrapped in alginate microspheres. APMIS. 98, 203-211 (1990).
- Bragonzi, A., et al. Nonmucoid Pseudomonas aeruginosa expresses alginate in the lungs of patients with cystic fibrosis and in a mouse model. J. Infect. Dis. 192, 410-419 (2005).
- van Heeckeren, A. M. Murine models of chronic Pseudomonas aeruginosa lung infection. Lab. Anim. 36, 291-312 (2002).
- Bragonzi, A., et al. Pseudomonas aeruginosa microevolution during cystic fibrosis lung infection establishes clones with adapted virulence AJRCCM. 180, 138-145 (2009).
- Kukavica-Ibrulj, I., Facchini, M., Cigana, C., Levesque, R. C., Bragonzi, A., Filloux, S., Ramos, J. L. Assessing Pseudomonas aeruginosa virulence and the host response using murine models of acute and chronic lung infection. Methods in Pseudomonas aeruginosa: Humana Press. , (2014).
- Moalli, F., et al. The Therapeutic Potential of the Humoral Pattern Recognition Molecule PTX3 in Chronic Lung Infection Caused by Pseudomonas aeruginosa. J. Immunol. 186, 5425-5534 .
- Paroni, M. Response of CFTR-deficient mice to long-term Pseudomonas aeruginosa chronic infection and PTX3 therapeutic treatment. J. Infect. Dis. In press, .
- Maxeiner, J., Karwot, R., Hausding, M., Sauer, K. A., Scholtes, P., Finotto, S. A method to enable the investigation of murine bronchial immune cells, their cytokines and mediators. Nat. Protoc. 2, 105-112 (2007).
- Bragonzi, A., et al. Pseudomonas aeruginosa microevolution during cystic fibrosis lung infection establishes clones with adapted virulence.. AJRCCM. In press, (2009).
- Pirone, L., et al. Burkholderia cenocepacia strains isolated from cystic fibrosis patients are apparently more invasive and more virulent than rhizosphere strains. Environ. Microbiol. 10, 2773-2784 (2008).
- Bragonzi, A., et al. Modelling co-infection of the cystic fibrosis lung by Pseudomonas aeruginosa and Burkholderia cenocepacia reveals influences on biofilm formation and host response. PLoS One. 7, .
- Bianconi, I., et al. Positive signature-tagged mutagenesis in Pseudomonas aeruginosa: tracking patho-adaptive mutations promoting long-term airways chronic infection. PLoS Pathog.. 7, (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten