Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Imágenes por resonancia magnética cuantitativa de la enfermedad del músculo esquelético
En este artículo
Resumen
enfermedades neuromusculares a menudo presentan una patología de variación temporal y espacialmente heterogéneos y de múltiples facetas. El objetivo de este protocolo es la caracterización de esta patología usando métodos de resonancia magnética no invasivos.
Resumen
Quantitative magnetic resonance imaging (qMRI) describes the development and use of MRI to quantify physical, chemical, and/or biological properties of living systems. Neuromuscular diseases often exhibit a temporally varying, spatially heterogeneous, and multi-faceted pathology. The goal of this protocol is to characterize this pathology using qMRI methods. The MRI acquisition protocol begins with localizer images (used to locate the position of the body and tissue of interest within the MRI system), quality control measurements of relevant magnetic field distributions, and structural imaging for general anatomical characterization. The qMRI portion of the protocol includes measurements of the longitudinal and transverse relaxation time constants (T1 and T2, respectively). Also acquired are diffusion-tensor MRI data, in which water diffusivity is measured and used to infer pathological processes such as edema. Quantitative magnetization transfer imaging is used to characterize the relative tissue content of macromolecular and free water protons. Lastly, fat-water MRI methods are used to characterize fibro-adipose tissue replacement of muscle. In addition to describing the data acquisition and analysis procedures, this paper also discusses the potential problems associated with these methods, the analysis and interpretation of the data, MRI safety, and strategies for artifact reduction and protocol optimization.
Introducción
imágenes de resonancia magnética cuantitativa (qMRI) describe el desarrollo y el uso de MRI para cuantificar características físicas, químicas, y / o propiedades biológicas de los sistemas vivos. QMRI requiere que uno adopte un modelo biofísico para el sistema, compuesto por el tejido de interés y una secuencia de impulsos de MRI. La secuencia de pulsos está diseñado para sensibilizar a las intensidades de señal de las imágenes 'para el parámetro de interés en el modelo. Propiedades de la señal de resonancia magnética (magnitud de la señal, la frecuencia y / o fase) son medidos y analizados de acuerdo con el modelo. El objetivo es producir una estimación objetiva, cuantitativa de un parámetro físico o biológico que tiene distribuidos de forma continua, unidades físicas de medición. A menudo, las ecuaciones que describen el sistema se analizan y se acoplen a una base de pixel por pixel, produciendo una imagen cuyos valores de pixel reflejar directamente los valores de la variable. Tal imagen se conoce como un mapa paramétrico.
Un uso común de qMRI es el desarrollo y aplicación de biomarcadores. Los biomarcadores se pueden usar para investigar un mecanismo de la enfermedad, establecer un diagnóstico, determinar un pronóstico, y / o evaluar una respuesta terapéutica. Pueden adoptar la forma de las concentraciones o actividades de las moléculas endógenas o exógenas, una muestra histológica, una cantidad física, o una imagen interna. Algunos de los requisitos generales de biomarcadores son que miden objetivamente una variable distribuida de forma continua utilizando unidades físicas de medida; tener una relación clara y bien entendida con la patología de interés; son sensibles a la mejora y empeoramiento del estado clínico; y se puede medir con exactitud y precisión adecuada. biomarcadores no invasivos o mínimamente invasivos son particularmente deseables, ya que promueven la comodidad del paciente y mínimamente perturban la patología de interés.
Uno de los objetivos para el desarrollo de biomarcadores basados en imágenes para enfermedades musculares es reflejar la enfermedad del músculo en formas que son Complementary a, más específico que, más espacialmente selectivo que, y / o menos invasiva que los enfoques existentes. Una ventaja particular de qMRI en este sentido es que tiene el potencial de integrar múltiples tipos de información y por lo tanto potencialmente caracterizar muchos aspectos del proceso de la enfermedad. Esta capacidad es muy importante en enfermedades musculares, que con frecuencia exhiben una patología espacialmente variables, complejo que incluye la inflamación, necrosis y / o atrofia con sustitución de la grasa, fibrosis, la interrupción de la red myofilament ( "streaming de Z-disco"), y daño de la membrana . Otra ventaja de los métodos qMRI es que las descripciones cualitativas o semi-cuantitativos de las imágenes de RM basadas en contraste reflejan no sólo la patología, sino también diferencias en los parámetros de adquisición de imágenes, hardware, y la percepción humana. Un ejemplo de este último punto fue demostrado por Wokke et al., Que mostraron que las evaluaciones semicuantitativas de la infiltración de grasa son muy variables y con frecuencia incorrecta, wgallina en comparación con la RM de grasa / agua cuantitativa (FWMRI) 1.
El protocolo descrito aquí incluye secuencias de pulso para medir la longitudinal (T1) y transversal (T 2) constantes de tiempo de relajación, transferencia de magnetización cuantitativa (Qmt) parámetros, coeficientes de difusión del agua utilizando tensor de difusión de resonancia magnética (DT-MRI) y la estructura muscular usando imágenes estructurales y FWMRI. T 1 se mide mediante el uso de una secuencia de recuperación de la inversión, en el que se invierte el vector de magnetización neta y su magnitud se muestrea como el sistema vuelve al equilibrio. T 2 se mide gracias a la reorientación repetidamente magnetización transversal usando un tren de pulsos reorientando, tales como el método de Carr-Purcell Meiboom-Gill (CPMG), y el muestreo de los spin-eco resultante. T 1 y T 2 de datos se pueden analizar utilizando métodos de ajuste de curvas no lineales que, o bien asumir un número de Exponecomponentes ntial a priori (típicamente entre uno y tres) o mediante el uso de un enfoque inverso lineal que se ajusta a los datos observados a la suma de un gran número de exponenciales en descomposición, lo que resulta en un espectro de amplitudes de señal. Este enfoque requiere una solución no negativo de mínimos cuadrados (NNLS) 3, y típicamente incluye regularización adicional para producir resultados estables. T 1 y T 2 mediciones se han utilizado ampliamente para estudiar las enfermedades musculares y lesiones 4-9. T 1 Los valores están normalmente disminuyeron en regiones infiltrado en la grasa de los músculos y elevados en las regiones inflamadas 4-6; T 2 valores son elevados en ambas regiones en grasa infiltrada e inflamadas 10.
QMT-RM caracteriza a las piscinas de protones macromoleculares de agua y sólido-como libres en los tejidos mediante la estimación de la proporción de macromolecular a los protones de agua libre (la relación entre el tamaño de la piscina, PSR); la intrínseca relajarsetasas de inflación de estas piscinas; y los tipos de cambio entre ellos. Enfoques Qmt comunes incluyen la saturación de impulsos 11 y los métodos de recuperación de la inversión 12,13 selectivos. El protocolo siguiente se describe el uso del enfoque de la saturación de impulsos, que explota el amplio ancho de línea de la señal de protón macromolecular, con relación a la estrecha anchura de línea de la señal de protón de agua. Saturando la señal macromolecular en frecuencias de resonancia suficientemente diferentes de la señal de agua, la señal de agua se reduce como resultado de la transferencia de magnetización entre las piscinas de protones del agua sólidos y gratuitas. Los datos se analizaron usando un modelo biofísico cuantitativo. QMT se ha desarrollado y aplicado en los músculos sanos 14,15, y un resumen reciente aparecido describiendo su aplicación en enfermedades musculares 16. QMT se ha utilizado para estudiar los pequeños modelos animales de inflamación muscular, en el que se ha demostrado que la inflamación disminuye el PSR 17. En la medida en MTrefleja tanto el contenido de agua y macromoleculares, los datos MT también pueden reflejar la fibrosis 18,19.
DT-MRI se utiliza para cuantificar el comportamiento de difusión anisotrópica de moléculas de agua en los tejidos con células alargadas, ordenados. En DT-MRI, la difusión del agua se mide en seis o más direcciones diferentes; estas señales se ajustaron a un modelo tensor 20. El tensor de difusión, D, se diagonalizarse para obtener tres valores propios (que son los tres principales difusividad) y tres vectores propios (que indican las direcciones correspondientes a los tres coeficientes de difusión). Estos y otros índices cuantitativos derivados de D proporcionan información acerca de la estructura del tejido y la orientación a nivel microscópico. Las propiedades de difusión del músculo, especialmente la tercera valor propio de D y el grado de anisotropía de difusión, reflejan la inflamación muscular 17 y el daño muscular debido a una lesión experimental 21, lesión por esfuerzo 22, y la enfermedad 23,24. Otras posibles influencias sobre las propiedades de difusión del músculo incluyen cambios en el diámetro de la celda 25 y cambios en la permeabilidad de la membrana.
Por último, la atrofia muscular, sin o sin infiltración de la grasa macroscópica, es un componente patológico de muchas enfermedades musculares. La atrofia muscular puede ser evaluada mediante el uso de imágenes estructurales para medir músculo área de sección transversal o el volumen y FW-MRI para evaluar la infiltración grasa. La infiltración de grasa se puede describir cualitativamente en T1 - y T2 y 26 imágenes, pero las señales de grasa y agua se miden mejor mediante la formación de imágenes que explotan las diferentes frecuencias de resonancia de grasa y agua protones 27-29. Métodos de imagen de grasa / agua cuantitativos se han aplicado en las enfermedades musculares como la distrofia muscular 1,30,31, y pueden predecir la pérdida de la deambulación en estos pacientes 31.
El protocolo qMRI descrito aquí utiliza todas estas mediciones para caracterizar la condición muscular en las miopatías inflamatorias autoinmunes dermatomiositis (DM) y la polimiositis (PM). Otros detalles del protocolo, incluyendo su reproducibilidad, se han publicado previamente 32. El protocolo incluye secuencias de pulso estándar, así como la radiofrecuencia (RF) y objetos gradiente de campo magnético programados específicamente en nuestros sistemas. Los autores prevén que el protocolo es también aplicable en otros trastornos neuromusculares caracterizados por atrofia muscular, inflamación, y la infiltración de grasa (como las distrofias musculares).Protocolo
NOTA: Se recuerda al lector que toda la investigación en seres humanos debe ser aprobado por la junta local de Revisión Institucional (IRB) para el Uso de Sujetos Humanos en Investigación. participantes en la investigación deben ser informados del propósito, los procedimientos, los riesgos y beneficios de la investigación propuesta; la disponibilidad de tratamientos o procedimientos alternativos; la disponibilidad de una remuneración; y de sus derechos de privacidad y de retirar su consentimiento y descontinuar su participación. Antes de la sesión de pruebas de resonancia magnética, un investigador debe presentar un potencial participante en la investigación con un documento de consentimiento informado aprobado por el IRB (ICD), explique su contenido, y pedir al potencial participante en la investigación si él / ella desea participar en el estudio. Si es así, el participante tendrá que firmar y fechar el CIE antes de completar cualquiera de las etapas del protocolo aquí.
1. Acciones Antes del día de la prueba
- Restringir hábitos de vida que podrían confundir la DATA
- Instruir al participante que no realice ejercicio moderado o fuerte durante la 48 h antes de la prueba. Instruir al participante que se abstengan de exceso de medicamentos de venta libre y la ingesta de alcohol durante las 24 h antes del ensayo. Instruir al participante para que se abstengan del uso del tabaco o el consumo de cafeína durante el 6 h antes de la prueba.
- Antes de la prueba, confirme que el participante ha sido compatible con estas instrucciones.
- Preparar el sistema de resonancia magnética
- Asegurar la disponibilidad de todo el equipo necesario, como aparece en la tabla de materiales y equipos.
- Definir un protocolo de resonancia magnética; parámetros sugeridos se encuentran en las Tablas 1 - 5.
2. día de la prueba: Prepárese para la adquisición de datos de resonancia magnética
- Presentación de la conducta de Seguridad
- Pantalla de peligros potenciales en el entorno de la RM por tener una resonancia magnética de seguridad-tllovió trabajador de la salud presente el participante en la investigación con una forma de seguridad MRI adecuado, tal como la que se encuentra en www.mrisafety.com.
- Si hay objetos magnéticos o magnéticamente sensibles implantados, garantizar que son seguros para la RM.
- Preparar el sistema de resonancia magnética
- Asegúrese de que todo el personal se han eliminado todos los objetos magnéticos sensibles a campos magnéticos y antes de entrar en la habitación que aloja el sistema de resonancia magnética. Llevar a cabo esta comprobación cada vez que alguien entra en la sala de resonancia magnética.
- Preparar el sistema de resonancia magnética mediante la colocación de la bobina de recepción en la cama del paciente del sistema de resonancia magnética. También, coloque un colchón con la hoja y almohada con una funda de almohada en la cama. Tener correas disponibles para colocar alrededor de los muslos y los collarines o almohadas para colocar debajo de las rodillas.
- Iniciar la interfaz de software, introduzca los datos del paciente, y abrir el protocolo de formación de imágenes.
- Coloque el participante en la investigación sobre la mesa del escáner MRI
- Observe el participante en la investigación como él / ella comprueba su / su persona y de la confección de objetos sensibles a campos magnéticos. Seguro fuera de la sala de resonancia magnética estos objetos en un contenedor bajo llave. Entra en la habitación de IRM con el participante en la investigación inmediatamente después de completar este paso.
- Coloque el participante en la cama del paciente en posición supina, con los pies por. Coloque la parte del cuerpo para formar una imagen tan cerca de la línea media de la tabla como sea práctico. Coloque los cojines o almohadas debajo de las rodillas para proporcionar alivio de tensión para la espalda baja y colocar una almohada debajo de la cabeza. Para limitar el movimiento, con suavidad pero garantizar eficazmente los muslos, las piernas y los pies, y asegurar que el participante se sienta cómodo.
- Coloque la bobina receptora de RF alrededor de los muslos del participante y conectarlo al sistema de resonancia magnética.
- Instruir al participante y completa Pasos finales previas al análisis,
- Dar instrucciones sobre cómo comunicarse con los investigadores. Proporcionar a la participant con protección y un dispositivo de señalización que puede ser utilizado para llamar la atención si es necesario de la audición. Instruir al participante de la necesidad de permanecer inmóvil durante y entre todas las secuencias de imágenes.
- Avanzar en la cama del paciente en el escáner de resonancia magnética de tal manera que la parte del cuerpo en ser fotografiado está alineado con el centro del equipo de resonancia magnética.
- Después de salir de la sala de resonancia magnética, confirme que el sistema de comunicación con el paciente está trabajando y ver que el participante se sienta cómodo. A lo largo del protocolo, comunicarse regularmente con el participante para asegurar su / su comodidad y el cumplimiento de las instrucciones.
3. día de la prueba: adquirir los datos de resonancia magnética
- Pasos preparatorios
- Como el sistema de MRI determina los ajustes instrumentales y calibraciones antes de cada secuencia de imágenes (frecuencia central, la calibración ganancia del receptor, etc.), supervisar estos procesos y asegurar que cada paso se realiza correctly.
- El uso de una interfaz de software adecuado, adquirir un conjunto de imágenes del localizador (también conocida como piloto o imágenes exploradoras); utilizando parámetros sugeridos presentados en la Tabla 2.
- Determinar dónde colocar la rodaja centro para las adquisiciones de datos qMRI, mediante la identificación de áreas de daño y / o haciendo referencia a la posición de la rebanada en relación con puntos de referencia anatómicos reproducibles.
- Transmisión y recepción de la bobina de calibración Pasos
- Para estos pasos, así como todos los pasos de formación de imágenes subsiguientes, definir región de la anatomía en la que para optimizar la homogeneidad del campo magnético estático (B 0), un proceso conocido como "cuñas". Ver la Figura 1A para la colocación típica del volumen cuñas de interés (VOI) usado en los presentes estudios.
- Si el escáner de resonancia magnética tiene una bobina de transmisión de múltiples elementos, adquirir un conjunto de datos de calibración RF.
- Si el escáner de resonancia magnética tiene un multi-elemento de bobina de recepción, adquirirun mapa de sensibilidad espacial de las bobinas.
- Adquirir estructural MRI Datos
- Adquirir alta resolución, multicorte, T1 ponderadas imágenes utilizando una secuencia (FSE) eco de espín rápido; los parámetros de las imágenes utilizadas en el presente estudio se proporcionan en la Tabla 1.
- Adquirir alta resolución, multicorte, T2 y las imágenes usando una secuencia FSE; los parámetros de las imágenes utilizadas en el presente estudio se proporcionan en la Tabla 2.
- Adquirir datos para control de calidad en tiempo real y hacer correcciones de post-procesamiento
- Adquirir múltiples datos de eco de gradiente (3D) en tres dimensiones para el cálculo de los mapas de campo B0. Los parámetros de las imágenes utilizadas en el presente estudio se proporcionan en la Tabla 3.
- Examinar los mapas de campo para asegurar que no existen desviaciones de más de ± 60 Hz (aproximadamente 0,5partes por millón a 3 Tesla) a través de la imagen. Si los hay, adoptar un enfoque alternativo para el calce (método diferente, distinta colocación de VOI, etc.).
- Adquirir datos 3D para el cálculo de los mapas ángulo de nutación. Los parámetros de las imágenes utilizadas en el presente estudio se proporcionan en la Tabla 2.
- Examinar los mapas de campo para asegurarse de que no hay áreas que se desvían excesivamente desde el ángulo de nutación nominal. Para los pulsos de RF que se utilizan en este protocolo, desviaciones superiores a ± 30% del ángulo de nutación nominal se consideran excesivos.
- Adquirir los datos qMRI
- Adquirir imágenes en 3D para el cálculo de la T 1, utilizando una secuencia de recuperación de inversión. Los parámetros de formación de imágenes utilizados en los presentes estudios se presentan en la Tabla 3.
- Repita la medición T1 en presencia de supresión de la señal de grasa (FS; este parámetro es sigla delTed T 1, FS).
- Adquirir imágenes de un segmento para el cálculo de la T 2, utilizando una secuencia de múltiples spin-eco. Utilice los parámetros de las imágenes que se presentan en la Tabla 3.
- Repita la medición de T 2 en presencia de FS (T 2, FS).
- Adquirir imágenes en 3D para el cálculo de los parámetros Qmt, utilizando una secuencia de saturación pulsado con FS y los parámetros de las imágenes dadas en la Tabla 4.
- Adquirir datos rebanada de múltiples parámetros para el cálculo del tensor de difusión, utilizando una serie de imágenes potenciadas en difusión. Los parámetros de formación de imágenes utilizados en estos estudios se dan en la Tabla 4.
- Adquirir datos 3D para el cálculo de las imágenes de grasa / agua, usando una serie de seis imágenes de eco de gradiente. Los parámetros de formación de imágenes utilizados en estos estudios se dan en la Tabla 5.
- Después de completar el protocolo qMRI
- Asegurarse de queTodas las imágenes son de calidad adecuada mediante el examen de los artefactos potencialmente corregibles y midiendo la suficiente relación señal-ruido.
- Para cada conjunto de datos qMRI, definir varias regiones de interés (ROI) en la serie de imágenes y examinar la señal como una función del parámetro relevante (por ejemplo, para los datos dependientes de T 1 adquiridas en los pasos 3.5.1 y 3.5.2, trazar la señal como una función de TI y asegurar que los datos se ajustan a la función de inversión-recuperación se enumeran a continuación en el paso 4.1.2).
- Después de completar una proyección personal para objetos sensibles a campos magnéticos, entrar en la sala de resonancia magnética. Retire el participante del imán, eliminar todas las correas y las almohadillas, y ayudar al participante a salir del escáner de resonancia magnética y la sala de resonancia magnética.
- La transferencia de los datos, utilizando métodos que cumplen con las leyes de privacidad de salud locales, a una estación de trabajo local para su procesamiento; los datos pueden ser exportados como comunicaciones de imágenes digitales en archivos de Medicina (DICOM) o en el proveedor'S formato propietario (el método utilizado en este protocolo).
4. Analizar los datos qMRI
- Calcular los mapas paramétricos
- Utilice un programa informático diseñado para la computación científica y análisis de imágenes. Mediante el examen de un histograma de la intensidad de señal en la imagen, formar una máscara de imagen basado en la señal de umbral que delinea áreas de señal de las zonas de ruido. Complete los pasos siguientes para cada píxel de las partes de la señal de las imágenes.
- Analizar el T 1 de datos mediante la medición de la señal de intensidad S para cada tiempo de inversión (TI). A continuación, coloque los valores de S a una inversión-recuperación con un modelo de pre-retardo reducida:
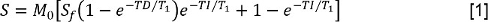
donde M 0 es una señal que representa la intensidad de la magnetización en el estado de equilibrio, S f es la relación de la inversión,y TD es el tiempo de pre-retardo. A continuación, ajustar los datos con FS al mismo modelo, lo que permite la determinación de la constante con FS, T 1, FS tiempo de relajación longitudinal. - Analizar la T 2 S datos midiendo en cada TE. A continuación, ajustar los datos a un modelo de decaimiento exponencial mono-:

donde N es la señal de compensación en la línea base. El lector también podrá decidir ajustar los datos a un modelo multi-exponencial, como el que a continuación:
donde J es el número de componentes exponenciales y j f y T 2, son la fracción de la señal y T 2 valores asociados a la j-ésima componente. O bien, el lector puede utilizar un método no negativos mínimos cuadrados (NNLS) 3. En el latter caso, el Multi-exponencial Relajación Análisis (MERA) caja de herramientas 33 está disponible gratuitamente; otros programas están disponibles también. Repita estos análisis de los datos con y sin FS. - Para analizar los datos Qmt, medir S para cada fuente de irradiación y desplazamiento de frecuencia. Corregir las potencias nominales de irradiación (representados por ω 1 en la siguiente ecuación) utilizando los mapas ángulo de nutación. Corregir los desplazamientos de frecuencia (Δ f en la ecuación a continuación) mediante el uso de la B 0 mapas para ajustar las frecuencias de desplazamiento aplicado. A continuación, ajustar los datos con el siguiente modelo 34,35
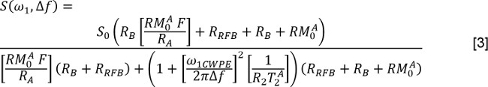
donde está el tipo de cambio de la piscina macromolecular a la piscina de agua libre, es la velocidad de relajación longitudinal de la piscina de agua libre, es la velocidad de relajación longitudinal de la piscina macromolecular (se supone que 1 s -1), es el PSR, se la T 2 de la piscina de agua libre, y ω 1CWPE es la potencia media del pulso de saturación. La tasa de saturación de la magnetización longitudinal de la piscina macromolecular, se describe mediante un modelo de super-Lorentz, como se describe en el trabajo de Henkelman y colegas 34,35. - Para analizar los datos DTI, primero utilice un algoritmo de transformación afín 36 para registrar cada imagen ponderada en difusión de la imagen ponderada no difusión correspondiente. Entonces, para cada pixel, medir los valores de S en la imagen ponderada no difusión y en cada dirección de difusión ponderada. Formar una matriz compuesta de las direcciones de difusión de codificación. Usando multivariante de regresión por mínimos cuadrados ponderados, una regresión a los datos de la señal en la matriz de difusión de codificación y la forma D. Diagonalizan D y realizar una magnitud-clasificación de los valores propios y los vectores propios sus. A continuación, calcular la difusividad media (DM) como:

donde λ 1, λ 2, 3 y λ son los valores propios del tensor de difusión. También calcular la anisotropía fraccional (FA) como:
- Analizar los datos FWMRI utilizando un enfoque cuantitativo que separa las señales de agua y grasa basado en el desplazamiento químico (tal como el algoritmo FattyRiot, disponible para su descarga gratuita desde https://github.com/welcheb/FattyRiot).
- Definir regiones de interés para el análisis
- Especificar regiones de interés en las imágenes anatómicas (mediante la definición de los límites de cada músculo de interés). Un ejemplo se muestra en la Figura 1.
- Cambiar el tamaño de las regiones de interés para que coincida con el tamaño de la matriz de las imágenes qMRI. Según sea necesario, ajustar la alineación de las regiones de interés para que coincida con el mapa qMRI (por ejemplo, si el participante se trasladóentre las adquisiciones, una traducción de la posición de retorno de la inversión puede ser necesaria para evitar la superposición de los límites del músculo).
- Examine cada ROI. Si es necesario, asegurar que no se incluyen píxeles que contienen artefactos parciales de volumen, el tejido no contráctil, y artefactos de flujo; Por favor, vea la Figura 1 para los ejemplos.
- Calcula la media y la desviación estándar de los valores qMRI en todos los píxeles dentro de las regiones de interés seleccionadas.
Resultados
La Figura 1 muestra imágenes anatómicas axiales representativos adquiridos a la mitad del muslo de un paciente con polimiositis. También se muestra la localización de la proyección en el plano del volumen cuña. Mapas de parámetros representativos para cada método qMRI, todo obtenido de este mismo paciente, se proporcionan en las Figuras 2 - 7.
Las figuras 2A
Discusión
enfermedades musculares como las distrofias musculares y las miopatías inflamatorias idiopáticas constituyen del grupo de enfermedades que son heterogéneos en la etiología y, como entidades individuales, rara en su incidencia. Por ejemplo, la distrofia muscular de Duchenne - la forma más común de distrofia muscular - tiene una incidencia de 1 de cada 3.500 varones nacidos vivos 37,38; dermatomiositis, a la que se ha aplicado este protocolo, tiene una incidencia de 1 en 100.000 39. La mayor in...
Divulgaciones
None of the authors has a financial conflict of interest to report.
Agradecimientos
We acknowledge grant support from the National Institutes of Health: NIH/NIAMS R01 AR050101 (BMD), NIH/NIAMS R01 AR057091 (BMD/JHP), NIH/NIBEB K25 EB013659 (RDD), and the Vanderbilt CTSA award RR024975. We also thank the reviewers for the comments and the subject for participating in these studies.
Materiales
| Name | Company | Catalog Number | Comments |
| 3T human MRI system | Philips Medical Systems (Best, the Netherlands) | Achieva/Intera | |
| Cardiac phased array receive coil | Philips Medical Systems | ||
| Pillows, straps, bolsters, and other positioning devices | |||
| Computer with MATLAB software | The Mathworks, Inc (Natick, MA) | r. 2014 |
Referencias
- Wokke, B. H., et al. Comparison of Dixon and T1-weighted MR methods to assess the degree of fat infiltration in duchenne muscular dystrophy patients. J Magn Reson Imaging. 38 (3), 619-624 (2013).
- Carr, H., Purcell, E. Effects of diffusion on free precession in NMR experiments. Phys Rev. 94, 630-638 (1954).
- Whittall, K. P., MacKay, A. L. Quantitative interpretation of NMR relaxation data. Journal of Magnetic Resonance. 84 (1), 134-152 (1989).
- Park, J. H., et al. Dermatomyositis: correlative MR imaging and P-31 MR spectroscopy for quantitative characterization of inflammatory disease. Radiology. 177 (2), 473-479 (1990).
- Park, J. H., et al. Magnetic resonance imaging and p-31 magnetic resonance spectroscopy provide unique quantitative data useful in the longitudinal management of patients with dermatomyositis. Arthritis & Rheumatism. 37 (5), 736-746 (1994).
- Park, J. H., et al. Use of magnetic resonance imaging and p-31 magnetic resonance spectroscopy to detect and quantify muscle dysfunction in the amyopathic and myopathic variants of dermatomyositis. Arthritis & Rheumatism. 38 (1), 68-77 (1995).
- Huang, Y., et al. Quantitative MR relaxometry study of muscle composition and function in Duchenne muscular dystrophy. J Magn Reson Imaging. 4 (1), 59-64 (1994).
- Kim, H. K., et al. T2 mapping in Duchenne muscular dystrophy: distribution of disease activity and correlation with clinical assessments. Radiology. 255 (3), 899-908 (2010).
- Arpan, I., et al. T2 mapping provides multiple approaches for the characterization of muscle involvement in neuromuscular diseases: a cross-sectional study of lower leg muscles in 5-15-year-old boys with Duchenne muscular dystrophy. NMR in Biomedicine. 26 (3), 320-328 (2013).
- Fan, R. H., Does, M. D. Compartmental relaxation and diffusion tensor imaging measurements in vivo in λ-carrageenan-induced edema in rat skeletal muscle. NMR in Biomedicine. 21 (6), 566-573 (2008).
- Sled, J. G., Pike, G. B. Quantitative interpretation of magnetization transfer in spoiled gradient echo MRI sequences. J Magn Reson. 145 (1), 24-36 (2000).
- Gochberg, D. F., Gore, J. C. Quantitative magnetization transfer imaging via selective inversion recovery with short repetition times. Magn Reson Med. 57 (2), 437-441 (2007).
- Li, K., et al. Optimized inversion recovery sequences for quantitative T1 and magnetization transfer imaging. Magn Reson Med. 64 (2), 491-500 (2010).
- Louie, E. A., Gochberg, D. F., Does, M. D., Damon, B. M. Magnetization transfer and T2 measurements of isolated muscle: effect of pH. Magn Reson Med. 61 (3), 560-569 (2009).
- Sinclair, C. D. J., et al. Quantitative magnetization transfer in in vivo healthy human skeletal muscle at 3 T. Magn Reson Med. 64 (6), 1739-1748 (2010).
- Sinclair, C., et al. Multi-parameter quantitation of coincident fat and water skeletal muscle pathology. Proc 21st Ann Meeting ISMRM. , (2013).
- Bryant, N., et al. Multi-parametric MRI characterization of inflammation in murine skeletal muscle. NMR Biomed. 27 (6), 716-725 (2014).
- Aisen, A. M., Doi, K., Swanson, S. D. Detection of liver fibrosis with magnetic cross-relaxation. Magn Reson Med. 31 (5), 551-556 (1994).
- Kim, H., et al. Induced hepatic fibrosis in rats: hepatic steatosis, macromolecule content, perfusion parameters, and their correlations-preliminary MR imaging in rats. Radiology. 247 (3), 696-705 (2008).
- Basser, P. J., Mattiello, J., LeBihan, D. MR diffusion tensor spectroscopy and imaging. Biophys J. 66 (1), 259-267 (1994).
- Heemskerk, A., Strijkers, G., Drost, M., van Bochove, G., Nicolay, K. Skeletal muscle degeneration and regeneration following femoral artery ligation in the mouse: diffusion tensor imaging monitoring. Radiology. 243 (2), 413-421 (2007).
- Zaraiskaya, T., Kumbhare, D., Noseworthy, M. D. Diffusion tensor imaging in evaluation of human skeletal muscle injury. J Magn Reson Imaging. 24 (2), 402-408 (2006).
- Qi, J., Olsen, N. J., Price, R. R., Winston, J. A., Park, J. H. Diffusion-weighted imaging of inflammatory myopathies: polymyositis and dermatomyositis. J Magn Reson Imaging. 27 (1), 212-217 (2008).
- McMillan, A. B., Shi, D., Pratt, S. J., Lovering, R. M. Diffusion tensor MRI to assess damage in healthy and dystrophic skeletal muscle after lengthening contractions. J Biomed Biotech. , (2011).
- Scheel, M., et al. Fiber type characterization in skeletal muscle by diffusion tensor imaging. NMR Biomed. 26 (10), 1220-1224 (2013).
- Kaufman, L. D., Gruber, B. L., Gerstman, D. P., Kaell, A. T. Preliminary observations on the role of magnetic resonance imaging for polymyositis and dermatomyositis. Annalsrheumatic Dis. 46 (8), 569-572 (1987).
- Dixon, W. T. Simple proton spectroscopic imaging. Radiology. 153 (1), 189-194 (1984).
- Glover, G. H. Multipoint Dixon technique for water and fat proton and susceptibility imaging. J Magn Reson Imaging. 1 (5), 521-530 (1991).
- Berglund, J., Kullberg, J. Three-dimensional water/fat separation and T2* estimation based on whole-image optimization--application in breathhold liver imaging at 1.5 T. Magn Reson Med. 67 (6), 1684-1693 (2012).
- Gloor, M., et al. Quantification of fat infiltration in oculopharyngeal muscular dystrophy: Comparison of three MR imaging methods. J Magn Reson Imaging. 33 (1), 203-210 (2011).
- Fischmann, A., et al. Quantitative MRI and loss of free ambulation in Duchenne muscular dystrophy. J Neurol. 260 (4), 969-974 (2013).
- Li, K., et al. Multi-parametric MRI characterization of healthy human thigh muscles at 3.0 T - relaxation, magnetization transfer, fat/water, and diffusion tensor imaging. NMR Biomed. 27 (9), 1070-1084 (2014).
- Morrison, C., Stanisz, G., Henkelman, R. M. Modeling magnetization transfer for biological-like systems using a semi-solid pool with a super-Lorentzian lineshape and dipolar reservoir. J Magn Reson Series B. 108 (2), 103-113 (1995).
- Li, J. G., Graham, S. J., Henkelman, R. M. A flexible magnetization transfer line shape derived from tissue experimental data. Magn Reson Med. 37 (6), 866-871 (1997).
- Mangin, J. F., Poupon, C., Clark, C., Le Bihan, D., Bloch, I. Distortion correction and robust tensor estimation for MR diffusion imaging. Med Image Anal. 6 (3), 191-198 (2002).
- Moser, H. Duchenne muscular dystrophy: pathogenetic aspects and genetic prevention. Hum Genet. 66 (1), 17-40 (1984).
- van Essen, A. J., Busch, H. F., te Meerman, G. J., ten Kate, L. P. Birth and population prevalence of Duchenne muscular dystrophy in The Netherlands. Hum Genet. 88 (3), 258-266 (1992).
- Bendewald, M. J., Wetter, D. A., Li, X., Davis, M. P. Incidence of dermatomyositis and clinically amyopathic dermatomyositis: A population-based study in olmsted county, minnesota. Arch Dermatol. 146 (1), 26-30 (2010).
- Carlier, P. G. Global T2 versus water T2 in NMR imaging of fatty infiltrated muscles: different methodology, different information and different implications. Neuromuscul Disord. 24 (5), 390-392 (2014).
- Foley, J. M., Jayaraman, R. C., Prior, B. M., Pivarnik, J. M., Meyer, R. A. MR measurements of muscle damage and adaptation after eccentric exercise. J Appl Physiol. 87 (6), 2311-2318 (1999).
- Garrood, P., et al. MR imaging in Duchenne muscular dystrophy: quantification of T1-weighted signal, contrast uptake, and the effects of exercise. J Magn Reson Imaging. 30 (5), 1130-1138 (2009).
- Bratton, C. B., Hopkins, A. L., Weinberg, J. W. Nuclear magnetic resonance studies of living muscle. Science. 147, 738-739 (1965).
- Fleckenstein, J. L., Canby, R. C., Parkey, R. W., Peshock, R. M. Acute effects of exercise on MR imaging of skeletal muscle in normal volunteers. AJR Am J Roentgenol. 151 (2), 231-237 (1988).
- Williams, S., Heemskerk, A., Welch, E., Damon, B., Park, J. The quantitative effects of inclusion of fat on muscle diffusion tensor MRI measurements. J Magn Reson Imaging. 38 (5), 1292-1297 (2013).
- Hernando, D., et al. Removal of olefinic fat chemical shift artifact in diffusion MRI. Magn Reson Med. 65 (3), 692-701 (2011).
- Willcocks, R. J., et al. Longitudinal measurements of MRI-T2 in boys with Duchenne muscular dystrophy: effects of age and disease progression. Neuromuscul Disord. 24 (5), 393-401 (2014).
- Poon, C. S., Henkelman, R. M. Practical T2 quantitation for clinical applications. J Magn Reson Imaging. 2 (5), 541-553 (1992).
- Does, M. D., Gore, J. C. Complications of nonlinear echo time spacing for measurement of T2. NMR Biomed. 13 (1), 1-7 (2000).
- Poon, C. S., Henkelman, R. M. 180° refocusing pulses which are insensitive to static and radiofrequency field inhomogeneity. J Magn Reson. 99 (1), 45-55 (1992).
- Hollingsworth, K. G., de Sousa, P. L., Straub, V., Carlier, P. G. Towards harmonization of protocols for MRI outcome measures in skeletal muscle studies: consensus recommendations from two TREAT-NMD NMR workshops, 2 May 2010, Stockholm, Sweden, 1-2 October 2009, Paris, France. Neuromuscul Disord. 22, S54-S67 (2010).
- Underhill, H. R., Rostomily, R. C., Mikheev, A. M., Yuan, C., Yarnykh, V. L. Fast bound pool fraction imaging of the in vivo rat brain: Association with myelin content and validation in the C6 glioma model. Neuroimage. 54 (3), 2052-2065 (2011).
- Smith, S. A., et al. Quantitative magnetization transfer characteristics of the human cervical spinal cord in vivo: application to adrenomyeloneuropathy. Magn Reson Med. 61 (1), 22-27 (2009).
- Li, K. D. R., Dortch, R. D., Gochberg, D. F., Smith, S. A., Damon, B. M., Park, J. H. Quantitative magnetization transfer with fat component in human muscles. Proc. 20th Ann Meeting ISMRM. , (2012).
- Damon, B. M. Effects of image noise in muscle diffusion tensor (DT)-MRI assessed using numerical simulations. Magn Reson Med. 60 (4), 934-944 (2008).
- Damon, B. M., Buck, A. K. W., Ding, Z. Diffusion-tensor MRI-based skeletal muscle fiber tracking. Imaging Med. 3 (6), 675-687 (2011).
- Froeling, M., Nederveen, A. J., Nicolay, K., Strijkers, G. J. DTI of human skeletal muscle: the effects of diffusion encoding parameters, signal-to-noise ratio and T2 on tensor indices and fiber tracts. NMR in Biomedicine. 26 (11), 1339-1352 (2013).
- Basser, P. J., Pajevic, S. Statistical artifacts in diffusion tensor MRI (DT-MRI) caused by background noise. Magn Reson Med. 44 (1), 41-50 (2000).
- Anderson, A. W. Theoretical analysis of the effects of noise on diffusion tensor imaging. Magn Reson Med. 46 (6), 1174-1188 (2001).
- Saupe, N., White, L. M., Stainsby, J., Tomlinson, G., Sussman, M. S. Diffusion tensor imaging and fiber tractography of skeletal muscle: optimization of B value for imaging at 1.5 T. AJR Am J Roentgenol. 192 (6), W282-W290 (2009).
- Levin, D. I., Gilles, B., Madler, B., Pai, D. K. Extracting skeletal muscle fiber fields from noisy diffusion tensor data. Med Image Anal. 15 (3), 340-353 (2011).
- Sinha, U., Sinha, S., Hodgson, J. A., Edgerton, R. V. Human soleus muscle architecture at different ankle joint angles from magnetic resonance diffusion tensor imaging. J Appl Physiol. 110 (3), 807-819 (2011).
- Jones, D. K., Cercignani, M. Twenty-five pitfalls in the analysis of diffusion MRI data. NMR Biomed. 23 (7), 803-820 (2010).
- Hamilton, G., et al. In vivo characterization of the liver fat 1H MR spectrum. NMR Biomed. 24 (7), 784-790 (2011).
- Hernando, D., Kellman, P., Haldar, J. P., Liang, Z. P. Robust water/fat separation in the presence of large field inhomogeneities using a graph cut algorithm. Magn Reson Med. 63 (1), 79-90 (2010).
- Hernando, D., Hines, C. D., Yu, H., Reeder, S. B. Addressing phase errors in fat-water imaging using a mixed magnitude/complex fitting method. Magn Reson Med. 67 (3), 638-644 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados