このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
骨格筋疾患の定量的磁気共鳴イメージング
要約
神経筋疾患は、多くの場合、時間的に変化する、空間的に不均質な、と多面的な病態を呈します。このプロトコルの目的は、非侵襲的磁気共鳴画像法を用いてこの病変を特徴づけることです。
要約
Quantitative magnetic resonance imaging (qMRI) describes the development and use of MRI to quantify physical, chemical, and/or biological properties of living systems. Neuromuscular diseases often exhibit a temporally varying, spatially heterogeneous, and multi-faceted pathology. The goal of this protocol is to characterize this pathology using qMRI methods. The MRI acquisition protocol begins with localizer images (used to locate the position of the body and tissue of interest within the MRI system), quality control measurements of relevant magnetic field distributions, and structural imaging for general anatomical characterization. The qMRI portion of the protocol includes measurements of the longitudinal and transverse relaxation time constants (T1 and T2, respectively). Also acquired are diffusion-tensor MRI data, in which water diffusivity is measured and used to infer pathological processes such as edema. Quantitative magnetization transfer imaging is used to characterize the relative tissue content of macromolecular and free water protons. Lastly, fat-water MRI methods are used to characterize fibro-adipose tissue replacement of muscle. In addition to describing the data acquisition and analysis procedures, this paper also discusses the potential problems associated with these methods, the analysis and interpretation of the data, MRI safety, and strategies for artifact reduction and protocol optimization.
概要
定量的磁気共鳴イメージング(qMRI)は、物理的、化学的に定量化するために開発およびMRIの使用を記載し、かつ/または生体系の生物学的特性。 QMRIは1つが目的の組織とMRIのパルスシーケンスで構成されるシステムのための生物物理学的モデルを、採用することが必要です。パルスシーケンスは、モデルへの関心のパラメータにイメージ」信号強度を感作するように設計されています。 MRI信号特性(信号強度、周波数、および/または位相)がモデルに準拠して測定され、分析されます。目的は、測定の継続的分散、物理的単位を有する物理的または生物学的パラメーターの公平な、定量的な推定値を生成することです。多くの場合、システムを記述する方程式を分析し、画素値を直接変数の値を反映した画像を生成し、画素毎に取り付けられています。このような画像は、パラメータマップと呼ばれます。
qMRIの一般的な使用をdevelopmentとバイオマーカーの応用。バイオマーカーは、疾患の機構を調べ、診断を確立する、予後を決定する、および/または治療応答を評価することができます。これらは、内因性または外因性分子は、組織試料、物理量、または内部の画像の濃度または活性の形態をとることができます。バイオマーカーのいくつかの一般的な要件は、彼らが客観的測定の物理単位を使用して連続的に分布変数を測定することです。関心の病理との明確な、よく理解関係を持っています。改善し、臨床状態の悪化に敏感です。そして適切な正確さと精度で測定することができます。彼らは患者の快適性を促進し、最小限に関心の病理を乱すような非侵襲的または低侵襲性バイオマーカーは、特に望ましいです。
筋肉疾患のための画像ベースのバイオマーカーを開発するための目標は、complementarな方法で筋肉疾患を反映することですyに、より具体的な、より多くの空間より選択的な、および/または既存のアプローチよりも低侵襲。この点でqMRIの1つの特定の利点は、複数の情報タイプを統合し、潜在的に疾患プロセスの多くの側面を特徴付ける可能性を有することです。この能力は、頻繁に脂肪の交換、線維症、筋フィラメント格子(「Z-ディスクストリーミング」)の破壊、および膜損傷と炎症、壊死および/または萎縮が含まれる空間的変数、複雑な病態を呈するれ、筋肉疾患において非常に重要です。 qMRI方法の別の利点は、コントラストに基づくMR画像の定性的または半定量的な説明は、単に病理だけでなく、画像取得パラメータ、ハードウェア、および人間の知覚の違いを反映していないことです。この最後の問題の例はWokke ら 、脂肪浸潤の半定量的評価は、wは、非常に可変と頻繁に間違っていることが示されたことで証明されました定量的な脂肪/水のMRI(FWMRI)と比較した鶏1。
プロトコルは、ここで説明する(QMT)パラメータ、拡散テンソルMRI(DT-MRI)を用いて水の拡散係数、及び筋肉構造を使用して縦(T 1)および横(T 2)緩和時間定数、定量的な磁化移動を測定するためのパルスシーケンスを含みます構造的なイメージとFWMRI。 T 1は、正味の磁化ベクトルが反転され、システムが平衡状態に戻るように、その大きさがサンプリングされた反転回復シーケンスを用いて測定されます。 T 2を繰り返し、このようなカー・パーセルMeiboom-ギル(CPMG)法などのリフォーカスパルスの列を使用して横磁化を再集束し、得られたスピンエコーをサンプリングすることによって測定されます。 T 1及びT 2のデータはexpone数を想定どちら非線形曲線適合法を用いて分析することができますntial成分先験的 (典型的には1〜3)または信号振幅のスペクトルが得られ、減衰指数の多数の和に観測データに適合する線形逆のアプローチを使用しています。このアプローチは、非負最小二乗(NNLS)溶液3を必要とし 、典型的には安定した結果を生成するために追加の正則化を含んでいます。 T 1及びT 2の測定は広く筋肉疾患および傷害4-9を研究するために使用されてきました。 T 1の値は、典型的には、筋肉の脂肪浸潤の地域で減少し、炎症を起こした領域4-6で上昇しています。 T 2の値は、両方の脂肪浸潤や炎症を起こした領域10に上昇しています。
QMT-MRIは、無料の水プロトン(プールのサイズ比、PSR)に高分子の割合を推定することにより、組織内の自由水と固体状の高分子プロトンプールを特徴付けます。リラックス固有これらのプールのエーション率;そして、それらの間の為替レート。共通QMTのアプローチは、パルス彩度11および選択反転回復12,13の方法が挙げられます。以下のプロトコルは、水プロトン信号の狭い線幅に比べて高分子プロトンシグナルの広い線幅を、利用するパルス状の飽和アプローチの使用を記載しています。水信号から十分に異なる共振周波数で高分子信号を飽和させることによって、水信号は、固体及び自由水のプロトンのプールとの間の磁化移動の結果として減少します。データは、定量的な生物物理学的モデルを用いて分析します。 QMTが開発され、健康な筋肉14,15に適用され、最近の要約は、筋肉疾患16にその実装を記述する登場してきました。炎症がPSR 17を減少させることが示されている、請求QMTは、筋肉炎症の小動物モデルを研究するために使用されてきました。だけれどもMTとして高分子と水の両方の内容を反映し、MTのデータはまた、線維18,19を反映することができます。
DT-MRIは、順序付けられた、細長い細胞と組織内の水分子の異方性拡散挙動を定量化するために使用されます。 DT-MRIにおいては、水の拡散は、6以上の異なる方向で測定されます。これらの信号は、テンソルモデル20に取り付けられています。拡散テンソル、Dは 、(3主要な拡散率である)3固有値及び(3拡散係数に対応する方向を示している)3固有ベクトルを得るために対角化されます。 D由来のこれらおよび他の定量的指標は、顕微鏡レベルで組織構造と方向に関する情報を提供します。筋肉の拡散特性、特にDの第固有値および拡散異方性の程度は、実験による負傷2に筋肉の炎症17と筋損傷を反映します1、ひずみ傷害22、および疾患23,24。筋肉の拡散特性の他の潜在的影響は、細胞の直径25と膜透過性の変化における変化を含みます。
最後に、筋萎縮は、なしまたは巨視的な脂肪浸潤することなく、多くの筋肉疾患の病理学的な構成要素です。筋萎縮は、脂肪浸潤を評価するために、筋肉の断面積又は体積を測定するための構造の画像を使用してFW-MRIにより評価することができます。脂肪浸潤を定性的T 1で説明することができる-およびT 2強調画像26が、脂肪と水の信号が最良脂肪と水プロトン27-29の異なる共振周波数を利用する画像を形成することによって測定されます。定量的な脂肪/水の撮像方法は、筋ジストロフィー1,30,31などの筋肉疾患に応用されており、これらの患者において31歩行の損失を予測することができます。
qMRIプロトコルは、ここで説明する自己免疫性炎症性筋疾患の皮膚筋炎(DM)および多発性筋炎(PM)の筋肉の状態を特徴付けるために、これらの測定値のすべてを使用しています。その再現性を含むプロトコルのさらなる詳細は、以前に32公開されています。プロトコルは、特に我々のシステムにプログラムの標準的なパルス配列ならびに無線周波数(RF)及び磁場勾配オブジェクトを含みます。著者らは、プロトコルはまた、筋萎縮、炎症、および(例えば筋ジストロフィーなど)の脂肪浸潤によって特徴付けられる他の神経筋疾患に適用可能であることを期待しています。プロトコル
注:読者は、ヒトを対象とするすべての研究は、研究におけるヒト被験者の使用のために地元の治験審査委員会(IRB)によって承認されなければならないことに留意されています。研究参加者は、提案された研究の目的、手順、リスクおよび便益を知らされなければなりません。代替治療や手順の利用可能性;報酬の可用性;やプライバシーへの権利のと彼らの同意を撤回し、彼らの参加を中止します。前MRI検査セッションに、研究者は、IRBが承認したインフォームドコンセント文書(ICD)との潜在的な研究の参加者を提示し、その内容を説明し、彼/彼女が研究に参加することを希望する場合の潜在的な研究の参加者に依頼する必要があります。もしそうであれば、参加者は前にここでは、プロトコルのステップのいずれかを完了するICDに署名し、日付する必要があります。
試験の前の日に1アクション
- D混乱させるでし生活習慣を制限ATA
- 試験前に48時間の間、中程度または激しい運動を行わない参加者に指示します。試験前に24時間の間に店頭薬とアルコールの摂取を控えるために参加者に指示します。試験前に6時間の間、たばこの使用やカフェインの摂取を控えるよう参加者に指示します。
- 試験の前に、参加者はこれらの指示に準拠していたことを確認します。
- MRIシステムの準備
- 材料および装置の表に記載されている、すべての必要な機器の可用性を確保します。
- MRIプロトコルを定義します。 5 -推奨パラメータを表1に見られます。
テストの2日目:MRIデータ収集のための準備
- 行動の安全性スクリーニング
- MRIの安全性-トンを有することにより、MRI環境での潜在的な危険のための画面医療従事者は、このようなwww.mrisafety.comで見られるように、適切なMRIの安全フォームに研究参加者を提示雨が降りました。
- 任意の移植された磁気又は磁気感応オブジェクトが存在した場合、彼らはMRIスキャンのために安全であることを確認してください。
- MRIシステムの準備
- すべての担当者がMRIシステムを収容する部屋に入る前に全ての磁性と磁気感応のオブジェクトを削除していることを確認してください。このチェックを誰かがMRI室に入室するたびに行っています。
- MRIシステムの患者のベッドの上で受信コイルを配置することによって、MRIシステムを準備します。また、ベッドの上で枕カバーとシートと枕とマットレスを置きます。膝の下に置くために太ももの周りに配置するために利用可能なストラップとボルスターや枕を持っています。
- 、ソフトウェアインタフェースを起動し、患者データを入力し、撮影プロトコルを開きます。
- オール>
- 彼/彼女が磁気感応のオブジェクトのために彼/彼女の人と衣服をチェックするような研究の参加者を確認します。ロック付き容器にMRI室の外でこれらのオブジェクトを固定します。すぐにこのステップを完了した後、研究参加者とMRI室を入力します。
- 仰臥位、足、第一の位置に患者のベッド上で参加者を置きます。実用的なテーブルの正中線に近いように画像化される身体部分を配置します。場所は腰にストレインリリーフを提供し、頭の下に枕を置くために膝の下にボルスターや枕。運動を制限するために、穏やかに、しかし効果的に太もも、脚、足を確保し、参加者が快適であることを確認してください。
- 参加者の太ももの周りのRF受信コイルを配置し、MRIシステムに接続します。
- 研究者と通信する方法についての指示を与えます。 Pを提供聴覚保護し、必要に応じて注意を呼び出すために使用することができる信号装置とarticipant。すべての撮像シーケンスの間との間にまだ滞在する必要の参加者に指示します。
- 撮像すべき身体部分は、MRIスキャナの中央に配置されるようにMRIスキャナに患者のベッドを進めます。
- MRI室を出た後、患者の通信システムが動作し、参加者が快適であることを確認されていることを確認します。プロトコルを通して、指示に彼/彼女の快適さとコンプライアンスを確保するために、参加者と定期的に通信します。
テストの3日目:MRIデータを取得
- 準備手順
- MRIシステムは、各撮像シーケンス(中心周波数、受信機の利得較正など )の前に楽器の設定及び較正、これらのプロセスを監視し、各ステップはcorrectlが行われていることを確実に判断するようにY。
- 適切なソフトウェアインタフェースを使用して、(また、パイロットまたはスカウト画像としても知られる)ローカライザ画像の組を取得します。 表2に提示したパラメータを使用して。
- および/または再現性の解剖学的目印にスライス位置を参照することにより、損傷の領域を識別することによって、qMRIデータの取得のための中央スライスをどこに置くかを決定します。
- コイルキャリブレーション手順を送受信します
- これらの手順だけでなく、すべての後続のイメージング手順については、静磁場(B 0)、「シム」として知られているプロセスの均一性を最適化する中で解剖学の領域を規定します。本研究で使用され、関心のシミング体積(VOI)の典型的な配置については、 図1Aを参照してください。
- MRIスキャナは、マルチエレメント送信コイルを有している場合、RF校正データセットを取得します。
- MRIスキャナは、多要素コイルを受け取った場合には、取得コイルの空間感度マップ。
- 構造的MRIデータを取得
- 高解像度、高速スピンエコー(FSE)シーケンスを使用して、マルチスライス、T 1強調画像を取得します。本研究で使用される撮像パラメータを表1に提供されています。
- 高解像度、FSEシーケンスを用いたマルチスライス、T 2強調画像を取得します。本研究で使用される撮像パラメータを表2に提供されます。
- リアルタイム品質管理のためのデータを取得し、後処理補正を行います
- B 0磁場マップの計算のための3次元(3D)多重勾配エコーデータを取得します。本研究で使用される撮像パラメータを表3に提供されます。
- 約0.5(より大きい±60ヘルツのない偏差がないことを確認するには、フィールドマップを調べ画像全体の3テスラでの百万分の一)。ある場合は、シム調整するための別のアプローチを採用(別の方法、VOIの異なる配置、 など 。)。
- 章動角マップの計算のための3次元データを取得します。本研究で使用される撮像パラメータを表2に提供されます。
- 公称章動角から過度に逸脱しない領域が存在しないことを確実にするために、フィールドマップを調べます。このプロトコルで使用されているRFパルスの場合は、公称章動角の±30%を超える偏差が過大と考えられています。
- qMRIデータを取得
- 反転回復シーケンスを使用して、T 1の計算のための3D画像を取得します。本研究で使用される撮像パラメータは、表3に示されています。
- 脂肪信号抑制(FSの存在下で、T 1の測定を繰り返し、このパラメータはabbreviaですテッドT 1、FS)。
- 複数のスピンエコーシーケンスを使用して、T 2を計算するために単一のスライス画像を取得します。 表3に示す撮像パラメータを使用します。
- FS(T 2、FS)の存在下で、T 2の測定を繰り返します。
- FSを有するパルス飽和配列および表4に示す撮影パラメータを用いて、QMTパラメータの計算のための3D画像を取得します。
- 拡散強調画像のシリーズを使用して、拡散テンソルパラメータの計算のためのマルチスライスデータを取得します。これらの研究で使用される撮像パラメータを表4に示します。
- 6グラディエントエコー一連の画像を用いて、脂肪/水の画像を計算するために3Dデータを取得します。これらの研究に使用される撮像パラメータは、 表5に示します。
- qMRIプロトコルを完了した後、
- 確認しておいて全ての画像は、潜在的に訂正アーチファクトのためにそれらを調べることによって、十分な信号対雑音比を測定することによって、適切な品質のものです。
- 、各qMRIデータセットの場合は、画像のシリーズに興味のあるいくつかの領域(ROIを)を定義し、(例えば、ステップ3.5.1および3.5.2で取得したT 1依存性データに関連するパラメータの関数としての信号を調べますTIの関数として信号をプロットし、データはステップ4.1.2で以下に列挙反転回復機能)に従うことを確認してください。
- 磁気感応オブジェクトのための個人的なスクリーニングを完了した後、MRI室に入ります。 、磁石からの参加者を削除し、すべてのストラップとパディングを削除し、MRIスキャナとMRI室を出るに参加者を支援します。
- 処理のためにローカル・ワークステーションに、地域の保健プライバシー法に準拠した方法を使用して、データを転送します。データはデジタル画像医学での通信(DICOM)ファイルまたはベンダーのようにエクスポートすることができます独自の形式(このプロトコルで使用される方法)。
4. qMRIデータの分析
- パラメトリックマップを計算します
- 科学技術計算や画像解析のために設計されたコンピュータプログラムを使用してください。画像における信号強度のヒストグラムを調べることによって、ノイズの領域からの信号の部分を描く信号閾値に基づく画像マスクを形成します。画像の信号部分のすべてのピクセルについては、以下の手順を実行します。
- 各反転時間(TI)は信号強度Sを測定することによって、T 1データを分析します。その後、減少したプリ遅延モデルと反転回復にSの値に適合:
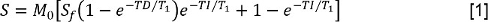
M 0は、平衡状態で磁化を表す信号の強度であり、S fは 、反転比でそして、TDは、プリディレイタイムです。その後、FS、T 1、FSと一定の縦緩和時間の決意を可能にする、同じモデルにFSを使用してデータをフィット。 - 各TEでSを測定することにより、T 2のデータを分析します。次に、単一指数減衰モデルにデータをフィット:

Nは、ベースラインでオフセット信号です。読者はまた、以下のような、多指数モデルにデータを適合することを決定することができます。
Jは指数構成要素と、F及びT 2 jの数であるj 番目の成分に関連する信号フラクション及びT 2の値です。または、リーダは非負最小二乗(NNLS)方法3を使用してもよいです。リットルでatterケースは、多指数関数的緩和分析(MERA)ツールボックス33は 、自由に利用可能です。他のプログラムも用意されています。し、FSのないデータのためにこれらの分析を繰り返します。 - QMTのデータを分析するために、オフセット各照射パワーと周波数のためにSを測定します。章動角マップを使用して(下の式にω1で表される)公称照射パワーを訂正してください。適用されるオフセット周波数を調整するためにB 0マップを用いて、周波数オフセット(以下の式において、ΔF)を修正します。次に、以下のモデル34,35にデータをフィット
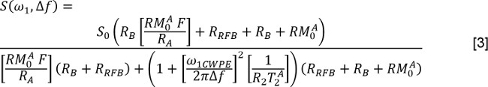
、無料の水プールの縦緩和速度は、自由水プールに巨大分子プールからの為替レートである場合には、(1秒-1であると仮定)高分子プールの縦緩和速度は、PSRがあり、されていますT 無料の水プールの2、およびω1CWPEは、飽和パルスの平均電力です。 Henkelmanと同僚34,35によって作業で説明したように高分子プールの長手方向の磁化の飽和率は、超ローレンツモデルによって記述されています。 - DTIのデータを分析するために、最初に対応する非拡散強調画像に各拡散強調画像を登録するアフィン変換アルゴリズム36を使用します 。そして、各画素について、非拡散強調画像では、各拡散強調方向にSの値を測定します。拡散符号の向きからなるマトリックスを形成します。多変量の加重最小二乗回帰を使用して、拡散符号化行列およびフォームDの信号データを退行。対角化Dと固有値とその固有ベクトルの大きさ、ソートを行います。その後、平均拡散係数(MD)を計算します。
を計算します。 <br /><br /><img title=)
- (https://github.com/welcheb/FattyRiotから無料でダウンロードすることができ、このようなFattyRiotアルゴリズムとして、)は、化学シフトに基づいて水と脂肪信号を分離定量的アプローチを使用してFWMRIデータを分析します。
- 分析のための関心領域を定義します。
- (関心の各筋肉の境界を定義することによって)解剖学的画像上のROIを指定します。例えば、 図1に示されています。
- qMRI画像のマトリックスサイズに合わせてのROIのサイズを変更します。必要に応じて、参加者が移動した場合(例えば、qMRIマップに一致するようにROIの配置を調整します買収の間、ROIの位置の翻訳)は、筋肉の境界を重複を避けるために必要になることがあります。
- 各ROIを調べます。必要に応じて、パーシャルボリュームアーチファクト、非収縮組織、およびフローアーチファクトが含まれていることは、画素が含まれていないことを確認してください。例については、 図1を参照してください。
- 選択されたROI内の全ての画素にqMRI値の平均値と標準偏差を計算します。
結果
図1は、多発性筋炎患者の大腿中央で取得された代表的な軸方向の解剖学的画像を示します。また、シム量の面内の突起の位置が示されています。 7 -各qMRIメソッドの代表的なパラメータマップ、同じ患者から得られた全ては、 図2に設けられています。
図2A?...
ディスカッション
そのような筋ジストロフィーおよび特発性炎症性筋疾患などの筋疾患は、病因で不均一で、個々のエンティティとして、その発生率は稀である疾患群で構成しています。例えば、デュシェンヌ型筋ジストロフィー-筋ジストロフィーの最も一般的な形態は、 - 1 3500でのライブ男性出生37,38の発生率を持っています。皮膚筋炎、このプロトコルを適用した100,000 39 1の発生率を有し...
開示事項
None of the authors has a financial conflict of interest to report.
謝辞
We acknowledge grant support from the National Institutes of Health: NIH/NIAMS R01 AR050101 (BMD), NIH/NIAMS R01 AR057091 (BMD/JHP), NIH/NIBEB K25 EB013659 (RDD), and the Vanderbilt CTSA award RR024975. We also thank the reviewers for the comments and the subject for participating in these studies.
資料
| Name | Company | Catalog Number | Comments |
| 3T human MRI system | Philips Medical Systems (Best, the Netherlands) | Achieva/Intera | |
| Cardiac phased array receive coil | Philips Medical Systems | ||
| Pillows, straps, bolsters, and other positioning devices | |||
| Computer with MATLAB software | The Mathworks, Inc (Natick, MA) | r. 2014 |
参考文献
- Wokke, B. H., et al. Comparison of Dixon and T1-weighted MR methods to assess the degree of fat infiltration in duchenne muscular dystrophy patients. J Magn Reson Imaging. 38 (3), 619-624 (2013).
- Carr, H., Purcell, E. Effects of diffusion on free precession in NMR experiments. Phys Rev. 94, 630-638 (1954).
- Whittall, K. P., MacKay, A. L. Quantitative interpretation of NMR relaxation data. Journal of Magnetic Resonance. 84 (1), 134-152 (1989).
- Park, J. H., et al. Dermatomyositis: correlative MR imaging and P-31 MR spectroscopy for quantitative characterization of inflammatory disease. Radiology. 177 (2), 473-479 (1990).
- Park, J. H., et al. Magnetic resonance imaging and p-31 magnetic resonance spectroscopy provide unique quantitative data useful in the longitudinal management of patients with dermatomyositis. Arthritis & Rheumatism. 37 (5), 736-746 (1994).
- Park, J. H., et al. Use of magnetic resonance imaging and p-31 magnetic resonance spectroscopy to detect and quantify muscle dysfunction in the amyopathic and myopathic variants of dermatomyositis. Arthritis & Rheumatism. 38 (1), 68-77 (1995).
- Huang, Y., et al. Quantitative MR relaxometry study of muscle composition and function in Duchenne muscular dystrophy. J Magn Reson Imaging. 4 (1), 59-64 (1994).
- Kim, H. K., et al. T2 mapping in Duchenne muscular dystrophy: distribution of disease activity and correlation with clinical assessments. Radiology. 255 (3), 899-908 (2010).
- Arpan, I., et al. T2 mapping provides multiple approaches for the characterization of muscle involvement in neuromuscular diseases: a cross-sectional study of lower leg muscles in 5-15-year-old boys with Duchenne muscular dystrophy. NMR in Biomedicine. 26 (3), 320-328 (2013).
- Fan, R. H., Does, M. D. Compartmental relaxation and diffusion tensor imaging measurements in vivo in λ-carrageenan-induced edema in rat skeletal muscle. NMR in Biomedicine. 21 (6), 566-573 (2008).
- Sled, J. G., Pike, G. B. Quantitative interpretation of magnetization transfer in spoiled gradient echo MRI sequences. J Magn Reson. 145 (1), 24-36 (2000).
- Gochberg, D. F., Gore, J. C. Quantitative magnetization transfer imaging via selective inversion recovery with short repetition times. Magn Reson Med. 57 (2), 437-441 (2007).
- Li, K., et al. Optimized inversion recovery sequences for quantitative T1 and magnetization transfer imaging. Magn Reson Med. 64 (2), 491-500 (2010).
- Louie, E. A., Gochberg, D. F., Does, M. D., Damon, B. M. Magnetization transfer and T2 measurements of isolated muscle: effect of pH. Magn Reson Med. 61 (3), 560-569 (2009).
- Sinclair, C. D. J., et al. Quantitative magnetization transfer in in vivo healthy human skeletal muscle at 3 T. Magn Reson Med. 64 (6), 1739-1748 (2010).
- Sinclair, C., et al. Multi-parameter quantitation of coincident fat and water skeletal muscle pathology. Proc 21st Ann Meeting ISMRM. , (2013).
- Bryant, N., et al. Multi-parametric MRI characterization of inflammation in murine skeletal muscle. NMR Biomed. 27 (6), 716-725 (2014).
- Aisen, A. M., Doi, K., Swanson, S. D. Detection of liver fibrosis with magnetic cross-relaxation. Magn Reson Med. 31 (5), 551-556 (1994).
- Kim, H., et al. Induced hepatic fibrosis in rats: hepatic steatosis, macromolecule content, perfusion parameters, and their correlations-preliminary MR imaging in rats. Radiology. 247 (3), 696-705 (2008).
- Basser, P. J., Mattiello, J., LeBihan, D. MR diffusion tensor spectroscopy and imaging. Biophys J. 66 (1), 259-267 (1994).
- Heemskerk, A., Strijkers, G., Drost, M., van Bochove, G., Nicolay, K. Skeletal muscle degeneration and regeneration following femoral artery ligation in the mouse: diffusion tensor imaging monitoring. Radiology. 243 (2), 413-421 (2007).
- Zaraiskaya, T., Kumbhare, D., Noseworthy, M. D. Diffusion tensor imaging in evaluation of human skeletal muscle injury. J Magn Reson Imaging. 24 (2), 402-408 (2006).
- Qi, J., Olsen, N. J., Price, R. R., Winston, J. A., Park, J. H. Diffusion-weighted imaging of inflammatory myopathies: polymyositis and dermatomyositis. J Magn Reson Imaging. 27 (1), 212-217 (2008).
- McMillan, A. B., Shi, D., Pratt, S. J., Lovering, R. M. Diffusion tensor MRI to assess damage in healthy and dystrophic skeletal muscle after lengthening contractions. J Biomed Biotech. , (2011).
- Scheel, M., et al. Fiber type characterization in skeletal muscle by diffusion tensor imaging. NMR Biomed. 26 (10), 1220-1224 (2013).
- Kaufman, L. D., Gruber, B. L., Gerstman, D. P., Kaell, A. T. Preliminary observations on the role of magnetic resonance imaging for polymyositis and dermatomyositis. Annalsrheumatic Dis. 46 (8), 569-572 (1987).
- Dixon, W. T. Simple proton spectroscopic imaging. Radiology. 153 (1), 189-194 (1984).
- Glover, G. H. Multipoint Dixon technique for water and fat proton and susceptibility imaging. J Magn Reson Imaging. 1 (5), 521-530 (1991).
- Berglund, J., Kullberg, J. Three-dimensional water/fat separation and T2* estimation based on whole-image optimization--application in breathhold liver imaging at 1.5 T. Magn Reson Med. 67 (6), 1684-1693 (2012).
- Gloor, M., et al. Quantification of fat infiltration in oculopharyngeal muscular dystrophy: Comparison of three MR imaging methods. J Magn Reson Imaging. 33 (1), 203-210 (2011).
- Fischmann, A., et al. Quantitative MRI and loss of free ambulation in Duchenne muscular dystrophy. J Neurol. 260 (4), 969-974 (2013).
- Li, K., et al. Multi-parametric MRI characterization of healthy human thigh muscles at 3.0 T - relaxation, magnetization transfer, fat/water, and diffusion tensor imaging. NMR Biomed. 27 (9), 1070-1084 (2014).
- Morrison, C., Stanisz, G., Henkelman, R. M. Modeling magnetization transfer for biological-like systems using a semi-solid pool with a super-Lorentzian lineshape and dipolar reservoir. J Magn Reson Series B. 108 (2), 103-113 (1995).
- Li, J. G., Graham, S. J., Henkelman, R. M. A flexible magnetization transfer line shape derived from tissue experimental data. Magn Reson Med. 37 (6), 866-871 (1997).
- Mangin, J. F., Poupon, C., Clark, C., Le Bihan, D., Bloch, I. Distortion correction and robust tensor estimation for MR diffusion imaging. Med Image Anal. 6 (3), 191-198 (2002).
- Moser, H. Duchenne muscular dystrophy: pathogenetic aspects and genetic prevention. Hum Genet. 66 (1), 17-40 (1984).
- van Essen, A. J., Busch, H. F., te Meerman, G. J., ten Kate, L. P. Birth and population prevalence of Duchenne muscular dystrophy in The Netherlands. Hum Genet. 88 (3), 258-266 (1992).
- Bendewald, M. J., Wetter, D. A., Li, X., Davis, M. P. Incidence of dermatomyositis and clinically amyopathic dermatomyositis: A population-based study in olmsted county, minnesota. Arch Dermatol. 146 (1), 26-30 (2010).
- Carlier, P. G. Global T2 versus water T2 in NMR imaging of fatty infiltrated muscles: different methodology, different information and different implications. Neuromuscul Disord. 24 (5), 390-392 (2014).
- Foley, J. M., Jayaraman, R. C., Prior, B. M., Pivarnik, J. M., Meyer, R. A. MR measurements of muscle damage and adaptation after eccentric exercise. J Appl Physiol. 87 (6), 2311-2318 (1999).
- Garrood, P., et al. MR imaging in Duchenne muscular dystrophy: quantification of T1-weighted signal, contrast uptake, and the effects of exercise. J Magn Reson Imaging. 30 (5), 1130-1138 (2009).
- Bratton, C. B., Hopkins, A. L., Weinberg, J. W. Nuclear magnetic resonance studies of living muscle. Science. 147, 738-739 (1965).
- Fleckenstein, J. L., Canby, R. C., Parkey, R. W., Peshock, R. M. Acute effects of exercise on MR imaging of skeletal muscle in normal volunteers. AJR Am J Roentgenol. 151 (2), 231-237 (1988).
- Williams, S., Heemskerk, A., Welch, E., Damon, B., Park, J. The quantitative effects of inclusion of fat on muscle diffusion tensor MRI measurements. J Magn Reson Imaging. 38 (5), 1292-1297 (2013).
- Hernando, D., et al. Removal of olefinic fat chemical shift artifact in diffusion MRI. Magn Reson Med. 65 (3), 692-701 (2011).
- Willcocks, R. J., et al. Longitudinal measurements of MRI-T2 in boys with Duchenne muscular dystrophy: effects of age and disease progression. Neuromuscul Disord. 24 (5), 393-401 (2014).
- Poon, C. S., Henkelman, R. M. Practical T2 quantitation for clinical applications. J Magn Reson Imaging. 2 (5), 541-553 (1992).
- Does, M. D., Gore, J. C. Complications of nonlinear echo time spacing for measurement of T2. NMR Biomed. 13 (1), 1-7 (2000).
- Poon, C. S., Henkelman, R. M. 180° refocusing pulses which are insensitive to static and radiofrequency field inhomogeneity. J Magn Reson. 99 (1), 45-55 (1992).
- Hollingsworth, K. G., de Sousa, P. L., Straub, V., Carlier, P. G. Towards harmonization of protocols for MRI outcome measures in skeletal muscle studies: consensus recommendations from two TREAT-NMD NMR workshops, 2 May 2010, Stockholm, Sweden, 1-2 October 2009, Paris, France. Neuromuscul Disord. 22, S54-S67 (2010).
- Underhill, H. R., Rostomily, R. C., Mikheev, A. M., Yuan, C., Yarnykh, V. L. Fast bound pool fraction imaging of the in vivo rat brain: Association with myelin content and validation in the C6 glioma model. Neuroimage. 54 (3), 2052-2065 (2011).
- Smith, S. A., et al. Quantitative magnetization transfer characteristics of the human cervical spinal cord in vivo: application to adrenomyeloneuropathy. Magn Reson Med. 61 (1), 22-27 (2009).
- Li, K. D. R., Dortch, R. D., Gochberg, D. F., Smith, S. A., Damon, B. M., Park, J. H. Quantitative magnetization transfer with fat component in human muscles. Proc. 20th Ann Meeting ISMRM. , (2012).
- Damon, B. M. Effects of image noise in muscle diffusion tensor (DT)-MRI assessed using numerical simulations. Magn Reson Med. 60 (4), 934-944 (2008).
- Damon, B. M., Buck, A. K. W., Ding, Z. Diffusion-tensor MRI-based skeletal muscle fiber tracking. Imaging Med. 3 (6), 675-687 (2011).
- Froeling, M., Nederveen, A. J., Nicolay, K., Strijkers, G. J. DTI of human skeletal muscle: the effects of diffusion encoding parameters, signal-to-noise ratio and T2 on tensor indices and fiber tracts. NMR in Biomedicine. 26 (11), 1339-1352 (2013).
- Basser, P. J., Pajevic, S. Statistical artifacts in diffusion tensor MRI (DT-MRI) caused by background noise. Magn Reson Med. 44 (1), 41-50 (2000).
- Anderson, A. W. Theoretical analysis of the effects of noise on diffusion tensor imaging. Magn Reson Med. 46 (6), 1174-1188 (2001).
- Saupe, N., White, L. M., Stainsby, J., Tomlinson, G., Sussman, M. S. Diffusion tensor imaging and fiber tractography of skeletal muscle: optimization of B value for imaging at 1.5 T. AJR Am J Roentgenol. 192 (6), W282-W290 (2009).
- Levin, D. I., Gilles, B., Madler, B., Pai, D. K. Extracting skeletal muscle fiber fields from noisy diffusion tensor data. Med Image Anal. 15 (3), 340-353 (2011).
- Sinha, U., Sinha, S., Hodgson, J. A., Edgerton, R. V. Human soleus muscle architecture at different ankle joint angles from magnetic resonance diffusion tensor imaging. J Appl Physiol. 110 (3), 807-819 (2011).
- Jones, D. K., Cercignani, M. Twenty-five pitfalls in the analysis of diffusion MRI data. NMR Biomed. 23 (7), 803-820 (2010).
- Hamilton, G., et al. In vivo characterization of the liver fat 1H MR spectrum. NMR Biomed. 24 (7), 784-790 (2011).
- Hernando, D., Kellman, P., Haldar, J. P., Liang, Z. P. Robust water/fat separation in the presence of large field inhomogeneities using a graph cut algorithm. Magn Reson Med. 63 (1), 79-90 (2010).
- Hernando, D., Hines, C. D., Yu, H., Reeder, S. B. Addressing phase errors in fat-water imaging using a mixed magnitude/complex fitting method. Magn Reson Med. 67 (3), 638-644 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved