JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
골격근 질환의 정량적 자기 공명 영상
요약
신경 근육 질환은 종종 다양한 시간적, 공간적으로 불균일하고, 다방면 병변을 나타낸다. 이 프로토콜의 목적은 비 침습 자기 공명 영상 법을 이용하여이 병변을 특성화한다.
초록
Quantitative magnetic resonance imaging (qMRI) describes the development and use of MRI to quantify physical, chemical, and/or biological properties of living systems. Neuromuscular diseases often exhibit a temporally varying, spatially heterogeneous, and multi-faceted pathology. The goal of this protocol is to characterize this pathology using qMRI methods. The MRI acquisition protocol begins with localizer images (used to locate the position of the body and tissue of interest within the MRI system), quality control measurements of relevant magnetic field distributions, and structural imaging for general anatomical characterization. The qMRI portion of the protocol includes measurements of the longitudinal and transverse relaxation time constants (T1 and T2, respectively). Also acquired are diffusion-tensor MRI data, in which water diffusivity is measured and used to infer pathological processes such as edema. Quantitative magnetization transfer imaging is used to characterize the relative tissue content of macromolecular and free water protons. Lastly, fat-water MRI methods are used to characterize fibro-adipose tissue replacement of muscle. In addition to describing the data acquisition and analysis procedures, this paper also discusses the potential problems associated with these methods, the analysis and interpretation of the data, MRI safety, and strategies for artifact reduction and protocol optimization.
서문
양 자기 공명 영상 (qMRI)는 물리적, 화학적 정량화 개발 및 MRI의 사용을 설명하고 / 또는 생명체의 생물학적 특성. QMRI 한 관심 조직 및 MRI 펄스 시퀀스로 구성된 시스템의 생물 리 학적 모델을 채용하는 것이 필요하다. 펄스 시퀀스는 모델에 대한 관심의 파라미터로 영상 '신호 세기 민감하도록 설계되었다. MRI 신호 특성 (신호 강도, 주파수, 및 / 또는 위상) 모델에 따라 측정되고 분석된다. 목표는 지속적으로 측정 한 분산 된 물리적 단위를 갖는 물리적 또는 생물학적 파라미터의 바이어스 정량적 추정치를 생성한다. 종종 시스템을 기술하는 방정식을 분석하고, 그 화소 값을 직접 변수의 값을 반영하여 이미지를 생성하는 화소 단위에 장착된다. 이러한 화상은 파라미터 맵으로 지칭된다.
qMRI의 일반적인 사용은 D이다evelopment 및 바이오 마커의 응용 프로그램입니다. 바이오 마커는 질병 메카니즘을 조사 진단을 확립 예후를 결정 및 / 또는 치료 학적 반응을 평가하기 위해 사용될 수있다. 이들은 내인성 또는 외인성 분자, 조직 학적 표본 물리량, 또는 내부 화상의 농도 또는 활동의 형태를 취할 수있다. 바이오 마커의 일반적인 요건은 객관적 측정의 물리적 단위를 사용하여 연속적으로 분산 변수를 측정한다는 것이다; 관심의 병리와 명확하고 잘 이해 관계를 가지고; 에 대한 개선과 임상 상태의 악화에 민감하다; 적합한 정확도와 정밀도로 측정 할 수있다. 그들은 환자의 편안함을 촉진하고 최소한의 관심의 병리를 방해로 비 침습적 또는 최소 침습 바이오 마커는, 특히 바람직하다.
근육 질환 이미지 기반 바이오 마커를 개발하기위한 목표 complementar있는 방법 근육 질환을 반영하는 것이다Y, 더욱보다 구체적 더 이상 선택적 공간적 및 / 또는 기존의 방법보다 덜 침습적. 이와 관련 qMRI의 한 가지 특별한 장점은 여러 가지 유형의 정보를 통합하고, 이에 따라 잠재적으로 질병 과정의 많은 부분을 특성화하는 잠재력을 가지고있다. 이 기능은 자주 지방 교체, 섬유증의 myofilament 격자 ( "Z 디스크 스트리밍")의 중단, 그리고 막 손상과 염증, 괴사 및 / 또는 위축을 포함하는 공간적 변수, 복잡한 병리학을 전시하는 근육 질환에서 매우 중요하다 . qMRI 방법의 또 다른 이점은 대조 계 MR 이미지의 질적 또는 반 정량적 인 설명이 아니라 병리학뿐만 아니라, 화상 취득 파라미터 하드웨어의 차이, 그리고 인간의 지각을 반영한다는 것이다. 이 마지막 문제의 예는 Wokke 등., 지방 침투의 반 정량적 평가 승, 매우 다양하고 자주 잘못된 것으로 나타났다에 의해 입증되었다양적 지방 / 물 MRI (FWMRI)에 비해 암탉 1.
여기에 설명되는 프로토콜 (QMT) 파라미터, 확산 텐서 MRI (DT-MRI)를 사용하여 수분 확산 계수, 그리고 근육의 구조를 사용하여 길이 (T 1)와 횡 방향 (T 2) 완화 시간 상수 정량적 자화 전송을 측정하기위한 펄스 시퀀스를 포함 구조적인 이미지와 FWMRI. T 1 순 자화 벡터가 반전되고 시스템은 평형 상태로 복귀하여 그 크기로 샘플링하는 반전 회수 시퀀스를 사용하여 측정된다. T 2는 반복적으로 같은 카 - 퍼셀 카르 · 퍼 어셀 · 메이 붐 · 길 (CPMG) 방법으로 재조명 펄스의 기차를 이용하여 가로 자화를 재조명하고, 생성 된 스핀 에코를 샘플링하여 측정한다. T 1 및 T 2 데이터 expone들을 가정 중 비 - 선형 곡선 피팅 방법을 사용하여 분석 될 수있다ntial 성분 사전 (일반적으로 하나 내지 3 개) 또는 신호의 진폭 스펙트럼의 결과 감쇠 지수 함수의 다수의 합 관측 데이터에 맞는 선형 역 방식을 사용하여이. 이 방법은 적어도 음이 아닌 사각 (NNLS) 용액 3을 요구하고 전형적 안정적인 결과를 생성하기 위해 추가 정규화를 포함한다. T 1과 T 2 측정 널리 근육 질환 및 부상 4-9을 연구하는 데 사용되었다. T 1 값은 일반적으로 근육의 지방 침투 지역에서 감소 및 염증 지역 4-6에서 증가된다 T 2 값은 모두 지방 침투 및 염증 영역 (10)에서 증가된다.
QMT-MRI 무료 물 양성자 (풀 크기 비율, PSR)에 고분자의 비율을 추정하여 조직에서 무료로 물과 고체와 같은 거대 분자 양자 풀을 특징; 휴식 고유이 풀의 ATION 속도; 그들 사이의 환율. 일반 QMT 방식은 펄스 채도 (11)와 선택적 반전 복구 12,13 방법을 포함한다. 프로토콜은 아래의 물 양성자 신호의 좁은 선폭에 대하여 거대 분자 양자 신호의 넓은 선폭을 이용한다 펄스 포화 접근법의 사용을 설명한다. 수분 신호로부터 충분히 서로 다른 공진 주파수에서의 거대 분자 신호를 포화시킴으로써, 수분 신호는 고체없는 물 양성자 풀 간의 자화 전달의 결과로서 감소된다. 데이터는 양적 생물 리 학적 모델을 사용하여 분석한다. QMT 개발하고 건강한 근육 14, 15에 적용하고, 최근의 추상적 인 근육 질환 (16)의 구현을 설명 등장하고있다. 이 염증은 PSR (17)를 감소 함을 보였다 특징 QMT는 근육 염증의 작은 동물 모델을 연구하는 데 사용되었습니다. 진대 MT로거대 분자와 물 모두 내용을 반영, MT 데이터는 섬유증 (18, 19)을 반영 할 수있다.
DT-MRI 주문시, 신장 세포 조직 내의 물 분자의 이방성 확산 동작을 정량화하는데 사용된다. DT-MRI에서 물의 확산은 6 개 이상의 상이한 방향에서 측정되고; 이 신호는 다음 텐서 모델 (20)에 장착되어 있습니다. 확산 텐서, D는 (세 가지 주요 확산율 있습니다) 세 가지 고유하고 (세 확산 계수에 대응하는 방향을 나타냅니다) 세 개의 고유 벡터를 얻기 위해 대각된다. D로부터 유도 및 다른 계량 지수 현미경 수준에서의 조직 구조 및 방향에 대한 정보를 제공한다. 근육의 확산 성, 특히 D의 제 3 고유 확산 이방성의 정도는, 실험 인해 손상이 염증에 근육 (17) 및 근육 손상을 반영1, 스트레인 부상 (22), 질병 (23, 24). 근육의 확산 특성에 다른 잠재적 인 영향은 기포 직경 (25)과 막 투과성의 변화의 변화를 포함한다.
마지막으로, 근육의 위축, 또는 육안없이 지방 침투없이 많은 근육 질환의 병리학 적 성분이다. 근육 위축 지방산 침투 평가 근육 단면적이나 부피 FW-MRI를 측정하는 구조의 이미지를 이용하여 평가 될 수있다. 지방 침윤 정성 T 1에서 설명 될 수있다 - 및 T (2)는 이미지 (26)를 -weighted하지만, 지방과 물 신호가 가장 지방과 물 양성자 27-29의 서로 다른 공진 주파수를 이용하는 이미지를 형성함으로써 측정된다. 양 지방 / 물 촬상 방법은 근이영양증 1,30,31으로 근육 질환으로 적용되었으며, 이들 환자 31 보행의 손실을 예측할 수있다.
여기서 설명 qMRI 프로토콜은 면역 염증성 근육 병증의 피부 근염 (DM) 및 다발성 근염 (PM) 근육 상태를 특성화하기 위해 이러한 측정을 모두 사용한다. 그 재현성을 포함하여 프로토콜의 더 자세한 사항은, 이전에 32 발표되었다. 프로토콜은 특히 우리의 시스템 표준 프로그래밍 펄스 시퀀스들뿐만 아니라 무선 주파수 (RF) 및 자기장 그래디언트 오브젝트를 포함한다. 저자는 프로토콜 (예, 근육 이영양증 등) 근육 위축증, 염증, 지방 침윤을 특징으로 다른 신경 근육 질환에 적용 할 수있는 것은 예상된다.프로토콜
참고 : 독자가 인체를 이용한 모든 조사 연구에서 인간 주제의 사용에 대한 지역 임상 시험 심사위원회 (IRB)의 승인을 받아야 것을 상기한다. 연구 참가자는 제안 된 연구의 목적, 절차, 위험과 혜택을 통보해야합니다; 대체 치료 또는 절차의 가용성; 보수의 가용성; 및 개인 정보 보호에 대한 자신의 권리 및 동의를 철회하고 참여를 중단합니다. MRI를 테스트 세션에 앞서, IRB 승인 동의서 문서 (ICD)와 전위 연구 참가자 제시 내용을 설명하고, 그 / 그녀가 본 연구에 참여하고자하는 경우 잠재적 인 연구 참여자를 요청해야 조사관. 그렇다면, 학습자는 서명을 가지고 여기 프로토콜의 모든 단계를 완료하기에 앞서 ICD 데이트된다.
테스트의 날 1. 작업 전
- 는 D 혼동 할 수 생활 습관 제한ATA
- 테스트하기 전에 48 시간 동안 중등도 또는 심한 운동을 수행하지 않도록 참가자를 지시한다. 시험을하기 전에 24 시간 동안 이상 - 더 - 카운터 약물과 알코올 섭취를 절제 할 수있는 참가자를 지시한다. 테스트하기 전에 6 시간 동안 흡연이나 카페인 섭취 자제 참가자를 지시한다.
- 테스트에 앞서, 참가자가이 지침을 준수하고 있는지 확인합니다.
- 자기 공명 영상 시스템 준비
- 재료 및 장비의 표에 나열된 모든 필요한 장비의 가용성을 확인합니다.
- MRI 검사 프로토콜을 정의; 5 - 제안 매개 변수는 표 1에서 발견된다.
테스트 2. 일 : MRI 데이터 수집을위한 준비
- 행동 안전 검사
- MRI를 안전-t을 가지는하여 MRI 환경에서 잠재적 인 위험에 대한 화면의료 노동자는 www.mrisafety.com에서 발견 된 것과 같은 적절한 MRI 안전 양식 연구 참가자를 제시 비가 내렸다.
- 모든 이식 자기 또는 자기 적으로 민감한 개체가있는 경우, 그들은 MRI 검사를위한 안전하다는 것을 확인하십시오.
- 자기 공명 영상 시스템 준비
- 모든 직원은 MRI 시스템을 수용 방에 들어가기 전에 모든 자성 및 자성을 띤 물체를 제거했는지 확인합니다. 이 검사에게 누군가가 MRI 실에 진입 할 때마다 실시한다.
- 자기 공명 영상 장치의 환자 베드의 수신 코일을 배치하여 MRI 시스템을 준비한다. 또한, 침대에 베개와 시트와 베개와 매트리스를 배치합니다. 무릎 아래에 배치 허벅지 주위에 배치 가능한 스트랩과 덧 베개 나 쿠션을 가지고있다.
- 소프트웨어 인터페이스를 시작 환자 데이터를 입력하고, 영상 프로토콜을 엽니 다.
- <자기 공명 영상 스캐너 표에 연구 참가자를 배치올>
- 그 / 그녀가 자기에 민감한 개체에 대한 그 / 그녀의 사람과 옷을 검사로 연구 참가자를 관찰한다. 잠글 용기에 MRI 실 외부에서 이러한 개체를 고정합니다. 바로이 단계를 완료 한 후 연구 참여자와 MRI 실을 입력합니다.
- 부정사, 발 - 첫 번째 위치에 환자 침대에 참가자를 놓습니다. 본체 부분을 배치하는 것이 실용적 같은 테이블의 중심선에 가깝게 이미지화한다. 무릎 아래 장소 덧 베개 나 베개는 낮은에 대한 스트레인 릴리프를 다시 제공하고 머리 아래에 베개를 배치합니다. 부드럽게 움직임을 제한하지만 효과적으로 허벅지, 다리와 발을 보호하고 참가자가 편안한 지 확인합니다.
- 참가자의 허벅지 주위 RF 수신기 코일을 배치하고는 MRI 시스템에 연결한다.
- 연구자와 통신하는 방법에 대한 지침을 제공합니다. 상기 p-을 제공합니다보호 및 필요한 경우주의를 요구하는 데 사용될 수있는 신호 장치를 청각 articipant. 동안 모든 영상 시퀀스 사이에 여전히 머물 수있는 필요의 참가자를 지시한다.
- 묘화 될 수있는 부위가 MRI 스캐너의 중앙에 정렬되어 있는지 등 MRI 스캐너로 환자 베드 전진.
- 자기 공명 영상 실을 종료 한 후, 환자 통신 시스템이 작동하고 참가자가 편안하게 볼되어 있는지 확인합니다. 프로토콜 전반에 걸쳐 지침에 그 / 그녀의 편안함과 준수를 보장하기 위해 참가자와 정기적으로 통신합니다.
테스트의 3 일 : 자기 공명 영상 데이터 획득
- 준비 단계
- 자기 공명 영상 시스템은 각각 이미징 시퀀스 (중심 주파수, 수신기 이득 조정 등)하기 전에 설정 및 교정 수단이 이들 공정을 감독하고, 각 단계를 수행하는 correctl되도록 결정으로서와이.
- 적합한 소프트웨어 인터페이스를 사용하면, 로컬 라이저 이미지의 세트 (또한, 파일럿 또는 정찰 이미지라고도 함) 획득; 표 2에 제시된 제안 된 파라미터를 이용.
- 및 / 또는 재생 가능한 해부학 적으로 조각의 위치를 참조하여 손상의 영역을 파악하여, qMRI 데이터 수집을위한 중앙 슬라이스를 배치 할 위치를 결정합니다.
- 코일 교정 단계를 전송 및 수신
- 단계뿐만 아니라 모든 후속 이미징 단계는 정적 자기장 (B 0) "shimming"로 알려진 프로세스의 균일 성을 최적화하는 해부학의 영역을 정의한다. 관심 shimming 볼륨의 전형적인 배치를도 1a를 참조 (VOI)는 본 연구에서 사용 하였다.
- 자기 공명 영상 스캐너가 다중 요소 송신 코일을 갖는 경우, RF 교정 데이터 세트를 획득.
- 자기 공명 영상 스캐너 다중 수신 소자 코일이 있으면 취득코일의 공간 감도지도.
- 구조 MRI 데이터 획득
- 높은 해상도, 멀티 슬라이스를 획득, T 1은 고속 스핀 에코 (FSE) 시퀀스를 사용하여 이미지 -weighted; 본 연구에서 사용 된 촬상 파라미터는 표 1에 제공된다.
- 고해상도 멀티 슬라이스, T (2)는 FSE 시퀀스를 사용하여 이미지를 획득 -weighted; 본 연구에서 사용 된 촬상 파라미터는 표 2에 제공된다.
- 실시간 품질 관리 및 제작 후 처리 수정에 대한 데이터 획득
- B 0 필드 맵의 계산을위한 3 차원 (3D) 다중 구배 에코 데이터를 획득. 본 연구에서 사용 된 촬상 파라미터는 표 3에 제공된다.
- 이상 ± 60 Hz에서의 어떠한 편차 (약 0.5가 없도록 필드 맵을 검사이미지에 3 테슬라에서 백만 분). 이 경우 shimming 대안 접근법을 채택 (다른 방법으로서, VOI의 상이한 배치 등.).
- 장동 각 맵의 계산을위한 3 차원 데이터를 획득. 본 연구에서 사용 된 촬상 파라미터는 표 2에 제공된다.
- 공칭 장동 각도에서 과도하게 벗어난 어떤 부분이 없는지 확인하기 위해 현장지도를 검사합니다. 이 프로토콜에서 사용되는 RF 펄스를 들어, 공칭 장동 각도 ± 30 % 이상 편차가 과도하게 간주된다.
- qMRI 데이터 획득
- 반전 복구 시퀀스를 사용하여 상기 T (1)의 연산에 3D 이미지를 획득. 본 연구에서 사용 된 촬상 파라미터는 표 3에 제시되어있다.
- 이 파라미터 abbrevia이다 (FS 지방 신호 억제의 존재하에 측정 한 T 반복테드 T 1, FS).
- 복수의 스핀 에코 시퀀스를 이용하여 T (2)의 계산을 위해 단일 슬라이스 이미지를 획득. 표 3에 제시된 촬상 파라미터를 사용한다.
- FS (T 2, FS)의 존재하에 T이 측정을 반복한다.
- FS와 펄스 포화 서열 및 표 4에 주어진 촬상 파라미터를 이용하여, QMT 파라미터의 계산 된 3D 이미지를 획득.
- 확산 강조 영상의 시리즈를 사용하여, 확산 텐서 파라미터 계산 다중 슬라이스 데이터 획득. 이러한 연구에 사용되는 촬상 파라미터는 표 4에 나타내었다.
- 여섯 구배 에코 이미지의 시리즈를 사용하여 지방 / 물 화상의 계산 된 3D 데이터를 획득. 이러한 연구에 사용되는 촬상 파라미터는 표 5에 나타내었다.
- qMRI 프로토콜을 완료 한 후
- 그 확인사진 잠재적 정정 아티팩트들을 검사하여 상기 충분한 신호 대 잡음비를 측정하여 적합한 품질이다.
- 각 qMRI 데이터 세트의 경우, 이미지 시리즈에서 관심 (로아)의 여러 영역을 정의하고, 단계 3.5.1 및 3.5.2에서 취득한 T 1 의존성 데이터를 (예를 들어, 관련 파라미터의 함수로서 신호를 검토 TI의 함수로서 신호를 플롯 데이터 단계 4.1.2 아래 반전 복구 기능)을 따르도록 보장한다.
- 자기 민감한 개체에 대한 개인 심사를 완료 한 후, MRI 실을 입력합니다. 자석에서 참가자를 제거 모든 스트랩과 패딩을 제거하고 MRI 스캐너 및 MRI 실을 종료에 참가자를 지원합니다.
- 처리를 위해 로컬 워크 스테이션에 지역 보건 개인 정보 보호 법률을 준수 방법을 사용하여 데이터를 전송; 데이터 의학 (DICOM) 파일 또는 공급 업체에 디지털 이미징 통신로 내보낼 수 있습니다의 독점 형식 (이 프로토콜에서 사용하는 방법).
4. qMRI 데이터 분석
- 파라 메트릭지도를 계산
- 과학 연산 및 이미지 분석을 위해 설계된 컴퓨터 프로그램을 사용한다. 이미지의 신호 세기의 히스토그램을 검사하여, 노이즈 영역에서의 신호의 부분을 묘사하는 신호 임계 값 기반 이미지 마스크를 형성한다. 이미지의 신호 부분의 모든 픽셀에 대해 다음 단계를 완료합니다.
- 각각의 반전 시간 (TI)에 대한 신호 강도 S를 측정하여 T 1 데이터를 분석한다. 그 후, 감소 된 프리 지연 모델 반전 복구으로 S의 값을 적합 :
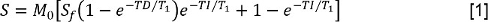
M 0은 평형 상태에서의 자화를 나타내는 신호 강도이고, S의 F는 반전 비율및 TD 프리 지연 시간이다. 그리고, FS, T 1, FS와 일정 길이 완화 시간의 결정을 허용하는 동일한 모델 FS와 데이터를 장착한다. - 각 TE에서 S를 측정하여 T 2 데이터를 분석 할 수 있습니다. 이어서, 모노 - 지수 감쇠 모델 데이터를 적합 :

여기서 N은 기준선 오프셋 신호이다. 독자는 또한 다음과 다중 지수 모델 데이터를 맞게 결정할 수있다 :
J는 지수 성분과, F 및 J T 2의 수이고 j 번째 구성 요소와 연관된 신호 분획 및 T 2의 값이다. 또는 리더가 음이 아닌 최소 제곱 (NNLS) 방법 3을 사용할 수있다. 패에서atter 케이스, 멀티 지수 휴식 분석 (메라) 도구 상자 (33)는 자유롭게 사용할 수 있습니다; 다른 프로그램도 사용할 수 있습니다. 와 FS없이 데이터에 대한 이러한 분석을 반복합니다. - QMT 데이터를 분석하는, 오프셋 각 조사 파워 및 주파수 S를 측정한다. 장동 각 맵을 사용하여 (아래 식 ω 1로 표시) 공칭 조사 권한을 수정합니다. 인가 된 주파수 오프셋을 조정 B 0지도를 사용하여 주파수 오프셋 (아래 식에서 Δ의 F)를 수정한다. 그런 다음 모델 (34, 35)에 데이터를 적합
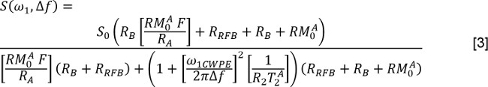
자유 물 풀의 종 방향 완화 율이없는 물 풀에 거대 풀 환율이다이고, (1 (S) -1 인 것으로 가정)를 고분자 풀 길이 완화 율은 PSR이된다이며 T 개의 유리 물 풀의 2, ω 1CWPE 채도 펄스의 평균 전력이다. Henkelman 동료 (34, 35)에 의해 작업에 기재된 거대 분자의 풀 길이 자화 포화 레이트, 수퍼 로렌 시안 모델에 의해 설명된다. - DTI에 데이터를 분석하기 위해, 우선 해당 비 확산 강조 영상 각각 확산 강조 화상을 등록하는 아핀 변환 알고리즘 (36)을 사용한다. 그리고, 각 화소에 대한 비 확산 강조 영상에서 각각 확산 가중 방향으로 S의 값을 측정한다. 확산 부호화 방향 이루어진 매트릭스를 형성한다. 다변량, 가중 최소 제곱 회귀를 사용하여, 확산 부호화 행렬 및 형태 D의 신호 데이터를 회귀. 대각 D는 고유 값과 고유 벡터의 크기 - 정렬을 수행합니다. 다음으로 평균 확산 (MD)을 계산 :

여기서, λ (1), λ (2) 및 λ 3 확산 텐서의 고유치이다. 또한 소수 이방성 (FA)를 계산한다 :
- (https://github.com/welcheb/FattyRiot에서 무료로 다운로드 할 수 있습니다 예를 들면 FattyRiot 알고리즘 등)의 화학 변화에 따라 물과 지방 신호를 분리하는 양적 접근 방식을 사용하여 FWMRI 데이터를 분석 할 수 있습니다.
- 분석에 대한 관심의 영역을 정의
- (관심있는 각각의 근육의 경계를 정의하는) 해부학 적 영상에 ROI를 지정. 예는도 1에 도시되어있다.
- qMRI 이미지 행렬의 크기에 맞도록 크기 조정 로아. 필요에 참가자가 이동 한 경우 (예를 들어, qMRI 맵과 일치하도록 ROI 영역의 배향을 조절인수 사이 ROI 위치의 변환)가 근육의 경계가 겹치지 않도록 요구 될 것이다.
- 각각의 투자 수익 (ROI)을 검사합니다. 필요한 경우, 픽셀이 부분 볼륨 아티팩트, 비 수축성 조직 및 흐름 아티팩트가 들어있는 포함되지 않도록; 예제 그림 1 참조하시기 바랍니다.
- 상기 선택된 ROI들 내의 모든 픽셀에 qMRI 값의 평균과 표준 편차를 계산한다.
결과
그림 1은 다발성 근염 환자의 허벅지 중간에서 획득 대표 축 해부학 적 이미지를 보여줍니다. 또한 심 량의 면내 돌기의 위치가 도시되어있다. 7 - 각 qMRI 방법에 대한 대표 매개 변수지도,이 같은 환자에서 얻은 모두는, 그림 2에서 제공된다.
도 2a 및도 2b는 각각 ?...
토론
등 근육 이영양증 및 특발성 염증성 근육 병증 등 근육 질환은 발생 희귀, 개별 기관으로, 원인에 이기종 및 질병의 그룹으로 구성한다. 예를 들어, 뒤 시엔 느 근이영양증 - 근육 영양 장애의 가장 흔한 형태는 - 1 3500 라이브 남성 출산 37, 38를의 발생률이있다; 피부 근염,이 프로토콜이 적용된에, 10 39 (1)의 발생률이 있습니다. 이 질병의 높은 집단 발생하지만, 그 종종 병적 징후 중...
공개
None of the authors has a financial conflict of interest to report.
감사의 말
We acknowledge grant support from the National Institutes of Health: NIH/NIAMS R01 AR050101 (BMD), NIH/NIAMS R01 AR057091 (BMD/JHP), NIH/NIBEB K25 EB013659 (RDD), and the Vanderbilt CTSA award RR024975. We also thank the reviewers for the comments and the subject for participating in these studies.
자료
| Name | Company | Catalog Number | Comments |
| 3T human MRI system | Philips Medical Systems (Best, the Netherlands) | Achieva/Intera | |
| Cardiac phased array receive coil | Philips Medical Systems | ||
| Pillows, straps, bolsters, and other positioning devices | |||
| Computer with MATLAB software | The Mathworks, Inc (Natick, MA) | r. 2014 |
참고문헌
- Wokke, B. H., et al. Comparison of Dixon and T1-weighted MR methods to assess the degree of fat infiltration in duchenne muscular dystrophy patients. J Magn Reson Imaging. 38 (3), 619-624 (2013).
- Carr, H., Purcell, E. Effects of diffusion on free precession in NMR experiments. Phys Rev. 94, 630-638 (1954).
- Whittall, K. P., MacKay, A. L. Quantitative interpretation of NMR relaxation data. Journal of Magnetic Resonance. 84 (1), 134-152 (1989).
- Park, J. H., et al. Dermatomyositis: correlative MR imaging and P-31 MR spectroscopy for quantitative characterization of inflammatory disease. Radiology. 177 (2), 473-479 (1990).
- Park, J. H., et al. Magnetic resonance imaging and p-31 magnetic resonance spectroscopy provide unique quantitative data useful in the longitudinal management of patients with dermatomyositis. Arthritis & Rheumatism. 37 (5), 736-746 (1994).
- Park, J. H., et al. Use of magnetic resonance imaging and p-31 magnetic resonance spectroscopy to detect and quantify muscle dysfunction in the amyopathic and myopathic variants of dermatomyositis. Arthritis & Rheumatism. 38 (1), 68-77 (1995).
- Huang, Y., et al. Quantitative MR relaxometry study of muscle composition and function in Duchenne muscular dystrophy. J Magn Reson Imaging. 4 (1), 59-64 (1994).
- Kim, H. K., et al. T2 mapping in Duchenne muscular dystrophy: distribution of disease activity and correlation with clinical assessments. Radiology. 255 (3), 899-908 (2010).
- Arpan, I., et al. T2 mapping provides multiple approaches for the characterization of muscle involvement in neuromuscular diseases: a cross-sectional study of lower leg muscles in 5-15-year-old boys with Duchenne muscular dystrophy. NMR in Biomedicine. 26 (3), 320-328 (2013).
- Fan, R. H., Does, M. D. Compartmental relaxation and diffusion tensor imaging measurements in vivo in λ-carrageenan-induced edema in rat skeletal muscle. NMR in Biomedicine. 21 (6), 566-573 (2008).
- Sled, J. G., Pike, G. B. Quantitative interpretation of magnetization transfer in spoiled gradient echo MRI sequences. J Magn Reson. 145 (1), 24-36 (2000).
- Gochberg, D. F., Gore, J. C. Quantitative magnetization transfer imaging via selective inversion recovery with short repetition times. Magn Reson Med. 57 (2), 437-441 (2007).
- Li, K., et al. Optimized inversion recovery sequences for quantitative T1 and magnetization transfer imaging. Magn Reson Med. 64 (2), 491-500 (2010).
- Louie, E. A., Gochberg, D. F., Does, M. D., Damon, B. M. Magnetization transfer and T2 measurements of isolated muscle: effect of pH. Magn Reson Med. 61 (3), 560-569 (2009).
- Sinclair, C. D. J., et al. Quantitative magnetization transfer in in vivo healthy human skeletal muscle at 3 T. Magn Reson Med. 64 (6), 1739-1748 (2010).
- Sinclair, C., et al. Multi-parameter quantitation of coincident fat and water skeletal muscle pathology. Proc 21st Ann Meeting ISMRM. , (2013).
- Bryant, N., et al. Multi-parametric MRI characterization of inflammation in murine skeletal muscle. NMR Biomed. 27 (6), 716-725 (2014).
- Aisen, A. M., Doi, K., Swanson, S. D. Detection of liver fibrosis with magnetic cross-relaxation. Magn Reson Med. 31 (5), 551-556 (1994).
- Kim, H., et al. Induced hepatic fibrosis in rats: hepatic steatosis, macromolecule content, perfusion parameters, and their correlations-preliminary MR imaging in rats. Radiology. 247 (3), 696-705 (2008).
- Basser, P. J., Mattiello, J., LeBihan, D. MR diffusion tensor spectroscopy and imaging. Biophys J. 66 (1), 259-267 (1994).
- Heemskerk, A., Strijkers, G., Drost, M., van Bochove, G., Nicolay, K. Skeletal muscle degeneration and regeneration following femoral artery ligation in the mouse: diffusion tensor imaging monitoring. Radiology. 243 (2), 413-421 (2007).
- Zaraiskaya, T., Kumbhare, D., Noseworthy, M. D. Diffusion tensor imaging in evaluation of human skeletal muscle injury. J Magn Reson Imaging. 24 (2), 402-408 (2006).
- Qi, J., Olsen, N. J., Price, R. R., Winston, J. A., Park, J. H. Diffusion-weighted imaging of inflammatory myopathies: polymyositis and dermatomyositis. J Magn Reson Imaging. 27 (1), 212-217 (2008).
- McMillan, A. B., Shi, D., Pratt, S. J., Lovering, R. M. Diffusion tensor MRI to assess damage in healthy and dystrophic skeletal muscle after lengthening contractions. J Biomed Biotech. , (2011).
- Scheel, M., et al. Fiber type characterization in skeletal muscle by diffusion tensor imaging. NMR Biomed. 26 (10), 1220-1224 (2013).
- Kaufman, L. D., Gruber, B. L., Gerstman, D. P., Kaell, A. T. Preliminary observations on the role of magnetic resonance imaging for polymyositis and dermatomyositis. Annalsrheumatic Dis. 46 (8), 569-572 (1987).
- Dixon, W. T. Simple proton spectroscopic imaging. Radiology. 153 (1), 189-194 (1984).
- Glover, G. H. Multipoint Dixon technique for water and fat proton and susceptibility imaging. J Magn Reson Imaging. 1 (5), 521-530 (1991).
- Berglund, J., Kullberg, J. Three-dimensional water/fat separation and T2* estimation based on whole-image optimization--application in breathhold liver imaging at 1.5 T. Magn Reson Med. 67 (6), 1684-1693 (2012).
- Gloor, M., et al. Quantification of fat infiltration in oculopharyngeal muscular dystrophy: Comparison of three MR imaging methods. J Magn Reson Imaging. 33 (1), 203-210 (2011).
- Fischmann, A., et al. Quantitative MRI and loss of free ambulation in Duchenne muscular dystrophy. J Neurol. 260 (4), 969-974 (2013).
- Li, K., et al. Multi-parametric MRI characterization of healthy human thigh muscles at 3.0 T - relaxation, magnetization transfer, fat/water, and diffusion tensor imaging. NMR Biomed. 27 (9), 1070-1084 (2014).
- Morrison, C., Stanisz, G., Henkelman, R. M. Modeling magnetization transfer for biological-like systems using a semi-solid pool with a super-Lorentzian lineshape and dipolar reservoir. J Magn Reson Series B. 108 (2), 103-113 (1995).
- Li, J. G., Graham, S. J., Henkelman, R. M. A flexible magnetization transfer line shape derived from tissue experimental data. Magn Reson Med. 37 (6), 866-871 (1997).
- Mangin, J. F., Poupon, C., Clark, C., Le Bihan, D., Bloch, I. Distortion correction and robust tensor estimation for MR diffusion imaging. Med Image Anal. 6 (3), 191-198 (2002).
- Moser, H. Duchenne muscular dystrophy: pathogenetic aspects and genetic prevention. Hum Genet. 66 (1), 17-40 (1984).
- van Essen, A. J., Busch, H. F., te Meerman, G. J., ten Kate, L. P. Birth and population prevalence of Duchenne muscular dystrophy in The Netherlands. Hum Genet. 88 (3), 258-266 (1992).
- Bendewald, M. J., Wetter, D. A., Li, X., Davis, M. P. Incidence of dermatomyositis and clinically amyopathic dermatomyositis: A population-based study in olmsted county, minnesota. Arch Dermatol. 146 (1), 26-30 (2010).
- Carlier, P. G. Global T2 versus water T2 in NMR imaging of fatty infiltrated muscles: different methodology, different information and different implications. Neuromuscul Disord. 24 (5), 390-392 (2014).
- Foley, J. M., Jayaraman, R. C., Prior, B. M., Pivarnik, J. M., Meyer, R. A. MR measurements of muscle damage and adaptation after eccentric exercise. J Appl Physiol. 87 (6), 2311-2318 (1999).
- Garrood, P., et al. MR imaging in Duchenne muscular dystrophy: quantification of T1-weighted signal, contrast uptake, and the effects of exercise. J Magn Reson Imaging. 30 (5), 1130-1138 (2009).
- Bratton, C. B., Hopkins, A. L., Weinberg, J. W. Nuclear magnetic resonance studies of living muscle. Science. 147, 738-739 (1965).
- Fleckenstein, J. L., Canby, R. C., Parkey, R. W., Peshock, R. M. Acute effects of exercise on MR imaging of skeletal muscle in normal volunteers. AJR Am J Roentgenol. 151 (2), 231-237 (1988).
- Williams, S., Heemskerk, A., Welch, E., Damon, B., Park, J. The quantitative effects of inclusion of fat on muscle diffusion tensor MRI measurements. J Magn Reson Imaging. 38 (5), 1292-1297 (2013).
- Hernando, D., et al. Removal of olefinic fat chemical shift artifact in diffusion MRI. Magn Reson Med. 65 (3), 692-701 (2011).
- Willcocks, R. J., et al. Longitudinal measurements of MRI-T2 in boys with Duchenne muscular dystrophy: effects of age and disease progression. Neuromuscul Disord. 24 (5), 393-401 (2014).
- Poon, C. S., Henkelman, R. M. Practical T2 quantitation for clinical applications. J Magn Reson Imaging. 2 (5), 541-553 (1992).
- Does, M. D., Gore, J. C. Complications of nonlinear echo time spacing for measurement of T2. NMR Biomed. 13 (1), 1-7 (2000).
- Poon, C. S., Henkelman, R. M. 180° refocusing pulses which are insensitive to static and radiofrequency field inhomogeneity. J Magn Reson. 99 (1), 45-55 (1992).
- Hollingsworth, K. G., de Sousa, P. L., Straub, V., Carlier, P. G. Towards harmonization of protocols for MRI outcome measures in skeletal muscle studies: consensus recommendations from two TREAT-NMD NMR workshops, 2 May 2010, Stockholm, Sweden, 1-2 October 2009, Paris, France. Neuromuscul Disord. 22, S54-S67 (2010).
- Underhill, H. R., Rostomily, R. C., Mikheev, A. M., Yuan, C., Yarnykh, V. L. Fast bound pool fraction imaging of the in vivo rat brain: Association with myelin content and validation in the C6 glioma model. Neuroimage. 54 (3), 2052-2065 (2011).
- Smith, S. A., et al. Quantitative magnetization transfer characteristics of the human cervical spinal cord in vivo: application to adrenomyeloneuropathy. Magn Reson Med. 61 (1), 22-27 (2009).
- Li, K. D. R., Dortch, R. D., Gochberg, D. F., Smith, S. A., Damon, B. M., Park, J. H. Quantitative magnetization transfer with fat component in human muscles. Proc. 20th Ann Meeting ISMRM. , (2012).
- Damon, B. M. Effects of image noise in muscle diffusion tensor (DT)-MRI assessed using numerical simulations. Magn Reson Med. 60 (4), 934-944 (2008).
- Damon, B. M., Buck, A. K. W., Ding, Z. Diffusion-tensor MRI-based skeletal muscle fiber tracking. Imaging Med. 3 (6), 675-687 (2011).
- Froeling, M., Nederveen, A. J., Nicolay, K., Strijkers, G. J. DTI of human skeletal muscle: the effects of diffusion encoding parameters, signal-to-noise ratio and T2 on tensor indices and fiber tracts. NMR in Biomedicine. 26 (11), 1339-1352 (2013).
- Basser, P. J., Pajevic, S. Statistical artifacts in diffusion tensor MRI (DT-MRI) caused by background noise. Magn Reson Med. 44 (1), 41-50 (2000).
- Anderson, A. W. Theoretical analysis of the effects of noise on diffusion tensor imaging. Magn Reson Med. 46 (6), 1174-1188 (2001).
- Saupe, N., White, L. M., Stainsby, J., Tomlinson, G., Sussman, M. S. Diffusion tensor imaging and fiber tractography of skeletal muscle: optimization of B value for imaging at 1.5 T. AJR Am J Roentgenol. 192 (6), W282-W290 (2009).
- Levin, D. I., Gilles, B., Madler, B., Pai, D. K. Extracting skeletal muscle fiber fields from noisy diffusion tensor data. Med Image Anal. 15 (3), 340-353 (2011).
- Sinha, U., Sinha, S., Hodgson, J. A., Edgerton, R. V. Human soleus muscle architecture at different ankle joint angles from magnetic resonance diffusion tensor imaging. J Appl Physiol. 110 (3), 807-819 (2011).
- Jones, D. K., Cercignani, M. Twenty-five pitfalls in the analysis of diffusion MRI data. NMR Biomed. 23 (7), 803-820 (2010).
- Hamilton, G., et al. In vivo characterization of the liver fat 1H MR spectrum. NMR Biomed. 24 (7), 784-790 (2011).
- Hernando, D., Kellman, P., Haldar, J. P., Liang, Z. P. Robust water/fat separation in the presence of large field inhomogeneities using a graph cut algorithm. Magn Reson Med. 63 (1), 79-90 (2010).
- Hernando, D., Hines, C. D., Yu, H., Reeder, S. B. Addressing phase errors in fat-water imaging using a mixed magnitude/complex fitting method. Magn Reson Med. 67 (3), 638-644 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유