A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
דימות תהודה מגנטית כמותי של מחלת שריר שלד
In This Article
Summary
מחלות Neuromuscular לעתים קרובות מפגינה שונה ובזמן, פתולוגיה הטרוגנית, ורב-פן מרחבית. מטרת פרוטוקול זה היא לאפיין הפתולוגיה הזאת בשיטות הדמיה בתהודה מגנטית לא פולשנית.
Abstract
Quantitative magnetic resonance imaging (qMRI) describes the development and use of MRI to quantify physical, chemical, and/or biological properties of living systems. Neuromuscular diseases often exhibit a temporally varying, spatially heterogeneous, and multi-faceted pathology. The goal of this protocol is to characterize this pathology using qMRI methods. The MRI acquisition protocol begins with localizer images (used to locate the position of the body and tissue of interest within the MRI system), quality control measurements of relevant magnetic field distributions, and structural imaging for general anatomical characterization. The qMRI portion of the protocol includes measurements of the longitudinal and transverse relaxation time constants (T1 and T2, respectively). Also acquired are diffusion-tensor MRI data, in which water diffusivity is measured and used to infer pathological processes such as edema. Quantitative magnetization transfer imaging is used to characterize the relative tissue content of macromolecular and free water protons. Lastly, fat-water MRI methods are used to characterize fibro-adipose tissue replacement of muscle. In addition to describing the data acquisition and analysis procedures, this paper also discusses the potential problems associated with these methods, the analysis and interpretation of the data, MRI safety, and strategies for artifact reduction and protocol optimization.
Introduction
הדמיה בתהודה מגנטית כמוני (qMRI) מתארת את הפיתוח ושימוש MRI לכמת פיסיקלי, כימי ו / או תכונות ביולוגיות של מערכות חיות. QMRI דורש כי אחד לאמץ מודל biophysical עבור המערכת, המורכבת של רקמת עניין רצף הדופק MRI. רצף הדופק נועד לרגש את עוצמת האות 'התמונות לפרמטר של עניין במודל. תכונות אות MRI (גודל אות, תדירות, ו / או שלב) נמדדות ונותחו על פי המודל. המטרה היא לייצר אומדן משוחד, כמותי של פרמטר פיזי או ביולוגי שיש מופץ באופן רציף, ביחידות פיסיות מדידה. לעתים קרובות את המשוואות המתארות את מערכת מנותחים ותאים על בסיס פיקסל אחר פיקסל, ייצור דימוי שערכיה פיקסל ישירות לשקף את הערכים של המשתנה. כזה דימוי מכונה כמפה פרמטרית.
שימוש נפוץ של qMRI הוא דevelopment ויישום של סמנים ביולוגיים. ניתן להשתמש סמנים לחקור מנגנון המחלה, לקבוע אבחנה, לקבוע פרוגנוזה, ו / או להעריך תגובה תרפויטית. הם עשויים ללבוש צורה של ריכוזים או פעילויות של מולקולות אנדוגני או אקסוגני, שדוגמא היסטולוגית, גודל פיזיקלי, או דימוי פנימי. כמה דרישות כלליות של סמנים ביולוגיים הן כי הם אובייקטיביים למדוד משתנים מופצים באופן רציף באמצעות יחידות פיסיות של מדידה; יש מערכת יחסים הבין ברור, גם עם הפתולוגיה של עניין; רגישים שיפור והחמרה של מדינה קלינית; וניתן למדוד בקפדנות ובדייקנות מתאימות. סמנים ביולוגיים לא פולשני או זעיר-פולשנית במיוחד רצויים, כפי שהם מקדמים נוחות מטופל מינימאלי להפריע הפתולוגיה של עניין.
מטרה לפיתוח ביומרקרים מבוסס תמונה עבור מחלת שריר היא לשקף מחלת שריר בדרכים שהן complementary כדי, ספציפית יותר, יותר מרחבית סלקטיבית יותר, ו / או פולשני פחות גישות קיימות. יתרון מסוים אחד qMRI בהקשר זה הוא כי יש לו את הפוטנציאל לשלב סוגים שונים של מידע ובכך לסכן לאפיין היבטים רבים של תהליך המחלה. יכולת זו חשובה מאוד מחלות שרירים, אשר לעתים קרובות מפגינים פתולוגיה משתנה, מורכבת מרחבית הכוללת דלקת, נמק ו / או ניוון עם החלפת שומן, סיסטיק, שיבוש של הסריג myofilament ( "הזרמת-דיסק Z"), ונזק הממברנה . יתרון נוסף של שיטות qMRI הוא שתיאורים איכותיים או חצי כמותית של תמונות MR מבוסס בניגוד המשקפים לא רק פתולוגיה, אלא גם הבדלים בפרמטרי רכישת תמונה, חומרה, לתפיסה אנושית. דוגמא הנושא האחרון זה הודגמה על ידי Wokke et al., שהראה כי ערכות וכמותיות של חדירת שומן הם משתנים מאוד לעתים קרובות שגויים, wתרנגולת לעומת MRI שומן / מים כמותית (FWMRI) 1.
הפרוטוקול מתואר כאן כולל רצפים הדופק למדידת האורך (T 1) ו רוחבי (T 2) קבועה זמן הרפיה, העברת המגנטיזציה כמותית (qMT) פרמטרים, מקדמי דיפוזיה מים באמצעות מותח דיפוזי MRI (DT-MRI), ומבנה שריר באמצעות תמונות מבניות FWMRI. T 1 נמדד באמצעות רצף התאוששות היפוך, שבו וקטור המגנטיזציה נטו הוא הפוך הגודל שלה ידגם כמערכת חוזרת לשיווי משקל. T 2 נמדד להפנות את עיקר המגנטיזציה רוחבי שוב ושוב באמצעות רכבת של פולסים להפנות את עיקר, כגון שיטת קאר-פרסל Meiboom-הגיל (CPMG), ולדגום את הספין-ההדים שהתקבלו. T 1 ו- T 2 נתונים ניתן לנתח באמצעות שיטות שאינן ליניארי הולם עקומות כי גם להניח מספר exponeרכיבים ntial אפריורי (בדרך כלל בין שנה עד שלוש) או באמצעות גישה ההופכי ליניארי אשר מתאים לנתונים נצפים לסכום של מספר רב של exponentials מתפורר, וכתוצאה מכך הספקטרום של אמפליטודות האות. גישה זו מחייבת מרובע לפחות לא שלילי (NNLS) פתרון 3, ובדרך כלל כוללת הסדרה נוספת כדי להפיק תוצאות יציבות. T 1 ו- T 2 מדידות היה בשימוש נרחב כדי לחקור מחלות שרירים ופגיעה 4-9. ערכי T 1 בדרך כלל ירד באזורים-הסתנן שומן של שרירים מוגברים באזורים מודלקים 4-6; ערכי T 2 מרוממים בשני אזורי השומן הסתנן ודלק 10.
QMT-MRI המאפיינת את ברכות פרוטון macromolecular מים מוצקים דמויים חינם ברקמות ידי אומדן היחס של macromolecular לפרוטוני מים חופשיים (יחס גודל ברכה, PSR); המהותי להירגעשיעורי ation של בריכות אלה; ואת שערי החליפין ביניהם. גישות qMT נפוצות כוללות רוויה פעמה 11 ושיטות 12,13 התאוששות היפוך סלקטיבית. הפרוטוקול הבא מתאר שימוש בגישה הרוויה פעמה, המנצל את linewidth הרחב של אות פרוטון macromolecular, ביחס linewidth הצר של אות פרוטון מים. על ידי להרוות את אות macromolecular בתדרי תהודה שונים מספיק מן אות המים, אות המים מצטמצמת כתוצאת העברת המגנטיזציה בין ברכות פרוטון מים המוצקות וחופשיות. הנתונים מנותחים באמצעות מודל ביו-כמותי. QMT פותח ויישומים בשרירים בריאים 14,15, ו מופשט אחרון הופיע מתאר יישומה מחלת שריר 16. QMT נעשה שימוש כדי ללמוד את המודלים שונים של בעלי חיים קטנים של דלקת שרירים, שבה הוכח כי דלקת מקטינה את PSR 17. הואיל MTמשקף הוא תוכן macromolecular ומים, נתוני MT עשויים גם לשקף סיסטיק 18,19.
DT-MRI משמש לכמת את ההתנהגות דיפוזיה אניסוטרופי של מולקולות המים ברקמות עם הורה, תאים מאורכים. ב DT-MRI, דיפוזיה מים נמדדת שישה או יותר לכיוונים שונים; אותות אלה מצוידים אז למודל מותח 20. טנזור הדיפוזיה, D, הוא diagonalized להשיג שלושה ערכים עצמיים (שהן השלושה diffusivities קרן) ושלושה עצמיים (המצביעים על כיווני בהתאמה לשלושה מקדמי דיפוזיה). מדדים כמותיים אחרים אלו נבעו D לספק מידע על מבנה רקמת והתמצאות ברמה מיקרוסקופית. המאפיינים דיפוזיה של שריר, במיוחד הערך העצמי השלישי של D ומידת אנאיזוטרופיה דיפוזיה, משקפים דלקת שרירים 17 וניזק לשרירים עקב פציעה ניסיון 2 1, פציעת זן 22, ומחלות 23,24. השפעות פוטנציאליות נוספות על המאפיינים דיפוזיה של שריר כוללות שינויים בקוטר תא 25 ושינויים חדירים הממברנה.
לבסוף, ניוון שרירים, בלי או בלי חדיר שומן מקרוסקופית, הוא מרכיב פתולוגי של מחלות שרירים רבות. ניוון שרירים יכול להיות מוערך על ידי שימוש בדימויים מבניים למדוד שריר חתך באזור או נפח FW-MRI כדי להעריך חדירת שומן. חדיר שומן ניתן לתאר באופן איכותי ב T 1 - ו- T 2 משוקלל תמונות 26, אבל אותות שומן ומים נמדדים בצורה הטובה ביותר על ידי יצירת תמונות המנצלות את תדרי תהודה השונים של פרוטוני שומן ומי 27-29. שיטות הדמיה שומן / מים כמותי יושמו מחלות שריר כגון ניוון שרירים 1,30,31, והוא יכול לחזות את אובדן ambulation בחולים אלו 31.
class = "jove_content"> פרוטוקול qMRI המתואר כאן משתמש בכל המדידות הללו לאפיין מצב שריר Dermatomyositis myopathies הדלקתי אוטואימוניות (DM) פולימיוזיטיס (PM). פרטים נוספים על הפרוטוקול, כולל השחזור שלה, פורסמו 32 בעבר. הפרוטוקול כולל רצפים דופקים סטנדרטיים כמו גם גל רדיו (RF) וחפץ שיפוע שדה מגנטי מתוכנים במיוחד על המערכות שלנו. המחברים צופים כי הפרוטוקול ישים גם בהפרעות תוקפת אחרות המאופיינות ניוון שרירים, דלקת, וחדירת שומן (כגון בניוון השרירים).
Protocol
הערה: הקורא הוא הזכיר כי כל המחקר המעורב בבני אדם חייב להיות מאושר על ידי דירקטוריון הסקירה המוסדי המקומי (IRB) עבור השימוש בבני אדם במחקר. משתתפי מחקר חייבים להיות מודעים לצורך, נהלים, סיכונים, ואת היתרונות של המחקר המוצע; הזמינות של טיפולים או הליכים חלופיים; הזמינות של תגמול; ושל זכויותיהם לפרטיות לסגת הסכימו ולחדול השתתפותם. לפני הפגישה בדיקות MRI, חוקר חייב להציג משתתף במחקר פוטנציאל עם מסמך הסכמה מדעת שאושר IRB (ICD), להסביר את תוכנו, ולשאול למשתתף הניסוי פוטנציאל אם הוא / היא רוצה להשתתף במחקר. אם כן, המשתתף יצטרך לחתום ותאריך ICD לפני השלמת כל אחד מהשלבים של הפרוטוקול כאן.
1. פעולות לפני היום של בדיקה
- הגבל הרגלי חיים כי יכול "לעזאזל עם Dאתא
- הדרך את המשתתף לא לבצע פעילות גופנית מתונה או כבדה במהלך 48 השעות לפני הבדיקה. הדריכו את המשתתף להתנזר תרופות Over-the-counter וצריכת אלכוהול במהלך 24 שעות לפני הבדיקה. הדריכו את המשתתף להימנע מצריכת אלכוהול טבק או צריכת קפאין במהלך 6 שעות לפני הבדיקה.
- לפני בדיקות, לאשר כי המשתתף כבר תואם עם ההוראות האלה.
- הכן את מערכת MRI
- להבטיח את הזמינות של כל הציוד הדרוש, כמפורט בטבלה של חומרים וציוד.
- להגדיר פרוטוקול MRI; פרמטרים הציעו נמצאים בלוחות 1 - 5.
2. יום של בדיקה: היכונו קליטת נתונים MRI
- הקרנת בטיחות ההתנהגות
- מסך עבור סכנות פוטנציאליות בסביבה MRI על ידי בעל-t בטיחות MRIגשם עובד בריאות להציג למשתתף הניסוי עם טופס בטיחות MRI מתאים, כגון כי למצוא בכתובת www.mrisafety.com.
- אם יש חפצים מגנטיים מושתלים או מגנטי רגישים, להבטיח כי הם בטוחים עבור סריקת MRI.
- הכן את מערכת MRI
- ודא שכל אנשי הסרה כל האובייקטים המגנטיים מגנטי רגישים לפני שנכנסתי לחדר שבו שוכן במערכת MRI. התנהגות סימון זו בכל פעם שמישהו נכנס לחדר MRI.
- הכן את מערכת MRI על ידי נחת הסליל לקבל על המיטה החולה של מערכת MRI. כמו כן, למקם מזרן עם סדין כרית עם ציפית על המיטה. יש רצועות זמינות למקם סביב ירך מחזקים או כריות למקם מתחת לברכיים.
- הפעל את ממשק התוכנה, להזין נתונים חולים, ולפתוח את פרוטוקול ההדמיה.
- מקם את המשתתף מחקר על לוח סורק MRI
- שים למשתתף הניסוי כפי שהוא / היא בודקת שלו / אישיותה ובגדים עבור אובייקטים רגישים מגנטי. Secure האובייקטים האלה מחוץ לחדר MRI במיכל לנעילה. הזן את החדר MRI עם המשתתף במחקר מיד לאחר השלמת שלב זה.
- מקם את המשתתף על המיטה החולה במצב שכיבה, רגליים ואחת. מניח את חלק הגוף להיות צלם כמו קרוב לקו האמצע של הטבלה כפי מעשי. מחזק מקום או כריות מתחת לברכיים כדי לספק הקלת זן לגב התחתון ומניח כרית מתחת לראש. כדי להגביל תנועה, בעדינות אך ביעילות להבטיח את הירך, הרגל, והרגליים ולהבטיח כי המשתתף הוא נוח.
- מניחים את סליל מקלט RF סביב הירכיים של המשתתף ולחבר אותו למערכת MRI.
- הדריכו את המשתתף ולהשלים סופי שלבים טרום בדיקה
- לתת הוראות על איך לתקשר עם החוקרים. ספק את participant עם שמיעת הגנת מכשיר איתות כי ניתן להשתמש כדי לקרוא על תשומה במידת הצורך. הדרך את המשתתף על הצורך להישאר עדיין במהלך ובין כל רצפי ההדמיה.
- לקדם את המיטה החולה לתוך סורק ה- MRI כזה שחלק הגוף להיות צלם מיושר למרכז סורק ה- MRI.
- לאחר היציאה לחדר MRI, מאשר כי מערכת תקשורת המטופל פועלת ותראה כי המשתתף הוא נוח. לאורך כל הפרוטוקול, לתקשר באופן קבוע עם המשתתף כדי להבטיח הנוחות והתאימות שלו / שלה עם הוראות.
יום 3. בדיקה: רוכש את נתוני MRI
- פעולות הכנה
- כאשר מערכת MRI קובע את הגדרות אינסטרומנטלי וכיולים לפני כל רצף הדמיה (תדר מרכזי, כיול רווח מקלט, וכו '), לפקח תהליכים אלה ולהבטיח שכל צעד מתבצע correctly.
- באמצעות ממשק תוכנה מתאימה, לרכוש סט של תמונות מְאַתֵר (הידוע גם בשם טייס או תמונות הסקאוט); באמצעות פרמטרים הציעו המוצגים בלוח 2.
- לקבוע היכן למקם את הפרוסה מרכז לרכישות נתונים qMRI, על ידי זיהוי תחומים של נזק ו / או על ידי הפניה יחסית בעמדה הפרוסה ציוני דרך אנטומיים לשחזור.
- שידור וקליט שלבי כיול קויל
- לקבלת שלבים אלה, כמו גם כל שלבי ההדמיה הבאים, להגדיר אזור של האנטומיה שבו כדי לייעל את ההומוגניות של השדה המגנטי סטטי (B 0), תהליך המכונה "shimming". ראה איור 1A עבור המיקום הטיפוסי של נפח shimming של עניין (VOI) ששמש מחקרים הנוכחיים.
- אם סורק ה- MRI יש סליל שידור רב אלמנט, לרכוש בסיס נתוני כיול RF.
- אם סורק ה- MRI יש אלמנט רב מקבלים סליל, לרכושמפת רגישות המרחבית של הסלילים.
- רוכשת מבנית MRI נתונים
- רוכש ברזולוציה גבוהה, פרוסה רבה, T 1 משוקלל תמונות באמצעות ספין הד מהיר (FSE) רצף; פרמטרי ההדמיה המשמשים במחקרים הנוכחיים ניתן בטבלת 1.
- רוכש ברזולוציה גבוהה, פרוסה רבה, T 2 משוקללת תמונות באמצעות רצף FSE; פרמטרי ההדמיה המשמשים במחקרים הנוכחיים ניתן בטבלה 2.
- רוכש את הנתונים עבור בקרת איכות בזמן אמת תיקונים לאחר עיבוד ביצוע
- רוכש את נתוני מספר תלת ממדי (3D) הד שיפוע לחישוב מפות שדה B 0. פרמטרי ההדמיה המשמשים במחקרים הנוכחיים ניתן בטבלה 3.
- בדוק את המפות בתחום על מנת להבטיח כי אין סטיות של יותר מ ± 60 הרץ (כ 0.5חלקים למיליון 3 טסלה) על פני התמונה. אם יש, לאמץ גישה חלופית shimming (שיטה אחרת, מיקום שונה של VOI, וכו.).
- רוכש את נתוני 3D לחישוב מפות זווית nutation. פרמטרי ההדמיה המשמשים במחקרים הנוכחיים ניתן בטבלה 2.
- בדוק את המפות בתחום על מנת להבטיח כי אין אזורים החורגים באופן מוגזם מזווית nutation הנומינלית. עבור פולסים RF המשמשים פרוטוקול זה, סטיות גדולות מ ± 30% של זווית nutation הנומינלית נחשבות מוגזמות.
- רוכש את נתוני qMRI
- לרכוש תמונות 3D עבור חישוב של T 1, באמצעות רצף התאוששות היפוך. פרמטרי ההדמיה המשמשים במחקרים הנוכחיים מוצגים בטבלה 3.
- חזור על מדידת T 1 בנוכחות דיכוי אות שומן (FS; פרמטר זה הוא abbreviaטד T 1, FS).
- לרכוש תמונות חד פרוסות חישוב T 2, תוך שימוש ברצף ספין הד מרובה. השתמש פרמטרי ההדמיה המוצגים בלוח 3.
- חזור על המדידה T 2 בנוכחות FS (T 2, FS).
- לרכוש תמונות 3D עבור חישוב פרמטרי qMT, תוך שימוש ברצף רווי פעם עם FS ואת פרמטרי ההדמיה נתונים בטבלה 4.
- רוכש את נתונים רבים-פרוס לחישוב פרמטרים דיפוזיה-מותחים, באמצעות סדרה של תמונות משוקללות דיפוזיה. פרמטרי הדמית שימוש במחקרים אלה מובאים בטבלה 4.
- רוכש את נתוני 3D עבור חישוב של תמונות שמנות / מים, באמצעות סדרה של שש תמונות-הד שיפוע. פרמטרי הדמית שימוש במחקרים אלה מוצגים בטבלה 5.
- לאחר השלמת פרוטוקול qMRI
- להבטיח שתמונות כל הם באיכות מתאימה על ידי בחינת אותם חפצים לתיקון בפוטנציה על ידי מדידת יחס אות לרעש מספיק.
- עבור כל נתוני qMRI, להגדיר מספר אזורים של עניין (ROIs) בסדרת התמונה ולבחון את האות כפונקציה של הפרמטר הרלוונטי (למשל, עבור הנתונים התלויים T 1 רכשו בצעדים 3.5.1 ו 3.5.2, עלילת האות כפונקציה של TI ולהבטיח כי הנתונים בצעו את פונקציית השחזור-היפוך המפורטים להלן בשלב 4.1.2).
- לאחר השלים הקרנה אישית עבור אובייקטים רגישים מגנטי, להיכנס לחדר MRI. הסר את המשתתף מן המגנט, להסיר את כל הרצועות ומרווחות, ולסייע משתתף יציאת סורק ה- MRI וחדר MRI.
- מעביר את הנתונים, תוך שימוש בשיטות תואמות עם חוקי פרטיות בריאות מקומיים, לתחנת עבודה מקומית לעיבוד; הנתונים עשויים להיות מיוצא כמו תקשורת ההדמיה הדיגיטלית ברפואה (DICOM) קבצים או הספקפורמט קנייני s '(שיטת שימוש בפרוטוקול זה).
4. ניתוח נתוני qMRI
- חשב את פרמטרית מפות
- השתמש בתכנית מחשב מיועדת מחשוב מדעי וניתוח תמונה. על ידי בחינת היסטוגרמה של עוצמות האות בתמונה, יוצרי מסכת תמונת אות מבוסס סף תוחמת תחומי אות מאזורים של רעש. השלם את השלבים הבאים עבור כל פיקסל בחלקי האות של התמונות.
- נתח את T 1 נתונים על ידי מדידת S עוצמת האות עבור כל פעם היפוך (TI). לאחר מכן, להתאים את הערכים עבור S אל-התאוששות היפוך עם מודל מראש עיכוב מופחת:
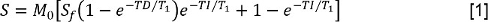
כאשר M 0 הוא עוצמת אות המייצגת את המגנטיזציה על מדינת שיווי המשקל, ו S הוא יחס ההיפוך,ו- TD הפעם מראש דיחוי. לאחר מכן, להתאים את הנתונים עם FS לאותו מודל, המאפשר קביעת זמן רגיעה האורך מתמיד עם FS, T 1, FS. - נתח את T 2 נתונים על ידי מדידת S בכל TE. לאחר מכן, להתאים את הנתונים למודל ריקבון מונה מעריכית:

כאשר N הוא האות לקזז בתחילת המחקר. הקורא יכול גם להחליט על מנת להתאים לנתונים למודל רב-מעריכים, כגון כי להלן:
שם J הוא מספר רכיבי מעריכי F ו- T 2, j הם חלק האות וערכי T 2 הקשורים j ה רכיב. או, הקורא עשוי להשתמש ריבועים פחותים שאינם שליליים (NNLS) שיטה 3. ב lבמקרה atter, הרפית הניתוח הרבה-מעריכים (Mera) ארגז הכלים 33 זמין באופן חופשי; תוכניות אחרות זמינות מדי. חזור על ניתוחים אלו עבור נתונים עם ובלי FS. - כדי לנתח את הנתונים qMT, למדוד S עבור כל כוח הקרנה ותדירות לקזז. תקן את סמכויות הקרנה הנומינליות (המיוצגים על ידי ω 1 במשוואה להלן) באמצעות מפות זווית nutation. תקן את קיזוז תדר (Δ f במשוואה להלן) על ידי שימוש ב 0 מפות להתאים את התדרים לקזז מיושם. לאחר מכן, להתאים את הנתונים למודל הבא 34,35
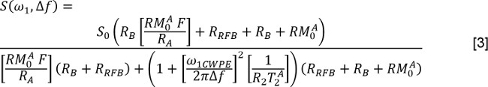
היכן הוא שער החליפין ממאגר macromolecular לבריכת מים בחינם, הוא שיעור הרפיה האורך של בריכת מים בחינם, הוא שיעור הרפיה האורך של הבריכה macromolecular (ההנחה היא להיות 1 s -1), הוא PSR, היא ה- T 2 של ברכת מים בחינם, ω 1CWPE ההספק הממוצע של הדופק הרווי. שיעור הרוויה של המגנטיזציה האורך של הבריכה macromolecular, מתואר על ידי דוגמנית העל-לורנץ, כמתואר בעבודה ידי Henkelman ועמיתיו 34,35. - כדי לנתח את נתוני DTI, השתמש תחילה אלגוריתם שינוי מאוחד 36 לרשום כל תמונת דיפוזיה משוקללת לדימוי המשוקלל הלא דיפוזיה המקביל. לאחר מכן, עבור כל פיקסל, למדוד את ערכי S בתמונה המשוקללת הלא דיפוזיה לכל כיוון דיפוזיה משוקלל. לטופס מטריקס מורכב כיווני קידוד דיפוזיה. שימוש רב-משתנה, רגרסיה לפחות ריבועים משוקללים, לסגת נתוני האות על D מטריקס טופס קידוד דיפוזיה. Diagonalize D ולבצע מיון בסולם ריכטר של ערכים עצמיים ווקטורים עצמיים שלהם. ואז לחשב את diffusivity אומר (MD) כמו:

שם λ 1, λ 2, ו λ 3 הם הערכים העצמיים של טנזור הדיפוזיה. גם לחשב את אנאיזוטרופיה השבר (FA) כמו:
- לנתח את נתוני FWMRI באמצעות גישה כמותית שמפרידה אותות מים ושומן מבוססים במשמרת כימית (כגון אלגוריתם FattyRiot, זמינה להורדה בחינם מ https://github.com/welcheb/FattyRiot).
- להגדיר אזורים של ריבית עבור ניתוח
- ציין ROIs על התמונות אנטומיים (על ידי הגדרת גבולות כל שריר עניין). דוגמה לכך היא שמוצג באיור 1.
- שינוי גודל ROIs כדי להתאים את גודל המטריצה של תמונות qMRI. בהתאם לצורך, התאם את היישור של ROIs כדי להתאים את מפת qMRI (למשל, אם המשתתף עברבין רכישות, תרגום של עמדת ROI ייתכן שיידרש כדי להימנע חופף את גבולות שריר).
- לבחון כל ROI. במידת צורך, לוודא ששום פיקסלים כלולים המכילים חפצי נפח חלקית, רקמות שאינן התכווצות, וממצאי זרימה; אנא ראה איור 1 עבור דוגמאות.
- לחשב את הממוצע ואת סטיית תקן של ערכי qMRI בכל פיקסלים בתוך ROIs הנבחר.
תוצאות
איור 1 מציג תמונות אנטומי ציריות נציג שנרכשו אמצע הירכיים של חולה עם פולימיוזיטיס. מוצג גם הוא המיקום של הקרנת המטוס של נפח שים. מפות פרמטר נציג לכל שיטת qMRI, כל המתקבל חולה אותו, ניתנות מתוך איורים 2 - 7.
Discussion
מחלות שרירים כגון בניוון השרירים ו myopathies הדלקתית אידיופטית מהוות קבוצה של מחלות שאינן הטרוגני האטיולוגיה, כישויות בודדות, נדירים בהיארעות שלהם. לדוגמה, ניוון שרירים דושן - הצורה הנפוצה ביותר של ניוון שרירים - יש שכיחות של 1 ב -3,500 לידות של זכרים חיים 37,38; פרוטוקול ...
Disclosures
None of the authors has a financial conflict of interest to report.
Acknowledgements
We acknowledge grant support from the National Institutes of Health: NIH/NIAMS R01 AR050101 (BMD), NIH/NIAMS R01 AR057091 (BMD/JHP), NIH/NIBEB K25 EB013659 (RDD), and the Vanderbilt CTSA award RR024975. We also thank the reviewers for the comments and the subject for participating in these studies.
Materials
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| 3T human MRI system | Philips Medical Systems (Best, the Netherlands) | Achieva/Intera | |
| Cardiac phased array receive coil | Philips Medical Systems | ||
| Pillows, straps, bolsters, and other positioning devices | |||
| Computer with MATLAB software | The Mathworks, Inc (Natick, MA) | r. 2014 |
References
- Wokke, B. H., et al. Comparison of Dixon and T1-weighted MR methods to assess the degree of fat infiltration in duchenne muscular dystrophy patients. J Magn Reson Imaging. 38 (3), 619-624 (2013).
- Carr, H., Purcell, E. Effects of diffusion on free precession in NMR experiments. Phys Rev. 94, 630-638 (1954).
- Whittall, K. P., MacKay, A. L. Quantitative interpretation of NMR relaxation data. Journal of Magnetic Resonance. 84 (1), 134-152 (1989).
- Park, J. H., et al. Dermatomyositis: correlative MR imaging and P-31 MR spectroscopy for quantitative characterization of inflammatory disease. Radiology. 177 (2), 473-479 (1990).
- Park, J. H., et al. Magnetic resonance imaging and p-31 magnetic resonance spectroscopy provide unique quantitative data useful in the longitudinal management of patients with dermatomyositis. Arthritis & Rheumatism. 37 (5), 736-746 (1994).
- Park, J. H., et al. Use of magnetic resonance imaging and p-31 magnetic resonance spectroscopy to detect and quantify muscle dysfunction in the amyopathic and myopathic variants of dermatomyositis. Arthritis & Rheumatism. 38 (1), 68-77 (1995).
- Huang, Y., et al. Quantitative MR relaxometry study of muscle composition and function in Duchenne muscular dystrophy. J Magn Reson Imaging. 4 (1), 59-64 (1994).
- Kim, H. K., et al. T2 mapping in Duchenne muscular dystrophy: distribution of disease activity and correlation with clinical assessments. Radiology. 255 (3), 899-908 (2010).
- Arpan, I., et al. T2 mapping provides multiple approaches for the characterization of muscle involvement in neuromuscular diseases: a cross-sectional study of lower leg muscles in 5-15-year-old boys with Duchenne muscular dystrophy. NMR in Biomedicine. 26 (3), 320-328 (2013).
- Fan, R. H., Does, M. D. Compartmental relaxation and diffusion tensor imaging measurements in vivo in λ-carrageenan-induced edema in rat skeletal muscle. NMR in Biomedicine. 21 (6), 566-573 (2008).
- Sled, J. G., Pike, G. B. Quantitative interpretation of magnetization transfer in spoiled gradient echo MRI sequences. J Magn Reson. 145 (1), 24-36 (2000).
- Gochberg, D. F., Gore, J. C. Quantitative magnetization transfer imaging via selective inversion recovery with short repetition times. Magn Reson Med. 57 (2), 437-441 (2007).
- Li, K., et al. Optimized inversion recovery sequences for quantitative T1 and magnetization transfer imaging. Magn Reson Med. 64 (2), 491-500 (2010).
- Louie, E. A., Gochberg, D. F., Does, M. D., Damon, B. M. Magnetization transfer and T2 measurements of isolated muscle: effect of pH. Magn Reson Med. 61 (3), 560-569 (2009).
- Sinclair, C. D. J., et al. Quantitative magnetization transfer in in vivo healthy human skeletal muscle at 3 T. Magn Reson Med. 64 (6), 1739-1748 (2010).
- Sinclair, C., et al. Multi-parameter quantitation of coincident fat and water skeletal muscle pathology. Proc 21st Ann Meeting ISMRM. , (2013).
- Bryant, N., et al. Multi-parametric MRI characterization of inflammation in murine skeletal muscle. NMR Biomed. 27 (6), 716-725 (2014).
- Aisen, A. M., Doi, K., Swanson, S. D. Detection of liver fibrosis with magnetic cross-relaxation. Magn Reson Med. 31 (5), 551-556 (1994).
- Kim, H., et al. Induced hepatic fibrosis in rats: hepatic steatosis, macromolecule content, perfusion parameters, and their correlations-preliminary MR imaging in rats. Radiology. 247 (3), 696-705 (2008).
- Basser, P. J., Mattiello, J., LeBihan, D. MR diffusion tensor spectroscopy and imaging. Biophys J. 66 (1), 259-267 (1994).
- Heemskerk, A., Strijkers, G., Drost, M., van Bochove, G., Nicolay, K. Skeletal muscle degeneration and regeneration following femoral artery ligation in the mouse: diffusion tensor imaging monitoring. Radiology. 243 (2), 413-421 (2007).
- Zaraiskaya, T., Kumbhare, D., Noseworthy, M. D. Diffusion tensor imaging in evaluation of human skeletal muscle injury. J Magn Reson Imaging. 24 (2), 402-408 (2006).
- Qi, J., Olsen, N. J., Price, R. R., Winston, J. A., Park, J. H. Diffusion-weighted imaging of inflammatory myopathies: polymyositis and dermatomyositis. J Magn Reson Imaging. 27 (1), 212-217 (2008).
- McMillan, A. B., Shi, D., Pratt, S. J., Lovering, R. M. Diffusion tensor MRI to assess damage in healthy and dystrophic skeletal muscle after lengthening contractions. J Biomed Biotech. , (2011).
- Scheel, M., et al. Fiber type characterization in skeletal muscle by diffusion tensor imaging. NMR Biomed. 26 (10), 1220-1224 (2013).
- Kaufman, L. D., Gruber, B. L., Gerstman, D. P., Kaell, A. T. Preliminary observations on the role of magnetic resonance imaging for polymyositis and dermatomyositis. Annalsrheumatic Dis. 46 (8), 569-572 (1987).
- Dixon, W. T. Simple proton spectroscopic imaging. Radiology. 153 (1), 189-194 (1984).
- Glover, G. H. Multipoint Dixon technique for water and fat proton and susceptibility imaging. J Magn Reson Imaging. 1 (5), 521-530 (1991).
- Berglund, J., Kullberg, J. Three-dimensional water/fat separation and T2* estimation based on whole-image optimization--application in breathhold liver imaging at 1.5 T. Magn Reson Med. 67 (6), 1684-1693 (2012).
- Gloor, M., et al. Quantification of fat infiltration in oculopharyngeal muscular dystrophy: Comparison of three MR imaging methods. J Magn Reson Imaging. 33 (1), 203-210 (2011).
- Fischmann, A., et al. Quantitative MRI and loss of free ambulation in Duchenne muscular dystrophy. J Neurol. 260 (4), 969-974 (2013).
- Li, K., et al. Multi-parametric MRI characterization of healthy human thigh muscles at 3.0 T - relaxation, magnetization transfer, fat/water, and diffusion tensor imaging. NMR Biomed. 27 (9), 1070-1084 (2014).
- Morrison, C., Stanisz, G., Henkelman, R. M. Modeling magnetization transfer for biological-like systems using a semi-solid pool with a super-Lorentzian lineshape and dipolar reservoir. J Magn Reson Series B. 108 (2), 103-113 (1995).
- Li, J. G., Graham, S. J., Henkelman, R. M. A flexible magnetization transfer line shape derived from tissue experimental data. Magn Reson Med. 37 (6), 866-871 (1997).
- Mangin, J. F., Poupon, C., Clark, C., Le Bihan, D., Bloch, I. Distortion correction and robust tensor estimation for MR diffusion imaging. Med Image Anal. 6 (3), 191-198 (2002).
- Moser, H. Duchenne muscular dystrophy: pathogenetic aspects and genetic prevention. Hum Genet. 66 (1), 17-40 (1984).
- van Essen, A. J., Busch, H. F., te Meerman, G. J., ten Kate, L. P. Birth and population prevalence of Duchenne muscular dystrophy in The Netherlands. Hum Genet. 88 (3), 258-266 (1992).
- Bendewald, M. J., Wetter, D. A., Li, X., Davis, M. P. Incidence of dermatomyositis and clinically amyopathic dermatomyositis: A population-based study in olmsted county, minnesota. Arch Dermatol. 146 (1), 26-30 (2010).
- Carlier, P. G. Global T2 versus water T2 in NMR imaging of fatty infiltrated muscles: different methodology, different information and different implications. Neuromuscul Disord. 24 (5), 390-392 (2014).
- Foley, J. M., Jayaraman, R. C., Prior, B. M., Pivarnik, J. M., Meyer, R. A. MR measurements of muscle damage and adaptation after eccentric exercise. J Appl Physiol. 87 (6), 2311-2318 (1999).
- Garrood, P., et al. MR imaging in Duchenne muscular dystrophy: quantification of T1-weighted signal, contrast uptake, and the effects of exercise. J Magn Reson Imaging. 30 (5), 1130-1138 (2009).
- Bratton, C. B., Hopkins, A. L., Weinberg, J. W. Nuclear magnetic resonance studies of living muscle. Science. 147, 738-739 (1965).
- Fleckenstein, J. L., Canby, R. C., Parkey, R. W., Peshock, R. M. Acute effects of exercise on MR imaging of skeletal muscle in normal volunteers. AJR Am J Roentgenol. 151 (2), 231-237 (1988).
- Williams, S., Heemskerk, A., Welch, E., Damon, B., Park, J. The quantitative effects of inclusion of fat on muscle diffusion tensor MRI measurements. J Magn Reson Imaging. 38 (5), 1292-1297 (2013).
- Hernando, D., et al. Removal of olefinic fat chemical shift artifact in diffusion MRI. Magn Reson Med. 65 (3), 692-701 (2011).
- Willcocks, R. J., et al. Longitudinal measurements of MRI-T2 in boys with Duchenne muscular dystrophy: effects of age and disease progression. Neuromuscul Disord. 24 (5), 393-401 (2014).
- Poon, C. S., Henkelman, R. M. Practical T2 quantitation for clinical applications. J Magn Reson Imaging. 2 (5), 541-553 (1992).
- Does, M. D., Gore, J. C. Complications of nonlinear echo time spacing for measurement of T2. NMR Biomed. 13 (1), 1-7 (2000).
- Poon, C. S., Henkelman, R. M. 180° refocusing pulses which are insensitive to static and radiofrequency field inhomogeneity. J Magn Reson. 99 (1), 45-55 (1992).
- Hollingsworth, K. G., de Sousa, P. L., Straub, V., Carlier, P. G. Towards harmonization of protocols for MRI outcome measures in skeletal muscle studies: consensus recommendations from two TREAT-NMD NMR workshops, 2 May 2010, Stockholm, Sweden, 1-2 October 2009, Paris, France. Neuromuscul Disord. 22, S54-S67 (2010).
- Underhill, H. R., Rostomily, R. C., Mikheev, A. M., Yuan, C., Yarnykh, V. L. Fast bound pool fraction imaging of the in vivo rat brain: Association with myelin content and validation in the C6 glioma model. Neuroimage. 54 (3), 2052-2065 (2011).
- Smith, S. A., et al. Quantitative magnetization transfer characteristics of the human cervical spinal cord in vivo: application to adrenomyeloneuropathy. Magn Reson Med. 61 (1), 22-27 (2009).
- Li, K. D. R., Dortch, R. D., Gochberg, D. F., Smith, S. A., Damon, B. M., Park, J. H. Quantitative magnetization transfer with fat component in human muscles. Proc. 20th Ann Meeting ISMRM. , (2012).
- Damon, B. M. Effects of image noise in muscle diffusion tensor (DT)-MRI assessed using numerical simulations. Magn Reson Med. 60 (4), 934-944 (2008).
- Damon, B. M., Buck, A. K. W., Ding, Z. Diffusion-tensor MRI-based skeletal muscle fiber tracking. Imaging Med. 3 (6), 675-687 (2011).
- Froeling, M., Nederveen, A. J., Nicolay, K., Strijkers, G. J. DTI of human skeletal muscle: the effects of diffusion encoding parameters, signal-to-noise ratio and T2 on tensor indices and fiber tracts. NMR in Biomedicine. 26 (11), 1339-1352 (2013).
- Basser, P. J., Pajevic, S. Statistical artifacts in diffusion tensor MRI (DT-MRI) caused by background noise. Magn Reson Med. 44 (1), 41-50 (2000).
- Anderson, A. W. Theoretical analysis of the effects of noise on diffusion tensor imaging. Magn Reson Med. 46 (6), 1174-1188 (2001).
- Saupe, N., White, L. M., Stainsby, J., Tomlinson, G., Sussman, M. S. Diffusion tensor imaging and fiber tractography of skeletal muscle: optimization of B value for imaging at 1.5 T. AJR Am J Roentgenol. 192 (6), W282-W290 (2009).
- Levin, D. I., Gilles, B., Madler, B., Pai, D. K. Extracting skeletal muscle fiber fields from noisy diffusion tensor data. Med Image Anal. 15 (3), 340-353 (2011).
- Sinha, U., Sinha, S., Hodgson, J. A., Edgerton, R. V. Human soleus muscle architecture at different ankle joint angles from magnetic resonance diffusion tensor imaging. J Appl Physiol. 110 (3), 807-819 (2011).
- Jones, D. K., Cercignani, M. Twenty-five pitfalls in the analysis of diffusion MRI data. NMR Biomed. 23 (7), 803-820 (2010).
- Hamilton, G., et al. In vivo characterization of the liver fat 1H MR spectrum. NMR Biomed. 24 (7), 784-790 (2011).
- Hernando, D., Kellman, P., Haldar, J. P., Liang, Z. P. Robust water/fat separation in the presence of large field inhomogeneities using a graph cut algorithm. Magn Reson Med. 63 (1), 79-90 (2010).
- Hernando, D., Hines, C. D., Yu, H., Reeder, S. B. Addressing phase errors in fat-water imaging using a mixed magnitude/complex fitting method. Magn Reson Med. 67 (3), 638-644 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved