É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Quantitativa Ressonância Magnética da doença do músculo esquelético
Neste Artigo
Resumo
doenças neuromusculares geralmente exibem um temporalmente variando patologia, espacialmente heterogêneo e multifacetado. O objetivo deste protocolo é caracterizar esta patologia utilizando métodos de ressonância magnética não-invasivos.
Resumo
Quantitative magnetic resonance imaging (qMRI) describes the development and use of MRI to quantify physical, chemical, and/or biological properties of living systems. Neuromuscular diseases often exhibit a temporally varying, spatially heterogeneous, and multi-faceted pathology. The goal of this protocol is to characterize this pathology using qMRI methods. The MRI acquisition protocol begins with localizer images (used to locate the position of the body and tissue of interest within the MRI system), quality control measurements of relevant magnetic field distributions, and structural imaging for general anatomical characterization. The qMRI portion of the protocol includes measurements of the longitudinal and transverse relaxation time constants (T1 and T2, respectively). Also acquired are diffusion-tensor MRI data, in which water diffusivity is measured and used to infer pathological processes such as edema. Quantitative magnetization transfer imaging is used to characterize the relative tissue content of macromolecular and free water protons. Lastly, fat-water MRI methods are used to characterize fibro-adipose tissue replacement of muscle. In addition to describing the data acquisition and analysis procedures, this paper also discusses the potential problems associated with these methods, the analysis and interpretation of the data, MRI safety, and strategies for artifact reduction and protocol optimization.
Introdução
Quantitativa ressonância magnética (qMRI) descreve o desenvolvimento e uso de MRI para quantificar físicas, químicas e / ou propriedades biológicas dos sistemas vivos. QMRI requer que um adoptar um modelo biofísico para o sistema, composto por o tecido de interesse e uma sequência de impulsos de ressonância magnética. A seqüência de pulso é projetado para sensibilizar intensidades de sinal das imagens ao parâmetro de interesse no modelo. propriedades do sinal de ressonância magnética (magnitude do sinal, frequência e / ou fase) são medidos e analisados de acordo com o modelo. O objectivo é o de produzir uma estimativa imparcial, quantitativa de um parâmetro físico ou biológica tendo continuamente distribuídos unidades físicas, de medição. Muitas vezes, as equações que descrevem o sistema são analisados e montado numa base de pixel-a-pixel, produzir uma imagem de pixel cujos valores reflectem directamente os valores da variável. Tal imagem é referido como um mapa paramétrico.
Um uso comum do qMRI é o desenvolvimento e aplicação de biomarcadores. Os biomarcadores podem ser utilizados para investigar um mecanismo da doença, estabelecer um diagnóstico, determinar um prognóstico, e / ou avaliar uma resposta terapêutica. Eles podem tomar a forma das concentrações ou actividades das moléculas endógenas ou exógenas, uma amostra histológica, uma grandeza física, ou uma imagem interna. Alguns requisitos gerais de biomarcadores são de que eles medir objetivamente uma variável contínua distribuído utilizando unidades físicas de medida; ter uma relação clara e bem compreendido com a patologia de interesse; são sensíveis à melhoria e piora do estado clínico; e pode ser medido com exactidão e precisão adequada. biomarcadores não-invasivas ou minimamente invasivas são particularmente desejável, uma vez que promovem o conforto do paciente e minimamente perturbar a patologia de interesse.
A meta para o desenvolvimento de biomarcadores com base em imagens para a doença muscular é refletir doença muscular de maneiras que são complementary para, mais específico do que, espacialmente mais seletiva do que, e / ou menos invasiva do que as abordagens existentes. Uma vantagem particular da qMRI a este respeito é que ela tem o potencial para integrar vários tipos de informação e, portanto, potencialmente caracterizar muitos aspectos do processo da doença. Esta capacidade é muito importante em doenças musculares, que frequentemente apresentam uma patologia espacialmente variável, complexo que inclui inflamação, necrose e / ou atrofia com substituição de gordura, fibrose, perturbação da estrutura miofilamentos ( "streaming de Z-disco"), e os danos da membrana . Outra vantagem de métodos qMRI é que as descrições qualitativas ou semi-quantitativa de imagens de RM baseada em contraste refletem não apenas patologia, mas também diferenças nos parâmetros de aquisição de imagem, hardware e percepção humana. Um exemplo desta última edição foi demonstrada por Wokke et al., Que mostrou que as avaliações de semi-quantitativa da infiltração de gordura são altamente variáveis e freqüentemente incorretos, when comparação com MRI de gordura / água quantitativa (FWMRI) 1.
O protocolo aqui descrito inclui sequências de pulso para medir a longitudinal (T 1) e transversal (T 2) constantes de tempo de relaxamento, transferência de magnetização quantitativa (QMT) parâmetros, coeficientes de difusão de água através do tensor de difusão MRI (DT-MRI), e estrutura muscular usando imagens estruturais e FWMRI. T 1 é medida por meio de uma sequência de recuperação de inversão, em que o vector de magnetização do líquido é invertido e a sua magnitude é amostrado como o sistema de volta ao equilíbrio. T é medido por dois reorientar repetidamente magnetização transversal através de um trem de impulsos de reorientação, tais como o método de Carr-Purcell-Meiboom Gill (CPMG), e amostragem dos spin-eco resultantes. Dados T 1 e T 2, podem ser analisados utilizando métodos de ajuste de curvas não-lineares que assumem, quer um número de Exponecomponentes ntial a priori (tipicamente entre uma e três) ou usando uma abordagem inversa linear que se ajusta aos dados observados para a soma de um grande número de exponenciais em decomposição, resultando em um espectro de amplitudes do sinal. Esta abordagem requer uma solução quadrada não-negativa menos (NNLS) 3, e normalmente inclui regularização adicional para produzir resultados estáveis. T 1 e T 2 medições têm sido amplamente utilizado para estudar doenças e lesões musculares 4-9. Valores T 1 são tipicamente diminuída em regiões infiltrado com gordura de músculo e elevada em regiões inflamadas 4-6; Valores de T 2 são elevados em ambas as regiões se infiltrado em gordura e inflamados 10.
QMT-MRI caracteriza os água e sólido como piscinas de prótons macromoleculares livres em tecidos estimando a proporção de macromolecular de prótons de água livre (a proporção de tamanho da piscina, PSR); o relaxe intrínsecotaxas ation destas piscinas; e as taxas de câmbio entre eles. Abordagens QMT comuns incluem a saturação pulsada 11 e métodos seletivos 12,13 recuperação de inversão. O protocolo a seguir descreve a utilização da abordagem de saturação pulsado, que explora a ampla largura de linha do sinal de protão macromolecular, em relação à largura de linha estreita do sinal de protão da água. Ao saturar o sinal macromolecular a frequências de ressonância suficientemente diferente do sinal da água, o sinal de água é reduzido como um resultado de transferência de magnetização entre as piscinas dos protões da água e sólidos livres. Os dados são analisados utilizando um modelo biofísico quantitativa. QMT foi desenvolvida e aplicada nos músculos saudáveis 14,15 e um resumo recente apareceu descrevendo a sua aplicação em doenças músculo 16. QMT tem sido utilizada para estudar pequenos modelos animais de inflamação muscular, em que foi demonstrado que a inflamação diminui a PSR 17. Na medida em que MTreflete conteúdos tanto macromoleculares e de água, os dados MT pode também refletir fibrose 18,19.
DT-MRI é usado para quantificar o comportamento de difusão anisotrópica de moléculas de água nos tecidos com células ordenadas, alongadas. Em DT-MRI, a difusão de água é medido em seis ou mais direções diferentes; estes sinais são então ajustados a um modelo tensor 20. O tensor de difusão, D, é diagonalizado para se obter três valores próprios (que são as três principais difusividades) e três vectores eigen (que indicam as direcções correspondentes aos três coeficientes de difusão). Estes e outros índices quantitativos derivados de D fornecer informações sobre a estrutura do tecido e a orientação a um nível microscópico. As propriedades de difusão de músculo, especialmente o terceiro valor próprio de D e o grau de anisotropia de difusão, reflectir inflamação muscular 17 e dano muscular devido a lesão experimental 21, lesão por esforço 22 e doença 23,24. Outras influências potenciais sobre as propriedades de difusão de massa muscular incluem alterações no diâmetro da célula 25 e alterações da permeabilidade da membrana.
Por último, a atrofia muscular, sem gordura ou sem infiltração macroscópica, é um componente patológico de várias doenças musculares. A atrofia muscular pode ser avaliada através da utilização de imagens estruturais do músculo para medir a área de secção transversal ou volume e FW-MRI para avaliar a infiltração de gordura. Infiltração de gordura pode ser qualitativamente descrito no T 1 - e T 2 imagens ponderadas 26, mas sinais de gordura ea água sejam melhor medida pela formação de imagens que exploram as diferentes frequências de ressonância de gordura e água prótons 27-29. / Métodos de imagiologia água gordura quantitativos foram aplicados em doenças musculares tais como distrofia muscular 1,30,31, e pode prever a perda de deambulação em 31 destes pacientes.
O protocolo qMRI descrito aqui usa todas estas medições para caracterizar a condição muscular nas auto-imunes inflamatórias miopatias dermatomiosite (DM) e polimiosite (PM). Mais detalhes do protocolo, incluindo a sua reprodutibilidade, foram publicados anteriormente 32. O protocolo inclui sequências padrão de pulso, bem como de radiofrequência (RF) e objetos de gradiente de campo magnético especificamente programados em nossos sistemas. Os autores antecipar que o protocolo é também aplicável em outros distúrbios neuromusculares caracterizados por atrofia muscular, inflamação, e infiltração de gordura (tal como a distrofia muscular).Protocolo
NOTA: O leitor é lembrado de que toda pesquisa envolvendo seres humanos deve ser aprovado pelo Institutional Review Board local (IRB) para o uso de Seres Humanos em Pesquisa. Os participantes da pesquisa devem ser informados da finalidade, procedimentos, riscos e benefícios da pesquisa proposta; a disponibilidade de tratamentos alternativos ou procedimentos; a disponibilidade de remuneração; e de seus direitos à privacidade e retirar o seu consentimento e descontinuar a sua participação. Antes da sessão de testes de ressonância magnética, um investigador deve apresentar um potencial participante da pesquisa com um documento de consentimento informado IRB-aprovado (ICD), explicar o seu conteúdo, e pedir o potencial participante da pesquisa se ele / ela deseja participar do estudo. Se assim for, o participante terá que assinar e datar o ICD antes de completar qualquer uma das etapas do protocolo aqui.
1. Recurso Antes do dia de testes
- Restringir hábitos de vida que poderiam confundir a Data
- Instruir o participante não realizar exercícios moderados ou pesados durante o 48 h antes dos testes. Instruir o participante a se abster de over-the-counter medicação e ingestão de álcool durante as 24 h antes do teste. Instruir o participante a abster-se do uso do tabaco ou o consumo de cafeína durante a 6 h antes do teste.
- Antes do teste, confirmar que o participante tem sido compatível com estas instruções.
- Preparar o sistema MRI
- Assegurar a disponibilidade de todos os equipamentos necessários, conforme listado na tabela de materiais e equipamentos.
- Definir um protocolo de ressonância magnética; parâmetros sugeridos são encontrados nas Tabelas 1 - 5.
2. dia de testes: Prepare-se para Aquisição de Dados MRI
- Screening Conduta Segurança
- Tela para os potenciais riscos no ambiente de MRI por ter uma ressonância magnética safety-tChoveu saúde trabalhador apresentar o participante da pesquisa com uma forma de segurança MRI adequado, tal como a encontrada na www.mrisafety.com.
- Se houver quaisquer objetos magnéticos ou magneticamente sensíveis implantados, garantir que eles são seguros para ressonância magnética.
- Preparar o sistema MRI
- Certifique-se de que todo o pessoal tenha removido todos os objetos magnéticos e magneticamente sensíveis antes de entrar na sala que abriga o sistema MRI. Realizar esta verificação a cada vez que alguém entra na sala de ressonância magnética.
- Prepara-se o sistema de ressonância magnética colocando a bobina recebe na cama do paciente sistema MRI. Além disso, colocar um colchão com lençol e travesseiro com fronha na cama. Têm alças disponíveis para colocar em torno das coxas e travesseiros ou almofadas para colocar sob os joelhos.
- Inicie a interface do software, insira os dados do paciente, e abrir o protocolo de imagem.
- Posicione o participante da pesquisa na tabela Scanner MRI
- Observe o participante da pesquisa como ele / ela verifica seu / sua pessoa e vestuário para objetos magneticamente sensíveis. Assegurar esses objetos fora da sala de MRI em um recipiente fechado à chave. Entre na sala de MRI com o participante da pesquisa imediatamente após a conclusão desta etapa.
- Posicione o participante sobre a cama do paciente em decúbito dorsal, os pés primeiro. Coloque a parte do corpo a ser trabalhada tão perto da linha média da tabela como prático. almofadas de lugar ou travesseiros sob os joelhos para aliviar a tensão para a parte inferior das costas e coloque um travesseiro sob a cabeça. Para limitar o movimento, suavemente, mas efetivamente garantir a coxa, perna e pé e garantir que o participante é confortável.
- Coloque a bobina receptor RF em torno de coxas do participante e conectá-lo ao sistema MRI.
- Instruir o participante e completar finais etapas de pré-testes
- Dê instruções sobre como se comunicar com os investigadores. Fornecer a participant com a protecção e um dispositivo de sinalização que pode ser usado para chamar a atenção, se necessário ouvir. Instruir o participante da necessidade de ficar parado durante e entre todas as sequências de imagem.
- Avançar a cama do paciente para o equipamento de ressonância magnética de tal modo que a parte do corpo a ser trabalhada está alinhado com o centro do scanner de IRM.
- Depois de sair da sala de ressonância magnética, confirmam que o sistema de comunicação do paciente está a trabalhar e ver que o participante é confortável. Durante todo o protocolo, comunicar-se regularmente com o participante para assegurar a sua / seu conforto e conformidade com as instruções.
3. dia de testes: adquirir os dados de MRI
- Etapas preparatórias
- Como o sistema de ressonância magnética determina os ajustes instrumentais e calibrações antes de cada sequência de imagens (frequência central, calibração ganho do receptor, etc.), supervisionar estes processos e assegurar que cada passo é realizado sendo correctly.
- Usando uma interface de software adequado, adquirir um conjunto de imagens localizador (também conhecido como piloto ou imagens de escoteiros); usando parâmetros sugeridos apresentados na Tabela 2.
- Determinar onde colocar a fatia centro de qMRI aquisições de dados, através da identificação de áreas de danos e / ou fazendo referência a posição fatia em relação a marcos anatômicos reprodutíveis.
- Transmitir e receber bobinas de calibração Passos
- Para estes passos, bem como todos os passos subsequentes de imagem, definir a região da anatomia na qual a optimizar a homogeneidade do campo magnético estático ou (B 0), um processo conhecido como "formação de calços". Ver Figura 1A para o posicionamento típico de o volume de calços de interesse (ISV) utilizado nos presentes estudos.
- Se o scanner de ressonância magnética tem uma bobina de transmissão multi-elemento, adquirir um conjunto de dados de calibração RF.
- Se o scanner de ressonância magnética tem um multi-elemento Receber bobina, adquiremum mapa sensibilidade espacial das bobinas.
- Adquirir Estrutural Dados MRI
- Adquirir alta resolução, multi-slice, T 1 imagens ponderadas usando um spin-eco rápida sequência (FSE); os parâmetros de imagiologia utilizadas nos presentes estudos são fornecidos na Tabela 1.
- Adquirir alta resolução, multi-slice, T 2 imagens ponderadas usando uma sequência de FSE; os parâmetros de imagiologia utilizadas nos presentes estudos são fornecidos na Tabela 2.
- Aquisição de dados em tempo real Controle de Qualidade e fazer correções de pós-processamento
- Aquisição de dados gradiente-eco múltiplos (3D) tridimensional para o cálculo de mapas B 0 campo. Os parâmetros de imagem utilizados nos presentes estudos são fornecidos na Tabela 3.
- Examinar os mapas de campo para assegurar que não haja desvios maiores do que ± 60 Hz (cerca de 0,5partes por milhão a 3 Tesla) através da imagem. Se houver, adoptar uma abordagem alternativa para calçar (método diferente, diferente colocação de VOI, etc.).
- Aquisição de dados 3D para o cálculo dos mapas ângulo de nutação. Os parâmetros de imagem utilizados nos presentes estudos são fornecidos na Tabela 2.
- Examinar os mapas de campo para garantir que não há áreas que se afastam excessivamente a partir do ângulo nutation nominal. Para os pulsos de RF que são usados neste protocolo, desvios superiores a ± 30% do ângulo nutation nominal são considerados excessivos.
- Obter os dados qMRI
- Adquirir imagens em 3D para o cálculo do T 1, utilizando uma sequência de recuperação de inversão. Os parâmetros de imagem utilizados nos presentes estudos são apresentados na Tabela 3.
- Repetir a medição T 1 na presença de supressão do sinal de gordura (FS; este parâmetro é abbreviated T 1, FS).
- Adquirir imagens de segmento único para o cálculo do T 2, utilizando uma sequência spin-echo múltipla. Use os parâmetros de imagem apresentados na Tabela 3.
- Repetir a medição T 2 na presença de FS (T 2, FS).
- Aquisição de imagens 3D para o cálculo de parâmetros QMT, utilizando uma sequência de saturação pulsado com a FS e os parâmetros de imagiologia dadas na Tabela 4.
- Aquisição de dados multi-slice para o cálculo dos parâmetros de difusão-tensor, utilizando uma série de imagens ponderadas em difusão. Os parâmetros de imagem utilizadas nestes estudos são apresentados na Tabela 4.
- Aquisição de dados 3D de cálculo de imagens de gordura / água, utilizando-se uma série de seis imagens gradiente-eco. Os parâmetros de imagem utilizadas nestes estudos são apresentados na Tabela 5.
- Depois de concluir o Protocolo qMRI
- Garanta quetodas as imagens são de qualidade adequada, examinando-os artefactos para potencialmente reversível e medindo a razão suficiente sinal-ruído.
- Para cada conjunto de dados qMRI, definir várias regiões de interesse (ROI) da série de imagens e examinar o sinal em função do parâmetro relevante (por exemplo, para os dados dependentes de T 1 adquiridos nos passos 3.5.1 e 3.5.2, representar graficamente o sinal como uma função de TI e assegurar que os dados seguem a função de inversão-recuperação listados abaixo no passo 4.1.2).
- Depois de completar uma triagem pessoal para objetos magneticamente sensíveis, entrar na sala de ressonância magnética. Remover o participante do magneto, remova todas as correias e estofo, e ajudar o participante sair do scanner de ressonância magnética e a sala de ressonância magnética.
- Transferir os dados, utilizando métodos compatíveis com as leis de privacidade de saúde locais, para uma estação de trabalho local para a transformação; os dados podem ser exportados como Digital Imaging Communications em arquivos de Medicina (DICOM) ou o fornecedorformato proprietário 's (o método utilizado neste protocolo).
4. Analisar os dados qMRI
- Calcular os mapas paramétricos
- Use um programa de computador projetado para computação científica e análise de imagem. Por análise de um histograma de intensidades de sinal na imagem, formam uma imagem máscara à base de limite do sinal que delineia as áreas de sinal das áreas de ruído. Conclua os passos abaixo para cada pixel nas porções de sinal das imagens.
- Analisar o t 1 de dados através da medição da intensidade do sinal S para cada tempo de inversão (TI). Em seguida, coloque os valores para o S a uma inversão recuperação com reduzida modelo de pré-delay:
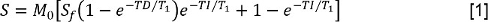
em que M é 0 uma intensidade do sinal que representa a magnetização no estado de equilíbrio, S f é a relação de inversão,e TD é o tempo de pré-delay. Em seguida, ajustar os dados com FS para o mesmo modelo, permitindo a determinação do tempo de relaxamento longitudinal constante com FS, T 1, FS. - Analisar o T 2 de dados através da medição S em cada TE. Em seguida, ajustar os dados a um modelo de decaimento mono-exponencial:

onde N é o sinal de desfasamento na linha de base. O leitor também pode decidir ajustar os dados para um modelo multi-exponencial, como a seguir:
onde j é o número de componentes exponenciais e j f e T 2, são a fracção do sinal e T 2 valores associados com o componente de ordem j. Ou, o leitor pode utilizar um método 3 mínimos quadrados não-negativos (NNLS). No lcaso Atter, o Multi-exponencial Relaxamento Análise (MERA) caixa de ferramentas 33 está disponível gratuitamente; outros programas também estão disponíveis. Repita essas análises para os dados com e sem FS. - Para analisar os dados QMT, medir S para cada fonte de irradiação e freqüência de offset. Corrigir os poderes de irradiação nominais (representados por ω 1 na equação abaixo) usando os mapas ângulo nutation. Corrigir os desfasamentos de frequência (Δ f na equação abaixo) utilizando o B 0 mapas para ajustar as frequências de deslocamento aplicado. Em seguida, ajustar os dados com o seguinte modelo 34,35
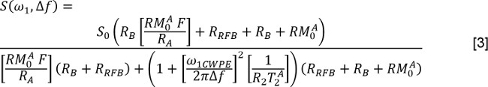
onde é a taxa de câmbio a partir da piscina macromolecular para a piscina de água livre, é a taxa de relaxamento longitudinal da piscina de água livre, é a taxa de relaxamento longitudinal da piscina macromolecular (assumido ser 1 s -1), é o PSR, é o t 2 da piscina de água gratuita, e ω 1CWPE é a potência média do pulso de saturação. A taxa de saturação da magnetização longitudinal da piscina macromolecular, é descrita por um modelo Super-Lorentz, tal como descrito no trabalho por Henkelman e colegas 34,35. - Para analisar os dados do DTI, primeiro use um algoritmo de transformação afim 36 para registrar cada imagem ponderada em difusão para a imagem ponderada não-difusão correspondente. Em seguida, para cada pixel, para medir os valores de S na imagem ponderada não-difusão e em cada direcção ponderada em difusão. Formar uma matriz composta por as instruções de codificação de difusão. Usando multivariada, ponderada de regressão por mínimos quadrados, regredir os dados do sinal na matriz de difusão de codificação e forma D. Diagonalizar D e realizar uma magnitude-ordenação dos valores próprios e os seus vectores próprios. Em seguida, calcular a difusividade média (MD) como:

onde λ 1, λ 2 e λ 3 são os valores próprios do tensor de difusão. Também calcular a anisotropia fraccionada (FA) como:
- Analisar os dados FWMRI usando uma abordagem quantitativa que separa os sinais de água e de gordura com base no deslocamento químico (tal como o algoritmo FattyRiot, disponível para download gratuito a partir https://github.com/welcheb/FattyRiot).
- Definir regiões de interesse para análise
- Especifique ROIs nas imagens anatômicas (definindo os limites de cada músculo de interesse). Um exemplo é mostrado na Figura 1.
- Redimensionar as ROIs para corresponder ao tamanho da matriz das imagens qMRI. Conforme necessário, ajustar o alinhamento dos ROIs para coincidir com o mapa qMRI (por exemplo, se o participante movidoentre as aquisições, uma tradução da posição ROI pode ser necessária para evitar a sobreposição dos limites musculares).
- Examine cada ROI. Se necessário, garantir que nenhum pixels são incluídos que contêm artefatos parciais de volume, tecido não-contrátil, e artefatos de fluxo; consulte a Figura 1 para exemplos.
- Calcule a média eo desvio-padrão dos valores qMRI em todos os pixels dentro das ROIs selecionadas.
Resultados
A Figura 1 mostra imagens anatômicas axiais representativos adquiridas no meio da coxa de um paciente com polimiosite. Também é mostrada a localização da projecção no plano do volume calço. Mapas de parâmetros representativos para cada método qMRI, todos obtidos a partir deste mesmo paciente, são fornecidos a partir das Figuras 2 - 7.
As Figuras 2A e 2B
Discussão
doenças musculares, como as distrofias musculares e miopatias inflamatórias idiopáticas constituem de um grupo de doenças que são heterogêneos em etiologia e, como entidades individuais, rara em sua incidência. Por exemplo, distrofia muscular de Duchenne - a forma mais comum de distrofia muscular - tem uma incidência de 1 em cada 3.500 nascimentos vivos do sexo masculino 37,38; dermatomiosite, a que foi aplicado este protocolo, tem uma incidência de 1 em 100.000 39. A maior incidência col...
Divulgações
None of the authors has a financial conflict of interest to report.
Agradecimentos
We acknowledge grant support from the National Institutes of Health: NIH/NIAMS R01 AR050101 (BMD), NIH/NIAMS R01 AR057091 (BMD/JHP), NIH/NIBEB K25 EB013659 (RDD), and the Vanderbilt CTSA award RR024975. We also thank the reviewers for the comments and the subject for participating in these studies.
Materiais
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| 3T human MRI system | Philips Medical Systems (Best, the Netherlands) | Achieva/Intera | |
| Cardiac phased array receive coil | Philips Medical Systems | ||
| Pillows, straps, bolsters, and other positioning devices | |||
| Computer with MATLAB software | The Mathworks, Inc (Natick, MA) | r. 2014 |
Referências
- Wokke, B. H., et al. Comparison of Dixon and T1-weighted MR methods to assess the degree of fat infiltration in duchenne muscular dystrophy patients. J Magn Reson Imaging. 38 (3), 619-624 (2013).
- Carr, H., Purcell, E. Effects of diffusion on free precession in NMR experiments. Phys Rev. 94, 630-638 (1954).
- Whittall, K. P., MacKay, A. L. Quantitative interpretation of NMR relaxation data. Journal of Magnetic Resonance. 84 (1), 134-152 (1989).
- Park, J. H., et al. Dermatomyositis: correlative MR imaging and P-31 MR spectroscopy for quantitative characterization of inflammatory disease. Radiology. 177 (2), 473-479 (1990).
- Park, J. H., et al. Magnetic resonance imaging and p-31 magnetic resonance spectroscopy provide unique quantitative data useful in the longitudinal management of patients with dermatomyositis. Arthritis & Rheumatism. 37 (5), 736-746 (1994).
- Park, J. H., et al. Use of magnetic resonance imaging and p-31 magnetic resonance spectroscopy to detect and quantify muscle dysfunction in the amyopathic and myopathic variants of dermatomyositis. Arthritis & Rheumatism. 38 (1), 68-77 (1995).
- Huang, Y., et al. Quantitative MR relaxometry study of muscle composition and function in Duchenne muscular dystrophy. J Magn Reson Imaging. 4 (1), 59-64 (1994).
- Kim, H. K., et al. T2 mapping in Duchenne muscular dystrophy: distribution of disease activity and correlation with clinical assessments. Radiology. 255 (3), 899-908 (2010).
- Arpan, I., et al. T2 mapping provides multiple approaches for the characterization of muscle involvement in neuromuscular diseases: a cross-sectional study of lower leg muscles in 5-15-year-old boys with Duchenne muscular dystrophy. NMR in Biomedicine. 26 (3), 320-328 (2013).
- Fan, R. H., Does, M. D. Compartmental relaxation and diffusion tensor imaging measurements in vivo in λ-carrageenan-induced edema in rat skeletal muscle. NMR in Biomedicine. 21 (6), 566-573 (2008).
- Sled, J. G., Pike, G. B. Quantitative interpretation of magnetization transfer in spoiled gradient echo MRI sequences. J Magn Reson. 145 (1), 24-36 (2000).
- Gochberg, D. F., Gore, J. C. Quantitative magnetization transfer imaging via selective inversion recovery with short repetition times. Magn Reson Med. 57 (2), 437-441 (2007).
- Li, K., et al. Optimized inversion recovery sequences for quantitative T1 and magnetization transfer imaging. Magn Reson Med. 64 (2), 491-500 (2010).
- Louie, E. A., Gochberg, D. F., Does, M. D., Damon, B. M. Magnetization transfer and T2 measurements of isolated muscle: effect of pH. Magn Reson Med. 61 (3), 560-569 (2009).
- Sinclair, C. D. J., et al. Quantitative magnetization transfer in in vivo healthy human skeletal muscle at 3 T. Magn Reson Med. 64 (6), 1739-1748 (2010).
- Sinclair, C., et al. Multi-parameter quantitation of coincident fat and water skeletal muscle pathology. Proc 21st Ann Meeting ISMRM. , (2013).
- Bryant, N., et al. Multi-parametric MRI characterization of inflammation in murine skeletal muscle. NMR Biomed. 27 (6), 716-725 (2014).
- Aisen, A. M., Doi, K., Swanson, S. D. Detection of liver fibrosis with magnetic cross-relaxation. Magn Reson Med. 31 (5), 551-556 (1994).
- Kim, H., et al. Induced hepatic fibrosis in rats: hepatic steatosis, macromolecule content, perfusion parameters, and their correlations-preliminary MR imaging in rats. Radiology. 247 (3), 696-705 (2008).
- Basser, P. J., Mattiello, J., LeBihan, D. MR diffusion tensor spectroscopy and imaging. Biophys J. 66 (1), 259-267 (1994).
- Heemskerk, A., Strijkers, G., Drost, M., van Bochove, G., Nicolay, K. Skeletal muscle degeneration and regeneration following femoral artery ligation in the mouse: diffusion tensor imaging monitoring. Radiology. 243 (2), 413-421 (2007).
- Zaraiskaya, T., Kumbhare, D., Noseworthy, M. D. Diffusion tensor imaging in evaluation of human skeletal muscle injury. J Magn Reson Imaging. 24 (2), 402-408 (2006).
- Qi, J., Olsen, N. J., Price, R. R., Winston, J. A., Park, J. H. Diffusion-weighted imaging of inflammatory myopathies: polymyositis and dermatomyositis. J Magn Reson Imaging. 27 (1), 212-217 (2008).
- McMillan, A. B., Shi, D., Pratt, S. J., Lovering, R. M. Diffusion tensor MRI to assess damage in healthy and dystrophic skeletal muscle after lengthening contractions. J Biomed Biotech. , (2011).
- Scheel, M., et al. Fiber type characterization in skeletal muscle by diffusion tensor imaging. NMR Biomed. 26 (10), 1220-1224 (2013).
- Kaufman, L. D., Gruber, B. L., Gerstman, D. P., Kaell, A. T. Preliminary observations on the role of magnetic resonance imaging for polymyositis and dermatomyositis. Annalsrheumatic Dis. 46 (8), 569-572 (1987).
- Dixon, W. T. Simple proton spectroscopic imaging. Radiology. 153 (1), 189-194 (1984).
- Glover, G. H. Multipoint Dixon technique for water and fat proton and susceptibility imaging. J Magn Reson Imaging. 1 (5), 521-530 (1991).
- Berglund, J., Kullberg, J. Three-dimensional water/fat separation and T2* estimation based on whole-image optimization--application in breathhold liver imaging at 1.5 T. Magn Reson Med. 67 (6), 1684-1693 (2012).
- Gloor, M., et al. Quantification of fat infiltration in oculopharyngeal muscular dystrophy: Comparison of three MR imaging methods. J Magn Reson Imaging. 33 (1), 203-210 (2011).
- Fischmann, A., et al. Quantitative MRI and loss of free ambulation in Duchenne muscular dystrophy. J Neurol. 260 (4), 969-974 (2013).
- Li, K., et al. Multi-parametric MRI characterization of healthy human thigh muscles at 3.0 T - relaxation, magnetization transfer, fat/water, and diffusion tensor imaging. NMR Biomed. 27 (9), 1070-1084 (2014).
- Morrison, C., Stanisz, G., Henkelman, R. M. Modeling magnetization transfer for biological-like systems using a semi-solid pool with a super-Lorentzian lineshape and dipolar reservoir. J Magn Reson Series B. 108 (2), 103-113 (1995).
- Li, J. G., Graham, S. J., Henkelman, R. M. A flexible magnetization transfer line shape derived from tissue experimental data. Magn Reson Med. 37 (6), 866-871 (1997).
- Mangin, J. F., Poupon, C., Clark, C., Le Bihan, D., Bloch, I. Distortion correction and robust tensor estimation for MR diffusion imaging. Med Image Anal. 6 (3), 191-198 (2002).
- Moser, H. Duchenne muscular dystrophy: pathogenetic aspects and genetic prevention. Hum Genet. 66 (1), 17-40 (1984).
- van Essen, A. J., Busch, H. F., te Meerman, G. J., ten Kate, L. P. Birth and population prevalence of Duchenne muscular dystrophy in The Netherlands. Hum Genet. 88 (3), 258-266 (1992).
- Bendewald, M. J., Wetter, D. A., Li, X., Davis, M. P. Incidence of dermatomyositis and clinically amyopathic dermatomyositis: A population-based study in olmsted county, minnesota. Arch Dermatol. 146 (1), 26-30 (2010).
- Carlier, P. G. Global T2 versus water T2 in NMR imaging of fatty infiltrated muscles: different methodology, different information and different implications. Neuromuscul Disord. 24 (5), 390-392 (2014).
- Foley, J. M., Jayaraman, R. C., Prior, B. M., Pivarnik, J. M., Meyer, R. A. MR measurements of muscle damage and adaptation after eccentric exercise. J Appl Physiol. 87 (6), 2311-2318 (1999).
- Garrood, P., et al. MR imaging in Duchenne muscular dystrophy: quantification of T1-weighted signal, contrast uptake, and the effects of exercise. J Magn Reson Imaging. 30 (5), 1130-1138 (2009).
- Bratton, C. B., Hopkins, A. L., Weinberg, J. W. Nuclear magnetic resonance studies of living muscle. Science. 147, 738-739 (1965).
- Fleckenstein, J. L., Canby, R. C., Parkey, R. W., Peshock, R. M. Acute effects of exercise on MR imaging of skeletal muscle in normal volunteers. AJR Am J Roentgenol. 151 (2), 231-237 (1988).
- Williams, S., Heemskerk, A., Welch, E., Damon, B., Park, J. The quantitative effects of inclusion of fat on muscle diffusion tensor MRI measurements. J Magn Reson Imaging. 38 (5), 1292-1297 (2013).
- Hernando, D., et al. Removal of olefinic fat chemical shift artifact in diffusion MRI. Magn Reson Med. 65 (3), 692-701 (2011).
- Willcocks, R. J., et al. Longitudinal measurements of MRI-T2 in boys with Duchenne muscular dystrophy: effects of age and disease progression. Neuromuscul Disord. 24 (5), 393-401 (2014).
- Poon, C. S., Henkelman, R. M. Practical T2 quantitation for clinical applications. J Magn Reson Imaging. 2 (5), 541-553 (1992).
- Does, M. D., Gore, J. C. Complications of nonlinear echo time spacing for measurement of T2. NMR Biomed. 13 (1), 1-7 (2000).
- Poon, C. S., Henkelman, R. M. 180° refocusing pulses which are insensitive to static and radiofrequency field inhomogeneity. J Magn Reson. 99 (1), 45-55 (1992).
- Hollingsworth, K. G., de Sousa, P. L., Straub, V., Carlier, P. G. Towards harmonization of protocols for MRI outcome measures in skeletal muscle studies: consensus recommendations from two TREAT-NMD NMR workshops, 2 May 2010, Stockholm, Sweden, 1-2 October 2009, Paris, France. Neuromuscul Disord. 22, S54-S67 (2010).
- Underhill, H. R., Rostomily, R. C., Mikheev, A. M., Yuan, C., Yarnykh, V. L. Fast bound pool fraction imaging of the in vivo rat brain: Association with myelin content and validation in the C6 glioma model. Neuroimage. 54 (3), 2052-2065 (2011).
- Smith, S. A., et al. Quantitative magnetization transfer characteristics of the human cervical spinal cord in vivo: application to adrenomyeloneuropathy. Magn Reson Med. 61 (1), 22-27 (2009).
- Li, K. D. R., Dortch, R. D., Gochberg, D. F., Smith, S. A., Damon, B. M., Park, J. H. Quantitative magnetization transfer with fat component in human muscles. Proc. 20th Ann Meeting ISMRM. , (2012).
- Damon, B. M. Effects of image noise in muscle diffusion tensor (DT)-MRI assessed using numerical simulations. Magn Reson Med. 60 (4), 934-944 (2008).
- Damon, B. M., Buck, A. K. W., Ding, Z. Diffusion-tensor MRI-based skeletal muscle fiber tracking. Imaging Med. 3 (6), 675-687 (2011).
- Froeling, M., Nederveen, A. J., Nicolay, K., Strijkers, G. J. DTI of human skeletal muscle: the effects of diffusion encoding parameters, signal-to-noise ratio and T2 on tensor indices and fiber tracts. NMR in Biomedicine. 26 (11), 1339-1352 (2013).
- Basser, P. J., Pajevic, S. Statistical artifacts in diffusion tensor MRI (DT-MRI) caused by background noise. Magn Reson Med. 44 (1), 41-50 (2000).
- Anderson, A. W. Theoretical analysis of the effects of noise on diffusion tensor imaging. Magn Reson Med. 46 (6), 1174-1188 (2001).
- Saupe, N., White, L. M., Stainsby, J., Tomlinson, G., Sussman, M. S. Diffusion tensor imaging and fiber tractography of skeletal muscle: optimization of B value for imaging at 1.5 T. AJR Am J Roentgenol. 192 (6), W282-W290 (2009).
- Levin, D. I., Gilles, B., Madler, B., Pai, D. K. Extracting skeletal muscle fiber fields from noisy diffusion tensor data. Med Image Anal. 15 (3), 340-353 (2011).
- Sinha, U., Sinha, S., Hodgson, J. A., Edgerton, R. V. Human soleus muscle architecture at different ankle joint angles from magnetic resonance diffusion tensor imaging. J Appl Physiol. 110 (3), 807-819 (2011).
- Jones, D. K., Cercignani, M. Twenty-five pitfalls in the analysis of diffusion MRI data. NMR Biomed. 23 (7), 803-820 (2010).
- Hamilton, G., et al. In vivo characterization of the liver fat 1H MR spectrum. NMR Biomed. 24 (7), 784-790 (2011).
- Hernando, D., Kellman, P., Haldar, J. P., Liang, Z. P. Robust water/fat separation in the presence of large field inhomogeneities using a graph cut algorithm. Magn Reson Med. 63 (1), 79-90 (2010).
- Hernando, D., Hines, C. D., Yu, H., Reeder, S. B. Addressing phase errors in fat-water imaging using a mixed magnitude/complex fitting method. Magn Reson Med. 67 (3), 638-644 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados