È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Quantitative Magnetic Resonance Imaging di malattia muscolare scheletrico
In questo articolo
Riepilogo
Le malattie neuromuscolari spesso mostrano una temporalmente variabile, patologia spazialmente eterogeneo e multiforme. L'obiettivo di questo protocollo è quello di caratterizzare questa patologia utilizzando magnetici metodi di imaging di risonanza non invasive.
Abstract
Quantitative magnetic resonance imaging (qMRI) describes the development and use of MRI to quantify physical, chemical, and/or biological properties of living systems. Neuromuscular diseases often exhibit a temporally varying, spatially heterogeneous, and multi-faceted pathology. The goal of this protocol is to characterize this pathology using qMRI methods. The MRI acquisition protocol begins with localizer images (used to locate the position of the body and tissue of interest within the MRI system), quality control measurements of relevant magnetic field distributions, and structural imaging for general anatomical characterization. The qMRI portion of the protocol includes measurements of the longitudinal and transverse relaxation time constants (T1 and T2, respectively). Also acquired are diffusion-tensor MRI data, in which water diffusivity is measured and used to infer pathological processes such as edema. Quantitative magnetization transfer imaging is used to characterize the relative tissue content of macromolecular and free water protons. Lastly, fat-water MRI methods are used to characterize fibro-adipose tissue replacement of muscle. In addition to describing the data acquisition and analysis procedures, this paper also discusses the potential problems associated with these methods, the analysis and interpretation of the data, MRI safety, and strategies for artifact reduction and protocol optimization.
Introduzione
la risonanza magnetica quantitativa (qMRI) descrive lo sviluppo e l'uso della risonanza magnetica per quantificare fisiche, chimiche e / o biologiche dei sistemi viventi. QMRI richiede che si adottano un modello biofisico per il sistema, costituita dal tessuto di interesse e una sequenza di impulsi MRI. La sequenza di impulsi è progettato per sensibilizzare intensità di segnale delle immagini 'al parametro di interesse nel modello. proprietà del segnale di risonanza magnetica (segnale di grandezza, la frequenza e / o di fase) sono misurati e analizzati secondo il modello. L'obiettivo è quello di produrre un imparziale, stima quantitativa di un parametro fisico o biologico dover continuamente distribuite, unità fisiche di misura. Spesso le equazioni che descrivono il sistema sono analizzati e montati su una base pixel per pixel, producendo un'immagine cui valori pixel riflettono direttamente i valori della variabile. Tale immagine viene indicato come una mappa parametrica.
Un uso comune di qMRI è il dviluppo e l'applicazione di biomarcatori. Biomarkers possono essere usati per studiare un meccanismo di malattia, stabilire una diagnosi, determinare una prognosi, e / o valutare una risposta terapeutica. Essi possono assumere la forma di concentrazioni o le attività di molecole endogeni o esogeni, un campione istologico, una grandezza fisica, o un'immagine interna. Alcuni requisiti generali di biomarcatori sono che oggettivamente misurano una variabile in continuo distribuito utilizzando unità fisiche di misura; avere una chiara, rapporto ben compreso con la patologia di interesse; sono sensibili al miglioramento e peggioramento dello stato clinico; e può essere misurata con adatto accuratezza e precisione. biomarcatori non invasivi o minimamente invasive sono particolarmente desiderabili, in quanto promuovono il comfort del paziente e minimamente disturbare la patologia di interesse.
Un obiettivo per lo sviluppo di biomarcatori basati su immagine per la malattia muscolare è quello di riflettere malattia muscolare in modi che sono complementary, più specifico rispetto, più selettivo rispetto spazialmente, e / o meno invasiva rispetto agli approcci esistenti. Un particolare vantaggio di qMRI a questo proposito è che ha la capacità di integrare diversi tipi di informazioni e quindi potenzialmente caratterizzare molti aspetti del processo di malattia. Questa capacità è molto importante in malattie muscolari, che spesso presentano una patologia complessa spazialmente variabile che comprende l'infiammazione, necrosi e / o atrofia con sostituzione grassi, fibrosi, interruzione del reticolo myofilament ( "streaming Z-disk"), e danni membrana . Un altro vantaggio di metodi qMRI è che le descrizioni qualitative o semi-quantitative delle immagini RM di contrasto a base di riflettere non solo la patologia, ma anche differenze nei parametri di acquisizione di immagini, hardware, e la percezione umana. Un esempio di questo ultimo numero è stato dimostrato da Wokke et al., Che hanno dimostrato che le valutazioni semi-quantitativa di infiltrazione di grasso sono molto variabili e spesso errate, wgallina in confronto con la risonanza magnetica di grasso / acqua quantitativa (FWMRI) 1.
Il protocollo qui descritto include sequenze di impulsi per misurare la longitudinale (T 1) e trasversale (T 2) costanti di tempo di relax, trasferimento di magnetizzazione quantitativa (QMT) parametri, coefficienti di acqua di diffusione utilizzando tensore di diffusione MRI (DT-MRI), e la struttura del muscolo utilizzando immagini strutturali e FWMRI. T 1 è misurato utilizzando una sequenza inversion recovery, in cui il vettore di magnetizzazione è invertita e la sua grandezza è campionata come il sistema ritorna all'equilibrio. T 2 viene misurata ripetutamente rifocalizzazione magnetizzazione trasversale con un treno di impulsi di riorientamento, come il metodo Carr-Purcell Meiboom-Gill (CPMG), e il campionamento dei risultanti spin-eco. T 1 e T 2 i dati possono essere analizzati usando metodi curva-montaggio non lineari che o assumono un numero di Exponecomponenti ntial a priori (tipicamente da uno a tre) o utilizzando un approccio inverso lineare che si adatta ai dati osservati alla somma di un gran numero di esponenziali decomposizione, con conseguente uno spettro di ampiezze dei segnali. Questo approccio richiede una soluzione a 3 non negativo dei minimi quadrati (NNLS), e comprende tipicamente regolarizzazione supplementare per produrre risultati stabili. T 1 e T 2 misurazioni sono stati ampiamente utilizzati per lo studio di malattie muscolari e lesioni 4-9. T 1 I valori sono in genere diminuiti in regioni grassi infiltrati di muscoli e di elevati nelle regioni infiammate 4-6; T 2 valori sono elevati in entrambe le regioni grassi infiltrati e infiammate 10.
QMT-MRI caratterizza l'acqua e solido come piscine protone macromolecolari liberi nei tessuti stimando il rapporto tra macromolecolare di protoni dell'acqua liberi (il rapporto dimensioni della piscina, PSR); l'intrinseca rilassarsitariffe ation di queste piscine; e il tasso di cambio tra di loro. Approcci comuni QMT includono saturazione pulsata 11 e metodi 12,13 recupero inversione selettivi. Il protocollo che segue descrive l'uso del metodo di saturazione pulsata, che sfrutta l'ampia larghezza di riga del segnale protonica macromolecolare, rispetto alla stretta larghezza di riga del segnale dell'acqua protone. Saturando il segnale macromolecolare a frequenze di risonanza sufficientemente diversi dal segnale dell'acqua, il segnale acqua si riduce a causa del trasferimento di magnetizzazione tra le piscine dell'acqua protone solidi e libero. I dati vengono analizzati utilizzando un modello biofisico quantitativa. QMT è stato sviluppato e applicato nei muscoli sani 14,15, e un estratto recente apparso descrivendo la sua attuazione nella malattia del muscolo 16. QMT è stato utilizzato per studiare piccoli modelli animali di infiammazione muscolare, in cui è stato dimostrato che l'infiammazione diminuisce la PSR 17. Nella misura in cui MTriflette il contenuto sia macromolecolari e di acqua, i dati MT possono anche riflettere la fibrosi 18,19.
DT-MRI viene utilizzato per quantificare il comportamento diffusione anisotropo delle molecole di acqua nei tessuti con ordinati, cellule allungate. In DT-MRI, diffusione dell'acqua viene misurata in sei o più direzioni diverse; questi segnali vengono poi montati su un modello di tensore 20. Il tensore di diffusione, D, è diagonalizzata di ottenere tre autovalori (che sono le tre principali diffusività) e tre autovettori (che indicano le direzioni corrispondenti ai tre coefficienti di diffusione). Questi ed altri indici quantitativi derivati da D forniscono informazioni sulla struttura dei tessuti e orientamento a livello microscopico. Le proprietà di diffusione di muscoli, in particolare il terzo autovalore di D ed il grado di anisotropia diffusione, riflettono l'infiammazione del muscolo 17 e danno muscolare a causa di lesioni sperimentali 21, lesioni da sforzo 22, e la malattia 23,24. Altre influenze potenziali sulle proprietà di diffusione del muscolo includono cambiamenti di diametro cella 25 e le variazioni di permeabilità della membrana.
Infine, atrofia muscolare, senza o senza macroscopica grasso di infiltrazione, è un componente patologica di molte malattie muscolari. Atrofia muscolare può essere valutata utilizzando immagini strutturali per misurare muscolare sezione trasversale o di volume e FW-MRI per valutare infiltrazione grassa. Infiltrazione di grasso può essere qualitativamente descritto in T 1 - e T 2 pesate 26, ma i segnali grasso e acqua migliore misurato formando immagini che sfruttano le diverse frequenze di risonanza di grassi e acqua protoni 27-29. Metodi quantitativi grasso / acqua di imaging sono state applicate nelle malattie muscolari come la distrofia muscolare 1,30,31, e possono prevedere la perdita della deambulazione in questi pazienti 31.
Il protocollo qMRI qui descritto utilizza tutte queste misurazioni per caratterizzare condizione muscolare nei autoimmuni infiammatorie miopatie dermatomiosite (DM) e polimiosite (PM). Ulteriori dettagli del protocollo, compresa la sua riproducibilità, sono stati pubblicati in precedenza 32. Il protocollo include sequenze standard di impulsi così come a radiofrequenza (RF) e il campo magnetico oggetti sfumati specificamente programmati sui nostri sistemi. Gli autori prevedono che il protocollo è applicabile anche in altri disturbi neuromuscolari caratterizzati da atrofia muscolare, infiammazione, e infiltrazione grassa (come la distrofia muscolare).Protocollo
NOTA: Il lettore è ricordato che tutta la ricerca che coinvolge soggetti umani deve essere approvato dal Institutional Review Board locale (IRB) per l'uso di soggetti umani nella ricerca. partecipanti alla ricerca devono essere informati dello scopo, le procedure, i rischi ei benefici della ricerca proposta; la disponibilità di trattamenti o procedure alternative; la disponibilità di remunerazione; e dei loro diritti alla privacy e di ritirare il loro consenso e interrompere la loro partecipazione. Prima della sessione di test MRI, un investigatore deve presentare un potenziale partecipante alla ricerca di un documento di consenso informato IRB approvato (ICD), spiegare i suoi contenuti, e chiedere il potenziale partecipante alla ricerca, se lui / lei vuole partecipare allo studio. In tal caso, il partecipante dovrà firmare e datare l'ICD prima di completare una qualsiasi delle fasi del protocollo qui.
1. Le azioni Prima della giornata di test
- Limitare le abitudini di vita che potrebbero confondere i Data
- Istruire il partecipante non eseguire esercizio fisico moderato o pesante durante la 48 ore prima della prova. Istruire il partecipante ad astenersi da over-the-counter farmaci e l'assunzione di alcol durante le 24 ore prima del test. Istruire il partecipante ad astenersi dal consumo di tabacco o il consumo di caffeina durante la 6 ore prima della prova.
- Prima della prova, verificare che il partecipante è stato conforme a queste istruzioni.
- Preparare il sistema di risonanza magnetica
- Assicurare la disponibilità di tutte le attrezzature necessarie, come indicato nella tabella di materiali ed attrezzature.
- Definire un protocollo di risonanza magnetica; parametri suggeriti si trovano nelle tabelle 1 - 5.
2. giornata di prove: Preparare per la risonanza magnetica acquisizione dati
- Screening condotta Sicurezza
- Schermo per i potenziali pericoli per l'ambiente MRI avendo una risonanza magnetica di sicurezza-tpiovuto operatore sanitario presentare il partecipante alla ricerca, con un opportuno modulo di sicurezza risonanza magnetica, come quello trovato alla www.mrisafety.com.
- ci Se oggetti magnetici o sensibili al magnetismo impiantati, in modo che essi siano sicuri per la scansione MRI.
- Preparare il sistema di risonanza magnetica
- Assicurarsi che tutto il personale hanno rimosso tutti gli oggetti magnetici e sensibili al magnetismo prima di entrare nella stanza che ospita il sistema di risonanza magnetica. Effettuare questo controllo ogni volta che qualcuno entra nella stanza MRI.
- Preparare il sistema MRI posizionando la bobina di ricezione del letto del paziente del sistema MRI. Inoltre, mettere un materasso con lenzuolo e cuscino con federa sul letto. Avere cinghie disponibili per posizionare intorno alle cosce e capezzali o cuscini per posizionare sotto le ginocchia.
- Avviare l'interfaccia software, inserire i dati del paziente, e aprire il protocollo di imaging.
- Posizionare il partecipante di ricerca sullo scanner MRI Tabella
- Osservare il partecipante alla ricerca come lui / lei controlla il suo / la sua persona e l'abbigliamento per gli oggetti sensibili al magnetismo. Fissare questi oggetti al di fuori della stanza risonanza magnetica in un contenitore chiudibile a chiave. Entrate nella stanza risonanza magnetica con il partecipante alla ricerca immediatamente dopo aver completato questo passaggio.
- Posizionare il partecipante sul letto paziente in posizione supina, piedi-prime. Posizionare la parte del corpo da esporre più vicino alla linea mediana del tavolo pratico. Luogo capezzali o cuscini sotto le ginocchia per fornire scarico della trazione per la parte bassa della schiena e mettere un cuscino sotto la testa. Per limitare il movimento, con delicatezza ma sicuro efficace coscia, gamba e piedi e far sì che il partecipante è comodo.
- Posizionare la bobina ricevente RF intorno le cosce del partecipante e collegarlo al sistema di risonanza magnetica.
- Istruire il partecipante e completi finali pre-test Passi
- Dare istruzioni su come comunicare con gli investigatori. Fornire il participant con protezione acustica e un dispositivo di segnalazione che può essere utilizzato per richiamare l'attenzione, se necessario. Istruire il partecipante della necessità di stare fermo durante e tra tutte le sequenze di imaging.
- Avanzare il letto del paziente nello scanner MRI tale che la parte del corpo per essere ripreso è allineato al centro dello scanner MRI.
- Dopo essere usciti dalla stanza risonanza magnetica, verificare che il sistema di comunicazione con il paziente sta funzionando e vedere che il partecipante è comodo. In tutto il protocollo, comunicare regolarmente con il partecipante al fine di garantire la sua / il suo conforto e la conformità con le istruzioni.
3. giornata di prove: acquisire i dati MRI
- Operazioni preliminari
- Poiché il sistema MRI determina le impostazioni strumentali e calibrazioni prima di ogni sequenza di immagini (frequenza centrale, la calibrazione guadagno del ricevitore, ecc), controllare questi processi e assicurarsi che ogni passo viene eseguita correctly.
- Utilizzando una opportuna interfaccia software, acquisire un insieme di immagini localizzatore (noto anche come pilota o immagini esploratore); utilizzando parametri suggeriti presentate in Tabella 2.
- Determinare dove posizionare la fetta centrale per qMRI acquisizioni di dati, identificando le aree di danni e / o facendo riferimento alla posizione fetta rispetto a punti di riferimento anatomici riproducibili.
- Trasmettere e ricevere Coil passaggi di calibrazione
- Per queste operazioni nonché tutte le successive fasi di imaging, definire regione dell'anatomia in cui ottimizzare l'omogeneità del campo magnetico statico (B 0), un processo noto come "shimming". Vedere Figura 1A per il tipico posizionamento del volume spessoramento di interesse (VOI) utilizzato nel presente studio.
- Se lo scanner MRI ha una bobina di trasmissione multi-elemento, acquisire un set di dati di calibrazione RF.
- Se lo scanner MRI ha un multi-elemento ricevono coil, acquisireuna mappa sensibilità spaziale delle bobine.
- Acquisire strutturale MRI dati
- Acquisire alta risoluzione, multistrato, T 1 pesate le immagini utilizzando un veloce spin-echo (FSE) sequenza; i parametri di imaging utilizzate nel presente studio sono forniti in Tabella 1.
- Acquisire alta risoluzione, multistrato, T 2 immagini utilizzando una sequenza FSE pesate; i parametri di imaging utilizzate nel presente studio sono riportati nella Tabella 2.
- Acquisire dati per il controllo di qualità in tempo reale e apportare correzioni post-processing
- Acquisire (3D) multipli di dati tridimensionali gradiente-eco per il calcolo delle mappe B 0 sul campo. I parametri di imaging utilizzate nel presente studio sono riportati nella Tabella 3.
- Esaminate le mappe di campo per assicurare che non vi siano deviazioni superiori a ± 60 Hz (circa 0,5parti per milione a 3 Tesla) in tutta l'immagine. Se ci sono, adottare un approccio alternativo alla spessori (metodo diverso, diverso posizionamento di Voi, ecc.).
- Acquisire dati 3D per il calcolo delle mappe angolo nutazione. I parametri di imaging utilizzate nel presente studio sono riportati nella Tabella 2.
- Esaminate le mappe di campo per garantire che non vi sono aree che si discostano eccessivamente dall'angolo nutazione nominale. Per gli impulsi RF che vengono utilizzati in questo protocollo, deviazioni superiori a ± 30% dell'angolo nutazione nominale siano considerati eccessivi.
- Acquisire i dati qMRI
- Acquisire immagini 3D per il calcolo del T 1, utilizzando una sequenza inversion recovery. I parametri di imaging utilizzate nel presente studio sono riportati in Tabella 3.
- Ripetere la misurazione T 1 in presenza di soppressione del segnale del grasso (FS, questo parametro è AbbreviaTed T 1, FS).
- Acquisire immagini singola slice per il calcolo del T 2, utilizzando un multiplo sequenza spin-echo. Utilizzare i parametri di imaging presentati nella tabella 3.
- Ripetere la misurazione T 2 in presenza di FS (T 2, FS).
- Acquisire immagini 3D di calcolo dei parametri QMT, usando una sequenza di saturazione pulsato con FS ei parametri di imaging indicati nella Tabella 4.
- Acquisire dati multi-slice per il calcolo dei parametri di diffusione-tensore, utilizzando una serie di immagini di diffusione ponderata. I parametri di imaging utilizzate in questi studi sono riportati in Tabella 4.
- Acquisire dati 3D per il calcolo di immagini grasso / acqua, utilizzando una serie di sei immagini gradiente-eco. I parametri di imaging utilizzate in questi studi sono riportati in Tabella 5.
- Dopo aver completato il protocollo qMRI
- Assicurarsi chetutte le immagini sono di qualità adeguata da essi esaminando gli artefatti potenzialmente correggibili e misurando il sufficiente rapporto segnale-rumore.
- Per ciascun gruppo di dati qMRI, definire diversi regioni di interesse (ROI) nella serie di immagini ed esaminare il segnale in funzione del parametro relativo (ad esempio, per i dati -dipendente T 1 acquisiti nei passi 3.5.1 e 3.5.2, tracciare il segnale in funzione di TI e garantire che i dati seguano la funzione di inversione-recupero elencati di seguito nel passaggio 4.1.2).
- Dopo aver completato una proiezione personale per oggetti sensibili al magnetismo, entrare nella stanza MRI. Rimuovere il partecipante dal magnete, rimuovere tutte le cinghie e le imbottiture, e assistere il partecipante in uscita dal scanner MRI e la sala MRI.
- Trasferire i dati, utilizzando metodi conformi alle leggi sulla privacy di salute locali, a una workstation locale per la trasformazione; i dati possono essere esportati come Imaging Digital Communications nei file di Medicina (DICOM) o il venditoreformato proprietario 's (il metodo utilizzato in questo protocollo).
4. Analizzare i dati qMRI
- Calcolare le mappe parametriche
- Utilizzare un programma per computer progettato per il calcolo scientifico e l'analisi delle immagini. Esaminando un istogramma delle intensità di segnale nell'immagine, formare una maschera immagine basato su soglie segnale che delinea aree di segnale dalle aree di rumore. Completare la procedura riportata di seguito per ogni pixel nelle porzioni delle immagini del segnale.
- Analizzare il T dati 1 misurando l'intensità di segnale S per ogni tempo di inversione (TI). Poi, inserire i valori di S per una inversione di recupero con ridotta modello pre-delay:
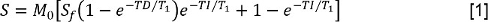
dove M 0 è una intensità di segnale che rappresenta la magnetizzazione allo stato di equilibrio, S f è il rapporto di inversione,e TD è il tempo di pre-delay. Poi, inserire i dati con FS per lo stesso modello, che consente la determinazione del tempo di rilassamento longitudinale costante con FS, T 1, FS. - Analizzare il T 2 dati misurando S ad ogni TE. Poi, inserire i dati in un modello di decadimento mono-esponenziale:

dove N è il segnale di offset al basale. Il lettore può anche decidere di inserire i dati in un modello multi-esponenziale, come quello qui sotto:
dove J è il numero di componenti esponenziali e j f e T 2, sono la frazione di segnale e T 2 valori associato al j esima componente. In alternativa, il lettore può utilizzare un metodo di 3 minimi quadrati non negativi (NNLS). Nel lcaso Atter, il Multi-esponenziale rilassamento Analysis (Mera) Toolbox 33 è liberamente disponibile; altri programmi sono disponibili anche. Ripetere queste analisi per i dati con e senza FS. - Per analizzare i dati QMT, misurare S per ogni potenza di irradiazione e la frequenza di offset. Correggere i poteri irradiazione nominali (rappresentate da ω 1 nell'equazione sotto) utilizzando delle mappe angolo nutazione. Correggere gli offset di frequenza (Δ f nell'equazione sotto) utilizzando il B 0 mappe per regolare le frequenze di offset applicate. Poi, inserire i dati per il seguente modello 34,35
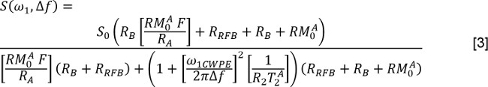
dove è il tasso di cambio dalla piscina macromolecolare per la piscina di acqua libera, è la velocità di rilassamento longitudinale della piscina di acqua libera, è la velocità di rilassamento longitudinale della piscina macromolecolare (presume essere 1 s -1), è il PSR, è T 2 della piscina di acqua libera e ω 1CWPE è la potenza media dell'impulso saturazione. Il tasso di saturazione della magnetizzazione longitudinale della piscina macromolecolare, è descritto da un modello super-Lorentzian, come descritto nel lavoro di Henkelman e colleghi 34,35. - Per analizzare i dati DTI, prima di utilizzare un algoritmo di trasformazione affine 36 per registrare ogni immagine pesata in diffusione al corrispondente immagine ponderata non diffusione. Quindi, per ogni pixel, misurare i valori di S nell'immagine pesata non-diffusione e rispettivamente pesata in diffusione. Formare una matrice composta direzioni codifica diffusione. Utilizzando multivariata, ponderata di regressione dei minimi quadrati, regredire i dati del segnale sulla matrice codifica diffusione e la forma D. Diagonalizzare D ed eseguire una magnitudo-smistamento degli autovalori e delle loro autovettori. Quindi calcolare la diffusività media (MD) come:

dove λ 1, λ 2 e λ 3 sono gli autovalori del tensore di diffusione. calcola anche l'anisotropia frazionaria (FA) come:
- Analizzare i dati FWMRI utilizzando un approccio quantitativo che separa i segnali acqua e grasso sulla base di spostamento chimico (come ad esempio l'algoritmo FattyRiot, disponibile per il download gratuito da https://github.com/welcheb/FattyRiot).
- Definire regioni di interesse per l'analisi
- Specificare ROI sulle immagini anatomiche (definendo i confini di ogni muscolo di interesse). Un esempio è mostrato in Figura 1.
- Ridimensionare le ROI in base alle dimensioni della matrice delle immagini qMRI. Se necessario, regolare l'allineamento delle ROI per abbinare la mappa qMRI (ad esempio, se il partecipante spostatotra le acquisizioni, una traduzione della posizione ROI potrebbe essere necessaria per evitare la sovrapposizione dei confini muscolari).
- Esaminate ogni ROI. Se necessario, assicurarsi che nessun pixel sono compresi che contengono manufatti parziali del volume, di tessuto non contrattile, e manufatti di flusso; si veda la Figura 1 per esempi.
- Calcolare la media e la deviazione standard dei valori qMRI in tutti i pixel all'interno delle ROI selezionati.
Risultati
La figura 1 mostra immagini anatomiche assiali rappresentativi acquisiti alla metà coscia di un paziente con polimiosite. Viene anche mostrato la posizione della proiezione in piano del volume spessore. Mappe parametri rappresentativi per ciascun metodo qMRI, tutti ottenuti da questo stesso paziente, sono forniti dalle figure 2 - 7.
Le figure 2A e 2B mostrano...
Discussione
malattie muscolari come le distrofie muscolari e le miopatie infiammatorie idiopatiche costituiscono di un gruppo di malattie che sono eterogenee in eziologia e, come entità individuali, rara nella loro incidenza. Ad esempio, la distrofia muscolare di Duchenne - la forma più comune di distrofia muscolare - ha un'incidenza di 1 su 3.500 maschi nati vivi 37,38; dermatomiosite, a cui è stato applicato questo protocollo, ha un'incidenza di 1 su 100.000 39. La maggiore incidenza collettiva di...
Divulgazioni
None of the authors has a financial conflict of interest to report.
Riconoscimenti
We acknowledge grant support from the National Institutes of Health: NIH/NIAMS R01 AR050101 (BMD), NIH/NIAMS R01 AR057091 (BMD/JHP), NIH/NIBEB K25 EB013659 (RDD), and the Vanderbilt CTSA award RR024975. We also thank the reviewers for the comments and the subject for participating in these studies.
Materiali
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| 3T human MRI system | Philips Medical Systems (Best, the Netherlands) | Achieva/Intera | |
| Cardiac phased array receive coil | Philips Medical Systems | ||
| Pillows, straps, bolsters, and other positioning devices | |||
| Computer with MATLAB software | The Mathworks, Inc (Natick, MA) | r. 2014 |
Riferimenti
- Wokke, B. H., et al. Comparison of Dixon and T1-weighted MR methods to assess the degree of fat infiltration in duchenne muscular dystrophy patients. J Magn Reson Imaging. 38 (3), 619-624 (2013).
- Carr, H., Purcell, E. Effects of diffusion on free precession in NMR experiments. Phys Rev. 94, 630-638 (1954).
- Whittall, K. P., MacKay, A. L. Quantitative interpretation of NMR relaxation data. Journal of Magnetic Resonance. 84 (1), 134-152 (1989).
- Park, J. H., et al. Dermatomyositis: correlative MR imaging and P-31 MR spectroscopy for quantitative characterization of inflammatory disease. Radiology. 177 (2), 473-479 (1990).
- Park, J. H., et al. Magnetic resonance imaging and p-31 magnetic resonance spectroscopy provide unique quantitative data useful in the longitudinal management of patients with dermatomyositis. Arthritis & Rheumatism. 37 (5), 736-746 (1994).
- Park, J. H., et al. Use of magnetic resonance imaging and p-31 magnetic resonance spectroscopy to detect and quantify muscle dysfunction in the amyopathic and myopathic variants of dermatomyositis. Arthritis & Rheumatism. 38 (1), 68-77 (1995).
- Huang, Y., et al. Quantitative MR relaxometry study of muscle composition and function in Duchenne muscular dystrophy. J Magn Reson Imaging. 4 (1), 59-64 (1994).
- Kim, H. K., et al. T2 mapping in Duchenne muscular dystrophy: distribution of disease activity and correlation with clinical assessments. Radiology. 255 (3), 899-908 (2010).
- Arpan, I., et al. T2 mapping provides multiple approaches for the characterization of muscle involvement in neuromuscular diseases: a cross-sectional study of lower leg muscles in 5-15-year-old boys with Duchenne muscular dystrophy. NMR in Biomedicine. 26 (3), 320-328 (2013).
- Fan, R. H., Does, M. D. Compartmental relaxation and diffusion tensor imaging measurements in vivo in λ-carrageenan-induced edema in rat skeletal muscle. NMR in Biomedicine. 21 (6), 566-573 (2008).
- Sled, J. G., Pike, G. B. Quantitative interpretation of magnetization transfer in spoiled gradient echo MRI sequences. J Magn Reson. 145 (1), 24-36 (2000).
- Gochberg, D. F., Gore, J. C. Quantitative magnetization transfer imaging via selective inversion recovery with short repetition times. Magn Reson Med. 57 (2), 437-441 (2007).
- Li, K., et al. Optimized inversion recovery sequences for quantitative T1 and magnetization transfer imaging. Magn Reson Med. 64 (2), 491-500 (2010).
- Louie, E. A., Gochberg, D. F., Does, M. D., Damon, B. M. Magnetization transfer and T2 measurements of isolated muscle: effect of pH. Magn Reson Med. 61 (3), 560-569 (2009).
- Sinclair, C. D. J., et al. Quantitative magnetization transfer in in vivo healthy human skeletal muscle at 3 T. Magn Reson Med. 64 (6), 1739-1748 (2010).
- Sinclair, C., et al. Multi-parameter quantitation of coincident fat and water skeletal muscle pathology. Proc 21st Ann Meeting ISMRM. , (2013).
- Bryant, N., et al. Multi-parametric MRI characterization of inflammation in murine skeletal muscle. NMR Biomed. 27 (6), 716-725 (2014).
- Aisen, A. M., Doi, K., Swanson, S. D. Detection of liver fibrosis with magnetic cross-relaxation. Magn Reson Med. 31 (5), 551-556 (1994).
- Kim, H., et al. Induced hepatic fibrosis in rats: hepatic steatosis, macromolecule content, perfusion parameters, and their correlations-preliminary MR imaging in rats. Radiology. 247 (3), 696-705 (2008).
- Basser, P. J., Mattiello, J., LeBihan, D. MR diffusion tensor spectroscopy and imaging. Biophys J. 66 (1), 259-267 (1994).
- Heemskerk, A., Strijkers, G., Drost, M., van Bochove, G., Nicolay, K. Skeletal muscle degeneration and regeneration following femoral artery ligation in the mouse: diffusion tensor imaging monitoring. Radiology. 243 (2), 413-421 (2007).
- Zaraiskaya, T., Kumbhare, D., Noseworthy, M. D. Diffusion tensor imaging in evaluation of human skeletal muscle injury. J Magn Reson Imaging. 24 (2), 402-408 (2006).
- Qi, J., Olsen, N. J., Price, R. R., Winston, J. A., Park, J. H. Diffusion-weighted imaging of inflammatory myopathies: polymyositis and dermatomyositis. J Magn Reson Imaging. 27 (1), 212-217 (2008).
- McMillan, A. B., Shi, D., Pratt, S. J., Lovering, R. M. Diffusion tensor MRI to assess damage in healthy and dystrophic skeletal muscle after lengthening contractions. J Biomed Biotech. , (2011).
- Scheel, M., et al. Fiber type characterization in skeletal muscle by diffusion tensor imaging. NMR Biomed. 26 (10), 1220-1224 (2013).
- Kaufman, L. D., Gruber, B. L., Gerstman, D. P., Kaell, A. T. Preliminary observations on the role of magnetic resonance imaging for polymyositis and dermatomyositis. Annalsrheumatic Dis. 46 (8), 569-572 (1987).
- Dixon, W. T. Simple proton spectroscopic imaging. Radiology. 153 (1), 189-194 (1984).
- Glover, G. H. Multipoint Dixon technique for water and fat proton and susceptibility imaging. J Magn Reson Imaging. 1 (5), 521-530 (1991).
- Berglund, J., Kullberg, J. Three-dimensional water/fat separation and T2* estimation based on whole-image optimization--application in breathhold liver imaging at 1.5 T. Magn Reson Med. 67 (6), 1684-1693 (2012).
- Gloor, M., et al. Quantification of fat infiltration in oculopharyngeal muscular dystrophy: Comparison of three MR imaging methods. J Magn Reson Imaging. 33 (1), 203-210 (2011).
- Fischmann, A., et al. Quantitative MRI and loss of free ambulation in Duchenne muscular dystrophy. J Neurol. 260 (4), 969-974 (2013).
- Li, K., et al. Multi-parametric MRI characterization of healthy human thigh muscles at 3.0 T - relaxation, magnetization transfer, fat/water, and diffusion tensor imaging. NMR Biomed. 27 (9), 1070-1084 (2014).
- Morrison, C., Stanisz, G., Henkelman, R. M. Modeling magnetization transfer for biological-like systems using a semi-solid pool with a super-Lorentzian lineshape and dipolar reservoir. J Magn Reson Series B. 108 (2), 103-113 (1995).
- Li, J. G., Graham, S. J., Henkelman, R. M. A flexible magnetization transfer line shape derived from tissue experimental data. Magn Reson Med. 37 (6), 866-871 (1997).
- Mangin, J. F., Poupon, C., Clark, C., Le Bihan, D., Bloch, I. Distortion correction and robust tensor estimation for MR diffusion imaging. Med Image Anal. 6 (3), 191-198 (2002).
- Moser, H. Duchenne muscular dystrophy: pathogenetic aspects and genetic prevention. Hum Genet. 66 (1), 17-40 (1984).
- van Essen, A. J., Busch, H. F., te Meerman, G. J., ten Kate, L. P. Birth and population prevalence of Duchenne muscular dystrophy in The Netherlands. Hum Genet. 88 (3), 258-266 (1992).
- Bendewald, M. J., Wetter, D. A., Li, X., Davis, M. P. Incidence of dermatomyositis and clinically amyopathic dermatomyositis: A population-based study in olmsted county, minnesota. Arch Dermatol. 146 (1), 26-30 (2010).
- Carlier, P. G. Global T2 versus water T2 in NMR imaging of fatty infiltrated muscles: different methodology, different information and different implications. Neuromuscul Disord. 24 (5), 390-392 (2014).
- Foley, J. M., Jayaraman, R. C., Prior, B. M., Pivarnik, J. M., Meyer, R. A. MR measurements of muscle damage and adaptation after eccentric exercise. J Appl Physiol. 87 (6), 2311-2318 (1999).
- Garrood, P., et al. MR imaging in Duchenne muscular dystrophy: quantification of T1-weighted signal, contrast uptake, and the effects of exercise. J Magn Reson Imaging. 30 (5), 1130-1138 (2009).
- Bratton, C. B., Hopkins, A. L., Weinberg, J. W. Nuclear magnetic resonance studies of living muscle. Science. 147, 738-739 (1965).
- Fleckenstein, J. L., Canby, R. C., Parkey, R. W., Peshock, R. M. Acute effects of exercise on MR imaging of skeletal muscle in normal volunteers. AJR Am J Roentgenol. 151 (2), 231-237 (1988).
- Williams, S., Heemskerk, A., Welch, E., Damon, B., Park, J. The quantitative effects of inclusion of fat on muscle diffusion tensor MRI measurements. J Magn Reson Imaging. 38 (5), 1292-1297 (2013).
- Hernando, D., et al. Removal of olefinic fat chemical shift artifact in diffusion MRI. Magn Reson Med. 65 (3), 692-701 (2011).
- Willcocks, R. J., et al. Longitudinal measurements of MRI-T2 in boys with Duchenne muscular dystrophy: effects of age and disease progression. Neuromuscul Disord. 24 (5), 393-401 (2014).
- Poon, C. S., Henkelman, R. M. Practical T2 quantitation for clinical applications. J Magn Reson Imaging. 2 (5), 541-553 (1992).
- Does, M. D., Gore, J. C. Complications of nonlinear echo time spacing for measurement of T2. NMR Biomed. 13 (1), 1-7 (2000).
- Poon, C. S., Henkelman, R. M. 180° refocusing pulses which are insensitive to static and radiofrequency field inhomogeneity. J Magn Reson. 99 (1), 45-55 (1992).
- Hollingsworth, K. G., de Sousa, P. L., Straub, V., Carlier, P. G. Towards harmonization of protocols for MRI outcome measures in skeletal muscle studies: consensus recommendations from two TREAT-NMD NMR workshops, 2 May 2010, Stockholm, Sweden, 1-2 October 2009, Paris, France. Neuromuscul Disord. 22, S54-S67 (2010).
- Underhill, H. R., Rostomily, R. C., Mikheev, A. M., Yuan, C., Yarnykh, V. L. Fast bound pool fraction imaging of the in vivo rat brain: Association with myelin content and validation in the C6 glioma model. Neuroimage. 54 (3), 2052-2065 (2011).
- Smith, S. A., et al. Quantitative magnetization transfer characteristics of the human cervical spinal cord in vivo: application to adrenomyeloneuropathy. Magn Reson Med. 61 (1), 22-27 (2009).
- Li, K. D. R., Dortch, R. D., Gochberg, D. F., Smith, S. A., Damon, B. M., Park, J. H. Quantitative magnetization transfer with fat component in human muscles. Proc. 20th Ann Meeting ISMRM. , (2012).
- Damon, B. M. Effects of image noise in muscle diffusion tensor (DT)-MRI assessed using numerical simulations. Magn Reson Med. 60 (4), 934-944 (2008).
- Damon, B. M., Buck, A. K. W., Ding, Z. Diffusion-tensor MRI-based skeletal muscle fiber tracking. Imaging Med. 3 (6), 675-687 (2011).
- Froeling, M., Nederveen, A. J., Nicolay, K., Strijkers, G. J. DTI of human skeletal muscle: the effects of diffusion encoding parameters, signal-to-noise ratio and T2 on tensor indices and fiber tracts. NMR in Biomedicine. 26 (11), 1339-1352 (2013).
- Basser, P. J., Pajevic, S. Statistical artifacts in diffusion tensor MRI (DT-MRI) caused by background noise. Magn Reson Med. 44 (1), 41-50 (2000).
- Anderson, A. W. Theoretical analysis of the effects of noise on diffusion tensor imaging. Magn Reson Med. 46 (6), 1174-1188 (2001).
- Saupe, N., White, L. M., Stainsby, J., Tomlinson, G., Sussman, M. S. Diffusion tensor imaging and fiber tractography of skeletal muscle: optimization of B value for imaging at 1.5 T. AJR Am J Roentgenol. 192 (6), W282-W290 (2009).
- Levin, D. I., Gilles, B., Madler, B., Pai, D. K. Extracting skeletal muscle fiber fields from noisy diffusion tensor data. Med Image Anal. 15 (3), 340-353 (2011).
- Sinha, U., Sinha, S., Hodgson, J. A., Edgerton, R. V. Human soleus muscle architecture at different ankle joint angles from magnetic resonance diffusion tensor imaging. J Appl Physiol. 110 (3), 807-819 (2011).
- Jones, D. K., Cercignani, M. Twenty-five pitfalls in the analysis of diffusion MRI data. NMR Biomed. 23 (7), 803-820 (2010).
- Hamilton, G., et al. In vivo characterization of the liver fat 1H MR spectrum. NMR Biomed. 24 (7), 784-790 (2011).
- Hernando, D., Kellman, P., Haldar, J. P., Liang, Z. P. Robust water/fat separation in the presence of large field inhomogeneities using a graph cut algorithm. Magn Reson Med. 63 (1), 79-90 (2010).
- Hernando, D., Hines, C. D., Yu, H., Reeder, S. B. Addressing phase errors in fat-water imaging using a mixed magnitude/complex fitting method. Magn Reson Med. 67 (3), 638-644 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon