Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un ensayo biológico Volumen pequeños para evaluar bacteriana / fitoplancton Co-cultura Usando AGUA-Pulse-Amplitud Modulada (AGUA-PAM) Fluorometría
En este artículo
Resumen
The goal of this procedure is to demonstrate the reproducibility and adaptability of using a microtiter plate format for microalgal screening. This rapid screen combines WATER-Pulse-Amplitude-Modulated (WATER-PAM) fluorometry to measure photosynthetic yield as an indicator of Photosystem II (PSII) health with small volume bacterial-algal co-cultures.
Resumen
Los métodos convencionales para la manipulación experimental de microalgas han empleado grandes volúmenes de cultivo (20 ml a 5 L), de manera que el cultivo puede dividirse en submuestras durante todo el experimento 1-7. El submuestreo de grandes volúmenes puede ser problemático por varias razones: 1) que causa la variación en el volumen total y el área superficial: relación de volumen de la cultura durante el experimento; 2) pseudo-replicación (es decir, muestras repetidas de un mismo frasco de tratamiento 8) a menudo se emplea en lugar de repeticiones verdaderas (es decir, el muestreo de los tratamientos replicados); 3) la duración del experimento es limitada por el volumen total; y 4) los cultivos axénicos o la microbiota bacteriana habitual son difíciles de mantener durante los experimentos a largo plazo ya que la contaminación ocurre comúnmente durante el submuestreo.
El uso de placas de microtitulación permite volúmenes de cultivo 1 ml de ser utilizados para cada replicar, con hasta 48 tratamientos separados dentro deuna placa de 12,65 cm x 8,5 x 2,2, disminuyendo de ese modo el volumen experimental y permitiendo la replicación extensa sin submuestreo cualquier tratamiento. Además, esta técnica puede ser modificada para adaptarse a una variedad de formatos experimentales, incluyendo: bacteriana-co-cultivos de algas, pruebas de fisiología de algas, y la toxina de detección 9-11. Pozos individuales con un alga, bacteria y / o co-cultivos pueden ser degustados por numerosos procedimientos de laboratorio, incluyendo, pero no limitado a: AGUA-Pulse-Amplitud Modulada (AGUA-PAM) fluorometría, microscopía, unidad de colonia de bacterias (UFC) condes y citometría de flujo. La combinación del formato de placa de microtitulación y agua-PAM fluorometría permite múltiples mediciones rápidas de rendimiento fotoquímico y otros parámetros fotoquímicos con baja variabilidad entre las muestras, alta reproducibilidad y evita las muchas trampas de submuestreo una bombona o matraz cónico en el transcurso de un experimento .
Introducción
Fisiología fitoplancton tradicionalmente se ha estudiado en experimentos meso-escala que van desde 20 ml en matraces cónicos de 5 L en bombonas 1-7. Esta escala experimental requiere submuestreo para el seguimiento experimental, como sacrificar muestras repetidas para cada momento crea un montaje experimental inmanejable.
La capacidad de aumentar el número de experimentos independientes, mientras que utilizando el mismo espacio de la incubadora diurna por miniaturizar el volumen experimental para experimentos de fisiología de algas ayuden a reducir o eliminar las limitaciones de submuestreo y pseudo-replicación de grandes volúmenes. Un formato de placa de microtitulación se ha desarrollado para bioensayos de algas utilizando un volumen de cultivo 1 ml para manipular experimentalmente algas en condiciones variables. Este pequeño volumen experimental permite el número de repeticiones que se incremente, aumenta la reproducibilidad experimental debido a una variabilidad disminuido entre muestras replicadas yexperimentos, y permite cierto replicación manteniendo controles experimentales (es decir, cultivos de algas axénicos) de 140 días (Figura 2) 12.
Este formato de placa de microtitulación se adapta fácilmente para una variedad de preguntas experimentales, tales como: una bacteria no tiene una interacción simbiótica, neutral o patógena con su anfitrión de algas? Es la adición de un compuesto estimulante o tóxicas para un alga? Estas y otras cuestiones se pueden abordar en una rápida forma de alto rendimiento utilizando este nuevo formato 9-11.
Una placa de cultivo de microtitulación de 48 pocillos permite que cada 1 ml bien para ser un montaje experimental independiente que se muestrea en un único punto de tiempo. Varios parámetros se pueden tomar de este volumen 1 ml incluyendo, pero no limitado a: fluorescencia de la clorofila y los parámetros fotoquímicos usando-Amplitud Modulada AGUA-Pulse (AGUA-PAM) fluorometría (ver Materiales y mesa Equipo) 13. Fluorometría AGUA-PAM es una técnica rápida y no invasiva que se puede utilizar para monitorear experimentos realizados con algas 13. Permite la medición de la eficiencia fotosintética y la salud PSII de un volumen de cultivo pequeño (150 a 300 l de cultivo diluido en medio a un 2 - volumen 4 ml de AGUA-PAM) 14,15. Además de fluorometría AGUA-PAM, esta configuración se puede utilizar para medir una variedad de otros parámetros incluyendo, pero no limitado a: la microscopía para visualizar las bacterias adheridas a las células de algas y los cambios en la morfología de células de algas; colonia de bacterias que forman el recuento (ufc) de la unidad; y citometría de flujo para el recuento de células de algas y subpoblaciones de identificación.
Protocolo
1. Los cálculos para el programa de instalación experimental
- Calcular el volumen de algas y / o cultivos bacterianos necesarios para los controles que se requieren para todo el experimento mediante el uso de la Ecuación 1:
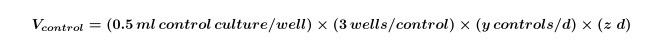
Donde y es igual al número de los controles necesarios por día y z es igual al número de días. - Calcular el volumen de cultivos de algas y / o bacterianas que se necesitan para co-cultivos para el experimento utilizando la ecuación 2:
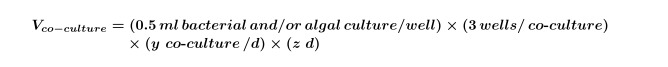
NOTA: Es posible sustituir los experimentos 'co-cultura' con cualquier pantalla compuesto; acaba de ajustar el compuesto final, el disolvente y las concentraciones de algas para ajustarse al diseño experimental. - Usar ecuaciones 1 y 2 para calcular el volumen final de cultivo de algas temprana-exponencial (comúnmente 5 días para ~ 10 4 células / ml, pero esto se debe determinar por performing una curva de crecimiento de las algas) requerido para el experimento (se necesita este volumen para el paso 2.3) utilizando la ecuación 3:

- Usar ecuaciones 1 y 2 para calcular el volumen final de 10 4 ufc / ml de cultivo bacteriano (o concentración de la inoculación deseado) requerido para el experimento (se necesita este volumen para el paso 4.2) usando la Ecuación 4:

NOTA: Utilice el adicional de 10 ml en pasos 1,3 y 1,4 para tener en cuenta el error pipetear y las pruebas que se realizan (por ejemplo, AGUA-PAM, citometría de flujo, microscopía, etc.) en 0 d. Aumente este volumen si es necesario para ajustarse al diseño experimental.
NOTA: Para obtener un ejemplo de cálculo de un experimento de 8 días ver la Sección 10. Ver la tabla suplementaria para las recetas de.
2. Cultivo de células de algas para la configuración experimental
- Aislar o obtener unacrecimiento activo cultivo de algas axénico.
- Transferencia asépticamente 10% del volumen final del cultivo de algas en un medio estéril de algas (por ejemplo, L1 o medio de algas marinas similares, véase Materiales y Equipo de mesa), asegurando una dilución 1: 9 de cultivo de algas en medio fresco. Cultivar el alga diluido en una incubadora diurna mediante condiciones de crecimiento previamente determinadas para esa cepa (por ejemplo, 18 ° C con un 16: 8 h luz: oscuridad ciclo es de uso común).
- Cuando el cultivo ha alcanzado la fase exponencial temprana, re-cultivo del alga en el mismo medio estéril de algas (por ejemplo, L1 o medio de algas marinas similar), asegurar la concentración final es una dilución 1: 9 y que el volumen final de las algas es igual a la V Una calculado (paso 1.3).
NOTA: Es importante garantizar que estas culturas son axénico. Pruebe todos los medios de algas y botellas de valores de algas para la contaminación mediante siembra de una alícuota de 20 l en un medio bacteriana marina general (por ejemplo, MarineCaldo 2216 suplementado con 1,5% de agar o similar). - Crecer cultivo de algas para primera fase exponencial (~ 10 4 células / ml).
NOTA: Cada cepa de algas tiene una curva de crecimiento único en función de las condiciones de cultivo. Fase exponencial temprana (~ 10 4 células / ml) se puede determinar mediante la realización de una curva de crecimiento de las algas sobre la base de la densidad celular (es decir, utilizando citometría de flujo o microscopía).
3. Preparación de células bacterianas para la inoculación
- Pre-determinar la concentración bacteriana (ufc / ml) y la densidad óptica (DO) de la bacteria en fase estacionaria haciendo una curva de crecimiento en las condiciones del medio y el crecimiento bacteriano elegido (por ejemplo, Marine Caldo de 2216 a 25 ° C y 160 rpm, o similar). Utilice esta información para cultivar las células (paso 3.3) y más tarde para diluir las células correctamente en el paso 3.7.
- Transferir asépticamente una colonia bacteriana aislada y recién crecido de una placa de agar 1,5% (por ejemplo, Marine Caldo 2216 flexiblementado con 1,5% de agar o medio sólido bacteriana marina similar) en 5 ml de medio líquido bacteriana (por ejemplo, Marine Broth 2216 o medio bacteriana marina similar).
- Crecer la bacteria hasta la fase estacionaria sobre un tambor de laminación o agitador (~ 12 a 36 h, dependiendo de la bacteria). Planificar el experimento de modo que la bacteria alcanza la fase estacionaria (~ 08 10 hasta 09 10 ufc / ml) al mismo tiempo que las células de algas han alcanzado la fase exponencial temprana (~ 10 4 células / ml).
- Con una pipeta, lavar cualquier biofilm adherido al tubo de ensayo en el medio. Pipeta 1 ml de cultivo bacteriano bien mezclada en una estéril 1,5 ml microtubo. Centrifugar durante 1 min a 14.000 x g.
- Retire y deseche el sobrenadante (medios de comunicación bacteriana) sin interrumpir el pellet (células bacterianas). Añadir 1 ml de medio estéril de algas (por ejemplo, L1 o similar) a la microtubo (con pellet). Microtubo Vortex para resuspender el sedimento en los medios de comunicación de algas.
- Segundo lavado:repita el paso 3.5.
NOTA: Es fundamental para lavar las células bacterianas con medios de algas con el fin de eliminar completamente todos los medios bacterianas, detritus celular, proteínas excretadas y pequeñas moléculas de las células antes de la inoculación de las algas con ellos, ya que esto podría cambiar la composición de nutrientes de los medios de comunicación de algas o introducir moléculas bioactivas a la pantalla. - Diluciones seriadas de las células bacterianas lavadas en medios de algas, a una concentración final que es 100 veces más concentrada que la concentración bacteriana final deseado (ufc / ml). Guarde el microtubo que contiene células que han sido lavadas y diluidas en medios de algas para la etapa 4.2.
NOTA: Planificar el experimento basado en tener una relación 1: 1 de las algas a las bacterias en 0 d. Para ello la concentración bacteriana inicial, el deseado para el experimento es 10 4 ufc / mL, por lo que en el paso 3.7 las células iniciales deben ser diluidas en serie a 10 6 ufc / ml.
4. Las bacterias Preparación para el Experimentoal programa de instalación
- Preparar 4 matraces cónicos de vidrio esterilizados en autoclave estériles y etiquetarlos: a) 'frasco de algas control ", b)" lote diluido bacteriana frasco', c) 'frasco de control bacteriano', y d) 'frasco co-cultura ".
- Diluir la suspensión bacteriana a partir de paso 3.7 1:99 con los medios de algas estériles a un volumen final = V B (paso 1.4). Hacer la dilución del stock bacteriana diluida frasco rotulado (paso 4.1).
NOTA: En el ejemplo anterior (paso 4.2), esta dilución 1:99 da una concentración final de 10 4 ufc / ml. Matraz de remolino para mezclar las células. - Pipeta de control V (paso 1.1) de la cepa bacteriana diluida y ponerla en el matraz de control bacteriano.
- Control V pipeta de medio estéril de algas en el matraz de control bacteriana (esta es una dilución 1: 1). Frasco de remolino para mezclar las células y dejar de lado para el paso 7.3.
- Pipeta V co-cultivo de la cepa bacteriana diluidamatraz al matraz de co-cultivo, frasco reservado para el paso 6.1.
NOTA: Al hacer múltiples co-cultivos en la misma alga a la vez (es decir, un co-cultivo de dos bacterias diferentes aislados con un control), es necesario volver a calcular el V co-cultivo para cada cepa individual y luego repita el paso 4,5 por cada co-cultivo por separado. También es necesario aumentar la V A calculado en el paso 1.3 para incluir ambos co-cultivos que se muestran en la Ecuación 5: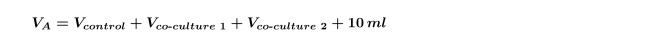
5. Preparación de algas para la instalación experimental
- Mezclar suavemente el cultivo de algas y principios exponencial (desde el paso 2.4) con una punta de pipeta de boca ancha hasta que las células parecen bien mezclado.
- Control V pipeta de las existencias botella de algas en el matraz de control de algas. Pipetear suavemente utilizando una pipeta de 10 ml. A continuación, regrese la botella stock de algas en la incubadora diurna.
- Pipeta V control de medio de algas estéril al matraz de control de algas (esta es una dilución 1: 1). Agitar para mezclar frasco y colocar en la incubadora diurna, hasta que sea necesario para el paso 7.4.
6. Preparación experimental Co-cultura
- Pipetear suavemente V co-cultivo del frasco stock de algas en el matraz co-cultivo de bacterias desde el paso 4.5. Volver frasco de co-cultivo de la incubadora diurna hasta que sea necesario para el paso 7.5.
NOTA: La concentración de bacterias en el control bacteriana debe ser igual a la concentración bacteriana en el co-cultivo experimental. Del mismo modo, la concentración de algas en el control de algas debe ser igual a la concentración de algas en el co-cultivo experimental. Al tener las mismas concentraciones de bacterias y algas iniciales, la densidad de población se puede comparar todo el experimento.
7. La creación de placas de microtitulación
- Dividir una placa de microtitulación de 48 pocillos estéril según la Figura 1.Etiquetar encima pocillos exteriores que contienen las muestras ya sea de diluyente estéril o no fotosintéticos.
NOTA: La aleatorización de los pocillos de la placa se puede hacer para las muestras tomadas en el mismo día. Por ejemplo, el cuadrante 1 será muestreada a 1 d en el experimento; los pozos que deben ser aleatorizados son B2 - 4 y C2 - 4. Dejar el perímetro de la placa de llenado de solución estéril como se muestra en la Figura 1.
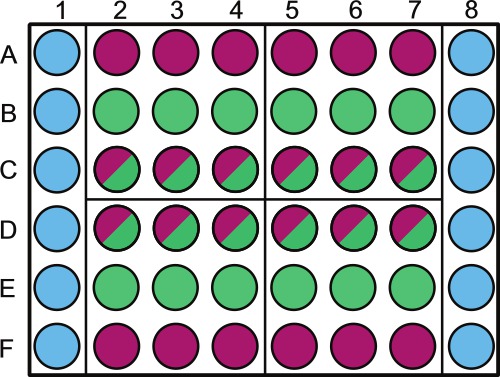
. Figura 1. Representación esquemática de la colocación de la muestra en una placa de microtitulación de 48 pocillos Wells se requerirá la realización de la siguiente manera: las columnas 1 y 6, pozos de la A a la F (  ) Se llenan con 1 ml de PBS 1x (u otra solución / media estéril). Filas A y F, pozos 2-8 (
) Se llenan con 1 ml de PBS 1x (u otra solución / media estéril). Filas A y F, pozos 2-8 (  ) Se llenan con 1 ml de control bacteriano; rows B y E pozos 2-8 (
) Se llenan con 1 ml de control bacteriano; rows B y E pozos 2-8 (  ) Se llenan con 1 ml de control de algas; filas C y D, los pozos 2-8 (
) Se llenan con 1 ml de control de algas; filas C y D, los pozos 2-8 (  ) Se llenan con 1 ml de co-cultivo. La placa se divide en 4 cuadrantes (A2, A5, D2 y D5) estos cuadrantes son cada día de muestreo específicos 1-4, esta deberá efectuarse al azar a lo largo de las placas y etiquetados en consecuencia. Dentro de cada día le recomendamos que asignaron al azar el control de algas (
) Se llenan con 1 ml de co-cultivo. La placa se divide en 4 cuadrantes (A2, A5, D2 y D5) estos cuadrantes son cada día de muestreo específicos 1-4, esta deberá efectuarse al azar a lo largo de las placas y etiquetados en consecuencia. Dentro de cada día le recomendamos que asignaron al azar el control de algas (  ) Y co-cultivo (
) Y co-cultivo (  ) pozos utilizando un generador de números aleatorios. Etiqueta de la tapa sobre el PBS 1x y / o pozos de control de bacterias para evitar el sombreado de cultivos de algas.
) pozos utilizando un generador de números aleatorios. Etiqueta de la tapa sobre el PBS 1x y / o pozos de control de bacterias para evitar el sombreado de cultivos de algas.
- Pipetear 1 ml de solución tampón de fosfato 1x (PBS, pH 7,4) u otra solución estéril en los pocillos apropiados como se indica en la Figura 1. Realice esto lentamente y con cuidado. PBS hará change la fuerza iónica del medio de algas y / o co-cultivo si se salpica en otros pozos para manejan con cuidado.
- Pipeta 1 ml de cultivo de control bacteriano en los pozos de control etiquetada bacteriana (Figura 1). Agitar el matraz bacteriana antes de pipetear cada placa para evitar la sedimentación bacteriana.
- Pipeta 1 ml de la cultura de control de algas en los pozos etiquetados de control de algas con una punta de pipeta de boca ancha (Figura 1). Agitar el matraz de algas con la regularidad que el frasco de bacterias. Si el alga tiende a hundirse o flotar, agitar con la regularidad que se necesita para mantener una cultura visual uniforme.
- Con una punta de pipeta de boca ancha, una pipeta 1 ml de co-cultivo en los pocillos apropiados (Figura 1). Remolinos del matraz de cultivo conjunto con la regularidad que el frasco de algas.
- Selle cada placa con parafilm y el lugar en una incubadora diurna a la temperatura deseada y ciclo de luz diurna (18 ° C con un 16: 8 h luz: oscuridad ciclo es de uso general). Dejarlas placas en la incubadora diurna hasta que esté listo para tomar lecturas PAM (Sección 8). Asegurarse de todas las placas están orientadas en la misma dirección para permitir la exposición a la luz coherente.
- Tomar una alícuota de 20 l de la PBS, medios de algas, las algas de valores y el control de algas y colocar la placa sobre un medio no selectivo apropiado (por ejemplo, Marine Caldo 2216 suplementado con 1,5% de agar) y se incuban las placas a 18 - 25 ° C durante 72 hr para la prueba de contaminación. Si el crecimiento aparece en ninguna de las soluciones que no debe contener bacterias, a continuación, no se deben utilizar estos datos.
- Tome lecturas PAM fluorometrıa utilizando la muestra restante de los frascos de control y de co-cultivo de algas para la experimental 0 d PAM fluorometrıa lectura (véase el paso 8.1). Cualesquiera otras mediciones 0 D también se deben realizar con el control de algas restante, control de bacterias y muestras de co-cultivo.
8. Toma de Lecturas PAM Fluorometría de muestras de archivo
- Cero el AGUA-PAMcon medios de algas estériles en una cubeta limpia antes de tomar lecturas 8.
- Pipetear 300 l de matraces de control o de co-cultivo de algas en una cubeta limpia que contiene 2,7 ml del mismo medio de algas usado en el experimento. Mezclar la muestra y el diluyente suavemente con una punta ancha boca pipeta.
- Limpie-off todas las huellas digitales de fuera de la cubeta con un pañuelo de papel antes de colocar la cubeta en el AGUA-PAM.
- Colocar la cubeta en AGUA-PAM. Cubra la muestra con la tapa y deje que se adapte oscuro durante 3 min. Tiempos de adaptación a la oscuridad varían dependiendo de las especies de algas y deben ser determinado para el alga específico utilizado en el experimento. Evite largos tiempos de adaptación a la oscuridad (> 20 min) tomando lecturas AGUA-PAM durante la mitad del ciclo de oscuridad de las incubadoras diurnas algas 16,17.
- Después de adaptación oscura, golpeó F 0 botón. Si las lecturas de fluorescencia están por encima de 3900, diluir la muestra 1: 1 en medio de algas. Dark-adaptación para un 3 minutos y tak adicionalea nueva lectura. Si los F 0 o F M lecturas son todavía por encima de 3900, continuará para diluir la muestra 1: 1 en medio de algas hasta que los F 0 y F m lecturas están por debajo de 3.900.
NOTA: Asegúrese de dar cuenta de estas diluciones al grabar fluorescencia definitiva: por ejemplo, si la muestra de algas se diluye 1: 9 durante la transferencia inicial del pozo al tubo de dilución, a continuación, la lectura de fluorescencia de las algas de 500 se debe multiplicar por el inverso del factor de dilución (en este caso 10) y la fluorescencia real del tubo es entonces 5.000. - Después de ajustar F 0, tome un pulso saturar (SAT-Pulse) leyendo cada 90 segundos pulsando el botón SAT para tomar lecturas m F. El intervalo de tiempo entre las lecturas se puede ajustar dependiendo de la cepa de algas. Muestra Descartar.
- Repita los pasos 08.01 a 08.06 para el resto de muestras.
9. Toma de Lecturas PAM Fluorometría de placas de microtitulación
- Etiqueta6 tubos de muestras estériles de> 3 ml de volumen para los pozos B2 - 4 para el control y pozos de algas C2 - 4 para el co-cultivo de bacterias (ver disposición de la placa en la Figura 1).
- Alícuota de 2,7 ml de medio estéril de algas en cada tubo.
- Colocar tubos en incubadora diurna y permitir que se aclimaten a la temperatura del alga se cultivó a 30 min.
- Antes de retirar la placa de microtitulación de la incubadora garantizar que la penetración de la luz en la oscuridad aclimatados pozos se limita cubriendo la placa con papel de aluminio (o similar), sólo retirar la lámina durante la transferencia activa de cultivo de los pozos para los tubos de dilución (pasos 9.5 - 9.7).
- Mezclar asépticamente la primera placa de microtitulación de (bien B2) con una pipeta de punta ancha boca lentamente pipeteando arriba y abajo.
- Obtener los tubos de dilución de la incubadora y asépticamente transferencia de 300 l de bien B2 (Figura 1) a su correspondiente tubo de muestra con una punta de pipeta de boca ancha (esto es una dilución 1: 9 de la muestra en un medio de algas).
- Repita los pasos 9.5 a 9.6 para los pozos restantes (B3,4 y C2 - 4).
- Cubra los tubos de muestra con papel de aluminio y devolverlos a la incubadora diurna hasta el momento de AGUA-PAM.
- Realizar lecturas AGUA-PAM como se describe en los pasos 8.1 a 8.7. Sellar la placa de microtitulación con parafilm antes de devolverla a la incubadora.
- Repetir las lecturas a intervalos de tiempo previstos para la duración del experimento. La frecuencia y la duración de la toma de muestras se deben planear en el principio del experimento.
Experimento 10. Muestra
El experimento muestra es un co-cultivo de 10 días con una bacteria (Phaeobacter gallaeciensis BS107) y una microalga (cepa Emiliania huxleyi (CCMP3266)). Incluye un control de algas, control bacteriano, y una bacteriana-algas experimental co-cultivo.
- Calcular volúmenes de cepas bacterianas y de algas necesarias (pasos 1.1-1,4)

- Preparar la población de algas, un V A de 40 ml, mediante la inoculación de 4 ml de alga en 36 ml de medio y se incubó hasta que se alcanza el crecimiento temprano-exponencial con una densidad celular de ~ 10 4 células / ml (pasos 2.1 a 2.4).
- Preparar el frasco stock bacteriana mediante la dilución de 400 l de las bacterias 10 6 ufc / ml obtenidos en la sección 3 a una V B de 40 ml con medios de algas (concentración final de bacterias será 10 4 ufc / ml).
- Medio de transferencia (20 ml) de la cepa bacteriana en el matraz de control bacteriano y agregar 20 ml de medio de algas para hacer el control de bacterias. Medio de transferencia (20 ml) de las existencias de algas en el matraz de control de algas y añadir 20 ml de medio de algas para compensar el control de algas (Sección 5). La transferencia de los restantes 20 ml de cepa bacteriana al matraz de co-cultivo y mezclar con los restantes 20 ml de existencias de algas para establecer el co-cultivo (Sección6).
- Pipetear los 1x PBS (pH 7,4), controles, y co-cultivo en dos placas de microtitulación pre-marcado (Figura 1), 1 ml por pocillo. Utilice 3 ml de los restantes controles y co-cultivos de hacer mediciones 0 d (recuentos ufc, AGUA-PAM (Sección 8), la observación microscópica de la morfología de células de algas, y fijación de células de algas para citometría de flujo).
- Tome lecturas AGUA-PAM para el control de algas y de co-cultivo una vez al día durante 10 días, y siempre en el mismo tiempo que las mediciones 0 d se tomaron (Sección 8).
11. otros parámetros de interés
- Determinar la concentración de ufc bacteriana: realizar una dilución en serie del control bacteriano y co-cultura en 1x PBS estéril (o similar), a continuación, colocar la placa hacia Marine Caldo 2216 suplementado con 1,5% de agar (o similar) y observar el número de ufc que crecen para determinar las bacterianas ufc / ml para cada pocillo 18.
- Para evaluar la concentración de células de algas: fijar el control de algas y la cooperacióncultivo con una concentración final de 0,15% de glutaraldehído. Incubar durante 10 minutos en la oscuridad, entonces congelación de flash en nitrógeno líquido y se almacena a -80 ° C. Proceso de todas las muestras en un citómetro de flujo (FACS Calibur o similar) para contar las células de algas.
- Observar la morfología celular de algas: cultivos de algas y algas bacteriana-co-cultivo utilizando microscopía (es decir, microscopía de luz, de epifluorescencia, o similar).
Resultados
Lecturas de fluorometría AGUA-PAM.
AGUA-Pulse-Amplitud Modulada (PAM) fluorometrıa es un método rápido y eficiente para determinar la fluorescencia (un proxy para el contenido de clorofila) y el rendimiento fotosintético (salud PSII) de cultivos de algas. El software PAM WinControl genera una hoja de cálculo de valores de datos en bruto para (los siguientes son los parámetros básicos para la adaptación a la oscuridad muestras de algas):
F = 0 flu...
Discusión
Crecimiento de las algas en un formato miniaturizado.
La miniaturización de los cultivos de algas a un volumen de cultivo 1 ml en una placa de microtitulación permite la replicación dentro de un experimento para ser aumentado. Es importante asegurar la alga es saludable durante un experimento; realizar una curva de crecimiento (Figura 2), utilizando el formato de placa de microtitulación para evaluar diversos medios de algas, para asegurar que se cumplan los requerimientos ...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work was supported by Natural Sciences and Engineering Research Council of Canada (grant 402105), Canadian Foundation for Innovation (grant 129087) and Alberta Education and Training (grant AAETRCP-12-026-SEG) to RJC.
Materiales
| Name | Company | Catalog Number | Comments |
| 10 cu. ft. Diurnal incubator (6012-1) | Caron Corporate | 112310-6012-1-11 | www.caronproducts.com |
| Nunc EasYFlask 25 cm2, Vent/Close Cap, 7 ml working volume, 200/cs | Thermo Fisher Scientific | N156340 | www.fishersci.ca |
| Multiwell TC Plates – 48-well | BD Biosciences Discovery Labware | 353078 | www.bdbiosciences.com |
| P1000 Gilson The Pipetting Standard—Gilson's Pipetman | Mandel Scientific Company Inc. | GF-F123602 | www.mandel.ca |
| P10mL Gilson The Pipetting Standard—Gilson's Pipetman | Mandel Scientific Company Inc. | GF-F161201 | www.mandel.ca |
| Wide Orifice Tips nonsterile [100–1,250 µl] | VWR International | 89079-468 | www.ca.vwr.com |
| Ultrafine Tips nonsterile [100–1,250 µl] | VWR International | 89079-470 | www.ca.vwr.com |
| Finntip 10 ml [Vol: 1 - 10 ml] | Thermo Fisher Scientific | 9402151 | www.fishersci.ca |
| WATER-Pulse Amplitude Modulation (Water-ED) | Heinz Walz GmbH, Effeltrich, Germany | EDEE0232 | www.walz.com |
| 15 mm diameter quartz glass cuvette (WATER-K) | Caron Corporate | www.caronproducts.com | |
| Sodium chloride (crystalline/certified ACS), Fisher Chemical | Thermo Fisher Scientific | Thermo Fisher Scientific | www.fishersci.ca |
| BD Difco Marine Broth 2216 | BD Biosciences Discovery Labware | BD Biosciences Discovery Labware | www.bdbiosciences.com |
| BD Bacto Agar | BD Biosciences Discovery Labware | BD Biosciences Discovery Labware | www.bdbiosciences.com |
| L1 Medium Kit, 50 L | NCMA [National Center for Marine Algae and Microbiota | NCMA [National Center for Marine Algae and Microbiota | www.ncma.bigelow.org |
Referencias
- Scarratt, M. G., Marchetti, A. Assessing microbial responses to iron enrichment in the Subarctic Northeast Pacific: Do microcosms reproduce the in situ condition?. Deep Sea Res Part II Top. Stud. Oceanogr. 53 (20-22), 2182-2200 (2006).
- Bidle, K. D., Haramaty, L., Barcelos E Ramos, J., Falkowski, P. Viral activation and recruitment of metacaspases in the unicellular coccolithophore, Emiliania huxleyi. Proc. Natl. Acad. Sci. U. S. A. 104 (14), 6049-6054 (2007).
- Moore, L. R., Goericke, R., Chisholm, S. W. Comparative physiology of Synechococcus and Prochlorococcus: influence of light and temperature on growth, pigments, fluorescence and absorptive. Mar. Ecol. Prog. Ser. 116, (1995).
- Iglesias-Rodriguez, M. D., Halloran, P. R. Phytoplankton calcification in a high-CO2 world. Science. 320 (5874), 336-340 (2008).
- Chen, M., Tang, H., Ma, H., Holland, T. C., Ng, K. Y. S., Salley, S. O. Effect of nutrients on growth and lipid accumulation in the green algae Dunaliella tertiolecta. Bioresour. Technol. 102 (2), 1649-1655 (2011).
- Lv, J. -. M., Cheng, L. -. H., Xu, X. -. H., Zhang, L., Chen, H. -. L. Enhanced lipid production of Chlorella vulgaris by adjustment of cultivation conditions. Bioresour. Technol. 101 (17), 6797-6804 (2010).
- Geider, R., Graziano, L., McKay, R. M. Responses of the photosynthetic apparatus of Dunaliella tertiolecta (Chlorophyceae) to nitrogen and phosphorus limitation. Eur. J. Phycol. 33 (4), 315-332 (1998).
- MacIntyre, H. L., Cullen, J. J. Using Cultures to Investigate the Physiological Ecology of Microalgae. Algal Cult. Tech. , 287-326 (2005).
- Blaise, C., Vasseur, P. Algal microplate toxicity test. Small-scale Freshw. Toxic. Investig. Vol. 1 Toxic. Test Methods. , 137-179 (2005).
- Skjelbred, B., Edvardsen, B., Andersen, T. A high-throughput method for measuring growth and loss rates in microalgal cultures. J. Appl. Phycol. 24, 1589-1599 (2012).
- Nagai, T., Taya, K., Annoh, H., Ishihara, S. Application of a fluorometric microplate algal toxicity assay for riverine periphytic algal species. Ecotoxicol. Environ. Saf. 94, 37-44 (2013).
- Seyedsayamdost, M. R., Case, R. J., Kolter, R., Clardy, J. The Jekyll-and-Hyde chemistry of Phaeobacter gallaeciensis. Nat. Chem. 3 (4), 331-335 (2011).
- Schreiber, U., Schliwa, U., Bilger, W. Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer. Photosynth. Res. 10 (1-2), 51-62 (1986).
- Jones, R. J., Ward, S., Amri, A. Y., Hoegh-Guldber, O. Changes in quantum efficiency of photosystem II of symbiotic dinoflagellates of corals after heat stress, and of bleached corals sampled after the 1998 Great Barrier Reef mass bleaching event. Mar. Freshw. Res. 51 (345), 659-668 (1998).
- Beer, S., Larsson, C., Poryan, O., Axelsson, L. Photosynthetic rates of Ulva (Chlorophyta) measured by pulse amplitude modulated fluorometry. Eur. J. Phycol. 35 (1), 69-74 (2000).
- . . WATER-PAM Chlorophyll Fluorometer. Instrument Description and Information for Users. , (2013).
- Maxwell, K., Johnson, G. M., Heers, J. Chlorophyll fluorescence--a practical guide. J. Exp. Bot. 51 (345), 659-668 (2000).
- Herigstad, B., Hamilton, M., Heersink, J. How to optimize the drop plate method for enumerating bacteria. J. Microbiol. Methods. 44 (2), 121-129 (2001).
- Kooten, O., Snel, J. The use of chlorophyll fluorescence nomenclature in plant stress physiology. Photosynth. Res. 25 (3), 147-150 (1990).
- Maxwell, K., Johnson, G. N. Chlorophyll fluorescence--a practical guide. J. Exp. Bot. 51 (345), 659-668 (2000).
- Schreiber, U. Pulse-Amplitude-Modulation (PAM) Fluorometry and Saturation Pulse Method: An Overview. Chlorophyll a Fluoresc. A Signat. Photosynth. , 279-319 (2004).
- Roháček, K., Barták, M. Technique of the modulated chlorophyll fluorescence: basic concepts, useful parameters, and some applications. Photosynthetica. 37 (3), 339-363 (1999).
- Da Silva, J. M., da Silva, A. B., Pádua, M. Modulated chlorophyll a fluorescence: a tool for teaching photosynthesis. J. Biol. Educ. 41 (4), 178-183 (2007).
- Vieira, S., Ribeiro, L., Jesus, B., Cartaxana, P., da Silva, J. M. Photosynthesis assessment in microphytobenthos using conventional and imaging pulse amplitude modulation fluorometry. Photochem. Photobiol. 89 (1), 97-102 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados