Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Küçük Hacim Biyodeneyler SU-Pulse-Genlik Modülasyonlu (SU-PAM) fluorometri Kullanma Bakteriyel / Fitoplankton Co-kültür değerlendirilmesi için
Bu Makalede
Özet
The goal of this procedure is to demonstrate the reproducibility and adaptability of using a microtiter plate format for microalgal screening. This rapid screen combines WATER-Pulse-Amplitude-Modulated (WATER-PAM) fluorometry to measure photosynthetic yield as an indicator of Photosystem II (PSII) health with small volume bacterial-algal co-cultures.
Özet
Kültür deney 1-7 boyunca alt örnekler, böylece mikroalg deneysel manipülasyonu için bilinen metotlar, kültürün büyük miktarda (5 L 20 mi) kullanmıştır. Büyük hacimlerde örnekleme çeşitli nedenlerle sorunlu olabilir: 1) toplam hacmi ve yüzey alanında bir değişime neden olur: deney sırasında kültür hacmi oranına; 2) Sözde çoğaltma (yani, aynı tedavi şişeye 8 örnekleri) genellikle oldukça gerçek çoğaltır (çoğaltmak tedaviler yani, örnekleme) daha kullanılır çoğaltmak; 3) Deney süresi toplam hacmine sınırlıdır; ve 4) aksenik kültürleri ya da her zamanki gibi bakteriyel Mikrobiyota kontaminasyon genel olarak alt-numûne alma sırasında oluşan uzun süreli deneyler sırasında bakımı zordur.
mikrotitrasyon plakaları içinde en fazla 48 ayrı tedaviler ile 1 ml kültür, her için kullanılacak miktarlar çoğaltma etkinleştirirBir 12.65 x 8.5 x 2.2 cm plaka, böylece deneysel hacmi azalan ve herhangi bir tedavi subsampling olmadan geniş çoğaltma için izin. 9-11 tarama bakteriyel-alg ko-kültürler, alg fizyolojisi testleri ve toksin: Ayrıca, bu teknik deneysel olmak üzere çeşitli biçimlerde uyacak şekilde modifiye edilebilir. Bir yosun, bakteri ve / veya ko-kültürler ile bireysel çukurlar bunlarla sınırlı olmamak üzere çok sayıda laboratuar prosedürleri için örneklenmiş ama edilebilir: SU darbe genlik-modülasyonlu (SU-PAM) fluorometri, mikroskopi, bakteri koloni oluşturan birimi (cfu), sayımları ve akım sitometri. mikrotiter plaka formatı ve SU-PAM fluorometri kombinasyonu fotokimyasal verim ve numuneler, yüksek tekrarlanabilirlik arasındaki düşük değişkenlik diğer fotokimyasal parametrelerin birden hızlı ölçümler için izin verir ve bir deney boyunca bir damacananızı veya konik balon subsampling birçok tuzaklar önler .
Giriş
Fitoplankton fizyolojisi geleneksel konik şişelerinde 20 ml lik karboya 1-7 5 L arasında değişen orta-ölçek deneylerinde incelenmiştir. Her zaman noktası için tekrarlanan örnekleri ödün yönetilemez bir deney düzeneği oluşturur gibi bu deneysel ölçek, deneysel izleme Subsampling gerektirir.
azaltmak veya büyük miktarlar subsampling ve sözde çoğaltma sınırlamaları ortadan kaldıracak alg fizyolojisi deneyleri için deney hacmini küçülterek aynı gündüz inkübatör alanını kullanırken yeteneği bağımsız deneyler sayısını artırmak için. Bir mikro-titre plakası biçimi deneysel olarak değişik koşullarda yosun kontrol etmek için bir 1 ml kültür hacmi kullanılarak yosun biyo-deneyler için geliştirilmiştir. Bu küçük hacimli deneysel çoğaltır sayısı artırılmalıdır için, izin verir nedeniyle tekrarlanan numuneler arasında bir azalma değişkenlik deneysel tekrarlanabilirlik artırır(Şekil 2) 12 140 gün boyunca deney kontroller (örneğin, aksenik alg kültürler) muhafaza ederken, deneyler ve gerçek çoğaltma sağlar.
Bu mikrotiter plakası formatında kolayca gibi, deneysel sorular çeşitli uyarlanmıştır: bir bakteri olan alg ev sahibi ile bir, simbiyotik nötr veya patojenik etkileşim var mı? Bir yosun bir bileşik uyarıcı eklenmesi veya toksik mi? Bu ve diğer sorular bu yeni formatı 9-11 kullanarak hızlı, yüksek verimli bir şekilde ele alınabilir.
48-çukurlu mikrotitre kültürü plakası, her biri 1 mi de tek bir zaman noktasında örneklenir bağımsız deney düzeneği olmasını sağlar. Çeşitli parametreler dahil olmak üzere bu 1 ml hacminde örneklenmiş, ancak bunlarla sınırlı olmamak kaydıyla: SU-Pulse-Genlik Modülasyonlu (SU-PAM) fluorometri (Malzemeler ve Ekipmanları tabloya bakınız) 1 kullanarak klorofil floresan ve fotokimyasal parametreler3. SU-PAM fluorometri yosunu 13 ile yapılan deneyler izlemek için kullanılabilecek bir hızlı ve invazif olmayan bir tekniktir. 14,15 (SU-PAM 4 ml hacim - - bir 2 ortamında seyreltilmiş kültür, 300 ul 150), küçük bir kültür hacmi fotosentez verimi ve PSII sağlığı ölçülebilir. SU-PAM fluorometri ek olarak, bu kurulum dahil olmak üzere diğer çeşitli parametreler ölçmek için kullanılabilir, ancak bunlarla sınırlı değildir: alg hücrelerinin ve yosun hücre morfolojisindeki değişiklikler ekli bakteri görselleştirmek için mikroskopi; Birim (cfu) sayısını oluşturan bakteri kolonisi; ve alg hücre sayımı ve belirlenmesi alt popülasyonlar için flow sitometri.
Protokol
Deneysel Kur 1. Hesaplamalar
- Alg ve / veya Denklem 1 kullanılarak tüm deney için gerekli olacaktır kontrolleri için gerekli bakteri kültürlerinin hacmini hesaplayın:
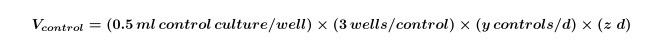
Y ve z gün başına gerekli kontrollerin sayısını eşittir gün sayısına eşittir. - Denklem 2 kullanılarak deney için ko-kültürler için gerekli olan yosun ve / veya bakteri kültürlerinin hacmi hesaplanır:
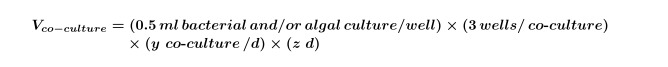
NOT: Herhangi bir bileşik ekran 'eş-kültürün' deneyler değiştirmek mümkündür; sadece deneysel tasarım uygun çözücü nihai bileşik ve alg konsantrasyonlarını ayarlayın. - Erken-üstel alg kültürünün son hacmini hesaplamak için Denklemler 1 ve 2 kullanın (genellikle 5 gün ~ 10 4 hücre / ml ama bu performi tarafından tespit edilmelidir(Bu hacim Denklem 3 kullanılarak adım 2.3) için gerekli olan deney için gerekli ng bir alg büyüme eğrisi):

- Denklem 4 kullanılarak (bu ses adımı 4.2 için tabi) deney için gerekli olan 10 4 cfu / ml bakteri kültürü (ya da istenilen aşılama konsantrasyonu) son hacmini hesaplamak için Denklemler 1 ve 2 kullanın:

NOT: Hatayı pipetle için hesap adımlar 1.3 ve 1.4 ek 10 ml ve gerçekleştirilen herhangi bir test kullanın (akım sitometri, örneğin, SU-PAM, mikroskopi, vb) 0 d. Deneysel tasarım sığdırmak gerekirse, bu ses düzeyini artırın.
NOT: 8 günlük deney örneği hesaplama Bölüm 10. bkz medya tarifleri için ek tabloya bakın.
Deneysel Kur 2. Büyüyen alg Hücreler
- Yalıtmak veya eldeaktif aksenik alg kültürü büyüyor.
- Aseptik transferi 1 sağlanması steril ortamda alg (örneğin, L1 veya benzeri deniz alg ortamı, Malzemeleri ve Ekipmanları tabloya bakınız) içine alg kültürünün son hacminin% 10,: taze ortamda alg kültür 9 seyreltme. Bu suş için önceden belirlenen büyüme koşulları kullanılarak bir gündüz inkübatör içinde seyreltilmiş Alga büyütün (örneğin, 16 ile 18 ° C: 8 saat aydınlık: karanlık döngüsü sık kullanılır).
- Yosun son hacmi olduğunu 9 seyreltme ve: Kültür erken üstel faz, yeniden kültür ulaştığında, aynı steril alg ortamda alg (örneğin, L1 veya benzeri deniz alg orta), nihai konsantrasyonu 1 sağlamak Hesaplanan V A (adım 1.3) eşit.
NOT: Bu kültürler aksenik sağlamak için önemlidir. (Genel deniz bakteriyel ortama örneğin, Marine 20 ul tablet kaplama ile kirlenme tüm alg medya ve alg stok şişeleri testEt suyu 2.216,% 1.5 agar veya benzeri) ile takviye edilmiştir. - Erken üslü faz (~ 10 4 hücre / ml) alg kültür büyütün.
NOT: Her alg suşu kültür koşullarına bağlı olarak benzersiz bir büyüme eğrisi vardır. Erken üstel faz (~ 10 ml / 4 hücreleri) (yani, akış sitometrisi veya mikroskopi kullanılarak) hücre yoğunluğuna bağlı olarak bir alg büyüme eğrisi gerçekleştirerek belirlenebilir.
3. Aşılama için bakteriyel hücrelerin hazırlanması
- (Seçilen bakteri ortamı ve büyüme koşullarında bir büyüme eğrisi yaparak durağan faz olarak bakteri bakteri konsantrasyonu (cfu / ml) ve optik yoğunluk (OD), önceden tespit örneğin, 25 ° C ve 160 rpm'de 2216 Deniz Broth ) veya benzeri. Adım 3.7 doğru hücreleri sulandırmak için, daha sonra hücrelerin (adım 3.3) büyümek için bu bilgileri kullanın.
- Aseptik örneğin% 1.5 agar plakası (2216 esnek Deniz Broth bir izole ve taze yetiştirilen bakteriyel koloni transferiörneğin, bakteri sıvı ortam (5 mL,% 1.5 agar ve benzeri deniz bakteriyel katı ortam) ile iliştirilmemiş, Deniz Broth 2216 veya benzeri deniz bakteri ortamı).
- (- Bakterinin bağlı, 36 saat ~ 12) bir yuvarlanma tambur veya çalkalayıcı üzerinde sabit faz için bakteri büyür. Yosun hücreleri, erken bir üssel evreye (~ 10 4 hücre / ml) ulaşmış olduğu, aynı zamanda - bakteri hareketsiz faz (10 9 hücre / ml ~ 10 8) ulaşır ve böylece deney planı.
- Bir pipet kullanarak, ortam içine bir test tüpüne bağlı herhangi bir biyofilm yıkama. Pipet steril 1.5 ml'lik bir mikrotüp içine iyi karışmış Bakteri kültürünün 1 mi. 14,000 x g'de 1 dakika santrifüj uygulayın.
- Sökün ve pelet (bakteri hücreleri) aksatmadan süpernatant (bakteriyel medya) atmayın. (Pelet) ile mikrotüpe steril alg medya (örneğin, L1 veya benzeri) 1 ml ekleyin. Vortex Mikrotüp alg medya pelet tekrar süspansiyon.
- İkinci yıkama:adımı 3.5 tekrarlayın.
NOT: Bu besin kompozisyonu değiştirebilecek gibi önce iyice onlarla yosun aşılamak için hücrelerden bakteri medya, hücre döküntü, atılır proteinler ve küçük moleküllerin kaldırmak amacıyla alg medya ile bakteri hücreleri yıkamak için kritik alg medya ekrana biyoaktif molekülleri tanıtmak veya. - Seri olarak arzulanan son bakteriyel konsantrasyon (cfu / ml) daha fazla konsantre edilir, 100-kat bir son konsantrasyona kadar, alg ortam içinde yıkanmıştır bakteriyel hücreleri seyreltin. Adım 4.2 alg medyada yıkanmış ve seyreltilmiş olan hücreleri içeren mikrotüpü kaydedin.
NOT: 0 d bakteri alg: 1 oranını 1 olan dayalı deney planlayın. Aşama 3.7 başlangıç hücreleri seri 10 6 hücre / ml olacak şekilde seyreltilir, böylece deney için istenen ilk bakteri konsantrasyonu yapmak için, 10 4 hücre / ml 'dir.
Deney için 4. hazırlanması Bakterileral Ayarı
- 4 steril otoklava cam konik şişeler hazırlayın ve bunları etiket: a) 'alg kontrolü şişesi', b) 'seyreltilmiş bakteriyel stok şişesi', c) 'bakteriyel kontrol şişesi', ve d) 'ko-kültür şişesi'.
- Bakteriyel süspansiyon sulandırmak son hacim = V B (adım 1.4) steril alg medya ile 3.7 1:99 adım. Şişe etiketli seyreltilmiş bakteriyel stoku (adım 4.1) seyreltme olun.
NOT: Bir önceki örnekte (adım 4.2), bu 1:99 seyreltme 10 4 cfu / ml'lik bir son konsantrasyon verir. Girdap şişesi hücreleri karıştırın. - Pipet V kontrol seyreltilmiş bakteriyel stoktan (adım 1.1) ve bakteriyel kontrol şişeye koyun.
- Bakteriyel kontrol şişesi içine steril bir alg ortamı pipetle V kontrol (bu da 1: 1 seyreltme). Girdap şişesi hücreleri karıştırın ve adım 7.3 için kenara.
- Seyreltilmiş bakteriyel stoktan Pipet V ko-kültürAşama 6.1 kenara şişeyi set eş-kültür şişesine şişe.
NOT: Aynı anda aynı yosun birden ortak kültürleri yaparken tek tek her bir suş V eş-kültür yeniden hesaplamak ve sonra adımı tekrarlayın için gerekli olan (yani, iki farklı bakteriyel bir ko-kültür bir kumanda ile izolatları) ayrı ayrı ko-kültür için 4.5. Bu Denklem 5'te gösterilen iki ko-kültürleri içerir adım 1.3 hesaplanan V A geliştirmek için gereklidir: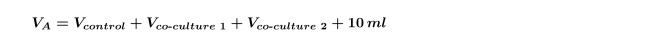
Deneysel Kur için Yosunlar hazırlanması 5.
- Hücreler de karışık görünen kadar hafifçe geniş ağız pipet ile (adım 2.4) erken üstel alg kültürü karıştırın.
- Alg kontrol balona alg stok şişesinden Pipet V kontrol. Yavaşça 10 ml'lik pipet kullanarak pipetle. Sonra gündüz inkübatör alg stok şişe dönmek.
- Pipet V devamalg kontrol şişeye steril alg ortamının rol (bu da 1: 1 seyreltme). Adım 7.4 için gerekli olana kadar, günlük inkübatör şişeyi ve yer karıştırmak için girdap.
6. hazırlanması Deneysel Co-kültür
- Yavaşça adım 4,5 bakteriyel ko-kültür balona alg stok şişesi V eş-kültür pipetle. Adım 7.5 için gerekli olana kadar günlük kuluçka ko-kültür şişesi getirin.
NOT: bakteri kontrolü bakteri konsantrasyonu deneysel ko-kültür bakteriyel konsantrasyon eşit olmalıdır. Benzer şekilde, alg kontrol yosun konsantrasyonu deneysel ko-kültür yosun konsantrasyonunu eşit olmalıdır. Aynı başlangıç bakteri ve yosun konsantrasyonlarına sahip olarak, nüfus yoğunluğu deney boyunca karşılaştırılabilir.
7. Mikrotiter Plakaları ayarlama
- Şekil 1 'deki gibi bir steril 48 oyuklu mikrotitre plakası bölün.Steril seyreltici veya non-fotosentetik ya örneklerini içeren dış kuyuları üzerinde etiketleyin.
Not: plaka havuzları bir randomizasyon aynı günde alınan numuneler için yapılabilir. Örneğin, kadran 1 deneyde 1 d örneklenmiş olacak; 4 ve C2 - - Şekil 1 'de gösterildiği gibi, 4 steril bir çözelti ile doldurulmuş plakanın çevre boş rasgeleleştirilmelidir kuyu B2.
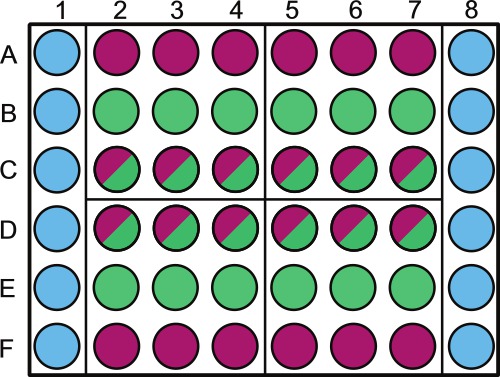
. Aşağıdaki gibi 48-çukurlu bir mikro-titre plaka kuyuları örnek bir yerleşimin Şekil 1 şematik temsili doldurulacak şunlardır: sütun 1 ve 6, A-F kuyular (  )), PBS (ya da başka steril çözelti / ortam 1x 1 ml ile doldurulur. Satırlar A ve E, kuyular 2-8 (
)), PBS (ya da başka steril çözelti / ortam 1x 1 ml ile doldurulur. Satırlar A ve E, kuyular 2-8 (  ) 1 ml bakteri kontrolü ile doldurulur; rows B ve E kuyuları 2-8 (
) 1 ml bakteri kontrolü ile doldurulur; rows B ve E kuyuları 2-8 (  ) 1 ml alg kontrolü ile doldurulur; satırlar C ve D, kuyular 2-8 (
) 1 ml alg kontrolü ile doldurulur; satırlar C ve D, kuyular 2-8 (  ), 1 ml'lik eş-kültür ile doldurulur. 4, bu plakalar boyunca randomize ve buna göre etiketlenmiş olmalıdır - plaka 4 kadran (A2, A5, D2 ve D5) Bu kadran 1 her özel örnekleme günleri ayrılmıştır. Her gün içinde biz alg kontrolü (rastgele tavsiye ederiz
), 1 ml'lik eş-kültür ile doldurulur. 4, bu plakalar boyunca randomize ve buna göre etiketlenmiş olmalıdır - plaka 4 kadran (A2, A5, D2 ve D5) Bu kadran 1 her özel örnekleme günleri ayrılmıştır. Her gün içinde biz alg kontrolü (rastgele tavsiye ederiz  ) Ile ko-kültür (
) Ile ko-kültür (  Bir rasgele sayı üreteci kullanılarak) kuyular. Alg kültürlerin gölgeleme önlemek için 1x PBS ve / veya bakteriyel kontrol tüpler üzerine kapak etiketleyin.
Bir rasgele sayı üreteci kullanılarak) kuyular. Alg kültürlerin gölgeleme önlemek için 1x PBS ve / veya bakteriyel kontrol tüpler üzerine kapak etiketleyin.
- Pipet 1 mi 1x Fosfat tampon çözeltisi (PBS, pH 7.4) veya Şekil 1 'de gösterildiği gibi uygun oyukları içinde, başka steril çözelti. Yavaşça ve dikkatle bu gerçekleştirin. PBS olacak change alg ve / veya ko-kültür ortamının iyonik gücü diğer kuyular kadar dikkatli ele de Splatters eğer.
- Pipet kuyulara bakteri kontrol kültürünün 1 ml bakteri kontrolü (Şekil 1) etiketli. Bakteriyel çökmesini önlemek için her plaka pipetle önce bakteriyel şişeyi girdap.
- Pipet 1 bir geniş ağızlı bir pipet ucu (Şekil 1) kullanılarak, alg kontrol etiketli kuyulara alg kontrol kültürü ile yıkanmaktadır. Bakteriyel şişeye gibi düzenli alg şişesi girdap. Alg lavabo veya yüzer eğilimi ise bir görsel homojen kültürünü korumak için gerekli olduğu gibi, düzenli olarak girdap.
- Geniş ağızlı bir pipet, pipet uygun oyukları içinde, eş-kültür, 1 ml (Şekil 1) kullanılması. Alg şişeye olarak düzenli ko-kültür balon dönen.
- İstenilen sıcaklığa ve gündüz ışık döngüsünde bir günlük inkübatör parafilm ve yerde her plaka Seal (: 8 saat ışık: 16 ile 18 ° C karanlık döngüsü sık kullanılır). Ayrılmakhazır olana kadar gündüz inkübatör plakaları PAM okumaları (Bölüm 8) almak. Sağlamak için, tüm plakalar tutarlı ışık maruz sağlamak için aynı yönde yönlendirilmiştir.
- PBS, alg ortam, alg stoku ve alg kontrol 20 ul tablet alın ve uygun bir seçici olmayan ortam üzerinde levha de (örneğin,% 1.5 agar ile takviye edilmiş Deniz Broth 2216) ve 18 plakalar inkübe - 72 ve 25 ° C hr kirlenme test etmek için. Büyüme bakteri içermemelidir çözümleri herhangi görünüyorsa, daha sonra bu verilerin kullanılmamalıdır.
- Okuma deneysel 0 d PAM fluorometri (adım 8.1 bakınız) alg kontrolü ve ko-kültür şişelerinden geri kalan örnek kullanarak PAM fluorometri okumaları alın. Başka bir 0 d ölçümleri de kalan alg kontrol, bakteri kontrolü ve ko-kültür numuneleri ile yapılmalıdır.
Stok Örneklerden 8. alarak PAM Fluorometri Okumalar
- SU-PAM sıfırokumalar 8 çekmeden önce temiz bir küvete steril alg medya ile.
- Pipet deneyde kullanılan aynı alg ortamın 2.7 ml içeren temiz bir küvet içinde alg kontrol ya da ko-kültür şişelerinden 300 ul. Geniş ağızlı bir pipet ucu ile hafifçe örnek ve seyrelticiyi karıştırın.
- Wipe-off doku ile küvetin dışından tüm parmak izlerini SU-PAM içinde küveti yerleştirmeden önce.
- SU-PAM içine küveti yerleştirin. Kapağı ile örnek örtün ve 3 dakika karanlık adapte sağlar. Koyu uyum kez su yosunu türlerine bağlı olarak değişir ve deneyde kullanılan belirli alg için belirlenmelidir. Alg gündüz kuluçka 16,17 karanlık döngüsünün ortasında sırasında SU-PAM okumaları alarak uzun karanlık adaptasyonu kez (> 20 dk) kaçının.
- Karanlık adaptasyon sonra, F 0 düğmesine basın. 1 alg ortamında: floresan okumaları 3900 üzerinde ise, örnek 1 seyreltin. Ek 3 dakika ve tak karanlık adapteea yeni okuma. F 0 ve F m okumaları 3900 altında olana kadar alg ortamda 1: F 0 veya F m okumaları 3900 üzerinde hala varsa, örneklemin 1 sulandırmak devam ediyor.
NOT: alg örnek 1 seyreltilmiş ise örneğin: Nihai floresan kaydederken bu dilüsyonlarının hesaba emin olun seyreltme tüpü iyi gelen ilk transferi sırasında 9, sonra 500 alg floresan okuma ters ile çarpılmalıdır seyreltme faktörü ve tüp gerçek floresan (bu durumda 10) daha sonra 5.000. - F 0 ayarladıktan sonra, F m değerleri almak için SAT tuşuna basarak her 90 saniyede okuma doyurarak darbe (SAT-Pulse) alır. Okumalar arasındaki zaman aralığı alg gerginlik bağlı olarak ayarlanabilir. Sil örnek.
- Kalan numuneler için 8.6 - 8.1 tekrarlayın adımları.
Mikrotiter Tabaklar 9. alarak PAM Fluorometri Okumalar
- EtiketAlg kontrol ve oyuklar C2 - 4 - bakteriyel ko-kültür için 4 (Şekil 1 'de bord düzeni bakınız) kuyu B2> 3 mi hacminin 6 steril numune tüpleri.
- Kısım her bir tüp içine steril alg ortamı 2.7 mi.
- Gündüz inkübatör tüpleri yerleştirin ve onları alg 30 dakika için yetiştirilen edildi sıcaklığına gelmesini bekleyin.
- Inkübatör mikrotiter plaka çıkarmadan önce aktif seyreltme tüplerine kuyulardan kültürünü transfer ederken, sadece 9.5 adımları (folyoyu çıkarın alüminyum folyo (veya benzeri) ile plaka kaplama ile sınırlıdır karanlık ortama alıştırılmış kuyulara o ışık nüfuz sağlamak - 9.7).
- Aseptik yavaş yavaş yukarı ve aşağı pipetleme geniş bir ağız pipet ile (iyi B2) de ilk mikrotiter plaka karıştırın.
- (Geniş ağızlı bir pipet ucu ile karşılık gelen numune tüpüne 300 ul de B2 (Şekil 1) için kuluçka ve aseptik olarak transfer seyreltme tüpleri elde ediliralg ortam içinde örnek) 9 seyreltme Bu a, 1'dir.
- Kalan Kuyular için 9.6 (B3,4 ve C2 - - 4) tekrarlayın 9.5 adımları.
- Alüminyum folyo ile örtün ve örnek tüpleri SU-PAM için hazır olana kadar gündüz inkübatör onları geri.
- 8.7 - 8.1 adımlarda açıklandığı gibi SU-PAM okumaları gerçekleştirin. Inkübatör dönmeden önce parafilm mikrotiter plaka Seal.
- Deneyin süresi boyunca planlanan zaman aralıklarında okumaları tekrarlayın. Frekans ve örnekleme uzunluğu deney başında planlanmalıdır.
10. Numune Deneyi
Örnek deney bir bakteri (Phaeobacter gallaeciensis BS107) ve mikroalgi (Emiliania huxleyi suşu (CCMP3266)) bir 10 günlük ko-kültür. Bir alg kontrolü, bakteriyel kontrolü ve bakteriyel-alg deneysel ko-kültür içerir.
- 1 adımları (gerekli bakteri ve yosun stokları hacimleri hesaplayın.1-1,4)

- 36 ml ortam içinde yosun 4 ml aşılayarak, alg stokları, 40 ml kadar olan bir V A hazırlamak ve erken üstel büyüme ~ 10 4 hücre / ml (2.1 adım - 2.4) değerinde bir hücre yoğunluğu elde edilene kadar kuluçkaya bırakıldı.
- (10 4 hücre / ml olacak bakteri nihai konsantrasyon) algli ortam ile 40 ml arasında bir V B Kısım 3'de elde edilen 10 6 hücre / ml bakteri 400 ul seyreltilmesiyle Bakteriyel stok balon hazırlayın.
- Aktarım bakteriyel kontrol şişeye bakteriyel stokunun yarısından (20 mi) ve bakteriyel kontrolü yapmak için yosun ortam 20 ml ilave ediniz. Aktarım yarısı (20 ml) alg alg kontrol şişesine stok ve alg kontrolü (Bölüm 5) makyaj alg medya 20 ml ekleyin. Ko-kültür kurmak için ko-kültür şişesine bakteriyel stokunun kalan 20 ml aktarın ve alg stokunun kalan 20 ml ile karıştırın (Bölüm6).
- İki önceden etiketlenmiş mikrotitre plakaları (Şekil 1), her bir çukura 1 ml 1 x PBS (pH 7.4), kontrol ve ko-kültür Pipet. 0 d ölçümleri (kob sayımı, SU-PAM (Bölüm 8), alg hücre morfolojisi mikroskopik gözlem ve akış sitometri için alg hücre fiksasyon) yapmak için kalan kontrolleri ve ortak kültürler 3 ml kullanın.
- 0 d ölçümleri (Bölüm 8) alınmıştır aynı zamanda her zaman 10 gün boyunca günde bir kez alg kontrolü ve ko-kültür için SU-PAM okumaları alın ve.
İlgi 11. Diğer Parametreler
- Bakteri CFU konsantrasyonu belirlemek: steril 1x PBS (veya benzeri) bakteri kontrolü ve ortak-kültürünün bir seri seyreltme yerine, daha sonra% 1.5 agar (veya benzeri) ile takviye edilmiş Deniz Broth 2216 plakasını bırakmak ve büyümek cfu sayısı dikkate Her bir oyuk 18 Bakteri CFU / mL değerini hesaplamak için.
- Alg hücre konsantrasyonunu değerlendirmek için: alg kontrolü ve ko- düzeltmekglutaraldehid% 0.15 nihai konsantrasyona sahip kültür. -80 ° C'de 10 sıvı azot içinde koyu, daha sonra flaş dondurucuda dakika ve mağaza inkübe edin. Süreç akış sitometresindeki (FACS Calibur veya benzeri) tüm numuneler alg hücreleri saymak için.
- Alg kültürleri ve mikroskopi (yani, ışık mikroskobu, Epifloresans veya benzeri) kullanılarak bakteriyel-alg ko-kültür: alg hücre morfolojisi gözlemleyin.
Sonuçlar
SU-PAM fluorometri okumaları.
SU-Pulse-Genlik Modülasyonlu (PAM) fluorometri floresan (klorofil içeriği için bir proxy) ve alg kültürlerinin fotosentez verimini (PSII sağlık) belirlemek için hızlı ve etkin bir yöntemdir. PAM WinControl yazılımı için ham veri değerleri bir elektronik tablo (aşağıdaki koyu adapte alg örnekleri için temel parametreler) oluşturur:
Koyu adapte hücrelerin F 0 = floresan
F
Tartışmalar
Bir minyatür formatta Alg büyüme.
Bir deney içinde, çoğaltma arttığı bir mikrotiter plakası içinde bir 1 ml kültür hacmi için alg kültürlerin minyatür sağlar. Bu alg bir deney boyunca sağlıklı olmasını sağlamak için önemlidir; alg besin gereksinimleri yerine getirilmesini sağlamak için, çeşitli alg medya değerlendirmek için mikrotiter plaka biçimini kullanarak, bir büyüme eğrisi (Şekil 2) gerçekleştirin. Ayrıca, gün ışığı döngüsü...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This work was supported by Natural Sciences and Engineering Research Council of Canada (grant 402105), Canadian Foundation for Innovation (grant 129087) and Alberta Education and Training (grant AAETRCP-12-026-SEG) to RJC.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 cu. ft. Diurnal incubator (6012-1) | Caron Corporate | 112310-6012-1-11 | www.caronproducts.com |
| Nunc EasYFlask 25 cm2, Vent/Close Cap, 7 ml working volume, 200/cs | Thermo Fisher Scientific | N156340 | www.fishersci.ca |
| Multiwell TC Plates – 48-well | BD Biosciences Discovery Labware | 353078 | www.bdbiosciences.com |
| P1000 Gilson The Pipetting Standard—Gilson's Pipetman | Mandel Scientific Company Inc. | GF-F123602 | www.mandel.ca |
| P10mL Gilson The Pipetting Standard—Gilson's Pipetman | Mandel Scientific Company Inc. | GF-F161201 | www.mandel.ca |
| Wide Orifice Tips nonsterile [100–1,250 µl] | VWR International | 89079-468 | www.ca.vwr.com |
| Ultrafine Tips nonsterile [100–1,250 µl] | VWR International | 89079-470 | www.ca.vwr.com |
| Finntip 10 ml [Vol: 1 - 10 ml] | Thermo Fisher Scientific | 9402151 | www.fishersci.ca |
| WATER-Pulse Amplitude Modulation (Water-ED) | Heinz Walz GmbH, Effeltrich, Germany | EDEE0232 | www.walz.com |
| 15 mm diameter quartz glass cuvette (WATER-K) | Caron Corporate | www.caronproducts.com | |
| Sodium chloride (crystalline/certified ACS), Fisher Chemical | Thermo Fisher Scientific | Thermo Fisher Scientific | www.fishersci.ca |
| BD Difco Marine Broth 2216 | BD Biosciences Discovery Labware | BD Biosciences Discovery Labware | www.bdbiosciences.com |
| BD Bacto Agar | BD Biosciences Discovery Labware | BD Biosciences Discovery Labware | www.bdbiosciences.com |
| L1 Medium Kit, 50 L | NCMA [National Center for Marine Algae and Microbiota | NCMA [National Center for Marine Algae and Microbiota | www.ncma.bigelow.org |
Referanslar
- Scarratt, M. G., Marchetti, A. Assessing microbial responses to iron enrichment in the Subarctic Northeast Pacific: Do microcosms reproduce the in situ condition?. Deep Sea Res Part II Top. Stud. Oceanogr. 53 (20-22), 2182-2200 (2006).
- Bidle, K. D., Haramaty, L., Barcelos E Ramos, J., Falkowski, P. Viral activation and recruitment of metacaspases in the unicellular coccolithophore, Emiliania huxleyi. Proc. Natl. Acad. Sci. U. S. A. 104 (14), 6049-6054 (2007).
- Moore, L. R., Goericke, R., Chisholm, S. W. Comparative physiology of Synechococcus and Prochlorococcus: influence of light and temperature on growth, pigments, fluorescence and absorptive. Mar. Ecol. Prog. Ser. 116, (1995).
- Iglesias-Rodriguez, M. D., Halloran, P. R. Phytoplankton calcification in a high-CO2 world. Science. 320 (5874), 336-340 (2008).
- Chen, M., Tang, H., Ma, H., Holland, T. C., Ng, K. Y. S., Salley, S. O. Effect of nutrients on growth and lipid accumulation in the green algae Dunaliella tertiolecta. Bioresour. Technol. 102 (2), 1649-1655 (2011).
- Lv, J. -. M., Cheng, L. -. H., Xu, X. -. H., Zhang, L., Chen, H. -. L. Enhanced lipid production of Chlorella vulgaris by adjustment of cultivation conditions. Bioresour. Technol. 101 (17), 6797-6804 (2010).
- Geider, R., Graziano, L., McKay, R. M. Responses of the photosynthetic apparatus of Dunaliella tertiolecta (Chlorophyceae) to nitrogen and phosphorus limitation. Eur. J. Phycol. 33 (4), 315-332 (1998).
- MacIntyre, H. L., Cullen, J. J. Using Cultures to Investigate the Physiological Ecology of Microalgae. Algal Cult. Tech. , 287-326 (2005).
- Blaise, C., Vasseur, P. Algal microplate toxicity test. Small-scale Freshw. Toxic. Investig. Vol. 1 Toxic. Test Methods. , 137-179 (2005).
- Skjelbred, B., Edvardsen, B., Andersen, T. A high-throughput method for measuring growth and loss rates in microalgal cultures. J. Appl. Phycol. 24, 1589-1599 (2012).
- Nagai, T., Taya, K., Annoh, H., Ishihara, S. Application of a fluorometric microplate algal toxicity assay for riverine periphytic algal species. Ecotoxicol. Environ. Saf. 94, 37-44 (2013).
- Seyedsayamdost, M. R., Case, R. J., Kolter, R., Clardy, J. The Jekyll-and-Hyde chemistry of Phaeobacter gallaeciensis. Nat. Chem. 3 (4), 331-335 (2011).
- Schreiber, U., Schliwa, U., Bilger, W. Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer. Photosynth. Res. 10 (1-2), 51-62 (1986).
- Jones, R. J., Ward, S., Amri, A. Y., Hoegh-Guldber, O. Changes in quantum efficiency of photosystem II of symbiotic dinoflagellates of corals after heat stress, and of bleached corals sampled after the 1998 Great Barrier Reef mass bleaching event. Mar. Freshw. Res. 51 (345), 659-668 (1998).
- Beer, S., Larsson, C., Poryan, O., Axelsson, L. Photosynthetic rates of Ulva (Chlorophyta) measured by pulse amplitude modulated fluorometry. Eur. J. Phycol. 35 (1), 69-74 (2000).
- . . WATER-PAM Chlorophyll Fluorometer. Instrument Description and Information for Users. , (2013).
- Maxwell, K., Johnson, G. M., Heers, J. Chlorophyll fluorescence--a practical guide. J. Exp. Bot. 51 (345), 659-668 (2000).
- Herigstad, B., Hamilton, M., Heersink, J. How to optimize the drop plate method for enumerating bacteria. J. Microbiol. Methods. 44 (2), 121-129 (2001).
- Kooten, O., Snel, J. The use of chlorophyll fluorescence nomenclature in plant stress physiology. Photosynth. Res. 25 (3), 147-150 (1990).
- Maxwell, K., Johnson, G. N. Chlorophyll fluorescence--a practical guide. J. Exp. Bot. 51 (345), 659-668 (2000).
- Schreiber, U. Pulse-Amplitude-Modulation (PAM) Fluorometry and Saturation Pulse Method: An Overview. Chlorophyll a Fluoresc. A Signat. Photosynth. , 279-319 (2004).
- Roháček, K., Barták, M. Technique of the modulated chlorophyll fluorescence: basic concepts, useful parameters, and some applications. Photosynthetica. 37 (3), 339-363 (1999).
- Da Silva, J. M., da Silva, A. B., Pádua, M. Modulated chlorophyll a fluorescence: a tool for teaching photosynthesis. J. Biol. Educ. 41 (4), 178-183 (2007).
- Vieira, S., Ribeiro, L., Jesus, B., Cartaxana, P., da Silva, J. M. Photosynthesis assessment in microphytobenthos using conventional and imaging pulse amplitude modulation fluorometry. Photochem. Photobiol. 89 (1), 97-102 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır