É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A Volume Bioassay pequeno para avaliar Bacteriana / fitoplâncton Co-cultura utilizando água-Pulse-Amplitude Modulada (água-PAM) Fluorometria
Neste Artigo
Resumo
The goal of this procedure is to demonstrate the reproducibility and adaptability of using a microtiter plate format for microalgal screening. This rapid screen combines WATER-Pulse-Amplitude-Modulated (WATER-PAM) fluorometry to measure photosynthetic yield as an indicator of Photosystem II (PSII) health with small volume bacterial-algal co-cultures.
Resumo
Os métodos convencionais para manipulação experimental de microalgas têm empregado grandes volumes de cultura (20 ml a 5 L), de modo que a cultura pode ser sub-amostrado ao longo da experiência 1-7. A subamostragem de grandes volumes pode ser problemática por várias razões: 1) que provoca variação no volume total e a área superficial: proporção em volume da cultura durante a experiência; 2) pseudo-replicação (isto é, a partir de duplicados de amostras ao mesmo balão de tratamento 8) é muitas vezes utilizados em vez de repetições verdadeiras (isto é, a amostragem de tratamentos replicados); 3) A duração da experiência é limitado pelo volume total; e 4) culturas axênicas ou a microbiota bacteriana normal são difíceis de manter, durante experimentos de longa duração como a contaminação geralmente ocorre durante subamostragem.
A utilização de placas de microtitulação permite volumes de 1 ml de cultura a serem utilizados para cada replicado, com até 48 tratamentos separados dentrouma placa de 12,65 cm x 8,5 x 2,2, diminuindo desse modo o volume e permitindo experimental para replicação extensiva subamostragem sem qualquer tratamento. Além disso, esta técnica pode ser modificado para caber uma variedade de formatos, incluindo: experimentais bacteriana-co-culturas de algas, algas, exames de fisiologia e toxina de rastreio 9-11. Pode ser amostrado poços individuais com uma alga, bactéria e / ou co-culturas para numerosos procedimentos laboratoriais, incluindo, mas não limitados a: ÁGUA-Pulse-amplitude modulada (WATER-PAM) fluorometria, microscopia, colónia bacteriana forming unit (ufc) condes e citometria de fluxo. A combinação do formato de placa de microtitulação e água-PAM fluorometria permite múltiplas medições rápidas de rendimento fotoquímico e outros parâmetros fotoquímicos com baixa variabilidade entre as amostras, de alta reprodutibilidade e evita as muitas armadilhas de subamostragem um garrafão ou erlenmeyer sobre o curso de um experimento .
Introdução
Fisiologia fitoplâncton tem sido tradicionalmente estudadas em experimentos meso-escala que varia de 20 ml em frascos cónicos de 5 L em garrafões 1-7. Esta escala experimental requer subsampling para o monitoramento experimental, como sacrificar amostras idênticas, para cada ponto de tempo cria uma montagem experimental incontrolável.
A capacidade para aumentar o número de experiências independentes utilizando o mesmo espaço incubadora diurna ao miniaturizar o volume experimental para experiências fisiológicas algas vai reduzir ou eliminar as limitações de sub-amostragem e pseudo-replicação a partir de grandes volumes. Um formato de placa de microtitulação foi desenvolvido para bioensaios de algas, utilizando um volume de 1 ml de cultura para manipulação experimental algas em condições variáveis. Este pequeno volume experimental permite o número de repetições de ser aumentada, aumenta a reprodutibilidade experimental devido a uma menor variabilidade entre as amostras replicadas eexperiências, e permite a replicação verdadeira, mantendo controles experimentais (ou seja, culturas de algas axênicos) para 140 dias (Figura 2) 12.
Este formato de placa de microtitulação é facilmente adaptado para uma variedade de questões experimentais, tais como: não uma bactéria ter uma interacção simbiótica, neutro ou patogénica com o seu hospedeiro de algas? É a adição de um composto estimulante ou tóxico para uma alga? Estas e outras questões podem ser abordadas de uma forma de alto rendimento rápido, utilizando este novo formato 9-11.
Uma placa de 48 poços de cultura de microtitulação permite a cada poço 1 ml de ser uma montagem experimental independente que é amostrada num único ponto de tempo. Vários parâmetros podem ser amostrados a partir desse volume de 1 ml, incluindo, mas não limitados a: a fluorescência e os parâmetros fotoquímicos utilizando-amplitude modulada ÁGUA-Pulse (WATER-PAM) fluorometria (ver Materiais e Equipamento tabela) 13. ÁGUA-PAM fluorometria é uma técnica rápida e não-invasiva, que pode ser utilizado para monitorizar as experiências realizadas com 13 algas. Ele permite a medição da eficiência fotossintética e saúde PSII de um pequeno volume de cultura (150-300 mL de cultura diluída em meio a um 2 - Volume 4 ml de água-PAM) 14,15. Além ÁGUA-PAM fluorometria, esta configuração pode ser usada para medir uma variedade de outros parâmetros, incluindo, mas não limitados a: a microscopia para visualizar as bactérias associadas às células de algas e as alterações na morfologia de células de algas; colônia de bactérias (UFC) contagens de unidade; e citometria de fluxo para a contagem de células de algas e as subpopulações de identificação.
Protocolo
1. Os cálculos para Setup Experimental
- Calcular o volume de algas e / ou culturas bacterianas necessárias para os controlos que serão necessários para toda a experiência por meio da Equação 1:
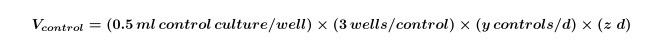
Onde y é igual ao número de controlos necessários por dia e z é igual ao número de dias. - Calcular o volume de culturas de algas e / ou bacterianos que são necessários para co-culturas para a experiência por meio da Equação 2:
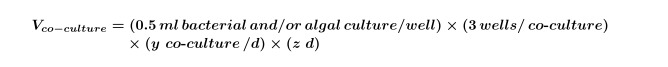
NOTA: É possível substituir experimentos 'co-cultura' com qualquer tela de composto; basta ajustar o composto final, solvente e concentrações de algas para caber o projeto experimental. - Use as equações 1 e 2 para calcular o volume final da cultura de algas exponencial precoce (geralmente 5 dias para 10 ~ 4 células / ml, mas isto deve ser determinado por performing uma curva de crescimento de algas) necessária para o experimento (este volume é necessária para o passo 2.3), utilizando a equação 3:

- Use Equações 1 e 2 para calcular o volume final de 10 4 cfu / ml de cultura bacteriana (ou concentração desejada inoculação) necessária para o experimento (este volume é necessária para o passo 4.2), utilizando a equação 4:

NOTA: Use o adicional de 10 ml em passos 1.3 e 1.4 para explicar pipetagem erro e quaisquer testes que são realizados (por exemplo, WATER-PAM, citometria de fluxo, microscopia, etc.) em 0 d. Aumentar esse volume se necessário, para se adequar ao design experimental.
NOTA: Para um exemplo de cálculo de uma experiência de 8 dias Ponto 10. Veja a tabela suplementar para as receitas de mídia.
2. Crescer células de algas para a Instalação Experimental
- Isolar ou obter umcrescendo ativamente cultura de algas axênica.
- Transferência assepticamente 10% do volume final da cultura de algas em meio de algas estéril (por exemplo, L1 ou semelhante forma de algas marinhas, ver Materiais e Equipamento tabela), assegurando uma diluição de 1: 9 de cultura de algas em meio fresco. Incubar a alga diluída numa incubadora diurna usando condições de crescimento previamente determinadas para que a tensão (por exemplo, 18 ° C, com um 16: 8 hr de luz: ciclo escuro é comumente utilizado).
- Quando a cultura atingiu-exponencial precoce fase, re-cultura da alga no mesmo meio de algas estéril (por exemplo, L1 ou meio de algas marinhas semelhante), assegurar a concentração final é de uma diluição de 1: 9 e que o volume final de algas é igual a V calculado (passo 1.3).
NOTA: É importante para garantir que essas culturas são axênica. Teste todos os meios de algas e garrafas banco de algas para a contaminação por plaqueamento uma alíquota de 20 mL em um meio de bactérias marinhas geral (por exemplo, MarineCaldo 2216 suplementado com 1,5% de agar ou semelhante). - Crescer a cultura de algas fase exponencial precoce (~ 10 4 células / ml).
NOTA: Cada cepa de algas tem uma curva de crescimento único, dependendo das condições de cultivo. Fase exponencial precoce (~ 10 4 células / ml) pode ser determinada através da realização de uma curva de crescimento de algas, com base na densidade celular (isto é, utilizando citometria de fluxo ou microscopia).
3. Preparar as células bacterianas para a inoculação
- Pré-determinar a concentração bacteriana (ufc / ml) e densidade óptica (OD) da bactéria em fase estacionária, fazendo uma curva de crescimento nas condições de meio de crescimento e bacterianas escolhidas (por exemplo, Marine Broth 2216 a 25 ° C e 160 rpm, ou semelhante). Use essas informações para crescer as células (passo 3.3) e, posteriormente, para diluir as células corretamente na etapa 3.7.
- Transferir assepticamente uma colônia de bactérias isoladas e recentemente crescido a partir de uma placa de ágar 1,5% (por exemplo, Marine Caldo 2.216 flexíveltado com 1,5% de agar ou meio sólido bacteriana marinha semelhante) em 5 ml de meio líquido bacteriana (por exemplo, Marine Broth 2216 ou meio marinho bacteriana semelhante).
- A bactéria crescer até à fase estacionária num tambor giratório ou agitador (~ 12-36 h, dependendo da bactéria). Plano da experiência de modo a que a bactéria atingir a fase estacionária (~ 10 agosto-10 setembro ufc / ml) ao mesmo tempo que as células de algas, atingiram a fase exponencial precoce (~ 10 4 células / ml).
- Usando uma pipeta, lavar qualquer biofilme ligado ao tubo de ensaio para o meio. Pipetar 1 ml de cultura bacteriana bem misturado em um estéril 1,5 ml microtubo. Centrifugar durante 1 minuto a 14.000 x g.
- Retire e descarte do sobrenadante (média bacteriana), sem perturbar o sedimento (células bacterianas). Adicionar 1 ml de meio estéril de algas (por exemplo, L1 ou semelhante) para o microtubo (com sedimento). Vortex microtubo para voltar a suspender pellet em meios de algas.
- Segundo lavagem:repita o passo 3.5.
NOTA: É crítico para lavar as células bacterianas com meios de algas, a fim de eliminar completamente todos os meios de bactérias, detritos de células, proteínas e pequenas moléculas excretadas das células antes da inoculação das algas com eles, pois isso poderia alterar a composição de nutrientes os meios de comunicação de algas ou introduzir moléculas bioativas para a tela. - Serialmente dilua as células bacterianas foram lavadas em meio de algas, a uma concentração final que é 100 vezes mais concentrada que a concentração final desejada bacteriana (ufc / ml). Guardar o microtubo contendo células que foram lavadas e diluídas em meio de algas para o passo 4.2.
NOTA: o Plano experimental baseado em ter uma proporção de 1: 1 de algas para bactérias em 0 d. Para fazer esta concentração bacteriana inicial desejada para o ensaio é de 10 4 cfu / ml, de modo que no passo 3.7 as células iniciais devem ser diluídos em série para 10 6 ufc / ml.
4. As bactérias que se preparam para ExperimentSetup al
- Prepare 4 estéreis frascos cónicos de vidro autoclavados e rotulá-los: a) 'balão de algas controle ", b)" balão de estoque bacteriana diluída ", c)' balão de controle bacteriano", e d) 'balão de co-cultura ".
- Dilui-se a suspensão bacteriana a partir de passo 3.7 1:99 com meio de algas estéril para um volume final = V B (passo 1.4). Faça a diluição no estoque bacteriana diluída frasco etiquetado (passo 4.1).
NOTA: No exemplo anterior (passo 4.2), esta diluição 1:99 dá uma concentração final de 10 4 cfu / ml. Frasco agite para misturar as células. - Pipeta controle V (passo 1.1) a partir do estoque bacteriana diluída e colocá-lo no balão de controle bacteriano.
- Pipeta de controlo V de meio de algas estéril para o balão de controlo bacteriano (isto é uma diluição 1: 1). Frasco agite para misturar as células e reserve para a etapa 7.3.
- Pipeta V co-cultura a partir do estoque bacteriana diluídaGarrafa para o balão de co-cultura, balão de lado para a etapa 6.1.
NOTA: Ao fazer várias co-culturas na mesma alga de uma vez (ou seja, a co-cultura de duas bactérias diferentes isolados com um controle) que é necessário voltar a calcular o co-cultura V para cada estirpe individualmente e, em seguida, repita o passo 4,5 para cada co-cultura separadamente. É também necessário aumentar a V calculado no passo 1.3 para incluir ambas as co-culturas mostrado na Equação 5: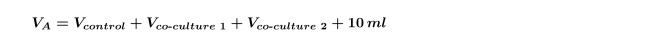
5. Preparação das algas por Setup Experimental
- Misture delicadamente a cultura de algas early-exponencial (a partir do passo 2.4), com uma ponteira de boca larga até que as células aparecem bem misturado.
- Controle V pipeta da garrafa estoque de algas para o balão de controle de algas. Pipeta suavemente com uma pipeta de 10 ml. Depois, volte a garrafa de algas na incubadora diurna.
- Pipeta V control de meio de algas estéril para o frasco de controlo de algas (esta é uma diluição 1: 1). Agite para misturar balão e colocar na incubadora diurna, até ser necessário para o passo 7.4.
6. Preparando Experimental Co-cultura
- Pipeta suavemente V co-cultura do frasco de estoque de algas para o balão de co-cultura de bactérias a partir do passo 4.5. Retorno balão de co-cultura para a incubadora diurna até que seja necessário para o passo 7.5.
NOTA: A concentração de bactérias no controlo de bactérias deve ser igual à concentração bacteriana na co-cultura experimental. Da mesma forma, a concentração de algas no controlo de algas deve igualar a concentração de algas na co-cultura experimental. Por ter as mesmas concentrações de bactérias e de algas iniciais, a densidade de população podem ser comparados ao longo da experiência.
7. Configurando Placas de Microtitulação
- Dividir um de 48 poços de placas de microtítulo estéril conforme a Figura 1.Etiqueta acima poços exteriores contendo amostras ou diluente estéril ou não fotossintéticos.
NOTA: A randomização dos poços da placa pode ser feito para as amostras colhidas no mesmo dia. Por exemplo, o quadrante 1 será amostrado a 1 d no experimento; os poços que deve ser randomizados são B2 - 4 e C2 - 4. Deixar o perímetro da placa de enchimento com a solução estéril tal como mostrado na Figura 1.
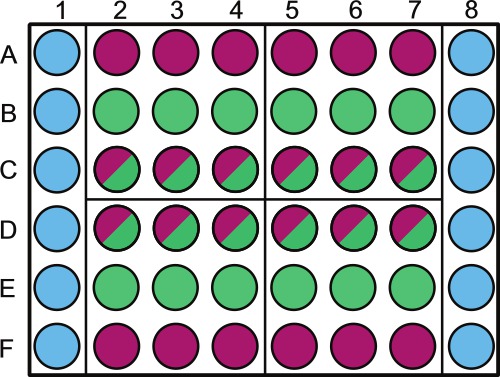
. Figura 1. Representação esquemática da colocação da amostra numa placa de microtitulação de 48 poços poços devem ser enchidos da seguinte forma: As colunas 1 e 6 poços, de A a F (  ) São cheios com 1 ml de PBS 1X (ou outra solução estéril / media). As linhas A e F, poços 2-8 (
) São cheios com 1 ml de PBS 1X (ou outra solução estéril / media). As linhas A e F, poços 2-8 (  ) São cheios com 1 ml de controlo bacteriano; rows B e E poços 2-8 (
) São cheios com 1 ml de controlo bacteriano; rows B e E poços 2-8 (  ) São cheios com 1 ml de controlo de algas; linhas C e D, poços 2-8 (
) São cheios com 1 ml de controlo de algas; linhas C e D, poços 2-8 (  ) São cheios com 1 ml de co-cultura. A placa é dividida em quatro quadrantes (A2, A5, D2 e D5) estes quadrantes são cada dia de amostragem específicas 1-4, este deve ser randomizados em todo placas e rotulados em conformidade. Dentro de cada dia, aconselhamos randomizando o controle de algas (
) São cheios com 1 ml de co-cultura. A placa é dividida em quatro quadrantes (A2, A5, D2 e D5) estes quadrantes são cada dia de amostragem específicas 1-4, este deve ser randomizados em todo placas e rotulados em conformidade. Dentro de cada dia, aconselhamos randomizando o controle de algas (  ) E co-cultura (
) E co-cultura (  ) poços usando um gerador de números aleatórios. Rotular a tampa sobre o PBS 1x e / ou cavidades de controlo para evitar o sombreamento bacterianas de culturas de algas.
) poços usando um gerador de números aleatórios. Rotular a tampa sobre o PBS 1x e / ou cavidades de controlo para evitar o sombreamento bacterianas de culturas de algas.
- Pipetar 1 ml de solução tampão de fosfato de 1x (PBS, pH 7,4) ou outra solução estéril em recipientes apropriados como indicado na Figura 1. Executar esta lentamente e com cuidado. PBS vai change a força iónica do meio de algas e / ou de co-cultura se respingos em outros poços de modo manipular cuidadosamente.
- Pipetar 1 ml de cultura bacteriana de controlo para os poços de controlo marcado bacteriana (Figura 1). Agitar o frasco bacteriana antes de cada placa pipetar para evitar a sedimentação bacteriana.
- Pipetar 1 mL da cultura de controlo de algas em poços de controlo de algas marcadas utilizando uma ponta de pipeta de boca larga (Figura 1). Agitar o balão de algas tão regularmente quanto o balão bacteriana. Se a alga tende a afundar ou flutuar, redemoinho tão regularmente quanto é necessário para manter uma cultura visual uniforme.
- Utilizando uma ponta de pipeta de boca larga, de pipeta de 1 ml de co-cultura em poços apropriados (Figura 1). Agitando o frasco co-cultura tão regularmente como o balão de algas.
- Selar cada placa com parafilme e coloque em uma incubadora diurna na temperatura desejada e ciclo de luz diurna (18 ° C com um 16: luz 8 hr: ciclo escuro é comumente usado). Deixaras placas na incubadora diurna até que esteja pronto para tomar PAM leituras (Seção 8). Garantir que todas as placas estão orientadas na mesma direcção para permitir a exposição de luz consistente.
- Tomar uma aliquota de 20 ul de PBS, meios de algas, estoque de algas e de controlo de algas e cair sobre uma placa de meio não-selectivo apropriado (por exemplo, Marine Broth 2216 suplementado com 1,5% de agar) e incubar as placas a 18 - 25 ° C durante 72 hr para testar a contaminação. Se o crescimento aparece em qualquer das soluções que contêm bactérias não deve, em seguida, estes dados não devem ser usados.
- Tome leituras PAM fluorometria usando a amostra restante dos frascos de controlo e co-cultura das algas para o experimental 0 d PAM lendo fluorometria (veja o passo 8.1). Quaisquer outras medições 0 d devem também ser realizados com o controlo de algas restante, o controlo de bactérias e amostras de co-cultura.
8. Tendo Leituras PAM Fluorometria a partir de amostras de Stock
- Zerar o WATER-PAMcom media de algas estéreis em uma tina limpo antes de tomar leituras 8.
- Pipetar 300 l de frascos de controlo ou de co-cultura das algas para uma cuvete limpa contendo 2,7 ml do mesmo meio de algas usada na experiência. Misturar a amostra e diluente delicadamente com uma grande ponta boca pipeta.
- Limpe-off todas as impressões digitais de fora da tina com um lenço de papel antes de colocar a cuba no WATER-PAM.
- Coloque a cuvete ÁGUA-PAM. Cubra a amostra com a tampa e deixe-a adaptar-escuro por 3 min. A adaptação ao escuro vezes variam, dependendo das espécies de algas e deve ser determinado para a alga específico utilizado na experiência. Evite vezes adaptação ao escuro longas (> 20 min), tendo leituras WATER-PAM durante o meio do ciclo escuro das incubadoras diurnas de algas 16,17.
- Após adaptação escuro, bateu F 0 botão. Se as leituras de fluorescência são acima de 3900, diluir a amostra 1: 1 em meio de algas. Dark-se adaptar para um 3 min e tak adicionaleA nova leitura. Se os F 0 ou F m leituras ainda estão acima de 3.900, continuar a diluir a amostra 1: 1 em meio de algas até que os F 0 e F m leituras estão abaixo de 3.900.
NOTA: Certifique-se de levar em conta essas diluições durante a gravação de fluorescência final: por exemplo, se a amostra de algas é diluído 1: 9 durante a transferência inicial do poço até o tubo de diluição, em seguida, a leitura de fluorescência de algas de 500 deve ser multiplicado pelo inverso do factor de diluição (neste caso 10) e a fluorescência real do tubo é, em seguida, 5.000. - Depois de definir F 0, tomar o pulso de saturação (SAT-Pulse) lendo cada 90 segundos batendo o botão SAT para tomar m leituras F. O intervalo de tempo entre as leituras podem ser ajustadas dependendo estirpe de algas. Amostra de descarte.
- Repita os passos de 8,1-8,6 para as amostras restantes.
9. Tendo Leituras PAM Fluorometria de Placas de Microtitulação
- Etiqueta6 estéreis tubos de amostras de> 3 ml de volume para poços B2 - 4 para o controle e poços de algas C2 - 4 para a co-cultura bacteriana (ver layout da placa na Figura 1).
- Aliquota de 2,7 ml do meio de algas estéril em cada tubo.
- Coloque tubos na incubadora diurno e permitir-lhes para se aclimatar à temperatura da alga foi cultivada a durante 30 minutos.
- Antes de remover a placa de microtitulação da incubadora assegurar que a penetração da luz para os poços escuros aclimatados é limitado por cobrir a placa com folha de alumínio (ou semelhante), só remover a folha durante a transferência activa de cultura das cavidades para os tubos de diluição (passos 9.5 - 9.7).
- Assepticamente misturar a primeira placa de microtitulação (bem B2) com uma grande ponta boca pipeta lentamente pipetando para cima e para baixo.
- Obter os tubos de diluição da incubadora e assepticamente transferência de 300 ul de bem B2 (Figura 1) para o seu tubo de amostra correspondente com uma ponta de pipeta de boca larga (esta é uma diluição 1: 9 da amostra em meio de algas).
- Repita os passos de 9,5-9,6 para os poços restantes (B3,4 e C2 - 4).
- Cubra os tubos de amostras com folha de alumínio e devolvê-los para a incubadora diurna até estar pronto para WATER-PAM.
- Realizar as leituras ÁGUA-PAM, conforme descrito nas etapas 8,1-8,7. Selar a placa de microtitulação com parafilm antes de voltar para a incubadora.
- Repita leituras em intervalos de tempo previstos para a duração do experimento. A frequência e comprimento de amostragem deve ser previsto no início da experiência.
10. Amostra Experiment
A exemplo de experimento é uma co-cultura de 10 dias de uma bactéria (Phaeobacter gallaeciensis BS107) e uma microalga (Emiliania huxleyi strain (CCMP3266)). Ele inclui um controlo de algas, o controlo bacteriano, e um bacteriana-algas experimental de co-cultura.
- Calcular volumes de estoques bactérias ou de algas necessários (etapas 1.1-1,4)

- Prepare o estoque de algas, um V de 40 ml, através da inoculação de 4 ml de alga em 36 ml de meio e incubou-se até que o crescimento exponencial precoce é conseguido com uma densidade celular de 10 ~ 4 células / ml (passos 2,1-2,4).
- Prepare o balão estoque bacteriana, diluindo 400 ul de as bactérias 10 6 ufc / ml obtidas na Secção 3 para um V B de 40 ml com meio de algas (concentração final de bactérias será 10 4 cfu / ml).
- Transferência de metade (20 ml) do estoque bacteriana para o frasco controle bacteriana e adicionar 20 ml de meio de algas para tornar o controlo bacteriano. Transferência de metade (20 ml) o estoque de algas para o balão de controle de algas e adicione 20 ml de meios de algas para fazer-se o controle de algas (Seção 5). Transferir os restantes 20 ml de estoque bacteriana para o balão de co-cultura e misturar com os restantes 20 ml de estoque de algas para estabelecer a co-cultura (Secção6).
- Pipetar a 1x PBS (pH 7,4), controlos, e co-cultura de duas placas de microtitulação pré-marcado (Figura 1), 1 ml por cavidade. Use 3 ml dos restantes controles e co-culturas para fazer medições 0 d (contagens de UFC, água-PAM (Seção 8), de observação microscópica da morfologia das células de algas, e de fixação de algas celular para citometria de fluxo).
- Fazer leituras ÁGUA-PAM para o controlo de algas e de co-cultura, uma vez por dia, durante 10 d, e sempre ao mesmo tempo como os 0 d medições foram feitas (secção 8).
11. Outros parâmetros de interesse
- Determinar a concentração bacteriana ufc: realizar uma diluição em série do controlo de bactérias e de co-cultura em 1x PBS estéril (ou semelhante), em seguida, cair na placa de caldo Marinho 2216 suplementado com 1,5% de agar (ou semelhante) e observar o número de ufc que crescem para determinar as bacterianas ufc / ml para cada poço 18.
- Para avaliar a concentração de células de algas: corrigir o controle de algas e co-cultura com uma concentração final de 0,15% de glutaraldeído. Incubar durante 10 min no escuro, seguida de flash congelamento em azoto líquido, e armazenar a -80 ° C. Processo de todas as amostras em um citómetro de fluxo (FACS Calibur ou semelhante) para contar as células de algas.
- Observar a morfologia de células de algas: culturas de algas e de bactérias, algas co-cultura usando microscopia (isto é, a microscopia de luz, de epifluorescência, ou semelhante).
Resultados
Leituras fluorometria WATER-PAM.
ÁGUA-Pulse-Amplitude Modulada (PAM) fluorometria é um método rápido e eficiente para determinar a fluorescência (um proxy para o teor de clorofila) e produção fotossintética (saúde PSII) de culturas de algas. O software PAM WinControl gera uma planilha de valores de dados em bruto para (a seguir estão os parâmetros básicos para escuras adaptado amostras de algas):
F 0 = fluorescência das células de adaptaçã...
Discussão
O crescimento de algas em um formato miniaturizado.
A miniaturização de culturas de algas a um volume de 1 ml de cultura numa placa de microtitulação permite a replicação dentro de uma experiência para ser aumentado. É importante garantir a alga é saudável durante todo um experimento; executar uma curva de crescimento (Figura 2), utilizando o formato de placa de microtitulação para avaliar vários meios de algas, para garantir o cumprimento dos requisitos nutriciona...
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported by Natural Sciences and Engineering Research Council of Canada (grant 402105), Canadian Foundation for Innovation (grant 129087) and Alberta Education and Training (grant AAETRCP-12-026-SEG) to RJC.
Materiais
| Name | Company | Catalog Number | Comments |
| 10 cu. ft. Diurnal incubator (6012-1) | Caron Corporate | 112310-6012-1-11 | www.caronproducts.com |
| Nunc EasYFlask 25 cm2, Vent/Close Cap, 7 ml working volume, 200/cs | Thermo Fisher Scientific | N156340 | www.fishersci.ca |
| Multiwell TC Plates – 48-well | BD Biosciences Discovery Labware | 353078 | www.bdbiosciences.com |
| P1000 Gilson The Pipetting Standard—Gilson's Pipetman | Mandel Scientific Company Inc. | GF-F123602 | www.mandel.ca |
| P10mL Gilson The Pipetting Standard—Gilson's Pipetman | Mandel Scientific Company Inc. | GF-F161201 | www.mandel.ca |
| Wide Orifice Tips nonsterile [100–1,250 µl] | VWR International | 89079-468 | www.ca.vwr.com |
| Ultrafine Tips nonsterile [100–1,250 µl] | VWR International | 89079-470 | www.ca.vwr.com |
| Finntip 10 ml [Vol: 1 - 10 ml] | Thermo Fisher Scientific | 9402151 | www.fishersci.ca |
| WATER-Pulse Amplitude Modulation (Water-ED) | Heinz Walz GmbH, Effeltrich, Germany | EDEE0232 | www.walz.com |
| 15 mm diameter quartz glass cuvette (WATER-K) | Caron Corporate | www.caronproducts.com | |
| Sodium chloride (crystalline/certified ACS), Fisher Chemical | Thermo Fisher Scientific | Thermo Fisher Scientific | www.fishersci.ca |
| BD Difco Marine Broth 2216 | BD Biosciences Discovery Labware | BD Biosciences Discovery Labware | www.bdbiosciences.com |
| BD Bacto Agar | BD Biosciences Discovery Labware | BD Biosciences Discovery Labware | www.bdbiosciences.com |
| L1 Medium Kit, 50 L | NCMA [National Center for Marine Algae and Microbiota | NCMA [National Center for Marine Algae and Microbiota | www.ncma.bigelow.org |
Referências
- Scarratt, M. G., Marchetti, A. Assessing microbial responses to iron enrichment in the Subarctic Northeast Pacific: Do microcosms reproduce the in situ condition?. Deep Sea Res Part II Top. Stud. Oceanogr. 53 (20-22), 2182-2200 (2006).
- Bidle, K. D., Haramaty, L., Barcelos E Ramos, J., Falkowski, P. Viral activation and recruitment of metacaspases in the unicellular coccolithophore, Emiliania huxleyi. Proc. Natl. Acad. Sci. U. S. A. 104 (14), 6049-6054 (2007).
- Moore, L. R., Goericke, R., Chisholm, S. W. Comparative physiology of Synechococcus and Prochlorococcus: influence of light and temperature on growth, pigments, fluorescence and absorptive. Mar. Ecol. Prog. Ser. 116, (1995).
- Iglesias-Rodriguez, M. D., Halloran, P. R. Phytoplankton calcification in a high-CO2 world. Science. 320 (5874), 336-340 (2008).
- Chen, M., Tang, H., Ma, H., Holland, T. C., Ng, K. Y. S., Salley, S. O. Effect of nutrients on growth and lipid accumulation in the green algae Dunaliella tertiolecta. Bioresour. Technol. 102 (2), 1649-1655 (2011).
- Lv, J. -. M., Cheng, L. -. H., Xu, X. -. H., Zhang, L., Chen, H. -. L. Enhanced lipid production of Chlorella vulgaris by adjustment of cultivation conditions. Bioresour. Technol. 101 (17), 6797-6804 (2010).
- Geider, R., Graziano, L., McKay, R. M. Responses of the photosynthetic apparatus of Dunaliella tertiolecta (Chlorophyceae) to nitrogen and phosphorus limitation. Eur. J. Phycol. 33 (4), 315-332 (1998).
- MacIntyre, H. L., Cullen, J. J. Using Cultures to Investigate the Physiological Ecology of Microalgae. Algal Cult. Tech. , 287-326 (2005).
- Blaise, C., Vasseur, P. Algal microplate toxicity test. Small-scale Freshw. Toxic. Investig. Vol. 1 Toxic. Test Methods. , 137-179 (2005).
- Skjelbred, B., Edvardsen, B., Andersen, T. A high-throughput method for measuring growth and loss rates in microalgal cultures. J. Appl. Phycol. 24, 1589-1599 (2012).
- Nagai, T., Taya, K., Annoh, H., Ishihara, S. Application of a fluorometric microplate algal toxicity assay for riverine periphytic algal species. Ecotoxicol. Environ. Saf. 94, 37-44 (2013).
- Seyedsayamdost, M. R., Case, R. J., Kolter, R., Clardy, J. The Jekyll-and-Hyde chemistry of Phaeobacter gallaeciensis. Nat. Chem. 3 (4), 331-335 (2011).
- Schreiber, U., Schliwa, U., Bilger, W. Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer. Photosynth. Res. 10 (1-2), 51-62 (1986).
- Jones, R. J., Ward, S., Amri, A. Y., Hoegh-Guldber, O. Changes in quantum efficiency of photosystem II of symbiotic dinoflagellates of corals after heat stress, and of bleached corals sampled after the 1998 Great Barrier Reef mass bleaching event. Mar. Freshw. Res. 51 (345), 659-668 (1998).
- Beer, S., Larsson, C., Poryan, O., Axelsson, L. Photosynthetic rates of Ulva (Chlorophyta) measured by pulse amplitude modulated fluorometry. Eur. J. Phycol. 35 (1), 69-74 (2000).
- . . WATER-PAM Chlorophyll Fluorometer. Instrument Description and Information for Users. , (2013).
- Maxwell, K., Johnson, G. M., Heers, J. Chlorophyll fluorescence--a practical guide. J. Exp. Bot. 51 (345), 659-668 (2000).
- Herigstad, B., Hamilton, M., Heersink, J. How to optimize the drop plate method for enumerating bacteria. J. Microbiol. Methods. 44 (2), 121-129 (2001).
- Kooten, O., Snel, J. The use of chlorophyll fluorescence nomenclature in plant stress physiology. Photosynth. Res. 25 (3), 147-150 (1990).
- Maxwell, K., Johnson, G. N. Chlorophyll fluorescence--a practical guide. J. Exp. Bot. 51 (345), 659-668 (2000).
- Schreiber, U. Pulse-Amplitude-Modulation (PAM) Fluorometry and Saturation Pulse Method: An Overview. Chlorophyll a Fluoresc. A Signat. Photosynth. , 279-319 (2004).
- Roháček, K., Barták, M. Technique of the modulated chlorophyll fluorescence: basic concepts, useful parameters, and some applications. Photosynthetica. 37 (3), 339-363 (1999).
- Da Silva, J. M., da Silva, A. B., Pádua, M. Modulated chlorophyll a fluorescence: a tool for teaching photosynthesis. J. Biol. Educ. 41 (4), 178-183 (2007).
- Vieira, S., Ribeiro, L., Jesus, B., Cartaxana, P., da Silva, J. M. Photosynthesis assessment in microphytobenthos using conventional and imaging pulse amplitude modulation fluorometry. Photochem. Photobiol. 89 (1), 97-102 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados