A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מבדק נפח קטן להערכה בקטריאלי / הפיטופלנקטון Co-תרבות שימוש במים-Pulse-Amplitude-אופנן (WATER-PAM) Fluorometry
In This Article
Summary
The goal of this procedure is to demonstrate the reproducibility and adaptability of using a microtiter plate format for microalgal screening. This rapid screen combines WATER-Pulse-Amplitude-Modulated (WATER-PAM) fluorometry to measure photosynthetic yield as an indicator of Photosystem II (PSII) health with small volume bacterial-algal co-cultures.
Abstract
שיטות מקובלות למניפולציה ניסויית של microalgae יש מועסקי כמויות גדולות של התרבות (20 מיליליטר עד 5 L), כך שהתרבות יכולה להיות subsampled לאורך הניסוי 1-7. Subsampling של כמויות גדולות יכול להיות בעייתי מכמה סיבות: 1) זה גורם לשינוי בשטח פן הנפח והכולל: יחס נפח של התרבות במהלך הניסוי; 2) פסאודו-שכפול (כלומר, לשכפל דגימות מאותו בקבוק הטיפול 8) לעתים קרובות מועסק ולא משכפל אמיתי (דגימה כלומר, מטיפולים לשכפל); 3) משך הניסוי מוגבל על ידי הנפח הכולל; ו 4) תרבויות axenic או חיידקי חיידקים הרגילים קשים לשמור במהלך ניסויים לטווח ארוך כזיהום מתרחש בדרך כלל במהלך subsampling.
השימוש בצלחות microtiter מאפשרת כרכי 1 מיליליטר תרבות שישמשו לכל לשכפל, עם עד 48 טיפולים נפרדים בתוךצלחת סנטימטר 12.65 x 8.5 x 2.2, ובכך להקטין את הנפח הניסיוני ומאפשר לשכפול נרחב ללא subsampling כל טיפול. בנוסף, טכניקה זו יכולה להיות שונה כדי להתאים מגוון רחב של פורמטים ניסיוניים כוללים: שיתוף תרבויות חיידקים-אצות, בדיקות פיזיולוגיה של אצות, ורעלן הקרנת 9-11. בארות בודדות עם אצה, חיידק ו / או שיתוף תרבויות ניתן לדגום לנוהלי מעבדה רבים, כולל, אך לא מוגבלת ל: WATER-Pulse-Amplitude-אופנן (WATER-PAM) fluorometry, מיקרוסקופיה, יחידת מושבת חיידקי יוצרים (CFU) רוזנים וcytometry זרימה. השילוב של fluorometry פורמט צלחת microtiter ומים-PAM מאפשר מדידות מהירות מרובות של תשואת פוטו ופרמטרים אחרים פוטו עם שונות נמוכות בין דגימות, שחזור גבוה וימנע את החסרונות רבים של subsampling בַּקבּוּק או בקבוק חרוטי במהלך ניסוי .
Introduction
הפיסיולוגיה הפיטופלנקטון באופן מסורתי למדה בניסויים טווינה-סולם הנעים בין 20 מיליליטר בצלוחיות חרוטי עד 5 L בcarboys 1-7. בקנה מידה ניסיוני זה דורש subsampling לניטור ניסוי, כהקרבת דגימות לשכפל לכל נקודת זמן יוצרת הגדרת ניסוי בלתי ניתנת לניהול.
היכולת להגדיל את מספר ניסויים בלתי תלויים תוך השימוש באותו מרחב חממה יומית על ידי miniaturizing הנפח הניסיוני לניסויי פיזיולוגיה אצות יהיה להפחית או לבטל את המגבלות של subsampling ופסאודו-שכפול מכמויות גדולות. פורמט צלחת microtiter פותח עבור bioassays אצות באמצעות 1 מיליליטר נפח תרבות לניסוי מניפולציה אצות בתנאים משתנים. נפח קטן וניסיוני זה מאפשר למספר החזרות להיות מוגבר, מגדיל שחזור ניסוי בשל השתנות ירד בין דגימות ולשכפלניסויים, ומאפשר שכפול אמיתי תוך שמירה על בקרת ניסוי (כלומר, תרבויות אצות axenic) עבור 140 ימים (איור 2) 12.
פורמט צלחת microtiter זה מותאם בקלות למגוון רחב של שאלות ניסיוניות, כגון: האם יש חיידק אינטראקציה סימביוטית, ניטראלית או פתוגניים עם מארח האצות שלה? האם התוספת של מגרה מתחם או רעילה לאצה? שאלות אלו ואחרות ניתן לטפל באופן תפוקה גבוהה מהיר באמצעות פורמט חדש זה 9-11.
צלחת תרבות microtiter 48 היטב מאפשרת לכל 1 מיליליטר גם להיות התקנה ניסיונית עצמאית שתדגם בנקודת זמן אחת. ניתן לדגום פרמטרים שונים מזה 1 מיליליטר כולל נפח, אך לא רק: הקרינה כלורופיל ופרמטרי פוטו באמצעות fluorometry במים Pulse-Amplitude-אופנן (WATER-PAM) (ראה חומרים וציוד שולחן) 13. Fluorometry במים PAM הוא טכניקה מהירה ולא פולשנית, שניתן להשתמש כדי לפקח על ניסויים שבוצעו עם אצות 13. זה מאפשר מדידה של יעילות פוטוסינתזה ובריאות PSII מקטן נפח תרבות (150-300 μl של התרבות בדילול מלא במדיום ל2-4 מיליליטר נפח מים-PAM) 14,15. בנוסף לfluorometry במים PAM, התקנה זו יכולה לשמש כדי למדוד מגוון של פרמטרים אחרים, כולל, אך לא מוגבלת ל: מיקרוסקופיה לדמיין את החיידקים מצורפים לתאים ושינויים במורפולוגיה של תאי אצות אצות; מושבת חיידקים יוצרת יחידת ספירה (CFU); וcytometry זרימה לספירת תאי אצות ותת-אוכלוסיות זיהוי.
Protocol
1. חישובים להתקנה ניסיונית
- חשב את הנפח של אצות ו / או תרבויות חיידקים זקוקים לבקרה שתידרש לניסוי כולו על ידי שימוש במשוואה 1:
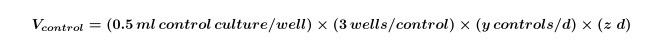
איפה y שווה למספר הבקרות הדרושות ליום וz שווה למספר הימים. - חשב את הנפח של תרבויות אצות ו / או בקטריאלי, הדרושים לשיתוף תרבויות לניסוי באמצעות משוואה 2:
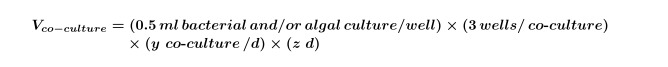
הערה: ניתן להחליף את הניסויים "התרבות המשותפת" עם כל מסך מתחם; רק להתאים את המתחם הסופי, ממס וריכוזי אצות שיתאימו לעיצוב ניסיוני. - השתמשו במשוואות 1 ו -2 כדי לחשב את הנפח הסופי של תרבות אצות מוקדם מעריכים (בדרך כלל 5 ימים ל~ 10 4 תאים / מיליליטר אבל זה צריך להיקבע על ידי performing עקומת צמיחת אצות) הנדרשת לניסוי (כרך זה נחוץ לשלב 2.3) באמצעות משוואה 3:

- השתמש במשוואות 1 ו -2 כדי לחשב את הנפח הסופי של 10 4 CFU / ml תרבות חיידקים (או ריכוז חיסון רצוי) הנדרש לניסוי (כרך זה נחוץ לשלב 4.2) באמצעות משוואה 4:

הערה: השתמש בתוספת של 10 מיליליטר בשלבים 1.3 ו -1.4 לחשבון pipetting שגיאה וכל בדיקות שמבוצעות (למשל, במים PAM, cytometry זרימה, מיקרוסקופיה, וכו ') על 0 ד. הגדל את נפח זה במידת צורך כדי להתאים את עיצוב ניסיוני.
הערה: לחישוב דוגמא של ניסוי 8 ימים ראה סעיף 10. ראה טבלה נוספת למתכוני תקשורת.
2. תאי אצת גידול להגדרת ניסוי
- לבודד או להשיגמתרחב תרבות אצות axenic.
- העברת הסביבה נקיה מחיידקים 10% מהנפח הסופי של תרבות האצות לתוך מדיום אצות סטרילי (למשל, L1 או בינוני אצות ימיות דומה, ראה חומרים וציוד שולחן), על מנת להבטיח דילול 1: 9 של תרבות של אצות במדיום חדש. לגדול האצה מדוללת בחממה יומית באמצעות תנאי גידול נקבעו בעבר לזן ש( למשל, C ° 18 עם 16: 8 שעות אור: מחזור כהה משמש בדרך כלל).
- כאשר התרבות הגיעה מוקדם מעריכי-שלב, מחדש תרבות האצה באותו מדיום אצות סטרילי (למשל, L1 או בינוני אצות ימיות דומה), להבטיח את הריכוז הסופי הוא 1: 9 דילול ושהנפח הסופי של אצות הוא שווה לV מחושב (שלב 1.3).
הערה: חשוב כדי להבטיח תרבויות אלה axenic. לבדוק את כל התקשורת של אצות ובקבוקי מניית אצות לזיהום על ידי ציפוי aliquot 20 μl על מדיום חיידקים ימי כללי (לדוגמא, ימיתמרק בתוספת 2,216 אגר 1.5% או דומה). - לגדול בתרבות של אצות לשלב מוקדם מעריכים (~ 10 4 תאים / מיליליטר).
הערה: לכל זן אצות עקומת צמיחה ייחודית בהתאם לתנאי culturing. שלב מוקדם מעריכים (~ 10 4 תאים / מיליליטר) ניתן לקבוע על ידי ביצוע עקום צמיחת אצות המבוססים על צפיפות תאים (כלומר באמצעות cytometry זרימה או מיקרוסקופ).
3. הכנת תאי חיידקים לחיסון
- טרום לקבוע את ריכוז החיידקים (CFU / ml) וצפיפות אופטית (OD) של החיידק בשלב נייח על ידי עושה עקומת צמיחה בתנאים הבינוני והתפתחות חיידקים נבחרו (לדוגמא, ימי מרק 2,216 ב 25 ° C ו -160 סל"ד, או דומה). השתמש במידע זה כדי לגדל את התאים (שלב 3.3) ולאחר מכן לדלל את התאים בצורה נכונה בשלב 3.7.
- הסביבה נקיה מחיידקים להעביר מושבת חיידקים מבודדת וטרי גדלה מצלחת 1.5% אגר (למשל, ימי מרק 2,216 גמישיםmented עם אגר 1.5% או בינוני מוצק חיידקים ימיים דומה) לתוך 5 מיליליטר של מדיום נוזלי חיידקים (למשל, ימי מרק 2,216 או בינוני חיידקים ימיים דומה).
- לגדול החיידק לשלב נייח על תוף מתגלגל או שייקר (~ 12-36 שעות, תלוי בחיידק). לתכנן את הניסוי כך שהחיידק מגיע שלב נייח (~ אוגוסט 10 - ספטמבר 10 CFU / ml) באותו הזמן שתאי האצה הגיעו לשלב מוקדם מעריכים (~ מיליליטר / 10 4 תאים).
- בעזרת פיפטה, לשטוף את כל biofilm המצורף למבחנה לתוך המדיום. פיפטה 1 מיליליטר של תרבית חיידקים מעורבות היטב לתוך microtube 1.5 מיליליטר סטרילי. צנטריפוגה 1 דקות ב14,000 x ז.
- הסר ולהשליך supernatant (תקשורת חיידקים) מבלי לשבש את גלולה (תאי חיידקים). הוסף 1 מיליליטר של תקשורת סטרילית אצות (למשל, L1 או דומה) לmicrotube (עם גלולה). microtube מערבולת כדי resuspend גלולה בתקשורת אצות.
- לשטוף את השני:חזור על שלב 3.5.
הערה: זה קריטי כדי לשטוף את תאי חיידקים עם תקשורת אצות כדי להסיר ביסודיות את כל חומרי ההדפסה חיידקים, שאריות תאים, חלבונים מופרשים ומולקולות קטנות מהתאים לפני inoculating האצות איתם כמו זה יכול לשנות את ההרכב התזונתי של תקשורת האצות או להציג את המולקולות ביו למסך. - סדרתי לדלל את תאי חיידקיים שטפו בתקשורת אצות, לריכוז סופי שהוא פי 100 יותר מרוכזים מאשר הריכוז הרצוי הסופי החיידקים (CFU / ml). שמור את microtube המכיל תאים שנשטפו ומדולל בתקשורת אצות לשלב 4.2.
הערה: תכנית הניסוי המבוסס על שיש יחס של 1: 1 של אצות לחיידקים על 0 ד. כדי לעשות ריכוז חיידקים ראשוני רצוי זה לניסוי הוא 10 4 CFU / ml, ולכן בשלב 3.7 התאים הראשוניים צריכים להיות מדוללים באופן סדרתי עד 10 6 CFU / ml.
4. חיידקים הכנה לניסויהתקנת אל
- הכן 4 צלוחיות חרוטי סטרילי autoclaved זכוכית ולתייג אותם: א) "בקבוק אצות שליטה ', ב)" בקבוק המניה בדילול מלא חיידקים', ג) 'בקבוק שליטת חיידקים', ו-ד) 'בקבוק שיתוף התרבות'.
- לדלל את ההשעיה חיידקים מ צעד 3.7 1:99 בתקשורת אצות סטרילי כדי נפח סופי = V B (שלב 1.4). הפוך את הדילול במניות הבקבוק שכותרתו מדוללת חיידקים (שלב 4.1).
הערה: בדוגמא הקודמת (שלב 4.2), דילול 1:99 זה נותן ריכוז סופי של 10 4 CFU / ml. בקבוק מערבולת לערבב תאים. - שליטת V פיפטה (שלב 1.1) מהמניות בדילול מלא החיידקים ולשים אותו בבקבוק שליטת החיידקים.
- שליטת פיפטה V של מדיום סטרילי אצות לתוך בקבוק שליטת החיידקים (זה דילול 1: 1). בקבוק מערבולת לערבב תאים ומניח בצד לצעד 7.3.
- שיתוף תרבות פיפטה V מהמניות בדילול מלא חיידקיםבקבוק כדי בקבוקון שיתוף התרבות, להגדיר בקבוק בצד לצעד 6.1.
הערה: כאשר עושים שיתוף תרבויות מרובות באותו האצה בפעם אחת (כלומר, תרבות משותפת של שני חיידקים שונים מבודדת עם שליטה אחד) יש צורך לחשב מחדש את שיתוף תרבות V עבור כל זן בנפרד ולאחר מכן חזור על שלב 4.5 לכל שיתוף תרבות בנפרד. זה הכרחי גם כדי להגדיל את V מחושב בשלב 1.3 לכלול גם שיתוף תרבויות שמוצגים במשוואה 5: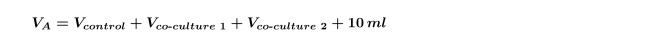
5. הכנת אצות להגדרת ניסוי
- לערבב בעדינות התרבות המוקדמת מעריכי אצות (משלב 2.4) עם קצה פיפטה רחב-פה עד תאים מופיעים גם מעורבים.
- שליטת V פיפטה מבקבוק מניית האצות לבקבוק שליטת האצות. בעדינות פיפטה באמצעות פיפטה 10 מיליליטר. לאחר מכן להחזיר את בקבוק מניית האצות בחממה היומית.
- המשך V פיפטהרול של מדיום אצות סטרילי לבקבוק שליטת אצות (זה דילול 1: 1). מערבולת לערבב בקבוק ומקום בחממה היומית, עד צורך לצעד 7.4.
6. ניסויי משותף תרבות הכנה
- בעדינות פיפטה שיתוף תרבות V מהבקבוק מניית האצות לתוך בקבוק שיתוף תרבות חיידקים משלב 4.5. חזור בקבוק שיתוף תרבות לחממה היומית עד צורך לצעד 7.5.
הערה: הריכוז של חיידקים בשליטת החיידקים צריך להיות שווה לריכוז החיידקים בשיתוף התרבות הניסיונית. באופן דומה, הריכוז של אצות בשליטת האצות צריך להיות שווה לריכוז של אצות בשיתוף התרבות הניסיונית. על ידי כך אותם ריכוזי חיידקים ואצות ראשוניים, צפיפות האוכלוסייה ניתן להשוות לאורך כל הניסוי.
7. הגדרת הצלחות microtiter
- לחלק צלחת microtiter 48 היטב סטרילי לפי איור 1.תווית מעל בארות חיצוניות המכילות דגימות או diluent סטרילי או לא פוטוסינתזה.
הערה: רנדומיזציה של בארות הצלחת ניתן לעשות לדגימות שנלקחו באותו היום. לדוגמא, ברבע 1 יהיה נדגם בד 1 בניסוי; הבארות שיש באופן אקראי הן B2 - 4 וC2 - 4. השאירו את המערכת של הצלחת מלאה בתמיסה סטרילית, כפי שמוצג באיור 1.
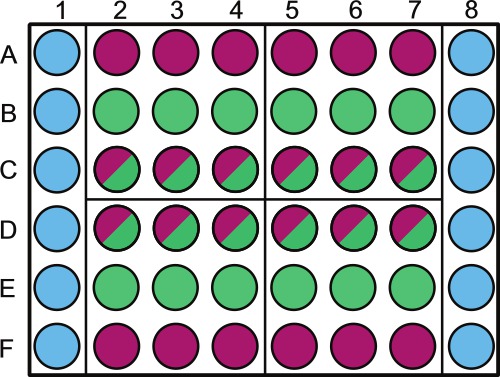
. איור 1. ייצוג סכמטי של מיקום מדגם בצלחת microtiter 48 היטב ולס הוא להיות מלא באופן הבא: עמודות 1 ו -6, בארות באמצעות F (  ) מלאים עם 1 מיליליטר 1x PBS (או פתרון / תקשורת סטרילית אחרת). שורות וF, בארות 2-8 (
) מלאים עם 1 מיליליטר 1x PBS (או פתרון / תקשורת סטרילית אחרת). שורות וF, בארות 2-8 (  ) מלאים עם 1 מיליליטר שליטת חיידקים; roבארות B ו- E ws 2-8 (
) מלאים עם 1 מיליליטר שליטת חיידקים; roבארות B ו- E ws 2-8 (  ) מלאים עם 1 מיליליטר שליטת אצות; שורות C ו- D, בארות 2-8 (
) מלאים עם 1 מיליליטר שליטת אצות; שורות C ו- D, בארות 2-8 (  ) מלאים בשיתוף תרבות מיליליטר 1. הצלחת מחולקת 4 רביעים (A2, A5, D2, וD5) הרביעים האלה הם כל ימי דגימה ספציפיים 1-4, זה צריך להיות באופן אקראי בכל צלחות ומסומנות בהתאם. בתוך כל יום אנו ממליצים באופן אקראי, שליטת האצות (
) מלאים בשיתוף תרבות מיליליטר 1. הצלחת מחולקת 4 רביעים (A2, A5, D2, וD5) הרביעים האלה הם כל ימי דגימה ספציפיים 1-4, זה צריך להיות באופן אקראי בכל צלחות ומסומנות בהתאם. בתוך כל יום אנו ממליצים באופן אקראי, שליטת האצות (  ) ותרבות משותפת (
) ותרבות משותפת (  בארות) באמצעות מחולל מספרים אקראי. תווית המכסה מעל PBS 1x ו / או בארות שליטת חיידקים כדי למנוע הצללה של תרבויות אצות.
בארות) באמצעות מחולל מספרים אקראי. תווית המכסה מעל PBS 1x ו / או בארות שליטת חיידקים כדי למנוע הצללה של תרבויות אצות.
- פתרון פיפטה 1 מיליליטר פוספט 1x חיץ (PBS, pH 7.4) או תמיסה סטרילית אחרת בבארות המתאימות כפי שמצוין באיור 1. בצע לאט ובזהירות זו. PBS יהיה change החוזק היוני של מדיום האצות ו / או התרבות משותפת אם זה ניתז בבארות אחרות כך לטפל בזהירות.
- פיפטה 1 מיליליטר של תרבות שליטת חיידקים לתוך בארות שכותרתו שליטת חיידקים (איור 1). לערבל את בקבוק החיידקים לפני pipetting כל צלחת כדי למנוע התישבות חיידקים.
- 1 פיפטה מיליליטר של תרבות שליטת אצות לתוך בארות שכותרתו שליטת אצות באמצעות קצה רחב הפה פיפטה (איור 1). לערבל את בקבוק האצות באופן סדיר כמו בקבוק החיידקים. אם האצה נוטה לשקוע או לצוף, מערבולת באופן סדיר כמו שצריך כדי לשמור על תרבות אחידה מבחינה ויזואלית.
- באמצעות קצה הפה פיפטה רחב, פיפטה 1 מיליליטר של התרבות המשותפת בבארות המתאימות (איור 1). מתערבל בקבוק שיתוף התרבות באופן סדיר כמו הבקבוק של אצות.
- לאטום כל צלחת עם parafilm ומקום בחממה יומית בטמפרטורה הרצויה ומחזור אור היומי (18 ° C עם 16: 8 שעות אור: מחזור כהה משמש בדרך כלל). השארהצלחות בחממה היומית עד מוכן לקחת PAM קריאה (סעיף 8). להבטיח את כל הצלחות מכוונים באותו הכיוון כדי לאפשר חשיפה לאור עולה בקנה אחד.
- קח aliquot 20 μl מPBS, תקשורת אצות, אצות ומניית שליטת אצות ושחרר צלחת על מדיום הלא סלקטיבי מתאים (למשל, הימי מרק 2,216 תוספת אגר 1.5%) ו דגירה צלחות ב18-25 מעלות צלזיוס במשך 72 שעות לבדיקת זיהום. אם צמיחה מופיעה באף אחד מהפתרונות שלא צריך להכיל חיידקים, אז לא צריכים להיות השתמשו בנתונים אלה.
- קח קריאות fluorometry PAM באמצעות המדגם שנותר מצלוחיות שליטה ושיתוף התרבות של אצות לfluorometry הניסיוני 0 ד PAM קריאה (ראה שלב 8.1). כל מדידות 0 ד אחרים גם צריכה להתבצע עם השליטה שתישאר אצות, שליטה בקטריאלי ודגימות התרבות המשותפת.
8. קריאת PAM Fluorometry לוקח מדוגמאות במלאי
- אפס במים PAMעם תקשורת אצות סטרילי בקובט נקי לפני נטילת קריאות 8.
- פיפטה 300 μl מצלוחיות שליטה או שיתוף התרבות של אצות לתוך קובט נקי המכיל 2.7 מיליליטר של המדיום זהה אצות המשמש בניסוי. מערבבים את המדגם ומדללים בעדינות עם קצה הפה פיפטה רחב.
- נגב את כל טביעות האצבעות-מחוץ לקובט עם רקמה לפני הצבת קובט במים-PAM.
- הנח קובט לתוך מים-PAM. מכסה את המדגם עם הכובע ולאפשר לו להסתגל כהה במשך 3 דקות. פעמים הסתגלות כהות משתנות בהתאם למין של אצות, ויש לקבוע לאצה מסוימת בשימוש בניסוי. הימנע פעמים הסתגלות כהות ארוכות (> 20 דקות) על ידי לקיחת קריאות במים PAM במהלך אמצע המחזור האפל של החממות יומי אצות 16,17.
- לאחר אימוצו הכהה, פגע F 0 כפתור. אם קריאות הקרינה הן מעל 3,900, לדלל מדגם 1: 1 במדיום אצות. Dark-להסתגל ל3 דקות וtak נוספיםקריאה חדשה ea. אם הקריאות מ 'F 0 או F הן עדיין מעל 3,900, תמשיך לדלל המדגם 1: 1 במדיום אצות עד הקריאות מ' F 0 וF נמצאות מתחת 3,900.
הערה: הקפד לתת דין וחשבון לדילולים אלה בעת הקלטת הקרינה סופית: למשל, אם מדגם האצות מדולל 1: 9 בהעברה הראשונית מהבאר אל צינור הדילול, אז קריאת הקרינה אצות של 500 יש לכפול ההפוך של הגורם לדילול (במקרה זה 10) והקרינה בפועל של הצינור הוא אז 5,000. - לאחר הגדרת F 0, לקחת דופק להרוות (SAT-פולס) קריאה כל sec 90 על ידי לחיצה על כפתור SAT לקחת קריאות מ 'F. מרווח הזמן בין הקריאה עשוי להיות מותאם בהתאם לזן אצות. מדגם מחק.
- חזור על שלבים 8.1-8.6 לדגימות שנותרו.
9. קריאת PAM Fluorometry לוקח מהצלחות microtiter
- תווית6 צינורות מדגם סטרילי של> 3 מיליליטר נפח לבארות B2 - 4 לC2 שליטה ובארות אצות - 4 לשיתוף תרבות החיידקים (ראה פריסת צלחת באיור 1).
- Aliquot 2.7 מיליליטר של מדיום אצות סטרילי לתוך צינור אחד.
- מניחים צינורות בחממה יומית ולאפשר להם להסתגל לטמפרטורת האצה הייתה גדלה בלמשך 30 דקות.
- לפני הסרת צלחת microtiter מן החממה להבטיח שחדירת האור לתוך הבארות הכהות התאקלם מוגבלת על ידי כיסוי הצלחת עם נייר אלומיניום (או דומה), רק להסיר את נייר הכסף בעת העברה באופן פעיל תרבות מהבארות לצינורות הדילול (שלבים 9.5 - 9.7).
- הסביבה נקיה מחיידקים לערבב צלחת microtiter הראשונה היטב (גם B2) עם קצה הפה פיפטה רחב על ידי pipetting לאט מעלה ומטה.
- השג את צינורות דילול מהעברת החממה והסביבה נקיה מחיידקים 300 μl מהיטב B2 (איור 1) לצינור המדגם המקביל שלה עם טיפ פיפטה פה רחב (זה דילול 1: 9 למדגם במדיום אצות).
- חזור על שלבים 9.5-9.6 לבארות הנותרות (B3,4 וC2 - 4).
- לכסות צינורות מדגם ברדיד אלומיניום ולהחזיר אותם לחממה היומית עד מוכן למים-PAM.
- לבצע קריאות במים PAM כפי שמתואר בצעדים 8.1-8.7. חותם את צלחת microtiter עם parafilm לפני החזרתו לחממה.
- חזור על קריאות במרווחי זמן מתוכננים לתקופת הניסוי. התדירות והאורך של דגימה צריכה להיות מתוכנן בתחילת הניסוי.
ניסוי 10. לדוגמא
ניסוי המדגם הוא תרבות משותפת 10 יום של חיידק (BS107 gallaeciensis Phaeobacter) וmicroalga (זן Emiliania huxleyi (CCMP3266)). הוא כולל שליטת אצות, שליטה בקטריאלי, ושיתוף תרבות ניסויים בקטריאלי-אצות.
- חישוב כמויות של מניות חיידקים ואצות הנדרשות (שלבים 1.1-1.4)

- הכן את מניית האצות, V של 40 מיליליטר, על ידי inoculating 4 מיליליטר של אצה ב -36 מיליליטר בינוני וטופחו עד שהצמיחה מוקדמת מעריכים מושגת עם צפיפות תאים של ~ / 10 4 תאי מיליליטר (שלבים 2.1-2.4).
- הכן את בקבוק מניית החיידקים על ידי דילול 400 μl של 10 6 CFU / מיליליטר החיידקים המתקבלים בסעיף 3 לV B של 40 מיליליטר עם תקשורת אצות (ריכוז סופי של חיידקים יהיה 10 4 CFU / ml).
- העברת מחצית (20 מיליליטר) של המניה בקטריאלי לבקבוק שליטת החיידקים ולהוסיף 20 מיליליטר של תקשורת אצות כדי להפוך את השליטה בקטריאלי. העברת מחצית (20 מיליליטר) מניית האצות לבקבוק שליטת האצות ולהוסיף 20 מיליליטר של תקשורת אצות לפצות את השליטה של אצות (סעיף 5). להעביר 20 מיליליטר הנותר של מניות בקטריאלי לבקבוק שיתוף התרבות ולערבב עם 20 מיליליטר הנותר של מניות אצות להקים שיתוף התרבות (סעיף6).
- פיפטה PBS 1x (pH 7.4), בקרות, ושיתוף התרבות בשתי צלחות שכותרתו מראש microtiter (איור 1), 1 מיליליטר לכל טוב. השתמש 3 מיליליטר של בקרות שנותרו ושיתוף תרבויות לעשות 0 מדידות ד (ספירת CFU, במים PAM (סעיף 8), תצפית מיקרוסקופית של מורפולוגיה של תאי אצות, וקיבוע תא אצות לזרימה cytometry).
- לקחת קריאות במים PAM לשליטה האצות והתרבות משותפת פעם ביום למשך 10 ד, ותמיד באותו הזמן כמדידות ד 0 נלקחו (סעיף 8).
11. פרמטרים אחרים של ריבית
- לקבוע את ריכוז CFU חיידקים: לבצע דילול סדרתי של השליטה בקטריאלי ושיתוף התרבות ב1x סטרילי PBS (או דומה), ולאחר מכן שחרר את הצלחת על ימי מרק 2,216 תוספת אגר 1.5% (או דומה) ולבחון את מספר CFU הגדלים כדי לקבוע את מיליליטר / CFU חיידקים לכל אחד גם 18.
- כדי להעריך את ריכוז תאי אצות: לתקן את השליטה ושיתוף אצותתרבות עם 0.15% ריכוז סופי של glutaraldehyde. דגירה של 10 דקות ב, אז פלאש הקפאה בחנקן נוזלי הכהה, ולאחסן ב -80 ° C. תהליך לכל הדגימות על cytometer זרימה (FACS Calibur או דומה) לספור תאי אצות.
- שים לב מורפולוגיה אצות תא: תרבויות אצות ושיתוף תרבות חיידקים-אצות באמצעות מיקרוסקופ (כלומר, מיקרוסקופ אור, epifluorescence, או דומה).
תוצאות
קריאות fluorometry במים PAM.
במים Pulse-Amplitude-אופנן (PAM) fluorometry היא שיטה מהירה ויעילה כדי לקבוע את הקרינה (proxy עבור תוכן כלורופיל) ותשואת פוטוסינתזה (בריאות PSII) של תרבויות אצות. תוכנת PAM WinControl יוצרת גיליון אלקטרוני של ערכי נתונים גולמיים ל( להלן ?...
Discussion
צמיחת אצות בפורמט מיניאטורי.
המזעור של תרבויות אצות למיליליטר 1 נפח תרבות בצלחת microtiter מאפשר לשכפול בניסוי להיות מוגבר. זה חשוב כדי להבטיח את האצה היא בריאה לאורך ניסוי; לבצע עקומת צמיחה (איור 2), תוך שימוש בפורמט צלחת microtiter ?...
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by Natural Sciences and Engineering Research Council of Canada (grant 402105), Canadian Foundation for Innovation (grant 129087) and Alberta Education and Training (grant AAETRCP-12-026-SEG) to RJC.
Materials
| Name | Company | Catalog Number | Comments |
| 10 cu. ft. Diurnal incubator (6012-1) | Caron Corporate | 112310-6012-1-11 | www.caronproducts.com |
| Nunc EasYFlask 25 cm2, Vent/Close Cap, 7 ml working volume, 200/cs | Thermo Fisher Scientific | N156340 | www.fishersci.ca |
| Multiwell TC Plates – 48-well | BD Biosciences Discovery Labware | 353078 | www.bdbiosciences.com |
| P1000 Gilson The Pipetting Standard—Gilson's Pipetman | Mandel Scientific Company Inc. | GF-F123602 | www.mandel.ca |
| P10mL Gilson The Pipetting Standard—Gilson's Pipetman | Mandel Scientific Company Inc. | GF-F161201 | www.mandel.ca |
| Wide Orifice Tips nonsterile [100–1,250 µl] | VWR International | 89079-468 | www.ca.vwr.com |
| Ultrafine Tips nonsterile [100–1,250 µl] | VWR International | 89079-470 | www.ca.vwr.com |
| Finntip 10 ml [Vol: 1 - 10 ml] | Thermo Fisher Scientific | 9402151 | www.fishersci.ca |
| WATER-Pulse Amplitude Modulation (Water-ED) | Heinz Walz GmbH, Effeltrich, Germany | EDEE0232 | www.walz.com |
| 15 mm diameter quartz glass cuvette (WATER-K) | Caron Corporate | www.caronproducts.com | |
| Sodium chloride (crystalline/certified ACS), Fisher Chemical | Thermo Fisher Scientific | Thermo Fisher Scientific | www.fishersci.ca |
| BD Difco Marine Broth 2216 | BD Biosciences Discovery Labware | BD Biosciences Discovery Labware | www.bdbiosciences.com |
| BD Bacto Agar | BD Biosciences Discovery Labware | BD Biosciences Discovery Labware | www.bdbiosciences.com |
| L1 Medium Kit, 50 L | NCMA [National Center for Marine Algae and Microbiota | NCMA [National Center for Marine Algae and Microbiota | www.ncma.bigelow.org |
References
- Scarratt, M. G., Marchetti, A. Assessing microbial responses to iron enrichment in the Subarctic Northeast Pacific: Do microcosms reproduce the in situ condition?. Deep Sea Res Part II Top. Stud. Oceanogr. 53 (20-22), 2182-2200 (2006).
- Bidle, K. D., Haramaty, L., Barcelos E Ramos, J., Falkowski, P. Viral activation and recruitment of metacaspases in the unicellular coccolithophore, Emiliania huxleyi. Proc. Natl. Acad. Sci. U. S. A. 104 (14), 6049-6054 (2007).
- Moore, L. R., Goericke, R., Chisholm, S. W. Comparative physiology of Synechococcus and Prochlorococcus: influence of light and temperature on growth, pigments, fluorescence and absorptive. Mar. Ecol. Prog. Ser. 116, (1995).
- Iglesias-Rodriguez, M. D., Halloran, P. R. Phytoplankton calcification in a high-CO2 world. Science. 320 (5874), 336-340 (2008).
- Chen, M., Tang, H., Ma, H., Holland, T. C., Ng, K. Y. S., Salley, S. O. Effect of nutrients on growth and lipid accumulation in the green algae Dunaliella tertiolecta. Bioresour. Technol. 102 (2), 1649-1655 (2011).
- Lv, J. -. M., Cheng, L. -. H., Xu, X. -. H., Zhang, L., Chen, H. -. L. Enhanced lipid production of Chlorella vulgaris by adjustment of cultivation conditions. Bioresour. Technol. 101 (17), 6797-6804 (2010).
- Geider, R., Graziano, L., McKay, R. M. Responses of the photosynthetic apparatus of Dunaliella tertiolecta (Chlorophyceae) to nitrogen and phosphorus limitation. Eur. J. Phycol. 33 (4), 315-332 (1998).
- MacIntyre, H. L., Cullen, J. J. Using Cultures to Investigate the Physiological Ecology of Microalgae. Algal Cult. Tech. , 287-326 (2005).
- Blaise, C., Vasseur, P. Algal microplate toxicity test. Small-scale Freshw. Toxic. Investig. Vol. 1 Toxic. Test Methods. , 137-179 (2005).
- Skjelbred, B., Edvardsen, B., Andersen, T. A high-throughput method for measuring growth and loss rates in microalgal cultures. J. Appl. Phycol. 24, 1589-1599 (2012).
- Nagai, T., Taya, K., Annoh, H., Ishihara, S. Application of a fluorometric microplate algal toxicity assay for riverine periphytic algal species. Ecotoxicol. Environ. Saf. 94, 37-44 (2013).
- Seyedsayamdost, M. R., Case, R. J., Kolter, R., Clardy, J. The Jekyll-and-Hyde chemistry of Phaeobacter gallaeciensis. Nat. Chem. 3 (4), 331-335 (2011).
- Schreiber, U., Schliwa, U., Bilger, W. Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer. Photosynth. Res. 10 (1-2), 51-62 (1986).
- Jones, R. J., Ward, S., Amri, A. Y., Hoegh-Guldber, O. Changes in quantum efficiency of photosystem II of symbiotic dinoflagellates of corals after heat stress, and of bleached corals sampled after the 1998 Great Barrier Reef mass bleaching event. Mar. Freshw. Res. 51 (345), 659-668 (1998).
- Beer, S., Larsson, C., Poryan, O., Axelsson, L. Photosynthetic rates of Ulva (Chlorophyta) measured by pulse amplitude modulated fluorometry. Eur. J. Phycol. 35 (1), 69-74 (2000).
- . . WATER-PAM Chlorophyll Fluorometer. Instrument Description and Information for Users. , (2013).
- Maxwell, K., Johnson, G. M., Heers, J. Chlorophyll fluorescence--a practical guide. J. Exp. Bot. 51 (345), 659-668 (2000).
- Herigstad, B., Hamilton, M., Heersink, J. How to optimize the drop plate method for enumerating bacteria. J. Microbiol. Methods. 44 (2), 121-129 (2001).
- Kooten, O., Snel, J. The use of chlorophyll fluorescence nomenclature in plant stress physiology. Photosynth. Res. 25 (3), 147-150 (1990).
- Maxwell, K., Johnson, G. N. Chlorophyll fluorescence--a practical guide. J. Exp. Bot. 51 (345), 659-668 (2000).
- Schreiber, U. Pulse-Amplitude-Modulation (PAM) Fluorometry and Saturation Pulse Method: An Overview. Chlorophyll a Fluoresc. A Signat. Photosynth. , 279-319 (2004).
- Roháček, K., Barták, M. Technique of the modulated chlorophyll fluorescence: basic concepts, useful parameters, and some applications. Photosynthetica. 37 (3), 339-363 (1999).
- Da Silva, J. M., da Silva, A. B., Pádua, M. Modulated chlorophyll a fluorescence: a tool for teaching photosynthesis. J. Biol. Educ. 41 (4), 178-183 (2007).
- Vieira, S., Ribeiro, L., Jesus, B., Cartaxana, P., da Silva, J. M. Photosynthesis assessment in microphytobenthos using conventional and imaging pulse amplitude modulation fluorometry. Photochem. Photobiol. 89 (1), 97-102 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved