Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un essai biologique de petit volume pour évaluer bactérienne / phytoplancton co-culture avec de l'eau-Pulse-modulé en amplitude (EAU-PAM) Fluorimétrie
Dans cet article
Résumé
The goal of this procedure is to demonstrate the reproducibility and adaptability of using a microtiter plate format for microalgal screening. This rapid screen combines WATER-Pulse-Amplitude-Modulated (WATER-PAM) fluorometry to measure photosynthetic yield as an indicator of Photosystem II (PSII) health with small volume bacterial-algal co-cultures.
Résumé
Les procédés classiques pour la manipulation expérimentale de microalgues ont utilisé de grands volumes de culture (20 ml) à 5 L, de sorte que la culture peut être sous-échantillonné pendant toute l'expérience 1-7. Le sous-échantillonnage de grandes quantités peut être problématique pour plusieurs raisons: 1) il provoque la variation du volume total et l'aire de surface: rapport en volume de la culture au cours de l'expérience; 2) pseudo-réplication (c.-à répliquer des échantillons de la même flacon de traitement 8) est souvent employé plutôt que de véritables répétitions (ce est à dire, l'échantillonnage des traitements répétés); 3) la durée de l'expérience est limitée par le volume total; et 4) les cultures axéniques ou le microbiote bactérienne d'habitude sont difficiles à maintenir au cours des expériences à long terme que la contamination se produit souvent au cours de sous-échantillonnage.
L'utilisation de plaques de microtitration permet volumes de culture 1 ml d'être utilisés pour chaque répétition, avec un maximum de 48 traitements distincts dansune plaque 12,65 cm x 8,5 x 2,2, diminuant ainsi le volume expérimental et permettant la replication extensive sans aucun traitement de sous-échantillonnage. En outre, cette technique peut être modifiée pour se adapter à une variété de formats, y compris expérimentales: bactérienne-algues co-cultures, tests d'algues de la physiologie et la toxine de dépistage 9-11. Puits individuels avec une algue, une bactérie et / ou co-cultures peuvent être prélevés pour de nombreuses procédures de laboratoire, y compris, mais sans s'y limiter: EAU-Pulse-modulé en amplitude (EAU-PAM) fluorométrie, la microscopie, formation de colonies bactériennes unité (ufc) comtes et cytométrie de flux. La combinaison du format de plaque de microtitration et EAU-PAM fluorométrie permet de multiples mesures rapides de rendement photochimique et d'autres paramètres photochimiques avec une faible variabilité entre les échantillons, une reproductibilité élevée et évite les nombreux pièges de sous-échantillonnage une bonbonne ou fiole conique au cours d'une expérience .
Introduction
Phytoplancton physiologie a traditionnellement été étudiée dans des expériences à méso-échelle allant de 20 ml dans des flacons coniques à 5 L dans des bonbonnes 1-7. Cette échelle expérimentale exige le sous-échantillonnage pour la surveillance expérimentale, comme sacrifier échantillons répétés pour chaque point de temps crée un dispositif expérimental ingérable.
La capacité d'augmenter le nombre d'expériences indépendantes tout en utilisant le même espace d'incubateur diurne par miniaturiser le volume expérimental pour des expériences de physiologie algues réduiront ou élimineront les limites de sous-échantillonnage et de pseudo-réplication à partir de grands volumes. Un format de plaque de microtitrage a été développé pour des essais biologiques d'algues en utilisant un volume de culture de 1 ml pour manipuler expérimentalement algues dans des conditions variables. Ce faible volume expérimental permet pour le nombre de répétitions d'augmenter, augmente la reproductibilité expérimental en raison d'une diminution de la variabilité entre les échantillons répétés etexpériences, et permet une véritable réplication tout en maintenant les contrôles expérimentaux (ie, les cultures d'algues axéniques) pour 140 jours (Figure 2) 12.
Ce format de plaque de microtitrage peut être facilement adapté pour une variété de questions expérimentales, telles que: une bactérie ne ont une interaction symbiotique, neutre ou pathogène avec son hôte algues? Est l'addition d'un composé stimulant ou toxiques pour une algue? Ces questions et d'autres peuvent être traitées de manière à haut débit rapide en utilisant ce nouveau format 9-11.
Une plaque de culture de microtitrage 48 puits permet à chaque 1 ml ainsi d'être un montage expérimental indépendant qui est échantillonné à un seul point dans le temps. Différents paramètres peuvent être échantillonnés à partir de ce volume de 1 ml, y compris, mais sans s'y limiter: fluorescence de la chlorophylle et les paramètres photochimiques utilisant-modulé en amplitude EAU-Pulse (EAU-PAM) fluorométrie (voir tableau Matériaux et équipement) 13. EAU-PAM fluorométrie est une technique rapide et non invasive qui peut être utilisé pour surveiller les expériences réalisées avec des algues 13. Il permet de mesurer l'efficacité photosynthétique et PSII santé à partir d'un petit volume de culture (150 à 300 ul de la culture dans un milieu dilué à une 2 - volume de 4 ml d'eau de water-PAM) 14,15. En plus de l'eau-PAM fluorométrie, cette configuration peut être utilisée pour mesurer une variété d'autres paramètres, y compris, mais sans s'y limiter: la microscopie à visualiser les bactéries fixées aux cellules des algues et des changements dans la morphologie des cellules d'algues; formation de colonies bactériennes unitaires (ufc) chefs d'accusation; et cytométrie de flux pour le nombre de cellules d'algues et des sous-populations d'identification.
Protocole
1. Les calculs pour l'installation expérimentale
- Calculer le volume d'algues et / ou de cultures bactériennes nécessaires pour les contrôles qui seront nécessaires pour l'ensemble de l'expérience en utilisant l'équation 1:
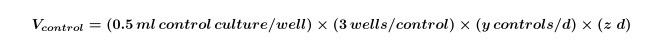
Lorsque y est égal au nombre de contrôles nécessaires par jour et z est égal au nombre de jours. - Calculer le volume de cultures d'algues et / ou de bactéries qui sont nécessaires pour les co-cultures de l'expérience en utilisant l'équation 2:
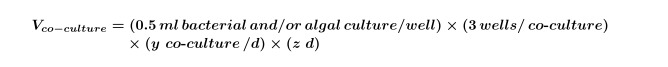
NOTE: Il est possible de remplacer les expériences 'de co-culture »avec ne importe quel écran composé; juste ajuster le composé final, solvant et concentrations d'algues pour se adapter à la conception expérimentale. - Utiliser des équations 1 et 2 pour calculer le volume final de la culture des algues exponentielle précoce (communément 5 jours pour ~ 10 4 cellules / ml, mais ce doit être déterminée par performing d'une courbe de la croissance des algues) requis pour l'expérience (ce volume est nécessaire pour l'étape 2.3) en utilisant l'équation 3:

- Utiliser des équations 1 et 2 pour calculer le volume final de 10 4 cfu / ml de culture bactérienne (ou la concentration souhaitée d'inoculation) requis pour l'expérience (ce volume est nécessaire pour l'étape 4.2), en utilisant l'équation 4:

REMARQUE: Utilisez les 10 ml supplémentaires dans les étapes 1.3 et 1.4 pour tenir compte de pipetage erreur et tous les tests qui sont effectués (par exemple, EAU-PAM, la cytométrie en flux, la microscopie, etc.) sur 0 d. Augmenter ce volume si nécessaire pour se adapter à la conception expérimentale.
NOTE: Pour un exemple de calcul d'une expérience de 8 jours voir Section 10. Voir le tableau supplémentaire pour les recettes des médias.
2. la culture de cellules d'algues pour l'installation expérimentale
- Isoler ou obtenir unede plus en plus activement la culture d'algues axénique.
- Aseptique transfert de 10% du volume final de la culture d'algues dans le milieu des algues stérile (par exemple, L1 ou support similaire d'algues marines, voir Matériaux et ustensiles de table), assurant une dilution 1: 9 de la culture des algues dans un milieu frais. Cultiver l'algue diluée dans un incubateur diurne en utilisant des conditions de croissance déterminées précédemment que la souche (par exemple, 18 ° C avec un 16: la lumière 8 h: cycle d'obscurité est couramment utilisé).
- Lorsque la culture a atteint précoce exponentielle phase ré-culture de l'algue dans le même milieu des algues stérile (par exemple, L1 ou support d'algues marines similaire), se assurer que la concentration finale est une dilution 1: 9 et que le volume final d'algues est égale à la V A calculée (étape 1.3).
NOTE: Il est important de se assurer que ces cultures sont axénique. Testez tous les médias d'algues et des bouteilles d'achat d'actions d'algues pour la contamination par placage une aliquote de 20 pi sur un support bactérienne marine général (par exemple, MarineBroth additionné de 2,216 à 1,5% de gélose ou similaire). - Cultiver la culture d'algues à la phase exponentielle précoce (~ 10 4 cellules / ml).
NOTE: Chaque souche d'algues a une courbe de croissance unique en fonction de conditions de culture. Au début de phase exponentielle (~ 10 4 cellules / ml) peut être déterminée en effectuant une courbe de la croissance des algues sur la base de la densité cellulaire (ce est à dire en utilisant la cytométrie en flux ou microscopie).
3. Préparation de cellules bactériennes pour l'inoculation
- Pré-déterminer la concentration bactérienne (UFC / ml) et de la densité optique (DO) de la bactérie à la phase stationnaire en faisant une courbe de croissance à moyen et les conditions de croissance bactériennes choisis (par exemple, Marine Broth 2216 à 25 ° C et 160 rpm, ou similaire). Utilisez ces informations pour cultiver les cellules (étape 3.3) et plus tard pour diluer les cellules correctement à l'étape 3.7.
- Transférer de façon aseptique une colonie bactérienne isolée et fraîchement passée d'une plaque de gélose de 1,5% (par exemple, Marine Broth 2216 soupleœuvre avec 1,5% de gélose ou milieu solide bactérienne marine similaire) dans 5 ml de milieu liquide bactérienne (par exemple, Marine Broth 2216 ou milieu bactérien similaire marine).
- Cultiver la bactérie jusqu'à la phase stationnaire sur un tambour roulant ou agitateur (~ 12 à 36 heures, en fonction de la bactérie). Prévoir l'expérience de sorte que la bactérie atteint la phase stationnaire (~ août 10-septembre 10 cfu / ml) en même temps que les cellules d'algues ont atteint la phase exponentielle précoce (~ 10 4 cellules / ml).
- En utilisant une pipette, arroser toute biofilm attaché au tube d'essai dans le milieu. Pipette 1 ml de culture bactérienne bien mélangé dans un stérile 1,5 ml microtubes. Centrifuger 1 min à 14 000 x g.
- Retirer et jeter le surnageant (médias bactérienne) sans perturber le culot (cellules bactériennes). Ajouter 1 ml de milieu stérile d'algues (par exemple, L1 ou similaire) au microtube (avec culot). Vortex microtube pour remettre en suspension le culot dans les médias d'algues.
- Deuxième lavage:répéter l'étape 3.5.
NOTE: Il est essentiel de se laver les cellules bactériennes avec les médias algues afin d'enlever complètement tous les médias bactériennes, de détritus de cellules, protéines excrétées et de petites molécules des cellules avant d'inoculer les algues avec eux car cela pourrait modifier la composition en éléments nutritifs de les médias d'algues ou d'introduire des molécules bioactives à l'écran. - Diluer en série des cellules bactériennes lavées dans un milieu des algues, à une concentration finale qui est 100 fois plus concentrée que la concentration bactérienne finale désirée (cfu / ml). Enregistrez le microtube contenant des cellules qui ont été lavés et dilué dans les médias d'algues pour l'étape 4.2.
REMARQUE: Planifier l'expérience basée sur ayant un rapport 1: 1 d'algues à des bactéries sur 0 d. Pour ce faire, la concentration bactérienne initiale souhaitée pour l'expérience est de 10 4 cfu / ml, de sorte que dans l'étape 3.7 les cellules initiales doivent être dilués en série de 10 6 cfu / ml.
4. Préparer les bactéries Expérienceal Setup
- Préparer 4 flacons coniques de verre autoclave stériles et de les étiqueter: a) «contrôle flacon d'algues», b) «bactérienne stocks flacon diluée», c) «ballon de contrôle bactérien», et d) «flacon co-culture».
- Diluer la suspension bactérienne à partir 3,7 1:99 étape avec des milieux stériles d'algues à un volume final = V B (étape 1.4). Faire la dilution dans le stock bactérienne diluée flacon étiqueté (étape 4.1).
Remarque: Dans l'exemple précédent (étape 4.2), cette dilution 1:99 donne une concentration finale de 10 4 cfu / ml. Flacon Agiter pour mélanger des cellules. - Pipette contrôle de V (étape 1.1) du stock bactérienne diluée et le mettre dans le ballon de contrôle bactérien.
- Pipette de contrôle V du support d'algues stérile dans la fiole de contrôle des bactéries (ce est une dilution 1: 1). Flacon Agiter pour mélanger des cellules et mis de côté pour l'étape 7.3.
- Pipette V co-culture de la souche bactérienne diluéeballon à l'flacon co-culture, réglez flacon de côté pour l'étape 6.1.
REMARQUE: Lorsque vous effectuez plusieurs co-cultures sur le même algue à la fois (ce est à dire, une co-culture de deux bactérienne différents isolats avec une commande), il est nécessaire de recalculer le V co-culture pour chaque souche individuellement, puis répétez l'étape 4,5 pour chaque co-culture séparément. Il est également nécessaire d'augmenter la V calculée à l'étape A de 1,3 à inclure à la fois co-cultures représenté dans l'équation 5: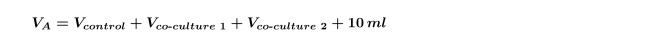
5. Préparer algues pour l'installation expérimentale
- Mélanger délicatement la culture d'algues précoce exponentielle (de l'étape 2.4) avec une pointe de pipette à large ouverture jusqu'à ce que les cellules apparaissent bien mélangé.
- Pipette contrôle de V à partir de la bouteille de algues dans le ballon de contrôle des algues. Pipette doucement en utilisant une pipette de 10 ml. Ensuite, retournez la bouteille de algues dans l'incubateur diurne.
- Pipette V suiterol de milieu stérile algues dans le ballon de contrôle des algues (ce est une dilution 1: 1). Agiter pour mélanger flacon et le placer dans l'incubateur diurne, jusqu'à ce que nécessaire pour l'étape 7.4.
6. Préparation expérimentale Co-culture
- Pipette doucement V co-culture du stock d'algues dans le flacon bactérienne flacon co-culture de l'étape 4.5. Retour flacon co-culture à l'incubateur diurne jusqu'à ce que nécessaire pour l'étape 7.5.
REMARQUE: La concentration des bactéries dans le contrôle de bactéries doit être égale à la concentration bactérienne dans la co-culture expérimentale. De même, la concentration d'algues dans le contrôle des algues doit être égale à la concentration d'algues dans la co-culture expérimentale. En ayant les mêmes concentrations bactériennes initiales et d'algues, la densité de la population peut être comparé tout au long de l'expérience.
7. Mise en place plaques de microtitration
- Diviser une plaque de microtitration 48 puits stérile selon la figure 1.Étiquette au-dessus des puits contenant des échantillons extérieures soit de diluant stérile ou non photosynthétiques.
REMARQUE: La randomisation des puits de la plaque peut être faite pour les échantillons prélevés sur le même jour. Par exemple, le quadrant 1 sera échantillonné à 1 d dans l'expérience; les puits qui devraient être randomisés sont B2 - 4 et C2 - 4. Laisser le périmètre de la plaque remplie de solution stérile comme le montre la figure 1.
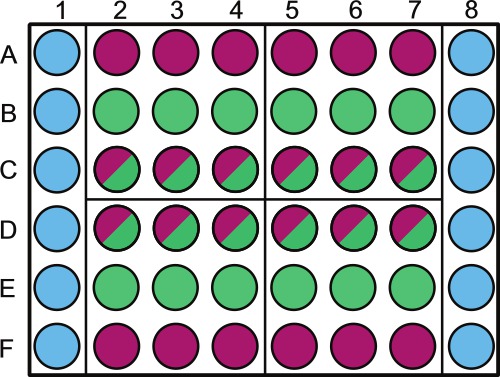
. Figure 1. Représentation schématique du placement de l'échantillon dans une plaque de microtitrage de 48 puits sont ainsi à pourvoir comme suit: colonnes 1 et 6, puits A à F (  ) Sont remplis avec 1 ml 1x PBS (ou une autre solution / media stérile). Lignes A et F, puits 2-8 (
) Sont remplis avec 1 ml 1x PBS (ou une autre solution / media stérile). Lignes A et F, puits 2-8 (  ) Sont remplis avec 1 ml de commande bactérienne; rows B et E puits 2-8 (
) Sont remplis avec 1 ml de commande bactérienne; rows B et E puits 2-8 (  ) Sont remplis avec 1 ml de commande d'algues; les lignes C et D, les puits 2-8 (
) Sont remplis avec 1 ml de commande d'algues; les lignes C et D, les puits 2-8 (  ) Sont remplis avec 1 ml de co-culture. La plaque est divisée en quatre quadrants (A2, A5, D2 et D5) ces quadrants sont chaque jour d'échantillonnage spécifiques 1-4, cela devrait être randomisés dans l'ensemble des plaques et étiquetés en conséquence. Au sein de chaque jour, nous vous conseillons de randomisation le contrôle des algues (
) Sont remplis avec 1 ml de co-culture. La plaque est divisée en quatre quadrants (A2, A5, D2 et D5) ces quadrants sont chaque jour d'échantillonnage spécifiques 1-4, cela devrait être randomisés dans l'ensemble des plaques et étiquetés en conséquence. Au sein de chaque jour, nous vous conseillons de randomisation le contrôle des algues (  ) Et de co-culture (
) Et de co-culture (  puits) en utilisant un générateur de nombres aléatoires. Etiqueter le couvercle sur la PBS 1x et / ou puits de contrôle bactériennes pour prévenir l'ombrage des cultures d'algues.
puits) en utilisant un générateur de nombres aléatoires. Etiqueter le couvercle sur la PBS 1x et / ou puits de contrôle bactériennes pour prévenir l'ombrage des cultures d'algues.
- Pipette 1 ml de solution de tampon phosphate 1x (PBS, pH 7,4) ou une autre solution stérile dans les puits appropriés comme indiqué dans la figure 1. Effectuez cette lentement et avec précaution. PBS change la force ionique du milieu des algues et / ou de co-culture se il éclabousse dans d'autres puits de sorte manipuler avec soin.
- Pipette 1 ml de la culture de contrôle des bactéries dans les puits étiqueté contrôle bactérien (Figure 1). Agiter le flacon bactérienne avant pipetage chaque plaque pour éviter décantation bactérienne.
- Pipette 1 ml de la culture de contrôle des algues dans des puits marqués le contrôle des algues en utilisant une pointe de pipette bouche large (Figure 1). Agiter le flacon d'algues aussi régulièrement que le ballon bactérienne. Si l'algue a tendance à couler ou flotter, tourbillonner aussi régulièrement que nécessaire pour maintenir une culture visuelle uniforme.
- En utilisant une pointe de pipette bouche large, une pipette 1 ml de co-culture dans les puits appropriés (Figure 1). En agitant le flacon co-culture aussi régulièrement que le ballon d'algues.
- Sceller chaque plaque avec du parafilm et placer dans un incubateur diurne à la température désirée et le cycle de la lumière diurne (18 ° C avec un 16: la lumière 8 h: cycle d'obscurité est couramment utilisé). Laisserles plaques dans l'incubateur diurne avant d'être prêt à prendre PAM lectures (Section 8). Assurer que toutes les plaques sont orientées dans la même direction pour permettre l'exposition de lumière cohérente.
- Prélever une partie aliquote de 20 pi de la PBS, les médias d'algues, des algues stock et le contrôle des algues et déposer la plaque sur un milieu non sélectif approprié (par exemple, Marine Broth 2216 complété avec 1,5% de gélose) et incuber les plaques à 18 - 25 ° C pendant 72 h pour tester la contamination. Si la croissance apparaît dans aucune des solutions qui ne doivent pas contenir des bactéries, ces données ne doivent pas être utilisés.
- Prenez les lectures PAM de l'aide de l'échantillon restant des flacons de contrôle et de co-culture des algues pour la expérimentale 0 d PAM fluorométrie lecture (voir l'étape 8.1). Toute autre 0 d mesures doivent également être effectuées avec le contrôle des algues restant, contrôle des bactéries et des échantillons de co-culture.
8. Prendre des lectures PAM FLUOROMETRIE à partir d'échantillons libres
- Zéro le EAU-PAMavec les médias algues stériles dans une cuvette propre avant de prendre des lectures 8.
- Introduire à la pipette 300 ul de flacons témoins ou co-culture d'algues dans une cuvette propre contenant 2,7 ml du même milieu d'algues utilisé dans l'expérience. Mélanger l'échantillon et le diluant délicatement avec une pointe de pipette bouche large.
- Essuyez-toutes les empreintes digitales de l'extérieur de la cuvette avec un mouchoir avant de placer la cuvette dans l'eau-PAM.
- Placez la cuvette dans l'eau-PAM. Couvrir l'échantillon avec le bouchon et lui permettre de se adapter foncé pendant 3 min. Temps d'adaptation à l'obscurité varient selon les espèces d'algues et doivent être déterminées pour l'algue spécifique utilisé dans l'expérience. Évitez les longues périodes sombres d'adaptation (> 20 min) en prenant des lectures EAU-PAM au milieu du cycle sombre des incubateurs diurnes algues 16,17.
- Après adaptation à l'obscurité, frapper F 0 bouton. Si les lectures de fluorescence sont au-dessus 3900, diluer l'échantillon 1: 1 dans un milieu d'algues. Dark-adapter pour un 3 min et tak supplémentairesea nouvelle lecture. Si les F 0 ou F m lectures sont encore au-dessus 3900, continuer à diluer l'échantillon 1: 1 dans un milieu d'algues jusqu'à ce que les F 0 et F m lectures sont inférieures à 3900.
REMARQUE: Assurez-vous de tenir compte de ces dilutions lors de l'enregistrement de fluorescence final: par exemple, si l'échantillon d'algues est dilué 1: 9 lors du transfert initial du puits au tube de dilution, alors la lecture de fluorescence d'algues de 500 devrait être multiplié par l'inverse du facteur de dilution (dans ce cas 10) et la fluorescence effective du tube est alors 5000. - Après avoir réglé F 0, prendre le pouls de saturer (SAT-Pulse) lire chaque 90 secondes en appuyant sur la touche SAT de prendre F m lectures. L'intervalle de temps entre les lectures peut être ajustée en fonction de la souche d'algues. Jeter l'échantillon.
- Répétez les étapes 8.1 à 8.6 pour les échantillons restants.
9. Prendre des lectures PAM FLUOROMETRIE de plaques de microtitration
- Étiquette6 tubes d'échantillons stériles de> 3 ml de volume pour les puits B2 - 4 pour le contrôle et puits algues C2 - 4 pour la co-culture bactérienne (voir la plaque mise à la figure 1).
- Aliquote 2,7 ml de milieu d'algues stérile dans chaque tube.
- Placez les tubes dans l'incubateur diurne et leur permettre de se acclimater à la température de l'algue a été cultivée à 30 min.
- Avant de retirer la microplaque de l'incubateur garantir que la pénétration de la lumière dans l'obscurité acclimatés puits est limitée en recouvrant la plaque avec une feuille d'aluminium (ou similaire), seulement retirer le film tout en transférant activement la culture des puits pour les tubes de dilution (étapes 9,5 - 9,7).
- Aseptique mélanger la première plaque de microtitrage (et B2) avec une pointe de pipette bouche large par pipetage lentement de haut en bas.
- Obtenir les tubes de dilution de la cession de l'incubateur et de façon aseptique 300 pl du puits B2 (figure 1) à son tube d'échantillon correspondant avec une pointe large de la pipette de la bouche (ce est un mélange 1: 9 de dilution de l'échantillon dans le milieu des algues).
- Répétez les étapes 9.5 à 9.6 pour les puits restants (B3,4 et C2 - 4).
- Couvrir tubes d'échantillons de papier d'aluminium et les retourner à l'incubateur diurne jusqu'au moment de l'EAU-PAM.
- Effectuer lectures EAU-PAM comme décrit dans les étapes 8.1 à 8.7. Sceller la microplaque avec du parafilm avant de le retourner à l'incubateur.
- Répétez lectures à intervalles de temps prévues pour la durée de l'expérience. La fréquence et la durée de l'échantillonnage doit être préparé au début de l'expérience.
Expérience 10. Exemple
L'expérience de l'échantillon est une co-culture d'une bactérie (Phaeobacter gallaeciensis de BS107) et une micro-algue (souche Emiliania huxleyi (de CCMP3266)) 10 jours. Il comprend un contrôle des algues, contrôle bactérien, et un bactérienne-algues co-culture expérimentale.
- Calculer les volumes de souches bactériennes et d'algues nécessaires (étapes 1.1 à 1,4)

- Préparer le bouillon d'algues, un V A de 40 ml, en inoculant 4 ml d'algue dans 36 ml de milieu et on incube jusqu'à ce que la croissance exponentielle précoce est réalisé avec une densité de cellules de 10 ~ 4 cellules / ml (étapes 2/1 à 2/4).
- Préparer le stock flacon bactérienne en diluant 400 pi des 10 6 UFC / ml de bactéries obtenus dans la section 3 à un V B de 40 ml avec les médias algues (concentration finale de bactéries sera 10 4 ufc / ml).
- Transférer la moitié (20 ml) du stock bactérienne dans le ballon de contrôle bactérienne et ajouter 20 ml de milieu d'algues pour rendre le contrôle bactérienne. Transférer la moitié (20 ml) du parc des algues dans le ballon de contrôle des algues et ajouter 20 ml de milieu d'algues pour compenser le contrôle des algues (section 5). Transférez les 20 ml restants d'actions bactérienne dans le ballon de co-culture et mélanger avec les 20 ml restants d'actions algues pour établir la co-culture (Section6).
- Pipeter l'1x PBS (pH 7,4), les contrôles, et co-culture dans deux plaques pré-étiquetés microtitrage (figure 1), 1 ml par puits. Utilisez 3 ml des témoins restants et co-cultures de faire 0 d mesures (chiffres ufc, EAU-PAM (Section 8), observation microscopique de la morphologie des cellules des algues, et de fixation de cellules d'algues pour la cytométrie de flux).
- Prenez les lectures EAU-PAM pour le contrôle des algues et de co-culture une fois par jour pendant 10 jours, et toujours dans le même temps que les 0 d mesures ont été prises (article 8).
11. Autres paramètres d'intérêt
- Déterminer la concentration bactérienne ufc: effectuer une dilution en série du contrôle bactérien et co-culture dans 1x PBS stérile (ou similaire), puis déposez plaque sur Marine Broth 2216 complété avec 1,5% d'agar (ou similaire) et observer le nombre de ufc qui poussent pour déterminer les bactéries ufc / ml pour chaque puits 18.
- Pour évaluer la concentration de cellules d'algues: fixer le contrôle des algues et de coopérationculture avec une concentration finale de 0,15% de glutaraldéhyde. Incuber pendant 10 min dans l'obscurité, puis gel rapide dans l'azote liquide, et les conserver à -80 ° C. Traiter tous les échantillons sur un cytomètre de flux (FACS Calibur ou similaire) pour compter les cellules d'algues.
- Observez algues morphologie cellulaire: cultures d'algues et de co-culture bactérienne-algues utilisant la microscopie (c.-à-microscopie optique, épifluorescence, ou similaire).
Résultats
EAU-PAM lectures de fluoro.
EAU-Pulse-modulé en amplitude (PAM) fluorométrie est une méthode rapide et efficace pour déterminer la fluorescence (un indicateur de la teneur en chlorophylle) et le rendement photosynthétique (PSII de santé) des cultures d'algues. Le logiciel PAM WinControl génère une feuille de calcul des valeurs de données brutes pour (voici les paramètres de base pour sombres adaptée échantillons d'algues):
F = 0 fluore...
Discussion
La croissance des algues dans un format miniaturisé.
La miniaturisation des cultures d'algues à un volume de culture de 1 ml dans une plaque de microtitration permet la réplication au sein d'une expérience à être augmentée. Il est important de veiller à l'algue est en bonne santé tout au long d'une expérience; effectuer une courbe de croissance (Figure 2), en utilisant le format de microplaques pour évaluer divers médias algues, afin d'assurer le...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was supported by Natural Sciences and Engineering Research Council of Canada (grant 402105), Canadian Foundation for Innovation (grant 129087) and Alberta Education and Training (grant AAETRCP-12-026-SEG) to RJC.
matériels
| Name | Company | Catalog Number | Comments |
| 10 cu. ft. Diurnal incubator (6012-1) | Caron Corporate | 112310-6012-1-11 | www.caronproducts.com |
| Nunc EasYFlask 25 cm2, Vent/Close Cap, 7 ml working volume, 200/cs | Thermo Fisher Scientific | N156340 | www.fishersci.ca |
| Multiwell TC Plates – 48-well | BD Biosciences Discovery Labware | 353078 | www.bdbiosciences.com |
| P1000 Gilson The Pipetting Standard—Gilson's Pipetman | Mandel Scientific Company Inc. | GF-F123602 | www.mandel.ca |
| P10mL Gilson The Pipetting Standard—Gilson's Pipetman | Mandel Scientific Company Inc. | GF-F161201 | www.mandel.ca |
| Wide Orifice Tips nonsterile [100–1,250 µl] | VWR International | 89079-468 | www.ca.vwr.com |
| Ultrafine Tips nonsterile [100–1,250 µl] | VWR International | 89079-470 | www.ca.vwr.com |
| Finntip 10 ml [Vol: 1 - 10 ml] | Thermo Fisher Scientific | 9402151 | www.fishersci.ca |
| WATER-Pulse Amplitude Modulation (Water-ED) | Heinz Walz GmbH, Effeltrich, Germany | EDEE0232 | www.walz.com |
| 15 mm diameter quartz glass cuvette (WATER-K) | Caron Corporate | www.caronproducts.com | |
| Sodium chloride (crystalline/certified ACS), Fisher Chemical | Thermo Fisher Scientific | Thermo Fisher Scientific | www.fishersci.ca |
| BD Difco Marine Broth 2216 | BD Biosciences Discovery Labware | BD Biosciences Discovery Labware | www.bdbiosciences.com |
| BD Bacto Agar | BD Biosciences Discovery Labware | BD Biosciences Discovery Labware | www.bdbiosciences.com |
| L1 Medium Kit, 50 L | NCMA [National Center for Marine Algae and Microbiota | NCMA [National Center for Marine Algae and Microbiota | www.ncma.bigelow.org |
Références
- Scarratt, M. G., Marchetti, A. Assessing microbial responses to iron enrichment in the Subarctic Northeast Pacific: Do microcosms reproduce the in situ condition?. Deep Sea Res Part II Top. Stud. Oceanogr. 53 (20-22), 2182-2200 (2006).
- Bidle, K. D., Haramaty, L., Barcelos E Ramos, J., Falkowski, P. Viral activation and recruitment of metacaspases in the unicellular coccolithophore, Emiliania huxleyi. Proc. Natl. Acad. Sci. U. S. A. 104 (14), 6049-6054 (2007).
- Moore, L. R., Goericke, R., Chisholm, S. W. Comparative physiology of Synechococcus and Prochlorococcus: influence of light and temperature on growth, pigments, fluorescence and absorptive. Mar. Ecol. Prog. Ser. 116, (1995).
- Iglesias-Rodriguez, M. D., Halloran, P. R. Phytoplankton calcification in a high-CO2 world. Science. 320 (5874), 336-340 (2008).
- Chen, M., Tang, H., Ma, H., Holland, T. C., Ng, K. Y. S., Salley, S. O. Effect of nutrients on growth and lipid accumulation in the green algae Dunaliella tertiolecta. Bioresour. Technol. 102 (2), 1649-1655 (2011).
- Lv, J. -. M., Cheng, L. -. H., Xu, X. -. H., Zhang, L., Chen, H. -. L. Enhanced lipid production of Chlorella vulgaris by adjustment of cultivation conditions. Bioresour. Technol. 101 (17), 6797-6804 (2010).
- Geider, R., Graziano, L., McKay, R. M. Responses of the photosynthetic apparatus of Dunaliella tertiolecta (Chlorophyceae) to nitrogen and phosphorus limitation. Eur. J. Phycol. 33 (4), 315-332 (1998).
- MacIntyre, H. L., Cullen, J. J. Using Cultures to Investigate the Physiological Ecology of Microalgae. Algal Cult. Tech. , 287-326 (2005).
- Blaise, C., Vasseur, P. Algal microplate toxicity test. Small-scale Freshw. Toxic. Investig. Vol. 1 Toxic. Test Methods. , 137-179 (2005).
- Skjelbred, B., Edvardsen, B., Andersen, T. A high-throughput method for measuring growth and loss rates in microalgal cultures. J. Appl. Phycol. 24, 1589-1599 (2012).
- Nagai, T., Taya, K., Annoh, H., Ishihara, S. Application of a fluorometric microplate algal toxicity assay for riverine periphytic algal species. Ecotoxicol. Environ. Saf. 94, 37-44 (2013).
- Seyedsayamdost, M. R., Case, R. J., Kolter, R., Clardy, J. The Jekyll-and-Hyde chemistry of Phaeobacter gallaeciensis. Nat. Chem. 3 (4), 331-335 (2011).
- Schreiber, U., Schliwa, U., Bilger, W. Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer. Photosynth. Res. 10 (1-2), 51-62 (1986).
- Jones, R. J., Ward, S., Amri, A. Y., Hoegh-Guldber, O. Changes in quantum efficiency of photosystem II of symbiotic dinoflagellates of corals after heat stress, and of bleached corals sampled after the 1998 Great Barrier Reef mass bleaching event. Mar. Freshw. Res. 51 (345), 659-668 (1998).
- Beer, S., Larsson, C., Poryan, O., Axelsson, L. Photosynthetic rates of Ulva (Chlorophyta) measured by pulse amplitude modulated fluorometry. Eur. J. Phycol. 35 (1), 69-74 (2000).
- . . WATER-PAM Chlorophyll Fluorometer. Instrument Description and Information for Users. , (2013).
- Maxwell, K., Johnson, G. M., Heers, J. Chlorophyll fluorescence--a practical guide. J. Exp. Bot. 51 (345), 659-668 (2000).
- Herigstad, B., Hamilton, M., Heersink, J. How to optimize the drop plate method for enumerating bacteria. J. Microbiol. Methods. 44 (2), 121-129 (2001).
- Kooten, O., Snel, J. The use of chlorophyll fluorescence nomenclature in plant stress physiology. Photosynth. Res. 25 (3), 147-150 (1990).
- Maxwell, K., Johnson, G. N. Chlorophyll fluorescence--a practical guide. J. Exp. Bot. 51 (345), 659-668 (2000).
- Schreiber, U. Pulse-Amplitude-Modulation (PAM) Fluorometry and Saturation Pulse Method: An Overview. Chlorophyll a Fluoresc. A Signat. Photosynth. , 279-319 (2004).
- Roháček, K., Barták, M. Technique of the modulated chlorophyll fluorescence: basic concepts, useful parameters, and some applications. Photosynthetica. 37 (3), 339-363 (1999).
- Da Silva, J. M., da Silva, A. B., Pádua, M. Modulated chlorophyll a fluorescence: a tool for teaching photosynthesis. J. Biol. Educ. 41 (4), 178-183 (2007).
- Vieira, S., Ribeiro, L., Jesus, B., Cartaxana, P., da Silva, J. M. Photosynthesis assessment in microphytobenthos using conventional and imaging pulse amplitude modulation fluorometry. Photochem. Photobiol. 89 (1), 97-102 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon