È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un piccolo volume Bioassay per valutare batterica / fitoplancton Co-cultura Utilizzando WATER-Pulse-modulata in ampiezza (WATER-PAM) fluorometria
In questo articolo
Riepilogo
The goal of this procedure is to demonstrate the reproducibility and adaptability of using a microtiter plate format for microalgal screening. This rapid screen combines WATER-Pulse-Amplitude-Modulated (WATER-PAM) fluorometry to measure photosynthetic yield as an indicator of Photosystem II (PSII) health with small volume bacterial-algal co-cultures.
Abstract
I metodi convenzionali per la manipolazione sperimentale di microalghe hanno impiegato grandi volumi di coltura (20 ml a 5 L), in modo che la cultura può essere sotto-campione durante l'esperimento 1-7. Subsampling di grandi volumi può essere problematico per diverse ragioni: 1) provoca variazione del volume totale e la superficie: rapporto in volume della coltura durante l'esperimento; 2) pseudo-replica (cioè, più campioni dello stesso pallone trattamento 8) è spesso impiegato piuttosto che vere e proprie repliche (cioè, il campionamento da trattamenti ripetute); 3) la durata dell'esperimento è limitata dal volume totale; e 4) colture axeniche o il solito microbiota batterica sono difficili da mantenere durante gli esperimenti a lungo termine, come la contaminazione si verifica comunemente durante sottocampionamento.
L'uso di micropiastre consente 1 volumi di coltura ml da utilizzare per ogni replica, con un massimo di 48 trattamenti separati all'internouna piastra di 12,65 cm x 8,5 x 2,2, diminuendo in tal modo il volume sperimentale e consentendo vasta replica senza sottocampionamento alcun trattamento. Inoltre, questa tecnica può essere modificato per adattarsi a una varietà di formati sperimentali tra cui: batterico-alghe co-culture, test algale fisiologia, e la tossina di screening 9-11. Pozzi individuali con un'alga, batterio e / o co-colture possono essere prelevati per numerose procedure di laboratorio, tra cui, ma non solo: WATER-Pulse-modulata in ampiezza (WATER-PAM) fluorometria, microscopia, colonia batterica formando unità (CFU) conti e citometria a flusso. La combinazione del formato micropiastra e WATER-PAM fluorometria consente misurazioni multiple rapide di rendimento fotochimico e di altri parametri fotochimici con bassa variabilità tra i campioni, alta riproducibilità ed evita le tante insidie di sottocampionamento una damigiana o beuta nel corso di un esperimento .
Introduzione
Il fitoplancton fisiologia è stato tradizionalmente studiato in esperimenti meso-scala che va da 20 ml in beute a 5 L in damigiane 1-7. Questa scala sperimentale richiede subsampling per il monitoraggio sperimentale, come sacrificare campioni replicati per ogni punto di tempo crea un apparato sperimentale ingestibile.
La possibilità di aumentare il numero di esperimenti indipendenti mentre si utilizza lo stesso spazio incubatore diurna dalla miniaturizzazione del volume sperimentale per esperimenti di fisiologia alghe sarà ridurre o eliminare le limitazioni di subsampling e pseudo-replica da grandi volumi. Un formato micropiastra è stata sviluppata per biosaggi algali utilizzando un volume di coltura 1 ml per manipolare sperimentalmente alghe in condizioni variabili. Questo piccolo volume sperimentale consente il numero di repliche per aumentare, aumenta la riproducibilità sperimentale a causa di una variabilità diminuita tra i campioni replicati eesperimenti, e consente la vera replica mantenendo controlli sperimentali (ad esempio, colture algali axeniche) per 140 giorni (Figura 2) 12.
Questo formato micropiastra è facilmente adattato per una varietà di questioni sperimentali, come ad esempio: un batterio non ha un'interazione simbiotico, neutro o patogeni con il suo ospite algale? È l'aggiunta di un composto o stimolante tossico per un'alga? Queste e altre domande possono essere affrontate in maniera rapida high-throughput con questo nuovo formato 9-11.
Una piastra di coltura microtitolo 48 pozzetti permette ogni 1 ml e di essere un apparato sperimentale indipendente che viene campionato ad una sola volta-point. I vari parametri si possono degustare da questo volume 1 ml compreso, ma non solo: fluorescenza della clorofilla e parametri fotochimici utilizzando-modulata in ampiezza WATER-Pulse (WATER-PAM) fluorometria (vedi Materiali e tavolo Equipment) 13. ACQUA-PAM fluorometria è una tecnica rapida e non invasiva che può essere utilizzato per monitorare esperimenti effettuati con alghe 13. Esso consente di misurare l'efficienza fotosintetica e la salute PSII da un piccolo volume di cultura (150-300 ml di cultura diluito in mezzo a un 2 - volume di 4 ml per WATER-PAM) 14,15. Oltre all'acqua-PAM fluorimetria, questa configurazione può essere usata per misurare una varietà di altri parametri tra cui, ma non limitato a: microscopio per visualizzare i batteri attaccati alle cellule algali e cambiamenti nella morfologia cellulare algale; colonia batterica formando unità (CFU) conta; e citometria a flusso per la conta delle cellule algali e sottopopolazioni di identificazione.
Protocollo
1. I calcoli per la configurazione sperimentale
- Calcolare il volume di alghe e / o colture batteriche necessarie per i controlli che saranno necessari per l'intero esperimento utilizzando Equazione 1:
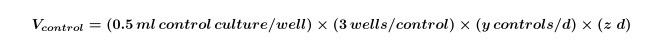
Dove Y è uguale al numero di controlli necessari al giorno e z è uguale al numero di giorni. - Calcolare il volume di colture di alghe e / o batterici che sono necessarie per co-colture per l'esperimento utilizzando Equazione 2:
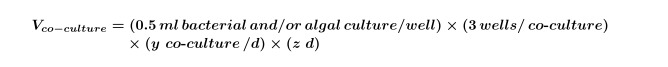
NOTA: E 'possibile sostituire gli esperimenti' co-coltura 'con qualsiasi schermo composto; basta regolare il composto finale, le concentrazioni algali solvente e per adattarsi al design sperimentale. - Utilizzare Equazioni 1 e 2 per calcolare il volume finale di coltura di alghe precoce esponenziale (comunemente 5 giorni per ~ 10 4 cellule / ml, ma questo dovrebbe essere determinato dal performing una curva di crescita delle alghe) necessari per l'esperimento (è necessario questo volume per il punto 2.3) usando Equazione 3:

- Utilizzare Equazioni 1 e 2 per calcolare il volume finale di 10 4 cfu / ml coltura batterica (o la concentrazione desiderata inoculazione) richiesto per l'esperimento (è necessario il suddetto volume per fase 4.2) usando Equazione 4:

NOTA: Utilizzare le ulteriori 10 ml a passi 1.3 e 1.4 per spiegare pipettaggio errore ed eventuali prove che vengono eseguite (ad esempio, WATER-PAM, citometria a flusso, microscopia, etc.) su 0 d. Aumentare il volume, se necessario, per adattarsi al design sperimentale.
NOTA: Per un esempio di calcolo di un esperimento di 8 giorni vedere la Sezione 10. Vedere la tabella supplementare per le ricette dei media.
2. crescenti cellule algali per Setup sperimentale
- Isolare o ottenere unattivamente crescente coltura di alghe axeniche.
- Trasferire asetticamente 10% del volume finale della coltura algale in terreno di coltura algale sterile (ad esempio, L1 o simile mezzo di alghe marine, vedi Materiali e tavolo Equipment), assicurando una diluizione 1: 9 di coltura algale in terreno fresco. Grow l'alga diluito in un incubatore diurna con condizioni di crescita stabilite precedentemente per questa deformazione (ad esempio, 18 ° C, con un 16: 8 ore di luce: buio ciclo è comunemente usato).
- Quando la coltura ha raggiunto precoce esponenziale di fase, ri-coltura dell'alga nello stesso mezzo algale sterile (ad esempio, L1 o simile mezzo alghe marine), assicurano la concentrazione finale è una diluizione 1: 9 e che il volume finale di alghe è pari al V A calcolata (passo 1.3).
NOTA: E 'importante garantire queste culture sono axeniche. Testare tutti i media algali e boccette alghe per la contaminazione da placcatura un'aliquota da 20 microlitri su un mezzo batterica marina generale (ad esempio, MarineBrodo 2216 integrato con 1,5% agar o simili). - Crescere coltura algale di fase precoce esponenziale (~ 10 4 cellule / ml).
NOTA: Ogni ceppo algale ha una curva di crescita unica funzione delle condizioni di coltura. Fase Early-esponenziale (~ 10 4 cellule / ml) può essere determinato eseguendo una curva di crescita delle alghe in base alla densità delle cellule (ad esempio con citometria a flusso o la microscopia).
3. Preparare cellule batteriche per inoculazione
- Pre-determinare la concentrazione batterica (cfu / ml) e la densità ottica (OD) del batterio in fase stazionaria facendo una curva di crescita in condizioni medie e crescita batterica scelti (ad esempio, 2216 Marine Broth a 25 ° C e 160 rpm, o simili). Utilizzare queste informazioni per far crescere le cellule (passo 3,3) e più tardi per diluire le cellule correttamente al punto 3.7.
- Trasferire asetticamente una colonia batterica isolata e appena cresciuta da una piastra di agar 1,5% (ad esempio, Marine Broth 2216 elasticamented 1,5% agar o simile mezzo solido batterica marina) in 5 ml di terreno liquido batterica (ad esempio, Marine Broth 2216 o liquido batterica marina simili).
- Grow il batterio di fase stazionaria su un tamburo o shaker laminazione (~ 12-36 ore, a seconda del batterio). Piano l'esperimento in modo che il batterio raggiunge fase stazionaria (~ 8 Ottobre-9 ottobre cfu / ml) nello stesso momento in cui le cellule algali hanno raggiunto la fase precoce esponenziale (~ 10 4 cellule / ml).
- Utilizzando una pipetta, lavare qualsiasi biofilm attaccato alla provetta nel mezzo. Pipettare 1 ml di coltura batterica ben miscelato in una sterile 1,5 ml provetta. Centrifugare per 1 min a 14000 x g.
- Rimuovere e smaltire il surnatante (supporto batterica) senza interrompere il pellet (cellule batteriche). Aggiungere 1 ml di media sterile algale (ad esempio, L1 o simile) nella microprovetta (con pellet). Vortex provetta per risospendere pellet nei media algali.
- Secondo lavaggio:ripetere il punto 3.5.
NOTA: È fondamentale per lavare le cellule batteriche con mezzi algali per rimuovere completamente tutti i mezzi batteriche, detriti cellulari, proteine e piccole molecole secrete dalle cellule prima inoculando le alghe con loro come potrebbe cambiare la composizione nutrizionale di i media algali o introdurre molecole bioattive allo schermo. - Serialmente diluire le cellule batteriche lavati in mezzi algali, ad una concentrazione finale che è 100 volte più concentrato rispetto alla concentrazione batterica finale desiderata (cfu / ml). Salvare la provetta contenente le cellule che sono stati lavati e diluito nei media algali per passo 4.2.
NOTA: Pianificare l'esperimento sulla base di avere un rapporto 1: 1 di alghe di batteri 0 d. Per effettuare questa concentrazione batterica iniziale desiderata per l'esperimento è 10 4 cfu / ml, quindi al passo 3.7 celle iniziali devono essere diluiti serialmente per 10 6 cfu / ml.
4. batteri Preparazione per Experimental Setup
- Preparare 4 beute vetro autoclave sterili ed etichettarli: a) 'fiasco algale di controllo', b) 'diluito batterica magazzino pallone', c) 'pallone di controllo batterico', e d) 'pallone di co-cultura'.
- Diluire la sospensione batterica passo 3.7 1:99 con mezzi algali sterili ad un volume finale = V B (passo 1.4). Effettuare la diluizione nel magazzino batterica diluito pallone etichettati (passo 4.1).
NOTA: Nell'esempio precedente (fase 4.2), questa 1:99 diluizione dà una concentrazione finale di 10 4 cfu / ml. Swirl pallone per mescolare le cellule. - Pipetta di controllo V (passo 1,1) dal magazzino batterica diluito e metterlo nel pallone di controllo batterico.
- Controllo V Pipettare di media algale sterile nel pallone di controllo batterica (questa è una diluizione 1: 1). Swirl pallone per mescolare le cellule e mettere da parte per la fase 7.3.
- Pipetta V co-coltura dal magazzino batterica diluitopallone al pallone co-coltura, impostare pallone da parte per passo 6.1.
NOTA: Nel fare più co-colture sullo stesso alghe alla volta (cioè, una co-coltura batterica di due diversi isolati con un controllo) è necessario ricalcolare il V co-coltura per ogni ceppo singolarmente e quindi ripetere passaggio 4.5 per ciascun co-coltura separatamente. È inoltre necessario aumentare la V A calcolata nel passo 1.3 per includere sia co-colture mostrati in Equazione 5: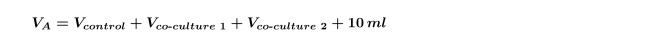
5. Preparazione Alghe per l'installazione sperimentale
- Mescolare delicatamente la coltura algale precoce esponenziale (dal punto 2.4) con un puntale a bocca larga fino cellule sembrano ben miscelati.
- Controllo V pipetta dalla algale magazzino bottiglia al pallone di controllo delle alghe. Pipetta delicatamente con una pipetta 10 ml. Quindi tornare il algale Stock Bottle nell'incubatrice diurna.
- Pipetta V control sterile medio algale al pallone di controllo algale (questa è una diluizione 1: 1). Agitare per mescolare pallone e posto in incubatrice diurna, fino al momento della fase 7.4.
6. Preparazione sperimentale Co-cultura
- Pipettare delicatamente V co-coltura dal magazzino fiasco alghe nel pallone co-coltura batterica dal punto 4.5. Ritorno pallone co-coltura per l'incubatore diurno fino al momento della fase 7.5.
NOTA: La concentrazione di batteri nel controllo batterica deve essere uguale alla concentrazione batterica nella co-coltura sperimentale. Analogamente, la concentrazione di alghe nel controllo delle alghe deve essere uguale alla concentrazione di alghe nella co-coltura sperimentale. Avendo le stesse concentrazioni batteriche e algali iniziali, la densità di popolazione può essere paragonato tutto l'esperimento.
7. Impostazione micropiastre
- Dividere una piastra microtiter a 48 pozzetti sterili di cui alla figura 1.Etichetta sopra pozzetti esterni contenenti campioni o diluente sterile o non-fotosintetici.
NOTA: randomizzazione dei pozzetti della piastra può essere fatto per campioni prelevati nello stesso giorno. Ad esempio, il settore 1 viene campionato a 1 d nell'esperimento; i pozzetti che dovrebbero essere randomizzati sono B2 - 4 e C2 - 4. Lasciare il perimetro della piastra riempito con soluzione sterile come mostrato in Figura 1.
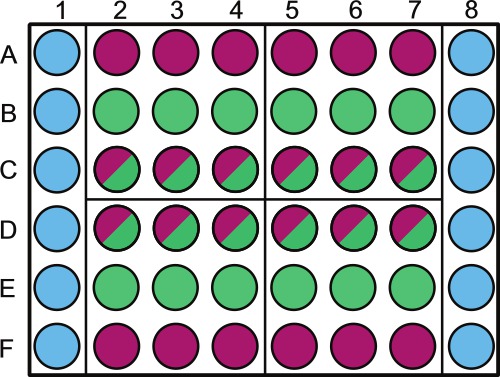
. Figura 1. Rappresentazione schematica di posizionamento del campione in una piastra microtiter a 48 pozzetti Wells devono essere riempiti come segue: colonne 1 e 6, pozzi A a F (  ) Vengono riempiti con 1 ml di PBS 1x (o altra soluzione / media sterile). Righe A e F, pozzi 2-8 (
) Vengono riempiti con 1 ml di PBS 1x (o altra soluzione / media sterile). Righe A e F, pozzi 2-8 (  ) Vengono riempiti con 1 ml di controllo batterica; rows B ed E pozzi 2-8 (
) Vengono riempiti con 1 ml di controllo batterica; rows B ed E pozzi 2-8 (  ) Sono pieni di 1 ml di controllo delle alghe; righe C e D, pozzetti 2 - 8 (
) Sono pieni di 1 ml di controllo delle alghe; righe C e D, pozzetti 2 - 8 (  ) Sono pieni di 1 ml di co-coltura. Il piatto è diviso in 4 quadranti (A2, A5, D2 e D5) questi quadranti sono ogni specifici giorni di campionamento 1 - 4, questo dovrebbe essere randomizzati in tutta piatti e debitamente etichettati. All'interno di ogni giorno si consiglia di randomizzazione il controllo delle alghe (
) Sono pieni di 1 ml di co-coltura. Il piatto è diviso in 4 quadranti (A2, A5, D2 e D5) questi quadranti sono ogni specifici giorni di campionamento 1 - 4, questo dovrebbe essere randomizzati in tutta piatti e debitamente etichettati. All'interno di ogni giorno si consiglia di randomizzazione il controllo delle alghe (  ) E co-coltura (
) E co-coltura (  ) pozzetti usando un generatore di numeri casuali. Etichettare il coperchio sopra il 1x PBS e / o pozzetti di controllo batteriche per evitare ombreggiature di colture algali.
) pozzetti usando un generatore di numeri casuali. Etichettare il coperchio sopra il 1x PBS e / o pozzetti di controllo batteriche per evitare ombreggiature di colture algali.
- Pipettare 1 ml di soluzione tampone fosfato 1x (PBS, pH 7,4) o altra soluzione sterile nei pozzetti appropriati come indicato in figura 1. Eseguire questa lentamente e con cura. PBS sarà change la forza ionica del mezzo alghe e / o co-coltura se schizza in altri pozzetti così gestire con attenzione.
- Pipettare 1 ml di coltura batterica di controllo in pozzi etichettato controllo batterico (Figura 1). Agitare il pallone batterica prima pipettaggio ogni piatto per evitare sedimentazione batterica.
- Pipettare 1 ml di cultura del controllo algale in pozzi etichettati controllo delle alghe con una punta larga bocca pipetta (Figura 1). Agitare il pallone algale regolarmente come il pallone batterica. Se l'alga tende ad affondare o galleggiare, agitare secondo la frequenza necessaria per mantenere una cultura visiva uniforme.
- Utilizzando una punta larga bocca pipetta, pipetta 1 ml di co-coltura nei pozzetti appropriati (Figura 1). Vorticoso il pallone co-cultura come regolarmente il pallone algale.
- Sigillare ogni piatto con parafilm e posto in un incubatore diurna alla temperatura desiderata e il ciclo di luce diurna (18 ° C, con un 16: 8 ore di luce: buio ciclo è comunemente usato). Lasciarele piastre nell'incubatore diurno fino al momento di prendere le letture PAM (sezione 8). Assicurarsi che tutte le piastre sono orientate nella stessa direzione per consentire l'esposizione di luce coerente.
- Prendete una un'aliquota 20 microlitri dalla PBS, mezzi di alghe, alghe magazzino e il controllo delle alghe e rilasciare piastra su un terreno non selettivo del caso (ad esempio, Marine brodo 2216 integrato con 1,5% agar) ed incubare le piastre a 18 - 25 ° C per 72 hr per verificare la contaminazione. Se la crescita appare in una qualsiasi delle soluzioni che non dovrebbero contenere batteri, allora non dovrebbero essere usati questi dati.
- Prendere letture PAM fluorometria utilizzando il campione rimanente dal controllo e co-coltura di alghe palloni per la sperimentazione 0 d PAM lettura fluorometria (vedi punto 8.1). Eventuali altre misure 0 d dovrebbero essere effettuati con il controllo delle alghe restanti, il controllo dei batteri e dei campioni co-coltura.
8. Assunzione di PAM fluorometria Letture da campioni Stock
- Azzerare il WATER-PAMcon i media algali sterile in una provetta pulita prima di prendere letture 8.
- Pipettare 300 microlitri di controllo o di co-coltura delle alghe palloni in una cuvetta pulita contenente 2,7 ml dello stesso mezzo algale utilizzato nell'esperimento. Mescolare il campione e diluente delicatamente con una punta larga bocca pipetta.
- Wipe-off tutte le impronte digitali al di fuori di cuvetta con un fazzoletto prima di mettere la provetta nel WATER-PAM.
- Mettere in cuvetta ACQUA-PAM. Coprire il campione con il tappo e lasciarlo dark-adattamento per 3 min. Tempi di adattamento al buio variano a seconda delle specie di alghe e devono essere determinati per l'alga specifico utilizzato nell'esperimento. Evitare lunghi tempi di adattamento al buio (> 20 min) prendendo letture WATER-PAM durante la metà del ciclo scuro delle alghe incubatori diurni 16,17.
- Dopo adattamento scura, premere il tasto F 0. Se le letture di fluorescenza sono al di sopra di 3.900, diluire il campione 1: 1 in media alghe. Dark-adattare per altri 3 min e takea nuova lettura. Se gli F 0 o F m letture sono ancora al di sopra 3.900, continuare a diluire il campione 1: 1 in terreno di coltura algale finché i F 0 e F m letture sono sotto 3.900.
NOTA: Assicurarsi di tenere conto di queste diluizioni durante la registrazione di fluorescenza finale: ad esempio se il campione delle alghe viene diluito 1: 9 durante il trasferimento iniziale dal pozzo al tubo di diluizione, quindi la lettura algale fluorescenza del 500 deve essere moltiplicato per l'inverso del fattore di diluizione (in questo caso 10) e la fluorescenza effettiva del tubo è poi 5.000. - Dopo aver impostato F 0, prendere un impulso saturando (SAT-Pulse) lettura ogni 90 secondi premendo il tasto SAT per prendere m letture F. L'intervallo di tempo tra le letture può essere regolata a seconda del ceppo di alghe. Campione Rifiuta.
- Ripetere i passaggi 8,1-8,6 per i restanti campioni.
9. Prendendo PAM fluorometria Letture da micropiastre
- Etichetta6 provette sterili di> 3 volumi ml per pozzi B2 - 4 per il controllo e pozzi algali C2 - 4 per il co-coltura batterica (vedi layout di piastra in figura 1).
- Aliquota 2,7 ml di terreno alghe sterile in ciascun tubo.
- Mettere i tubi in incubatrice diurna e consentire loro di acclimatarsi alla temperatura l'alga è stato coltivato in 30 min.
- Prima di rimuovere la piastra microtiter dall'incubatore garantire che la penetrazione della luce nei pozzetti scure acclimatati è limitata coprendo la piastra con un foglio di alluminio (o simile), rimuovere solo dell'estruso attivamente trasferimento cultura dai pozzi ai tubi di diluizione (passi 9.5 - 9.7).
- Asetticamente mescolare la prima micropiastra bene (bene B2) con una punta larga bocca pipetta lentamente pipettando su e giù.
- Ottenere i tubi di diluizione del incubatore e asettico trasferimento da 300 ml e B2 (figura 1) al suo tubo campione corrispondente con la punta larga pipetta bocca (questa è una diluizione 1: 9 del campione in terreno di coltura algale).
- Ripetere i passaggi 9,5-9,6 per i restanti pozzetti (B3,4 e C2 - 4).
- Coprire tubi campione con un foglio di alluminio e restituirli alla incubatrice diurno fino al momento WATER-PAM.
- Eseguire letture WATER-PAM come descritto nei passaggi 8,1-8,7. Sigillare la piastra con parafilm prima di rimetterla in incubatrice.
- Ripetere le letture ad intervalli di tempo programmati per la durata dell'esperimento. La frequenza e la durata di campionamento devono essere pianificate all'inizio dell'esperimento.
10. Campione Experiment
L'esperimento di esempio è un 10 giorni di co-coltura di un batterio (Phaeobacter gallaeciensis BS107) e una microalga (ceppo Emiliania huxleyi (CCMP3266)). Esso comprende un controllo delle alghe, il controllo batterico, e batteri-algale sperimentale co-coltura.
- Calcola volumi di scorte batteriche e algali richiesti (punti 1.1-1,4)

- Preparare il brodo di alghe, una V di 40 ml, inoculando 4 ml di alga in 36 ml di mezzo e incubato finché la crescita precoce esponenziale si ottiene con una densità cellulare di ~ 10 4 cellule / ml (passi 2,1-2,4).
- Preparare il brodo matraccio batterica diluendo 400 ml di 10 6 cfu / ml batteri ottenuti nella sezione 3 a V B di 40 ml con mezzi algali (concentrazione finale di batteri sarà 10 4 cfu / ml).
- Mezzo di trasferimento (20 ml) dello stock batterica nel pallone di controllo batterico e aggiungere 20 ml di media algali per rendere il controllo batterico. Mezzo di trasferimento (20 ml) lo stock delle alghe nel pallone di controllo delle alghe e aggiungere 20 ml di mezzi algali per rendere il controllo delle alghe (sezione 5). Trasferire i restanti 20 ml di brodo batterica al pallone co-coltura e mescolare con i restanti 20 ml di algale al fine di determinare la co-coltura (Section6).
- Pipettare il 1x PBS (pH 7,4), i controlli, e co-coltura in due piastre pre-etichettati microtitolazione (Figura 1), 1 ml per pozzetto. Utilizzare 3 ml dei rimanenti controlli e co-culture di fare 0 d misure (una conta, WATER-PAM (Sezione 8), osservazione microscopica della morfologia delle cellule algali, e fissazione delle cellule algali per citometria a flusso).
- Prendere letture WATER-PAM per il controllo delle alghe e co-coltura volta al giorno per 10 d, e sempre nello stesso tempo come i 0 d misurazioni sono state prese (Sezione 8).
11. Altri parametri di interesse
- Determinare la concentrazione cfu batterica: effettuare una diluizione seriale del controllo batterico e co-coltura in 1x PBS sterile (o simile), poi rilasciare piastra su Marine Brodo 2216 integrato con 1,5% agar (o simili) e osservare il numero di cfu che crescono determinare batterica cfu / ml per ciascun pozzetto 18.
- Per valutare la concentrazione di cellule algali: fissare il controllo delle alghe e cooperazionecoltura con una concentrazione finale 0,15% di glutaraldeide. Incubare per 10 minuti al buio, poi il flash congelare in azoto liquido, e conservare a -80 ° C. Processo tutti i campioni su un citometro di flusso (FACS Calibur o simile) per contare le cellule algali.
- Osservare algale morfologia cellulare: colture algali e batteri-alghe co-coltura usando la microscopia (cioè, microscopia ottica, epifluorescenza, o simili).
Risultati
Letture fluorometria WATER-PAM.
WATER-Pulse-modulata in ampiezza (PAM) fluorometria è un metodo rapido ed efficace per determinare la fluorescenza (un proxy per il contenuto di clorofilla) e la resa fotosintetica (salute PSII) di colture algali. Il software PAM WinControl genera un foglio di calcolo di valori di dati grezzi per (i seguenti sono i parametri fondamentali per scuri adattato campioni algali):
F 0 = fluorescenza delle cellule adattati al buio...
Discussione
Crescita delle alghe in un formato miniaturizzato.
La miniaturizzazione di colture algali ad un volume coltura 1 ml in una piastra microtiter consente di replicare in un esperimento possa essere aumentata. È importante garantire l'alga è sano durante un esperimento; eseguire una curva di crescita (figura 2), utilizzando il formato micropiastre per valutare vari media algali, al fine di garantire la conformità ai requisiti nutrizionali del alghe. Inoltre, può essere impo...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This work was supported by Natural Sciences and Engineering Research Council of Canada (grant 402105), Canadian Foundation for Innovation (grant 129087) and Alberta Education and Training (grant AAETRCP-12-026-SEG) to RJC.
Materiali
| Name | Company | Catalog Number | Comments |
| 10 cu. ft. Diurnal incubator (6012-1) | Caron Corporate | 112310-6012-1-11 | www.caronproducts.com |
| Nunc EasYFlask 25 cm2, Vent/Close Cap, 7 ml working volume, 200/cs | Thermo Fisher Scientific | N156340 | www.fishersci.ca |
| Multiwell TC Plates – 48-well | BD Biosciences Discovery Labware | 353078 | www.bdbiosciences.com |
| P1000 Gilson The Pipetting Standard—Gilson's Pipetman | Mandel Scientific Company Inc. | GF-F123602 | www.mandel.ca |
| P10mL Gilson The Pipetting Standard—Gilson's Pipetman | Mandel Scientific Company Inc. | GF-F161201 | www.mandel.ca |
| Wide Orifice Tips nonsterile [100–1,250 µl] | VWR International | 89079-468 | www.ca.vwr.com |
| Ultrafine Tips nonsterile [100–1,250 µl] | VWR International | 89079-470 | www.ca.vwr.com |
| Finntip 10 ml [Vol: 1 - 10 ml] | Thermo Fisher Scientific | 9402151 | www.fishersci.ca |
| WATER-Pulse Amplitude Modulation (Water-ED) | Heinz Walz GmbH, Effeltrich, Germany | EDEE0232 | www.walz.com |
| 15 mm diameter quartz glass cuvette (WATER-K) | Caron Corporate | www.caronproducts.com | |
| Sodium chloride (crystalline/certified ACS), Fisher Chemical | Thermo Fisher Scientific | Thermo Fisher Scientific | www.fishersci.ca |
| BD Difco Marine Broth 2216 | BD Biosciences Discovery Labware | BD Biosciences Discovery Labware | www.bdbiosciences.com |
| BD Bacto Agar | BD Biosciences Discovery Labware | BD Biosciences Discovery Labware | www.bdbiosciences.com |
| L1 Medium Kit, 50 L | NCMA [National Center for Marine Algae and Microbiota | NCMA [National Center for Marine Algae and Microbiota | www.ncma.bigelow.org |
Riferimenti
- Scarratt, M. G., Marchetti, A. Assessing microbial responses to iron enrichment in the Subarctic Northeast Pacific: Do microcosms reproduce the in situ condition?. Deep Sea Res Part II Top. Stud. Oceanogr. 53 (20-22), 2182-2200 (2006).
- Bidle, K. D., Haramaty, L., Barcelos E Ramos, J., Falkowski, P. Viral activation and recruitment of metacaspases in the unicellular coccolithophore, Emiliania huxleyi. Proc. Natl. Acad. Sci. U. S. A. 104 (14), 6049-6054 (2007).
- Moore, L. R., Goericke, R., Chisholm, S. W. Comparative physiology of Synechococcus and Prochlorococcus: influence of light and temperature on growth, pigments, fluorescence and absorptive. Mar. Ecol. Prog. Ser. 116, (1995).
- Iglesias-Rodriguez, M. D., Halloran, P. R. Phytoplankton calcification in a high-CO2 world. Science. 320 (5874), 336-340 (2008).
- Chen, M., Tang, H., Ma, H., Holland, T. C., Ng, K. Y. S., Salley, S. O. Effect of nutrients on growth and lipid accumulation in the green algae Dunaliella tertiolecta. Bioresour. Technol. 102 (2), 1649-1655 (2011).
- Lv, J. -. M., Cheng, L. -. H., Xu, X. -. H., Zhang, L., Chen, H. -. L. Enhanced lipid production of Chlorella vulgaris by adjustment of cultivation conditions. Bioresour. Technol. 101 (17), 6797-6804 (2010).
- Geider, R., Graziano, L., McKay, R. M. Responses of the photosynthetic apparatus of Dunaliella tertiolecta (Chlorophyceae) to nitrogen and phosphorus limitation. Eur. J. Phycol. 33 (4), 315-332 (1998).
- MacIntyre, H. L., Cullen, J. J. Using Cultures to Investigate the Physiological Ecology of Microalgae. Algal Cult. Tech. , 287-326 (2005).
- Blaise, C., Vasseur, P. Algal microplate toxicity test. Small-scale Freshw. Toxic. Investig. Vol. 1 Toxic. Test Methods. , 137-179 (2005).
- Skjelbred, B., Edvardsen, B., Andersen, T. A high-throughput method for measuring growth and loss rates in microalgal cultures. J. Appl. Phycol. 24, 1589-1599 (2012).
- Nagai, T., Taya, K., Annoh, H., Ishihara, S. Application of a fluorometric microplate algal toxicity assay for riverine periphytic algal species. Ecotoxicol. Environ. Saf. 94, 37-44 (2013).
- Seyedsayamdost, M. R., Case, R. J., Kolter, R., Clardy, J. The Jekyll-and-Hyde chemistry of Phaeobacter gallaeciensis. Nat. Chem. 3 (4), 331-335 (2011).
- Schreiber, U., Schliwa, U., Bilger, W. Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer. Photosynth. Res. 10 (1-2), 51-62 (1986).
- Jones, R. J., Ward, S., Amri, A. Y., Hoegh-Guldber, O. Changes in quantum efficiency of photosystem II of symbiotic dinoflagellates of corals after heat stress, and of bleached corals sampled after the 1998 Great Barrier Reef mass bleaching event. Mar. Freshw. Res. 51 (345), 659-668 (1998).
- Beer, S., Larsson, C., Poryan, O., Axelsson, L. Photosynthetic rates of Ulva (Chlorophyta) measured by pulse amplitude modulated fluorometry. Eur. J. Phycol. 35 (1), 69-74 (2000).
- . . WATER-PAM Chlorophyll Fluorometer. Instrument Description and Information for Users. , (2013).
- Maxwell, K., Johnson, G. M., Heers, J. Chlorophyll fluorescence--a practical guide. J. Exp. Bot. 51 (345), 659-668 (2000).
- Herigstad, B., Hamilton, M., Heersink, J. How to optimize the drop plate method for enumerating bacteria. J. Microbiol. Methods. 44 (2), 121-129 (2001).
- Kooten, O., Snel, J. The use of chlorophyll fluorescence nomenclature in plant stress physiology. Photosynth. Res. 25 (3), 147-150 (1990).
- Maxwell, K., Johnson, G. N. Chlorophyll fluorescence--a practical guide. J. Exp. Bot. 51 (345), 659-668 (2000).
- Schreiber, U. Pulse-Amplitude-Modulation (PAM) Fluorometry and Saturation Pulse Method: An Overview. Chlorophyll a Fluoresc. A Signat. Photosynth. , 279-319 (2004).
- Roháček, K., Barták, M. Technique of the modulated chlorophyll fluorescence: basic concepts, useful parameters, and some applications. Photosynthetica. 37 (3), 339-363 (1999).
- Da Silva, J. M., da Silva, A. B., Pádua, M. Modulated chlorophyll a fluorescence: a tool for teaching photosynthesis. J. Biol. Educ. 41 (4), 178-183 (2007).
- Vieira, S., Ribeiro, L., Jesus, B., Cartaxana, P., da Silva, J. M. Photosynthesis assessment in microphytobenthos using conventional and imaging pulse amplitude modulation fluorometry. Photochem. Photobiol. 89 (1), 97-102 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon