Method Article
Plataforma modular de selección automatizados de alto rendimiento de exopolisacáridos Junto con el análisis de carbohidratos de la huella digital de alta sensibilidad
En este artículo
Resumen
We present an automated modular high-throughput-method for the identification and characterization of microbial exopolysaccharides in small scale. This method combines a fast preselection to analyze the total amount of secreted polysaccharides with a detailed carbohydrate fingerprint to enable the fast screening of newly isolated bacterial strains or entire strain collections.
Resumen
Muchos microorganismos son capaces de producir y secretar exopolisacáridos (EPS), que tienen importantes implicaciones en los campos médicos, aplicaciones de alimentos o en la sustitución de productos químicos basados en petroquímicos. Se describe una plataforma de análisis para ser automatizado en un sistema de tratamiento de líquidos que permite el análisis rápido y fiable del tipo y la cantidad de EPS producidas por microorganismos. Se permite al usuario identificar nuevos productores de exopolisacáridos microbianas naturales y analizar la huella digital de hidratos de carbono de los polímeros correspondientes dentro de un día en de alto rendimiento (HT). El uso de esta plataforma, colecciones de cepas, así como bibliotecas de variantes de cepas que podrían ser obtenidos en los enfoques de ingeniería pueden ser examinados. La plataforma tiene una configuración modular, lo que permite una separación del protocolo en dos partes principales. En primer lugar, hay un sistema de detección automatizada, que combina diferentes módulos de detección de polisacárido: un análisis semi-cuantitativo de viscosity la formación a través de una etapa de centrifugación, un análisis de la formación de polímero a través de precipitación con alcohol y la determinación del contenido total de hidratos de carbono a través de una transformación de fenol-ácido sulfúrico. Aquí, es posible seleccionar hasta 384 cepas por corrida. La segunda parte ofrece un análisis monosacárido detallada para todos los productores de EPS seleccionados identificados en la primera parte mediante la combinación de dos módulos esenciales: el análisis de la composición de monómero completa mediante cromatografía líquida de ultra-alto rendimiento junto con la luz ultravioleta y la ionización por electrospray detección de trampa de iones ( UHPLC-UV-ESI-MS) y la determinación de piruvato como sustituyente polímero (presencia de cetal piruvato) a través de la oxidación enzimática que se acopla a una formación de color. Todos los módulos de análisis de esta plataforma de cribado se pueden combinar de diferentes maneras y se ajustan a las necesidades individuales. Además, todos ellos pueden ser manejados manualmente o realizarse con un sistema de manejo de líquidos. De esta manera, el pla de cribadoTForm permite una gran flexibilidad con el fin de identificar las diversas EPS.
Introducción
exopolisacáridos microbianos (EPS) son un grupo estructuralmente muy diversa de polímeros que cumplen diversas funciones biológicas. Por lo general se construyen de unidades repetitivas complejas, que se distinguen por diferentes tipos de monómeros (azúcar, derivados de azúcares, ácidos azúcar), los enlaces entre estos monómeros y sus sustituciones. La diversidad estructural de los polisacáridos microbianos confiere características muy diferentes a los miembros de esta clase molécula, lo que permite su aplicación en diferentes campos como la alimentación 1, 2,3 cosméticos, química construcción de 4 o 5 de tratamiento de agua. Para ampliar aún más el campo de aplicación de estos polímeros sostenibles de base biológica y tales la identificación de nuevos polisacáridos microbianos naturales, así como la ingeniería de variantes estructurales representa enfoques prometedores. De cualquier manera, se requiere un método de cribado rápido para explorar rápidamente un gran número de cepas microbianas para their formación de polisacárido, y analizar sus productos. Por lo tanto, hemos desarrollado recientemente una plataforma HT-cribado de 96 pocillos para el análisis de la producción de polisacáridos microbianos a partir de aislados naturales o variantes de cepas de ingeniería que incluye la identificación de la composición monomérica 6.
La aplicación de esta plataforma para una primera ronda de cribado de ~ 500 aislados naturales nos permitió identificar sólo alrededor del 10 al 20% de las cepas aisladas como ser capaz de producir EPS (datos no mostrados). Esto significa que el 80-90% de las cepas analizadas no produjo EPS en las condiciones aplicadas, y por lo tanto, un nuevo análisis de la huella digital detallada de hidratos de carbono no era necesario. Como esta identificación altamente sofisticado de la composición monomérica es un proceso que consume tiempo, especialmente para el análisis de datos, un método de pre-selección rápido para identificar las cepas positivas en la producción de EPS, aumentaría drásticamente la eficiencia. Además, los reactivos,consumibles y tiempo de medición en el UHPLC-UV-ESI-MS se reducirían. Además, los diferentes módulos de análisis, mientras que por un lado hacer que el método altamente fiable, son por el contrario lo que complica la manipulación manual de más de dos placas de 96 pocillos en paralelo, y como tal restringir al máximo el potencial del método. Por estas razones, hemos decidido desarrollar una plataforma de exploración automático. Por lo tanto, se combinaron el formato modular de la técnica de la huella digital de hidratos de carbono existente con un método de detección rápido totalmente automatizada del contenido total de azúcar, basado en la medición de la absorbancia.
El método de fenol-ácido sulfúrico representa todavía el método de elección para la determinación rápida del contenido total de hidratos de carbono de polisacáridos bacterianos de plantas y 7,8. Este método fue descrito por primera vez por Dubois et al. 9 y adaptado para diferentes aplicaciones y tamaños de muestra, incluso para pequeña escala en placas de 96 pocillos 10,11. el phemétodo nol-ácido sulfúrico-mide el contenido total de carbohidratos por un valor, summating todo monómeros, oligómeros y los carbohidratos poliméricos de las muestras.
Teniendo en cuenta estos aspectos, la elección de un medio de cultivo adecuado es esencial para aplicar este método. medios complejos que contienen oligómeros o compuestos poliméricos de hidratos de carbono como el extracto de levadura pueden conducir a un contenido de polímero modificado y, por tanto, en sentido estricto debe ser evitado. Además, altas cantidades de azúcares se utilizan como fuente de C para el cultivo de las cepas. Los altos niveles de hidratos de carbono restantes del proceso de cultivo podrían interferir negativamente con la medición del contenido de EPS.
Por lo tanto, se aconseja el uso de azúcares definidos y puros. En nuestros experimentos usamos la glucosa para el cultivo de las células. La glucosa restante después del cultivo se redujo a través de una filtración en gel y se determina a través de una glucosa-ensayo. Por último, el equivalente de glucosas de los polisacáridos se calcularon restando la glucosa restante después de la filtración en gel a partir del contenido total de carbohidratos que había sido detectado con el método de fenol-ácido sulfúrico. Filtración en gel y la glucosa-ensayo en combinación con el método de fenol-ácido sulfúrico-garantizan resultados fiables y son capaces de ser nuestra primera, sistema de detección completamente automatizada.
Dos nuevos módulos de análisis se incluyeron en la plataforma de cribado automatizado para aumentar la cantidad de información desde el sistema de detección de EPS: la precipitación y la observación de un aumento de la viscosidad.
Muchos EPS diferentes - por ejemplo, succinoglicano, xantano y colon ácido 12 - se informa que ser modificado con un cetal piruvato no de hidratos de carbono en las posiciones de azúcar C4 y C6. Esos cetales piruvato (justo como ésteres succinil medio y ácidos urónicos) contribuyen a la naturaleza polianiónica y, por tanto, a la prope físicarties del polímero mediante la interacción a través de puentes de cationes divalentes 13. Con el fin de identificar aquellos polímeros particular la determinación de piruvato se estableció como otro módulo de análisis adicional. Esto aumenta la información acerca de los sustituyentes de polisacáridos y sus propiedades macroscópicas potenciales.
La combinación de todos los módulos permite la identificación de diferentes EPS, así como una determinación rápida y eficiente de los productores de EPS. Por que el enfoque de la plataforma de cribado podría dividirse en dos partes principales (Figura 1). Dentro de la proyección automatizada (parte I) se produce el flujo de trabajo totalmente automatizado (Tabla 1) para preseleccionar rápidamente las cepas productoras de EPS. El análisis de carbohidratos de huellas digitales (parte II) determina cuantitativamente la composición de monómero de la EPS producidos por las cepas preseleccionadas. De este modo, el análisis de datos se reduce al mínimo con el fin de optimizar la detección de grandes colecciones de cepas. Estaofrece la posibilidad de analizar 384 cepas en una sola corrida de detección automatizada y con dos carreras que son posibles por día de 768 cepas por día. Además, el análisis de carbohidratos huella digital ofrece una visión general más detallada de todas las EPS identificados. Esto permite el análisis dirigido y la identificación de sólo ligeramente diferentes variantes EPS o otros completamente nuevos en comparación con las estructuras químicas ya descritos de EPS.
Protocolo
1. selección automatizados
Nota: Todas las medidas de manejo de líquidos se hacen con un sistema de tratamiento de líquidos robótico. La composición de la mesa de trabajo del robot se presenta en la Figura 2. Todos los consumibles se almacenan en el carrusel de almacenamiento, a menos que se indique lo contrario. A pesar de la detección automatizada pasos un manipulador robótico (RM) mueve los consumibles, (placa de pozo profundo (DWP); placa de titulación de micro (MTP); polimerasa placa de reacción en cadena (PCR-placa) y así sucesivamente) entre las posiciones de carrusel (CP ) y las posiciones de la mesa de trabajo (WTP). Todos los pasos de pipeta se realizan con un 96-canal-pipeta-brazo, excepto si se menciona lo contrario. Todos los pasos se programan y se realizan automáticamente en formato de 96 pocillos.
- Strain de cultivo (Grupo 1 en la Figura 1)
Nota: la manija de la inoculación de las cepas productoras de EPS putativo y el sellado de las placas de cultivo en condiciones estériles (flujo laminar). la automatizadodetección rápida puede manejar cuatro placas de 96 pocillos en cada procesamiento. Las diferentes cepas de varios géneros ya se ensayaron 6.- inocular manualmente el pre-cultivo (1 ml EPS-media en un DWP) con un replicador de 96 pines de un 96 pocillos de glicerol plato. Cubrir la placa con una lámina de sellado transpirable para evitar la evaporación y para permitir la aireación. Incubar a 30 ° C durante 48 horas a 1000 rpm en un agitador MTP-.
- Inocular el principal cultivo (990 l EPS-media en un DWP) la transferencia de 10 l de la pre-cultivo utilizando un 50 l de 12 canales multi-pipeta e incubar en las mismas condiciones que el precultivo. Tome nota de todas las cepas que no crecen.
- Preparación de la mesa de trabajo del robot y el carrusel de almacenamiento
- Proporcionar todos los consumibles que figuran en los materiales y equipos a la posición correcta en el carrusel de almacenamiento. Añadir 990 l de agua doblemente destilada (ddH2O) en cada pocillo de la DWP para las diluciones 1: 100 para THe-ensayo de glucosa (posición carrusel de 4-1 a 4-4).
- Organizar una cubeta de 250 ml que contiene 150 ml de ddH2O en la posición de la mesa de trabajo (DAP) 11.
- Depositar una cubeta de 250 ml que contiene 50 ml de glucosa-ensayo de reactivos de mezcla (4 ml 500 mM de fosfato de potasio (pH 5,7), 1,5 ml de 50 mM de 2,2-azinobis- (3ethylbenzthiazoline) -6-ácido sulfónico, 2 ml 100 U de glucosa oxidasa, 10 l 1.000 U de peroxidasa de rábano y 42,49 ml ddH2O) en la posición WTP 1-2.
- Coloque dos placas MTP F-inferior ficticias vacíos en la posición WTP 3-1 y 3-2.
- Retire la película de sellado transpirable, asignar los principales-culturas en las posiciones del carrusel (CP) 1-1 a 1-4 e inicie el programa robótico automatizado.
- El equilibrado de las placas de filtración en gel
Nota: Las placas de filtración de gel que se utilizan durante esta prueba de detección pueden ser reutilizados. Para esto, lavar y centrifugar tres veces cada una con 150 ml de ddH 2 O a 2000 xg durante 2 min a 20 ° C. Posteriormente, se almacena a 4° C con 75 l de etanol al 20% y la cubierta con un tapete tapa de silicona.- Mover la cubeta 250 ml (CP 5-7) con tampón 5 mM de acetato de amonio (pH 5,6) a la DAP 3-3.
- La transferencia de las placas de filtración en gel (CP 1-6, 1-7, 2-6 y 2-7) desde el carrusel de la EDAR de 4-1 a 4-4.
- Aspirar 150 l de tampón de acetato de amonio utilizando 200 l consejos y dispensar en el centro de todas las placas de filtración en gel para la equilibración.
- Transferir las placas de filtración en gel en la centrífuga (2.000 x g durante 2 min a 20 ° C).
- La transferencia de las placas de nuevo a la mesa de trabajo, repita los pasos 1.3.3, 1.3.4 y 1.3.3. No repetir la etapa de centrifugación para evitar la deshidratación de las placas de filtración en gel. Almacenar las placas de filtración en gel se equilibró de nuevo dentro del carrusel.
- La eliminación de la célula a través de centrifugación (Grupo 1 en la Figura 1)
Nota: Con el fin de garantizar un fondo de baja dentro del enfoque de detección, análisis celular gratisEPS que contiene sobrenadantes solamente y eliminar las células mediante centrifugación después del cultivo.- Transferir el principal cultivo DWP desde el carrusel (1-1 a 1-4) en la centrífuga (4.300 xg durante 30 min a 20 ° C).
- Preparar la mesa de trabajo a través de la RM para procesar el cultivo principal.
Nota: Para los pasos 1.4.2 a 1.4.3.5 del sistema siempre maneja dos placas en paralelo y luego se repite todos los pasos con los siguientes dos placas.- Para la precipitación antes de la filtración mover el MTP del CP 6-1 y 6-2 a la DAP 4-1 y 5-1. Mover las placas MTP-indicadores de pH de 7-1 y 7-2 CP a WTP 4-2 y 5-2.
- La transferencia de la placa de filtración junto con la placa del colector de la CP 2-1 y 2-2 a la DAP 4-3 y 5-3. Reubicar el principal cultivo DWP 1-1 y 1-2 de la centrífuga para WTP 4-4 y 5-4.
- Preparar los módulos analíticos.
Nota: Tomar 200 l consejos de almacenamiento de la punta (posición 2-1 a 2-4). Con el fin de reducir el consumo, usar la misma punta de serie para el paso 1.4.3.1.- Transferir 180 l del sobrenadante de cultivo principal a la placa de filtración. Aspirar 150 l de sobrenadante de cultivo principal y prescindir de 50 l en el PPM para la precipitación antes de la filtración y 100 l a la placa de indicador de pH.
Nota: El pH determinación no es esencial; sin embargo, después de añadir 12,5 ml de metil indicador rojo (50 mg en 50 ml de etanol) en cada pocillo con una pipeta de múltiples pasos que indica cepas productoras de ácido altos. Esta información puede ser útil para evitar la inhibición del crecimiento (a pH bajo) para más cultivos, por ejemplo para un segundo cribado con una mayor concentración de tampón. Por otra parte, un pH bajo también puede inducir la producción de EPS con el fin de proteger a la célula contra el ambiente ácido. - Repita el paso 1.4.3.1 para la segunda placa de cultivo principal. Utilice una punta-juego nuevo.
- Mover las placas de filtración de la centrífuga y eliminar todas las otras placas de la mesa de trabajo de vuelta a sus posiciones iniciales en el carousEL.
- Repetir la 1.4.2.1 a 1.4.3.3 pasos para la placa de tercera y cuarta cultivo principal.
- Tomar nota de los caldos de fermentación, que muestran una disminución de la sedimentación después de la centrifugación de las placas de cultivo principales, cuando se transfieren de nuevo al carrusel (control de la viscosidad).
- Transferir 180 l del sobrenadante de cultivo principal a la placa de filtración. Aspirar 150 l de sobrenadante de cultivo principal y prescindir de 50 l en el PPM para la precipitación antes de la filtración y 100 l a la placa de indicador de pH.
- La filtración de 96 pocillos para la eliminación completa de la célula (Grupo 2 en la Figura 1)
Nota: Para asegurar la eliminación de células del caldo de fermentación viscoso una etapa de filtración se incluye en la proyección.- Centrifugar las placas de filtración a 3.000 xg durante 10 minutos a 20 ° C y llevarlos de vuelta a su posición inicial carrusel.
- Preparar las placas de filtración en gel.
- Mover las placas de filtración en gel equilibrada desde el carrusel a la centrífuga y centrifugado a 1000 xg durante 2 min a 20 ° C.
- La transferencia de las placas de filtración en gel de la centrífuga para WTP 4-1 a 44.
- Mueva el gel frescoplacas colectoras -filtration de CP (3-1 a 3-4) a la DAP (5-1 a 5-4).
- La transferencia de las placas de filtración en gel se equilibró (WTP 4-1 a 4-4) para placas colectoras frescas (5-1 a 5-4).
- Limpiar la mesa de trabajo, excepto las posiciones 5-1 y 5-2 y mover la posición 5-1 a la posición 4-1.
- Preparar la mesa de trabajo a través de la RM para procesar los filtrados.
Nota: Para los pasos 1.5.3 a 1.6.3.5 El sistema maneja dos placas en paralelo y repite todos los pasos con los siguientes dos placas.- 50 consejos mover l desde el carrusel (4-6 y 4-7) a la DAP 3-3 y 3-4.
- La transferencia de las placas de filtración de CP 3-1 a 3-2 en la mesa de trabajo (4-4 y 5-4).
- Reubicar el DWP (dilución 1: 100) para la detección del consumo de glucosa de la CP 4-1 y 4-2 a la DAP 4-2 y 5-1.
- Mueva el MTP para la segunda precipitación después de la filtración del CP 8-1 y 8-2 a la DAP 4-3 y 5-3.
- Levantar las placas de filtración de la placa colectoras (WTP 4-4 y 5-4) y moverlos a la DAP 3-1 y 3-2.
- Preparar los módulos de análisis después de la filtración. Con el fin de reducir el consumo, usar la misma punta-conjunto de pasos 1.5.4.1 y 1.5.4.3.
- Tomar 50 l consejos y la pipeta una alícuota de 10 l del filtrado a la DWP (dilución 1: 100) para el ensayo de glucosa (el consumo de glucosa).
- Pipetear 35 l de filtrado para el centro de la placa de filtración en gel equilibrada y 50 l a la MTP que se utiliza para la precipitación.
- Repita los pasos 1.5.4.1 a 1.5.4.2 para la segunda placa de filtración.
- Mover las placas de filtración en gel a la centrífuga y se mueven todas las otras placas de la mesa de trabajo de nuevo a las posiciones iniciales en el carrusel.
- Repita los pasos 1.5.3.1 a 1.5.4.4 para la placa de tercera y cuarta filtración.
- Después de un almacenamiento de todas las placas de nuevo en el carrusel en tomar nota de los sobrenadantes de alta viscosidad, como se indica por los residuos en la placa de filtro (alta viscosidad de control después de la etapa de filtración). A falta de filtrado puede conducir a resultados negativos falsos en los siguientes módulos analíticos.
- La eliminación de la glucosa a través de 96 pocillos de filtración en gel (Grupo 3 en la Figura 1)
- Centrifugar las placas de filtración en gel a 1.000 xg durante 2 min a 20 ° C.
- Preparar la mesa de trabajo a través del manipulador robótico para procesar los filtrados de gel.
- Proporcionar 50 consejos l desde el carrusel (5-3 y 5-4) a la DAP 3-3 y 3-4.
- Para la determinación de la glucosa restante después de filtración en gel mover dos placas MTP de CP 9-1 y 9-2 para WTP 4-1 y 5-1.
- Para el método de fenol-ácido sulfúrico mover dos placas MTP de CP 8-5 y 8-6 a la DAP 4-2 y 5-2.
- Transferir dos placas de filtración en gel de la centrífuga de WTP (4-3 y 5-3).
- Levantar las placas de filtración en gel de la placa colectora (4-3 y 5-3) y moverlos a la DAP 3-1 y 3-2.
- Preparar la mesa de trabajo a través del manipulador robótico para procesar los filtrados de gel.
Nota: Con el fin de reducir los consumibles, utilice la punta de conjunto de pasos 1.6.3.1 y 1.6.3.2 misma.- Para detectar la glucosa que queda después de filtración en gel (dilución 1:10) llevará 50 consejos y transferir l 25 l de ddH2O (WTP 1-1) a un MTP frescos. Aspirar 20 l de ddH2O (WTP) 1-1, 5 l de aire y 5 l de gel filtrado y distribución dentro de la misma placa.
- Para la pipeta de fenol-ácido sulfúrico-Método 20 l de gel filtrado a la MTP.
- Repita los pasos 1.6.3.1 y 1.6.3.2 de la segunda placa de gel-filtrado.
- Transferir todos los platos de la mesa de trabajo de nuevo a las posiciones iniciales en el carrusel.
- Repetir la 1.6.2.1 a 1.6.3.4 pasos para la placa de tercero y cuarto de filtración en gel.
- Módulos de glucosa-ensayo
- Preparar la mesa de trabajo a través del manipulador robótico para realizar la glucosa-asdecir.
- Reubicar el DWP (dilución 1: 100) a partir de CP 4-1 y 4-4 para WTP 5-1 y 5-4.
- Mover todos los MTP del CP 9-5 y 9-8 a la DAP 4-1 y 4-4.
- Tomar 200 consejos mu l y se mezcla la dilución mediante la aspiración y dispensación de diez veces el volumen de 180 l. A continuación, la pipeta una alícuota de 50 l de la MTP.
- Repita los pasos 1.7.1.2 y 1.7.1.3 para los cuatro DWPs (dilución 1: 100).
- Eliminar todos los PSD (5-1 a 5-4) de la mesa de trabajo.
- Preparar la mesa de trabajo para iniciar la glucosa-ensayo.
- Para la determinación de la glucosa restante después de la transferencia de filtración de gel todas las MTP de CP (9-1 a 9-4) a WTP (5-1 a 5-4).
- Mover la placa de calibración de glucosa-ensayo - que contiene tres veces con 50 l de las siguientes concentraciones de glucosa (90, 45, 18, 9, 4.5, 1.8, 0.9, 0.45 y 0 mg / L) - CP de 9-9 a WTP 3- 3.
- Tomar 200 l consejos y aspirado de 50 l de glucosa-ensayo reactivo mezcla de WTP 1-2, para iniciar el primer ensayo. Mover las MTP en la incubadora (30 ° C a 150 rpm durante 30 min).
- Establecer el calendario para iniciar el programa con 5 minutos de retraso entre las placas.
- Después de 30 minutos de incubación mover las placas de la incubadora a la MTP-lector y registro de la absorbancia a 418 y 480 nm.
- Después de la medición mover las placas a su posición inicial en el carrusel.
- Preparar la mesa de trabajo a través del manipulador robótico para realizar la glucosa-asdecir.
- Preparación de la precipitación
Nota: Con el fin de evaluar la producción de EPS realizar una precipitación del sobrenadante con 2-propanol antes y después de la primera etapa de filtración. Además, evaluar la adsorción del polímero sobre la membrana de filtro por la observación de las fibras y copos en el primero, pero no en la segunda precipitación.
Precaución: Handle 2-propanol en forma de un líquido inflamable estrictamente bajo una campana de humos.- Eliminar todas las placas de precipitación (CP 6-1 a 6-4 y 8-1 a 8-4) desde el carrusel. Y añadamanualmente 150 ml de 2-propanol a cada pocillo con una pipeta 12,5 ml de múltiples pasos.
- Cubrir todas las MTP con una estera tapa de silicona y agitar a temperatura ambiente (TA) (10 min a 900 rpm). observar visualmente formaciones de fibra o escama después de la agitación que indican la producción de EPS.
- Método de fenol-ácido sulfúrico
Precaución: Manipular concentrada de ácido sulfúrico y fenol bajo una campana de humos. El fenol es un agente corrosivo y mutagénico.- Para el método de fenol-ácido sulfúrico, retirar las placas (CP 8-5 a 8-8) desde el carrusel y colocarlos en el sistema de tratamiento de líquidos (Posición 4 a 8). Incluir la placa de calibración con 20 l de diferentes concentraciones de glucosa (10; 5; 2,5; 1; 0,5; 0,25; 0,1; 0,05; 0 g / L) en triplicado.
- Colocar un recipiente de residuos en la posición 1, una caja de punta 200 l en la posición 2 y un canal 250 ml con 110 ml de fenol-ácido sulfúrico (recién preparada en with18.3 hielo ml de fenol 5% (w / v) en ddH 2 O y 91,7 ml de HCl conc. sácido ulfuric) en la posición 3.
- Utilice una pipeta de 8 canales con 300 l consejos y la transferencia de 180 l de fenol-ácido sulfúrico en cada fila de todas las placas.
- Cubrir todas las MTP con tapas, mezclarlas agitación (5 min a 900 rpm, TA) y se incuban durante 35 minutos a 80 ° C en un horno de reacción de color. Después de enfriar bajo una campana de extracción, medir la extinción a 480 nm.
- Selección de EPS positiva sobrenadantes (Grupo 4 en la Figura 1)
- Para la evaluación de la producción de EPS, seleccionar aquellas cepas de la proyección automatizado que cumplen al menos dos de los tres criterios como positivos (control de la viscosidad 2.6.1 y 2.6.2, la detección de polímero 2.6.3, glucosa equivalente 2.6.5). Transferir los filtrados restantes de los éxitos positivos de un nuevo plan de mediano plazo para su posterior procesamiento.
Nota: Cuando las placas se cubren con una película de sellado de aluminio que se pueden almacenar a -20 ° C durante al menos una semana. En ese momento, la determila de la huella dactilar de hidratos de carbono se debe realizar.
- Para la evaluación de la producción de EPS, seleccionar aquellas cepas de la proyección automatizado que cumplen al menos dos de los tres criterios como positivos (control de la viscosidad 2.6.1 y 2.6.2, la detección de polímero 2.6.3, glucosa equivalente 2.6.5). Transferir los filtrados restantes de los éxitos positivos de un nuevo plan de mediano plazo para su posterior procesamiento.
2. Hidratos de carbono de la huella digital
Nota: Todos los pasos para la huella digital de hidratos de carbono se llevan a cabo manualmente.
- Gel-filtración de los sobrenadantes positivos (Grupo 5 en la Figura 1)
Nota: Gel-filtración es necesario ya que no hay filtrado la izquierda desde el cribado automatizado. Filtración en gel con un volumen de más de 35 l resultados en disminución de la eficiencia de purificación.- Preparar la equilibración de las placas de filtración en gel mediante la supresión de 150 l de tampón de acetato de amonio en todos los pocillos a través de una pipeta ml 12,5 multi-paso.
- La transferencia de la placa de filtración en gel en la centrífuga (2.000 x g durante 2 min a 20 ° C).
- Repita los pasos 2.1.1, 2.1.2 y 2.1.1 de nuevo. Se centrifuga la placa de filtración en gel a 1.000 xg durante 2 min a 20 ° C antes de su uso posterior.
- Pipeta de 35 l de filtrado y ponerlos enel centro de la placa de filtración en gel utilizando un 12-canal de pipeta 50 l.
- Se centrifuga la placa de filtración en gel a 1.000 xg durante 2 min a 20 ° C y luego levantarlo desde la placa colectora.
- Preparar la glucosa-ensayo antes de la hidrólisis: Realizar una dilución 1:10 añadiendo 45 l de ddH2O y 5 l de gel filtrado con una l pipeta de 12 canales 50 y cubrir las placas MTP con una estera de tapa de silicona.
Nota: Para la determinación correcta del valor de glucosa del polímero, medir el contenido de glucosa antes de la hidrólisis y restarlo del contenido de glucosa cuantificado después de la etapa de hidrólisis. - Preparar la piruvato-ensayo antes de la hidrólisis: Realizar una dilución 1:20 utilizando una pipeta de 12 canales de 200 l para añadir 95 l de ddH2O, transferencia de 5 l de gel filtrado a cada pocillo y sellar la MTP con una estera tapa de silicona .
- De 96 pocillos Micro hidrólisis (Grupo 6 en la Figura 1)
Nota: Calentarel horno de incubación (incluyendo un baño de arena) a 121 ° C durante al menos 1,5 h antes de usar. Un dispositivo de sujeción especial fue desarrollado para evitar la evaporación durante la etapa de hidrólisis pequeña escala.- Tome una nueva PCR-placa y la transferencia de 20 l de gel filtrado con una pipeta de 12 l-canal 50.
Precaución: Ácido trifluoroacético es un ácido corrosivo y tóxico. solución de amonio es corrosivo. Manejar tanto las sustancias químicas sólo bajo una campana de humos. - Añadir 20 l de ácido trifluoroacético 4 M con una pipeta 1,25 ml de pasos múltiples a cada pocillo. Luego cubra la placa de PCR con un elastómero termoplástico (TPE) estera tapa y coloque la PCR de la placa en el dispositivo de sujeción especial.
- Mezclar las soluciones a través de la inversión del dispositivo de sujeción de diez veces. Ponga la placa de PCR en una centrífuga y centrifugado a 2.000 xg durante 2 min para recoger todo el líquido en la parte inferior. Ponga la PCR-placa de nuevo al dispositivo de sujeción y fijar el dispositivo con tornillos.
- Colocar eldispositivo de sujeción segura en el baño de arena precalentado y se incuba durante 90 minutos a 121 ° C.
- Retire el dispositivo de sujeción del baño de arena y dejar que se enfríe a temperatura ambiente.
- Quitar los tornillos y girar de nuevo en una centrífuga a 2000 xg durante 2 min con el fin de recoger todo el condensado en la parte inferior de los pocillos y para evitar la contaminación cruzada durante la retirada de la estera de tapa.
- Añadir una solución de amoniaco 3,2% para ajustar el pH a aprox. 8 utilizando una pipeta de 12 canales de 200 l. Cubrir la placa de PCR con una estera tapa de TPE y agitar manualmente mediante el dispositivo de sujeción.
- Después de la neutralización centrifugar la PCR-placa a 2.000 xg durante 2 min.
- Tome una nueva PCR-placa y la transferencia de 20 l de gel filtrado con una pipeta de 12 l-canal 50.
- De alto rendimiento-1-fenil-3-metil-5-pirazolona (HT-PMP) -derivatization de los hidratos de carbono (Grupo 7 en la figura 1)
- Transferencia de 25 l de hidrolizado neutralizado en una PCR-placa fresca utilizando una pipeta de 12 canales de 50 l.
Nota: Después de tomar la alícuota, comprobar el neutrzación del líquido que queda en la placa de hidrólisis a través de la adición de 12,5 l de fenol indicador rojo (0,05 g de rojo de fenol en 5 ml de etanol 20%) con una pipeta 1,25 ml de múltiples pasos. Todos los pozos que no se conviertan en color rosado (pH 8) no se derivatizan correctamente. - Añadir 75 l de reactivo de derivatización de mezcla (125 mg PMP, 7 ml de metanol, 3,06 ml ddH2O, y 438 l solución de amonio 3,2%) y cubrir el plato con una estera tapa de TPE.
- Después de sacudir la PCR-placa en la centrífuga dispositivo de sujeción de la placa a 2000 xg durante 2 min a acumulan todo el líquido en la parte inferior.
- Por lugar derivatización la PCR-placa en una PCR-ciclador a 70 ° C durante 100 minutos, seguido de enfriamiento a 20 ° C.
- Transferir una alícuota de 20 l en un nuevo PMP utilizando una pipeta de 12 canales de 50 l. A continuación, utilice una pipeta de 12 canales de 200 l y añadir 130 l 19.23 mM de ácido acético (ácido acético 0,962 ml 1 M + 49.038 ml ddH2O) para cada línea. Mezclar directamente a través de aspiratción y dispensación (mínimo seis veces) y transferir todo el líquido a una placa de filtro de 0,2 micras con una placa colectora MTP.
- Se centrifuga la placa (1.000 xg durante 5 min), retire la placa de filtro, sellar la MTP con una estera tapa de silicona y colocar el MTP en el UHPLC-UV-ESI-MS para la determinación de la huella digital de hidratos de carbono 14.
- Transferencia de 25 l de hidrolizado neutralizado en una PCR-placa fresca utilizando una pipeta de 12 canales de 50 l.
- Preparación de la glucosa-ensayo
- Realizar una dilución 1:10 a través de la adición de 45 l de ddH2O y 5 l de hidrolizado neutralizado utilizando una pipeta de l 12 canales 50 y cubrir las placas MTP con una estera de tapa de silicona. Añadir tres veces 50 l de diferentes estándares de glucosa (500, 250, 100, 50, 25, 10, 5, 2,5 y 0 M) a un nuevo MTP utilizado para la calibración.
- Añadir 50 l de glucosa-ensayo reactivo-mix (step1.2.3 receta) usando una pipeta de 12 l canal 50. A continuación, cubrir las placas con una estera de tapa de silicio y se incuba a 30 ° C y 400 rpm durante 30 min en un MTP-incubadora.
- Inmediatamente después de la incubación hacer una lectura de absorbancia en un lector en MTP-418 y 480 nm en un MTP-lector. Para el cálculo de la concentración de glucosa realizar una calibración lineal tal como se realizó en el paso 2.6.4.
- Preparación de la piruvato-ensayo
- Realizar una dilución 1:20 utilizando una pipeta de 12 canales de 200 l. Añadir 95 l de ddH2O y de transferencia de 5 l de hidrolizado neutralizado a cada pocillo. Cubrir la MTP con una estera tapa de silicona.
- Añadir 100 l de piruvato-ensayo reactivo-mix (3 ml 1 mM N - (carboximetilamino-carbonil) -4.4'-bis (dimetilamino) difenilamina sal de sodio (DA-64), 300 l 10 mM de pirofosfato de tiamina, 60 l 100 mM de cloruro de magnesio hexahidratado, 2,4 ml de 500 mM de fosfato de potasio soplador (pH 5,7), 30 l de 100 U piruvato oxidasa, 12 l 1.000 U de peroxidasa de rábano y 24.19 ml ddH2O) usando una pipeta de 12 canales de 200 l.
- Se cubren las placas con una tapa de silicio Mat And incubar a 37 ° C y 150 rpm durante 30 min. Directamente después de la absorbancia medida de incubación en un MTP-lector a 727 y 540 nm.
- La evaluación de todos los resultados de la selección automatizados y los hidratos de carbono Las huellas dactilares.
- Tomar nota de aquellas muestras que muestran una disminución de la sedimentación después de que las placas de cultivo principales han sido centrifugada y se almacena de nuevo al carrusel (etapa de control de la viscosidad 1.4.1). Las muestras que no muestran la formación de gránulos son positivos (criterio 1 para la detección automatizada).
- Tomar nota de sobrenadantes de alta viscosidad, que se indican por los residuos en la placa de filtro después de la etapa de filtración (paso de control de alta viscosidad 1.5.4.6). A falta de filtrado puede conducir a un resultado falso negativo en los siguientes módulos analíticos. Las muestras que mantienen sobrenadantes de cultivos en el filtro de pozos son positivos (también criterio 1 para la detección automatizada).
- observar visualmente la formación de fibras o de copos después de la incubación. Tomar notas como THes decir indica polisacáridos. Valorar sin precipitación con (-); baja precipitación de fibras o copos con (+) y alta precipitación con (++). Por otra parte, detectar la adsorción del polímero sobre la membrana de filtro a través de la observación de las fibras y copos en el primero, pero no en la segunda precipitación (criterio 2 para el cribado automatizado).
- Realice una calibración lineal para el cálculo de la concentración de glucosa.
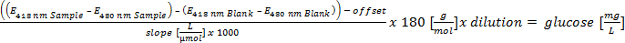
Haga clic aquí para ver una versión más grande de esta ecuación. - Realice la calibración lineal (absorción a través de la concentración) entre 5-0,1 g / l de glucosa. Cálculo de la glucosa equivalente de los polímeros hidrolizados y evaluar por los siguientes parámetros: glucosa equivalente:> 700 mg / L = positivo; 300-700 mg / L = putativo positivo; <300 mg / L = negativo en relación de formato EPSión (criterio 3 para la detección automatizada).
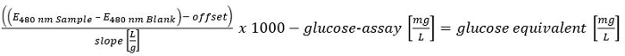
Haga clic aquí para ver una versión más grande de esta ecuación. - Cuantificar todos los carbohidratos determinados con el método HT-PMP. Resumiendo todas las cantidades y evaluar de la siguiente manera:> 300 mg / L (positivo); 150-300 mg / L (putativo positivo) y <150 mg / L (negativo).
- Para el cálculo de la concentración de piruvato realizar una calibración lineal (100, 50, 25, 10, 5, 2,5, 1, 0,5 y 0 M). Para excluir la piruvato restante en el sobrenadante, corregir el contenido de piruvato después de la hidrólisis por medio del contenido de piruvato antes de la hidrólisis.
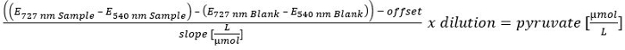
Haga clic aquí para ver una versión más grande de este Ecuation.
Resultados
La validación del método de fenol-ácido sulfúrico mostró buenos resultados con un coeficiente de determinación (r²) de 0,9998 (Tabla 2). Para el 5 g / concentración de L el coeficiente de variación (CV) y la exactitud mostró un buen rendimiento con 1,8% y error 2,2%, pero el rendimiento inferior para el L estándar 0,25 g / con 5,3% (CV) y error 6,1% ( Parcialidad).
Los coeficientes de determinación de ambas curvas de calibración de piruvato-ensayo (con y sin matriz) fueron> 0,9999 en un intervalo de calibración de 150 mu M (Tabla 3). Los coeficientes de variación (CV) para el nivel de calibración alto y más bajo fueron <4,6% y la exactitud mostraron un muy buen rendimiento en el rango de calibración completa con error de menos de 3,9%. Por lo tanto, la matriz de la etapa de hidrólisis no mostró ninguna influencia en el ensayo enzimático, que es por lo tanto capaz de measure piruvato antes y después de la hidrólisis.
La Tabla 4 muestra los resultados detallados de tres nuevas cepas ejemplares como identificadas con éxito con la plataforma de cribado. La parte izquierda de la tabla muestra los resultados de los módulos de detección automatizados relativos a la formación de viscosidad, la producción de polímero y el equivalente de glucosa de la hidrólisis total de los cuales fueron utilizados como parámetros de evaluación para el análisis detallado de hidratos de carbono de huellas dactilares. La huella digital de hidratos de carbono a base de azúcares calibrados, así como azúcares desconocidos, dímeros y sustituyentes se han dado en la parte derecha de la tabla. Mediante el uso de esta información, la composición monomérica puede ser calculada y comparada con estructuras de polímero ya conocidos. Por otra parte, una proyección específica para las composiciones monoméricas interesantes y carbohidratos raros se puede realizar.
El alto rendimiento de la microhidrólisis escala y el HT-PMP-derivatización se demostraron en nuestro trabajo previo 14. Además, la validación de la filtración en gel y la huella digital de hidratos de carbono para diferentes géneros se han descrito en otra publicación 6. En suma, la plataforma de cribado con su estructura modular puede ser fácilmente modificada y adaptada a las necesidades individuales del usuario. El cribado automatizado de la plataforma permite que un ocho veces más alto rendimiento y da resultados fiables. módulos analíticos novedosos como el piruvato-ensayo pueden ser integrados y en combinación con el análisis de carbohidratos de huellas digitales que proporcionan información detallada acerca de las EPS identificados. De esta manera, la plataforma de cribado es esencial en la búsqueda de las dos variantes de BPA ligeramente modificados y completamente novedosos.
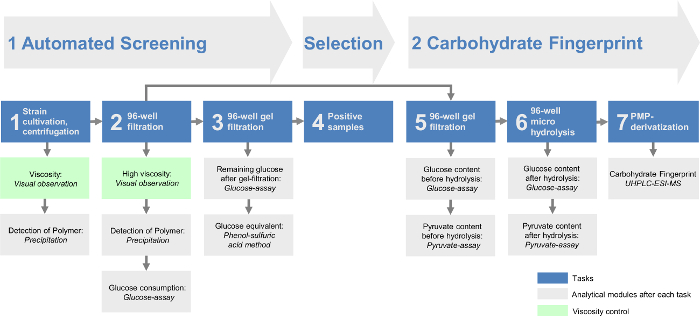
Figura 1: Esquema general del h modularIGH rendimiento plataforma de cribado de exopolisacáridos. La detección automatizada incluye las tres primeras tareas. Después las bacterias se cultivan en placas de 96 pocillos, las células se separan por centrifugación (tarea 1) y una filtración de 96 pocillos (tarea 2). Luego, el resto de los azúcares monoméricos de los medios de crecimiento se eliminan a través de una filtración en gel de 96 pocillos (tarea 3). Los EPS que contienen las muestras se evalúan en la tarea 4. La huella digital de carbohidratos de la plataforma de cribado contiene los últimos tres tareas. El filtrado restante de los éxitos positivos de tarea 2 proporciona la base para el gel-filtrado en la tarea 5. Después de hidrolización en la tarea 6 la huella digital de hidratos de carbono puede ser analizada mediante el método HT-PMP (alto rendimiento de 1-fenil-3-metil -5-pirazolona, la tarea 7). Todas las tareas son seguidas por diferentes módulos analíticos y / o un control de la viscosidad. Haga clic aquí para ver una versión más grande de esta figura.
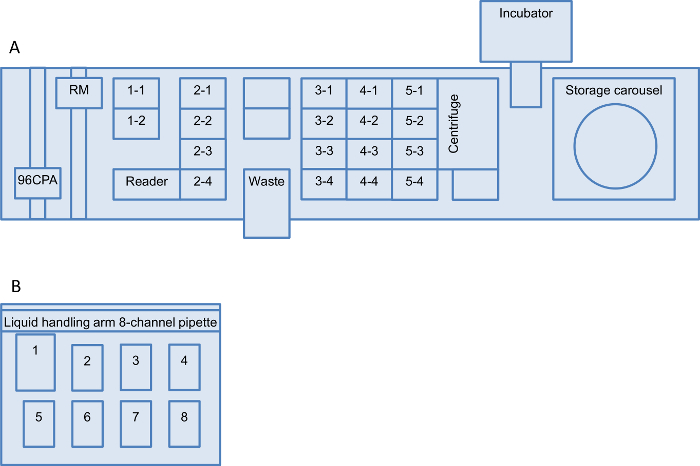
Figura 2: Configuración de la mesa de trabajo del robot para la plataforma de cribado Diseños de ambas mesas de trabajo del robot de manejo de líquidos se muestran:. (A) Sistema de tratamiento de líquidos robótico y la estación de manipulación (B) líquido. (A) La configuración consiste en un portador de microplacas con dos posiciones (posiciones 1-1 a 1-2), un soporte para puntas desechables con cuatro posiciones (posiciones 2-1 a 2-4) y tres soportes para microplacas con cuatro posiciones de cada uno (posiciones 3-1 a 3-4, 4-1 a 4-4 y 5-1 a 5-4). Además, hay un carrusel de almacenamiento con cinco portadores de hoteles (1 a 5), cada uno de los siete platos hondos pozos (DWP) y cuatro portadores de hoteles (6-9) cada una para 21 micro-titulación de placas. El hardware instalado en el robot de manejo de líquidos es un 96-canal-pipeta-brazo para su uso con puntas desechables y un manipulador robótico (RM) que se mueve placas / equipos entrn la mesa de trabajo, el carrusel de almacenamiento, el MTP-lector, la centrífuga y la incubadora de agitación. (B) La estación de tratamiento de líquidos está equipado con un brazo de manipulación de líquidos y un 8-canal de pipeta 300 l, un contenedor de residuos en la posición 1, un adaptador de punta con 300 consejos mu l (posición 2), un adaptador de altura 30 con unos 250 ml artesa (posición 3) y cinco altura adaptador 60 para MTP (posición 4 a 8). La numeración de las posiciones se hace referencia a lo largo de este protocolo. Mesas de trabajo alternativos también pueden ser utilizados si hay configuraciones equivalentes disponibles. Por favor, haga clic aquí para ver una versión más grande de esta figura.
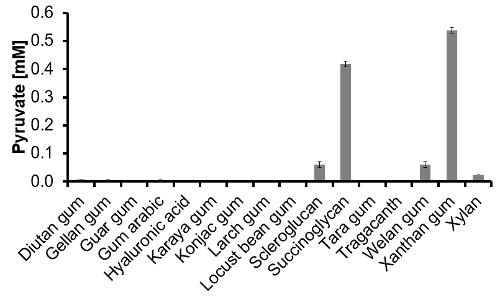
Figura 3: El contenido de piruvato de 16 polímeros disponibles comercialmente determinados a través de piruvato-ensayo. Después de la solución de polímero 1 g / Ls se hidrolizaron y neutralizaron, el piruvato-ensayo se realizó a partir de una dilución 1:10 (n = 3). Haga clic aquí para ver una versión más grande de esta figura.
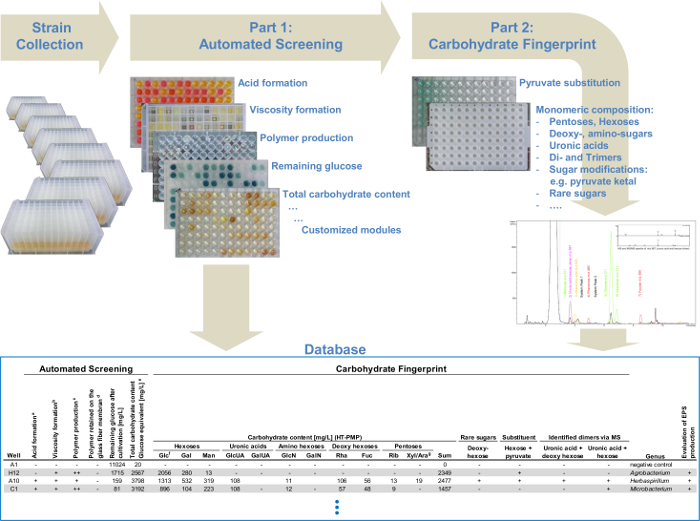
Figura 4: Diagrama de flujo de la plataforma de cribado de alto rendimiento modular. El sistema automatizado de detección, que combina diferentes módulos de detección de polisacárido: análisis de la formación de la viscosidad, la producción de polímeros y la determinación del contenido total de hidratos de carbono. La segunda parte ofrece un análisis detallado de monosacáridos para todos los productores de EPS seleccionados identificados en la primera parte. Todos los datos de la detección automatizada y los datos de la huella digital de hidratos de carbono a través de UHPLC-ESI-MS se recogen en una base de datos y permiten la sencilla identificación de variantes estructuralmente relacionados de ALReady conocido EPS o EPS novedosos y, por tanto, una proyección específica. Por favor, haga clic aquí para ver una versión más grande de esta figura.
| Paso principal del módulo / Analítica | Flujo de Trabajo | Observación / Descripción |
| El cultivo de las cepas | 1 ml de una EPS-medio Pre-cultivo de 48 horas, 30 ° C, 1.000 rpm una Principal-cultivo de 48 horas, 30 ° C, 1.000 rpm una | Producción de EPS |
| la eliminación de células / viscosidad | Centrifugación: 30 min a 4.300 xg | No pellet = aumento de la viscosidad = positivo |
| La detección de Polymer: Precipitación | 50 l Dopernatant + 150 l 2-propanol b Agitando 10 minutos a temperatura ambiente y 900 rpm b | Visuales: Fibras y copos = precipitación positiva de polímero |
| la eliminación de células / alta viscosidad | 180 l de sobrenadante de cultivo principal Centrifugación: 10 min a 3.000 xg 1,0 micras membrana de fibra de vidrio | No se pasa el filtro de alta viscosidad = = positivo |
| La detección de Polymer: Precipitación | 50 l filtrado + 150 l 2-propanol b Agitando 10 minutos a temperatura ambiente y 900 rpm b | Visuales: Fibras y copos = precipitación positiva de polímero |
| El consumo de glucosa: La glucosa-ensayo | Dilución 1: 100: 10 l filtrado + 990 l de ddH2O 50 l alícuota de 50 l + reagent-mix La incubación de 30 min a 30 ° C 150 rpm Medición de 418-480 nm | Restante de la glucosa después del cultivo |
| Filtración en gel | Equilibrio: 3 x 150 l NH 4 -acetat tampón de pH 5,6 2 x 2 min a 2.000 xg 1 x 2 min a 1.000 xg Filtración en gel: 35 filtrado l, 2 min a 1.000 xg Lavado: 3 x 150 ml ddH2O, 2 min a 2.000 xg 75 l 20% de etanol para el almacenamiento | purificación Polymer: La eliminación de sales, glucosa, piruvato y otros monómeros de azúcar a partir de sobrenadante de cultivo |
| Restante de la glucosa después de filtración en gel La glucosa-ensayo | Dilución 1:10: 25 l ddH 2 O + 20 l ddH 2 O y 5 l filtrado + 50 l de reactivo-mix incubación de 30 min a 30 ° C, 150 rpm Medición de 418-480 nm | La resta de la glucosa restante después de filtración en gel a partir del método de fenol-ácido sulfúrico |
| equivalentes de glucosa: Método de fenol-ácido sulfúrico-c | 20 l de gel filtrado + 180 l de fenol-ácido sulfúrico (30 l 5% (w v) de fenol / en ddH 2 O + 150 l conc. H 2 SO 4 (ρ = 1,84 g / ml)) Sacudiendo 5 min a 900 rpm La incubación 35 min a 80 ° C Medición a 480 nm | equivalentes de glucosa: Δ (valor de fenol-ácido sulfúrico - glucosa que queda después de filtración en gel) <300 mg / L negativo > 300 y <700 mg / L putativo positivo > 700 mg / L positivo |
| una manejado manualmente en condiciones estériles (flujo laminar). | ||
| Líquido inflamable b manejado manualmente bajo una campana de humos. | ||
| c fenol-ácido sulfúrico-manejado con Marca de manejo de líquidos estación (LHS) bajo una campana de humos. | ||
Tabla 1:. Flujo de trabajo completo de la preselección automatizado con el sistema de tratamiento de líquidos robótico y la estación de tratamiento de líquidos Descripción general de todos los parámetros de los módulos de análisis automatizados.
| linealidad | LOD | LOQ | ||
| r² una | pendiente de una | compensar una | mg / L | mg / L |
| 0,9998 | 0.0007 | -0.021 | 50 | 100 |
| Estándar | b Media | b precisión | b exactitud | |
| mg / L | mg / L | CV% | Sesgo (error%) | |
| 5,000 | 5,112 | 1.8 | 2.2 | |
| 250 | 265 | 5.3 | 6.1 | |
| una media de ocho mediciones, calibración con seis niveles de glucosa de 0,1 a 5 g / L | ||||
| b Realizado con la prueba t de Student (α = 0,05; n = 8). | ||||
| LDD: límite de determinación, LDC: Límite de cuantificación: CV: coeficiente de variación. | ||||
Tabla 2:Validación del método de fenol-ácido sulfúrico se llevó a cabo con la estación de tratamiento de líquidos. La linealidad se calculó basándose en una calibración de seis puntos (n = 8). Mean, precisión y exactitud de dos concentraciones de glucosa a modo de ejemplo elegido se dan aquí.
| linealidad | LOQ | |||
| r² una | pendiente de una | compensar una | M | |
| sin matriz | 0.99999 | 0,0223 | -0,0019 | 1 |
| 01:10 matriz diluida | 0.99999 | 0,0221 | -0,0011 | 1 |
| Estándar | b Media | b precisión | b exactitud | |
| M | M | CV% | Sesgo (error%) | |
| sin matriz | 50 | 49.96 | 3.05 | -0.09 |
| 1 | 1.04 | 2.95 | 3.86 | |
| 01:10 matriz diluida | 50 | 49.98 | 0.44 | -0.04 |
| 1 | 1.00 | 4.58 | 0.33 | |
| una media de tres mediciones, calibración con seis concentraciones de piruvato a partir de 1 a 50 mM. | ||||
| b (n = 3) | ||||
| LDC: Límite de cuantificación: CV: coeficiente de variación. | ||||
Tabla 3:. Validación de la piruvato-ensayo con y sin un trifluoroacético-ácido-matriz neutralizado 1:10 diluido dos calibraciones de seis puntos (n = 3) con y sin se realizaron la evaluación de influencias de la matriz. Mean, precisión y exactitud de dos concentraciones de piruvato a modo de ejemplo elegidos con y sin efectos de una dilución 1:10 se calcularon.

Tabla 4:.. Los resultados de tres cepas ejemplares examinados con la plataforma de datos recogidos de la proyección automatizada y la huella digital de carbohidratos Por favor, clamer aquí para descargar la tabla como un archivo de Microsoft Excel.
| Carbohidrato | Absorción máx [nm] | La absorción a 480 nm media ± desviación estándar | Relativa absorbancia a la glucosa [%] | |
| goma de diutano | 470 | 0,342 | ± 0,010 | 187 |
| Goma gellan | 472 | 0,334 | ± 0,002 | 183 |
| Goma de guar | 478 | 0,387 | ± 0,017 | 212 |
| Gummi árabe | 476 | 0,393 | ± 0,034 | 215 |
| Ácido hialurónico | 484 | 0,231 | ± 0,011 | 126 |
| goma karaya | 478 | 0,455 | ± 0,023 | 249 |
| goma de Konjac | 480 | 0,297 | ± 0,009 | 163 |
| goma de alerce | 480 | 0,337 | ± 0,032 | 185 |
| goma de algarrobo | 478 | 0,354 | ± 0,033 | 194 |
| escleroglucano | 484 | 0,168 | ± 0,010 | 92 |
| succinoglicano | 482 | 0,168 | ± 0,005 | 92 |
| La goma de tara | 480 | 0,318 | ± 0,016 | 174 |
| tragacanto | 478 | 0,513 | ± 0,003 | 281 |
| goma welan | 472 | 0,226 | ± 0,016 | 124 |
| xilano | 472 | 0,567 | ± 0,007 | 311 |
| La goma de xantano | 482 | 0,245 | ± 0,021 | 134 |
| Glucosa | 484 | 0,191 | ± 0,014 | 100 |
| SD: desviación estándar | ||||
Tabla 5:. Resultados tal como se obtiene por el método de fenol-ácido sulfúrico durante 16 polímeros y glucosa disponibles en el comercio El máximo de absorción y la absorción a 480 nm de 16 polímeros disponibles en el mercado (1 g / l), así como la glucosa (1 g / L ) se midieron aplicando el método de fenol-ácido sulfúrico. Se calculó la absorbancia relativa a la glucosa de todos los polímeros.
| Estándar | Media a | la precisión de una | la exactitud de una | |
| mg / L | mg / L | CV% | Sesgo (error%) | |
| dilución 1:10 | 450 | 460 | 1.01 | 2.14 |
| 45 | 44.7 | 1.41 | -0.70 | |
| Dilución 100: 1 | 4.500 | 5,026 | 1.19 | 11.6 |
| 450 | 471 | 1.16 | 4.55 | |
| b Realizado con la prueba t de Student (α = 0,05; n = 8). | ||||
| CV: coeficiente de variación. | ||||
Tabla 6:. Validación de la dilución automatizado para la glucosa-ensayo La dilución para la glucosa-ensayo después del cultivo (1: 100) y después de filtración en gel (1:10) fueron validados. Dos concentraciones de glucosa (n = 8) se diluyeron a través del sistema de manejo de líquidos y evaluados. Media, la precisión y la exactitud se calcularon.
| Valor teórico de la glucosa | Revestida con tejido de tapa de silicona | Prueba de evaporación (descubierto) | |||||
| la media de una | la precisión de una | la exactitud de una | la media de una | la precisión de una | La exactitud de un </ Strong> | Evaporación | |
| mg / L | mg / L | CV % | Sesgo (error%) | mg / L | CV % | Sesgo (error%) | %error |
| 45.0 | 45.2 | 0.69 | 0.44 | 46.0 | 0.66 | 2.05 | 1.60 |
| 18.0 | 17.7 | 0.80 | -1.68 | 18.0 | 0,72 | -0.01 | 1.69 |
| 9.0 | 8.74 | 1.20 | -2.98 | 8.92 | 0,81 | -0.95 | 2.09 |
| 4.5 | 4.50 | 1.26 | -0.04 | 4.58 | 1.57 | 1.76 | 1.80 |
| 1.8 | 1.85 | 0.74 | 2.90 | 2.01 | 2.82 | 11.6 | 8.48 |
| 0,9 | 1.03 | 1.43 | 14.1 | 1.16 | 3.52 | 28.3 | 12.4 |
| un (n = 4) | |||||||
| CV: coeficiente de variación. | |||||||
Tabla 7:. Evaluación del efecto de la evaporación de los estándares de glucosa en diferentes MTP seis cubiertas y descubiertas (n = 4) se almacena en el carrusel durante 3,5 horas a temperatura ambiente. El efecto de la evaporación se evaluó mediante el uso de no cubierto, así como cubierta (mat de silicio) muestras estándar. Mean, la precisión, la exactitud y la evaporación en error% se calcularon.
Antes de filtración en gel| Después de filtración en gel | Restante de la glucosa después de filtración en gel | ||||
| la media de una | SD una | la media de una | SD una | ||
| mg / L | mg / L | mg / L | mg / L | % | |
| 1 | 8.647 | 110 | 259 | 121 | 3.00 |
| 2 | 5.108 | 56 | 116 | 37 | 2.27 |
| 3 | 2.014 | 12 | 50.8 | 14 | 2.52 |
| 4 | 1,015 | 12 | 25.1 | 8.1 | 2.47 |
| 5 | 510 | 4.9 | 12.8 | 4.3 | 2.51 |
| 6 | 223 | 8.6 | 6.6 | 15 | 2.94 |
| 7 | 122 | 5.6 | 4.3 | 0,9 | 3.48 |
| 8 | 75 | 6.0 | 3.1 | 0,3 | 4.18 |
| un (n = 8) | |||||
| SD: desviación estándar | |||||
Tabla 8:. Los resultados de la eficiencia de filtración en gel ocho patrones de glucosa diferentes se determinaron antes y después de filtración en gel para evaluar la eficiencia de la filtración en gel. Media, desviación estándar y la glucosa restante después se calcularon de filtración en gel en%.
Discusión
Detección de polisacárido con el método de fenol-ácido sulfúrico-: Diferentes monosacáridos muestran diferentes máximos de absorción y coeficientes de extinción molar por el uso de este método 9. Esto da lugar a diferentes máximos de absorción de los polímeros, que contienen varios azúcares en cantidades diferentes. Las diferentes longitudes de onda de absorción máxima para 16 polímeros disponibles en el mercado diferentes se dan en la Tabla 5. Los polímeros se disolvieron (1 g / L) en ddH 2 O, se agitó (150 rpm) durante la noche y se mide con el fenol-ácido sulfúrico-método . goma Diutan mostró los máximos de absorción más baja a 470 nm y ácido hialurónico escleroglucano y la más alta en 484 nm. Basándose en estos resultados 480 nm fue elegido para esta plataforma de cribado. La absorbancia relativa de los polímeros se calculó basándose en la absorbancia obtenida con 1 g / l de glucosa (establecido como 100%). Los resultados más bajos se obtuvieron con escleroglucano y succinoglicano, ambos con 92%. Este fue expreflejada porque escleroglucano solamente contiene glucosa y succinoglicano contiene glucosa y galactosa en una proporción de 7: 1. Ambos polímeros comerciales tienen diferentes pérdidas de secado y diferentes contenidos de cenizas, esta es la razón por la cual no se alcanzó el valor teórico de ~ 110%. Xylan mostró la absorbancia relativa más alta con 311%. La razón de esto es el alto coeficiente de extinción molar logrado a partir de xilosa debido a la forma de furanosa más dominante. A un nivel de 0,1 g / L de glucosa se alcanza el límite de cuantificación, así como el límite de detección a una concentración <0,05 g / L. Sin embargo, el límite de detección para las cepas positivas en la proyección es mayor que 0,7 g / L y por lo tanto, el ensayo mostró un buen rendimiento. Con el fin de conseguir resultados fiables, la glucosa restante después de filtración en gel se determinó con un ensayo de glucosa-y este valor se resta del valor a partir del método de fenol-ácido sulfúrico.
dilución de la glucosa-Ensayo automatizado: El desempeñode la determinación de glucosa después del cultivo (dilución 1: 100) se investigó. Para esto, 10 l de sobrenadante fueron transferidos a 990 l de ddH 2 O en una placa de pozo profundo y se mezclan a través de diez veces aspiración y dispensación 180 l de esta dilución. El segundo paso crítico fue el pipeteado correcto de solamente 5 alícuota l de la dilución 1:10 de la glucosa-ensayo después de filtración en gel. Con el fin de generar el l de dilución 25 de ddH 2 O fueron transferidos con una l-punta 50 primero, después 20 l de ddH 2 O y 5 l de gel filtrado fueron aspirados juntos. Esto asegura una mejor eliminación de la alícuota de 5 l de la punta. Ambos pasos de dilución fueron verificadas con varios estándares de glucosa a través de una glucosa-ensayo. Los resultados para dos concentraciones ejemplares se dan en la Tabla 6 El 1:. Dilución 100 para la determinación del contenido de glucosa después del cultivo mostró una alta precisión para los estándares con un CV & #60; 1,2%. Al mismo tiempo, la precisión de la norma más alta fue de hasta 11,6 (error%). Sin embargo, esto es insignificante como la determinación de la glucosa representa sólo el contenido de glucosa restante después del cultivo y, por tanto, no es importante para la detección del polímero. La dilución 1:10 de la glucosa que queda después de filtración en gel mostró resultados muy fiables con un CV <1,4% y una precisión <2,1% de error.
La consideración de la evaporación: El cribado requiere 3,5 hr de la primera etapa a la primera glucosa-ensayo. Con el fin de averiguar, si este marco de tiempo tiene una influencia en el almacenamiento MTP sin tapar, 50 l de estándares de calibración de glucosa-ensayo fueron almacenados con y sin tapa durante 3,5 horas en el carrusel de robot. En el rango de calibración (45 a 4,5 mg / L) la concentración de la muestra apenas aumentó. Un aumento - causado por la evaporación - estaba por debajo de 2,1% y sólo para las dos concentraciones más bajas (1,8 y 0,9 mg / L) que alcanza hasta el 12,4% ( Tabla 7).
Filtración en gel: Las altas cantidades de glucosa no metabolizada perturban la detección cuantitativa de la glucosa a partir del polímero hidrolizado. Por lo tanto, se requiere una etapa de filtración en gel para eliminar la glucosa restante después del cultivo. Además, el gel-filtración purifica el polímero que contiene sobrenadante de sales y compuestos de hidratos de carbono monoméricos, otros que la glucosa, para minimizar el fondo analítico en el análisis de monómero. En la etapa de filtración en gel se colocaron 35 l de filtrado en el centro del pozo. Para la validación de la robustez de filtración en gel en el sistema automatizado, se filtraron ocho patrones de calibración de 0,045 hasta 9 g / L de glucosa (n = 8). La glucosa de cada concentración siempre se redujo en más de un 95% del valor inicial (Tabla 8). De este modo, la filtración en gel mostró muy buenos resultados para varias concentraciones de glucosa. Además, la glucosa restante después de gel-filtration También se determinó con un ensayo de glucosa y se resta de la determinación de fenol-ácido sulfúrico para recibir la cantidad correcta de glucosa equivalente para el polímero hidrolizado.
El piruvato-ensayo: En primer lugar, se investigó si la (1:10) TFA-matriz neutralizado y diluido a partir de la etapa de hidrólisis interfiere con la reacción enzimática. Por lo tanto, el ensayo completo se realizó dos veces, una vez con y otra vez sin matriz y mostró resultados fiables. Finalmente, el contenido de piruvato de 16 polímeros disponibles comercialmente se midió con éxito y se representa en la Figura 3. Se sabe en general que, de esos 16 polímeros solamente succinoglicano y xantana contienen de forma natural piruvato. Con nuestro piruvato-ensayo tanto de estos polímeros fueron correctamente identificados. En escleroglucano, goma welan y piruvato xilano también se detectó en cantidades significativas. En general, la capacidad del enfoque fue validado y la piruvato-ensayo showed un alto rendimiento. Se demostró que es capaz de detectar piruvato en diferentes polímeros después de la hidrólisis.
huella digital de hidratos de carbono: Después de realizar todos los módulos de análisis en la detección automatizada, se seleccionaron los productores potenciales de BPA para el análisis de carbohidratos de huellas digitales. Para esto, se aplicaron varios criterios: 1) la observación positiva de la viscosidad después de la centrifugación y / o después de la filtración. 2) Precipitación antes y después de la filtración. fibras observadas y las escamas se evaluaron como positiva. 3) El valor equivalente de la glucosa a partir del método de fenol-ácido sulfúrico. Valores> 700 mg / L se calificaron como positivo y los valores entre 300 y 700 mg / L fueron calificados como productores EPS putativos. Cuando se evaluaron dos o tres criterios como positivos, se seleccionaron las cepas para análisis de huella digital de hidratos de carbono. Los criterios pueden ser personalizados hacia el objetivo individual de la proyección EPS (por ejemplo, EPS de baja viscosidad). Nuestro enfoque dirigido a la búsqueda de efficient EPS productores. Durante la búsqueda de cepas que sólo producen pequeñas cantidades de EPS del límite de evaluación de la glucosa equivalente debe ser reducida.
beneficio técnico y aplicaciones futuras: Una característica interesante de este protocolo es el carácter modular de los pasos y los diferentes módulos analíticos. Se pueden combinar de diferentes maneras, ajustado a las necesidades individuales y nuevos módulos pueden implementarse fácilmente. Además, los módulos de análisis se pueden utilizar por separado, por ejemplo, el módulo de hidrólisis en combinación con el módulo de HT-PMP-derivatización es capaz de realizar un análisis de la composición monomérica de diferentes soluciones de polímero (1 g / l) en formato de 96 pocillos. Para los laboratorios sin tener acceso a un sistema de tratamiento de líquidos de la proyección completo pueda ser manipulado manualmente sin ningún cambio en el esquema de pipeteo. Sin embargo, usando un sistema de manejo de líquidos aumenta el rendimiento de hasta 768 cepas (en lugar de 192 cepas si Screened manualmente) por día. El protocolo que se describe aquí es capaz de una detección de diferentes géneros y, por lo tanto, para el cribado de grandes colecciones de cepas para identificar nuevos productores EPS y analizar su huella digital de hidratos de carbono en un enfoque (Figura 4). Por otra parte, una proyección dirigida para polisacáridos que contienen azúcares raras como fucosa, ácidos urónicos o incluso azúcares desconocidos se puede realizar a través del análisis de monosacárido detallada. Además, diferentes combinaciones de azúcar en proporciones definidas pueden ser detectados. Esto permite la sencilla identificación de variantes estructuralmente relacionados de EPS ya conocidos o nuevos EPS.
Divulgaciones
We have nothing to disclose.
Agradecimientos
We sincerely thank Thomas Howe and Jörg Carsten for the programming and technical support with the liquid handling systems.
Materiales
| Name | Company | Catalog Number | Comments |
| 96 well deep well plate 2.0 ml (DWP) | Greiner Bio-One | 780271 | Main-culture (CP 1-1 to 1-4), equilibration plates for gel-filtration (CP 1-6, 1-7, 2-6 and 2-7), 1:100 dilution for the glucose assay (CP 4-1 to 4-4) containing 990 µl of ddH2O |
| Breathable Sealing Film | Axygen | BF-400-S | Incubation film for pre- and main-culture DWP |
| Aluminum Sealing Film | Axygen | PCR-AS-200 | -80 °C storage film for glycerol-stock plates |
| MCA96 Nested Disposable Tips 200 µl | TECAN | 30038619 | Worktable position (WTP 2-1 to 2-4) |
| A/B glass-filter-plate 1 µm | Pall Corporation | PN 8031 | Stored on collector plate (CP 2-1 to 2-4) |
| 96-well micro titer plate V-Bottom | Greiner Bio-One | 651201 | Collector plate for filtration plate (CP 2-1 to 2-4) |
| 96-well SpinColumn G-25 | Harvard Apparatus | 74-5612 | Stored on washing DWP (CP 1-6, 1-7, 2-6 and 2-7) |
| 96-well micro titer plate V-Bottom | Nunc | 249944 | Collector plate for gel-filtration plate (CP 3-1 to 3-4) |
| Nested Disposable Tips SBS 50 µl tips | TECAN | 30038609 | Carousel position (CP 4-6, 4-7 and 5-1 to 5-6) |
| Trough 250 ml | Axygen | Res-SW96-HP | Water WTP 1-1, Glucose assay reagent-mix WPT 1-2, ammonium-acetate buffer pH 5.6 (CP 5-7) |
| 96-well micro titer plate F-Bottom (MTP) | Greiner Bio-One | 655101 | precipitation 1 (CP 6-1 to 6-4), pH-value (CP 7-1 to 7-4), precipitation 2 (CP 8-1 to 8-4), phenol-sulfuric-acid method (CP 8-5 to 8-8), glucose-assay (CP 9-1 to 9-9), dummy plates (WTP 3-1, 3-2) |
| 96-well silicon cap mat | Whatmann | 7704-0105 | Cover mat for MTP |
| 200 µl pipette tips | Sarstedt | 70.760.002 | For manually handling |
| 1,000 µl pipette tips | Sarstedt | 70.762 | For manually handling |
| 96-well-PCR micro titer plate | Brand | 781350 | Hydrolysis, PMP-derivatisation |
| TPE (thermoplastic elastomer) cap mat | Brand | 781405 | Hydrolysis, PMP-derivatisation |
| Filter plate 0.2 µm Supor | Pall Corporation | PN 8019 | Filtration of samples for UHPLC-ESI-MS analysis with a MTP collector plate |
| Pipette Tips LHS 5-300 µl | Brand | 732150 | Brand LHS system |
| Glucose oxidase | Sigma-Aldrich | G2133 | Glucose-assay |
| Horseradish peroxidase | Sigma-Aldrich | P6782 | Glucose-assay, pyruvat-assay |
| DA-64 (N-(Carboxymethylaminocarbonyl)-4.4'-bis(dimethylamino)-diphenylamine sodium salt) | Wako Chemicals GmbH | 043-22351 | Pyruvat-assay |
| Pyruvate oxidase | Sigma-Aldrich | P4591 | Pyruvat-assay |
| Potassium phosphate dibasic | Carl-Roth | P749.3 | Pyruvat- and glucose-assay |
| Potassium phosphate monobasic | Carl-Roth | 3904.3 | Pyruvat- and glucose-assay |
| Thiamine pyrophosphate | Sigma-Aldrich | C8754 | Pyruvat-assay |
| Magnesium chloride hexahydrate | Sigma-Aldrich | 31413 | Pyruvat-assay |
| 2-Propanol | VWR | 20922.466 | Precipitation |
| Phenol | VWR | 20599.231 | Phenol-sulfuric-acid method |
| Sulfuric acid | Carl-Roth | 4623.4 | Phenol-sulfuric-acid method |
| Trifluoroacetic acid | Sigma-Aldrich | T6508 | Hydrolysis |
| Ammonium solution | Carl-Roth | P093.1 | Hydrolysis, PMP-derivatization |
| Ethanol absolut | VWR | 20821.321 | Hydrolysis, PMP-derivatization |
| Phenol red | Alfa Aesar | B21710 | Hydrolysis, PMP-derivatization |
| 1-Phenyl-3-methyl-5-pyrazolone | Sigma-Aldrich | M70800 | PMP-derivatization |
| Methanol LC-MS | VWR | 83638.320 | PMP-derivatization |
| Acetonitril LC-MS | VWR | 83040.320 | PMP-derivatization |
| Acetic acid | Sigma-Aldrich | 338826 | PMP-derivatization |
| Ethanol absolut | VWR | 20821.321 | PMP-derivatization |
| Methyl red | Alfa Aesar | 36667 | pH-value |
| Robotic liquid handling system | Tecan | Freedom EVO | Worktable setup in Figure 2 |
| Liquid handling station LHS | Brand | 709400 | Worktable setup in Figure 2 |
| Tip-Adapter | Brand | 709434 | Worktable setup in Figure 2 |
| Liquid Ends MC 20-300 µl | Brand | 709416 | Worktable setup in Figure 2 |
| Adapter 60 mm | Brand | 709430 | Worktable setup in Figure 2 |
Referencias
- Milani, J., Maleki, G., Valdez, B. Ch. 2, Hydrocolloids in Food Industry. Food Industrial Processes - Methods and Equipment. 2, (2012).
- Thibodeau, A. Protecting the skin from environmental stresses with an exopolysaccharide formulation. Cosmet Toiletries. 120 (12), 81-90 (2005).
- Prajapati, V. D., Jani, G. K., Zala, B. S., Khutliwala, T. A. An insight into the emerging exopolysaccharide gellan gum as a novel polymer. Carbohydr Polym. 93 (2), 670-678 (2013).
- Schmidt, W., Brouwers, H. J. H., Kuehne, H. C., Meng, B. The working mechanism of starch and diutan gum in cementitious and limestone dispersions in presence of polycarboxylate ether superplasticizers. Appl. Rheol. 23 (5), 52903 (2013).
- Srinivasan, R. Natural Polysaccharides as Treatment Agents for Wastewater. Green Materials for Sustainable Water Remediation and Treatment. , 51-81 (2013).
- Rühmann, B., Schmid, J., Sieber, V. High throughput exopolysaccharide screening platform: From strain cultivation to monosaccharide composition and carbohydrate fingerprinting in one day. Carbohydr Polym. 122, 212-220 (2015).
- Ortega-Morales, B. O., et al. Characterization of extracellular polymers synthesized by tropical intertidal biofilm bacteria. J Appl Microbiol. 102 (1), 254-264 (2007).
- Xu, R., Ma, S., Wang, Y., Liu, L., Li, P. Screening identification and statistic optimization of a novel exopolysaccharide producing Lactobacillus paracasei HCT. Afr. J. Microbiol. Res. 4 (9), 783-795 (2010).
- Dubois, M., Gilles, K. A., Hamilton, J. K., Rebers, P. A., Smith, F. Colorimetric method for determination of sugars and related substances. Anal. Chem. 28 (3), 350-356 (1956).
- Masuko, T., et al. Carbohydrate analysis by a phenol-sulfuric acid method in microplate format. Anal Biochem. 339 (1), 69-72 (2005).
- Geater, C. W., Fehr, W. R., Wilson, L. A., Robyt, J. F. A more rapid method of total sugar analysis for soybean seed. Crop Sci. 41 (1), 250-252 (2001).
- Sutherland, I. W., Dumitriu, S. Ch 16, Microbial Exopolysaccharides. Polysaccharides Structural Diversity and Functional Versatility. , 431-457 (2005).
- Wingender, J., Neu, T. R., Flemming, H. C., Wingender, J., Neu, T. R., Flemming, H. C. What are Bacterial Extracellular Polymeric Substances?. Microbial extracellular polymeric substances: characterization, structure and function. , 258 (1999).
- Rühmann, B., Schmid, J., Sieber, V. Fast carbohydrate analysis via liquid chromatography coupled with ultra violet and electrospray ionization ion trap detection in 96-well format. J. Chromatogr. A. 1350, 44-50 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados