Method Article
Automated Modular High Throughput exopolissac�ido Plataforma de Triagem Juntamente com Análise Carboidratos Fingerprint Highly Sensitive
Neste Artigo
Resumo
We present an automated modular high-throughput-method for the identification and characterization of microbial exopolysaccharides in small scale. This method combines a fast preselection to analyze the total amount of secreted polysaccharides with a detailed carbohydrate fingerprint to enable the fast screening of newly isolated bacterial strains or entire strain collections.
Resumo
Muitos microorganismos são capazes de produzir e secretar exopolissacarídeos (EPS), que têm implicações importantes nos campos da medicina, aplicações em alimentos ou na substituição de produtos químicos baseados em petro. Descrevemos uma plataforma de análise a ser automatizado em um sistema de manuseamento de líquido que permite a análise rápida e fiável sobre o tipo e a quantidade de EPS produzidos por microorganismos. Ele permite ao utilizador identificar novos produtores naturais exopolissacarídeo microbianas e para analisar a impressão digital de hidratos de carbono dos polímeros correspondentes no prazo de um dia de alto rendimento (HT). Usando esta plataforma, colecções de deformação, assim como bibliotecas de variantes de tensão que pode ser obtida em abordagens de engenharia podem ser rastreados. A plataforma tem uma configuração modular, o que permite uma separação do protocolo em duas partes principais. Em primeiro lugar, existe um sistema de rastreio automatizado, que combina diferentes módulos de detecção polissacarídeo: uma análise semi-quantitativa da viscositY formação por meio de um passo de centrifugação, uma análise da formação de polímeros por meio de precipitação com álcool e a determinação do teor total de hidratos de carbono através de uma transformação de fenol-ácido sulfúrico-ácido. Aqui, é possível rastrear até 384 cepas por corrida. A segunda parte apresenta uma análise monosaccharide detalhada para todos os produtores de EPS selecionados identificados na primeira parte pela combinação de dois módulos essenciais: a análise da composição de monómeros completa através de cromatografia líquida de ultra-alta performance juntamente com ultra-violeta e detecção ion trap ionização electrospray ( UHPLC-UV-ESI-MS) e a determinação de piruvato como um substituinte polímero (presença de cetal de piruvato) por oxidação enzimática, que é acoplado a uma formação de cor. Todos os módulos de análise desta plataforma de triagem podem ser combinados de maneiras diferentes e ajustada às necessidades individuais. Além disso, todos eles podem ser feitos manualmente ou realizada com um sistema de manuseamento de líquidos. Desse modo, a pla triagemTForm permite uma enorme flexibilidade, a fim de identificar vários EPS.
Introdução
exopolissacáridos microbiana (EPS) são um grupo estruturalmente diverso de polímeros altamente que desempenham várias funções biológicas. Eles são construídos geralmente de unidades de repetição complexos, que são distinguidas pelos diferentes tipos de monómeros (açúcar, derivados de açúcar e ácidos de açúcar), as ligações entre estes monómeros e as suas substituições. A diversidade estrutural dos polissacarídeos microbianos confere características bastante diferentes para os membros desta classe molécula, o que permite sua aplicação em diferentes áreas, como alimentos 1, cosméticos 2,3, construção química 4 ou 5 tratamento de água. Para ampliar ainda mais o campo de aplicação destas de base biológica e tais polímeros sustentáveis a identificação de novos polissacarídeos microbianos naturais, bem como a engenharia de variantes estruturais representa abordagens promissoras. De qualquer maneira, um método de triagem rápido é necessário para digitalizar rapidamente um grande número de estirpes microbianas para their formação de polissacarídeo, e analisar seus produtos. Por isso, nós desenvolvemos recentemente um de 96 poços plataforma HT-rastreio para a análise da produção de polissacarídeo microbiano a partir de isolados naturais ou variantes da estirpe por engenharia, que inclui a identificação da composição monomérica 6.
Aplicando esta plataforma para uma primeira ronda de rastreio ~ 500 isolados naturais permitiu-nos identificar apenas cerca de 10 a 20% das estirpes isoladas como sendo capaz de produzir EPS (dados não mostrados). Isto significa que 80-90% das amostras analisadas não produziu EPS nas condições aplicadas, e, portanto, uma nova análise da impressão digital carboidratos detalhada não era necessário. Uma vez que esta identificação altamente sofisticada da composição monomérica é um processo demorado, especialmente para a análise de dados, um método de pré-rastreio rápido para identificar as estirpes positivas na produção de EPS, iria aumentar drasticamente a eficiência. Além disso, os reagentes,consumíveis e tempo de medição no UHPLC-UV-ESI-MS seria reduzido. Além disso, os diferentes módulos de análise, enquanto por um lado, tornar o método altamente fiáveis, são por outro lado, o que complica a movimentação manual de mais do que duas placas de 96 poços em paralelo, e, como tal restringem o pleno potencial do método. Por estas razões, decidimos desenvolver uma plataforma de triagem automatizada. Por isso, combinaram o formato modular da técnica de impressão digital de hidrato de carbono existente com um método de detecção rápida totalmente automatizada do seu conteúdo de açúcar total, com base em medições de absorvância.
O método do fenol-ácido sulfúrico-ácido ainda representa o método de escolha para a determinação rápida do teor total de hidratos de carbono de plantas e bacterianas polissacáridos 7,8. Este método foi descrito pela primeira vez por Dubois et al. 9 e adaptado para diferentes aplicações e tamanhos de amostra, mesmo para pequena escala em placas de 96 poços 10,11. o phemétodo nol-ácido sulfúrico-ácido mede o teor total de hidratos de carbono por um valor, somatória todos monoméricos, oligoméricos e poliméricos os hidratos de carbono das amostras.
Tendo em conta estes aspectos, a escolha de um meio de cultura apropriado é essencial para a aplicação deste método. meios complexos contendo compostos de hidratos de carbono oligoméricos ou poliméricos, como extracto de levedura pode levar a um teor de polímero alterada e, por conseguinte, deve ser estritamente evitado. Além disso, quantidades elevadas de açúcares são utilizados como fonte de C para o cultivo das estirpes. Altos níveis de hidratos de carbono restantes do processo de cultivo pode interferir negativamente com a medição do teor de EPS.
Portanto, o uso de açúcares definidos e puros é aconselhada. Nas nossas experiências utilizou-se glucose para a cultura das células. O restante da glicose após cultivo foi reduzida por meio de uma filtração em gel e determinada através de um ensaio de glucose-. Por último, o equivalente de glucoses dos polissacáridos foram calculados subtraindo-se o restante da glicose após a filtração em gel, a partir do teor total de hidratos de carbono que tinha sido detectadas com o método do fenol-ácido sulfúrico-ácido. Filtração em gel e ensaio de glucose-em combinação com o método do fenol-ácido sulfúrico-ácido garantir resultados fiáveis e são capazes de ser nosso primeiro sistema de detecção, completamente automatizado.
Dois novos módulos de análise foram incluídos na plataforma de rastreio automatizado para aumentar a quantidade de informação a partir do sistema de detecção de EPS: a precipitação e a observação de um aumento da viscosidade.
Muitos EPS diferentes - por exemplo succinoglicano, xantana e cólon ácido 12 - são relatados para ser modificado com um cetal piruvato não-carboidratos em posições de açúcar C4 e C6. Esses cetais piruvato (assim como ésteres de succinil meia e ácidos urônicos) contribuem para a natureza polyanionic e, portanto, ao prope físicarties do polímero por interagir através de pontes 13 de catiões divalentes. A fim de identificar os polímeros particulares a determinação de piruvato foi estabelecido como um outro módulo de análise adicional. Isto aumenta a informação sobre os substituintes de polissacáridos e suas propriedades macroscópicas potenciais.
A combinação de todos os módulos permite a identificação de diferentes EPS, bem como uma determinação rápida e eficiente dos produtores de EPS. Por que a abordagem da plataforma de rastreio pode ser dividido em duas partes principais (Figura 1). Dentro da triagem automatizada (parte I) o fluxo de trabalho ocorre totalmente automatizado (Tabela 1) para pré-selecionar rapidamente os EPS cepas produtoras. A análise de hidratos de carbono da impressão digital (parte II) determina quantitativamente a composição de monómero do EPS produzidos pelas estirpes pré-seleccionados. Deste modo, a análise dos dados foi minimizado de modo a optimizar o rastreio de grandes colecções de deformação. esteoferece a possibilidade de analisar 384 cepas em uma única corrida de triagem automatizada e com duas corridas que são possíveis por dia de 768 cepas por dia. Além disso, a análise de carboidratos impressão digital dá uma visão ainda mais detalhada de todos os EPS identificados. Isto permite a análise e identificação de dirigido EPS variantes que diferem apenas ligeiramente ou completamente novos em comparação com as estruturas químicas já descritas de EPS.
Protocolo
1. Triagem Automatizada
Nota: Todos os passos de manuseamento de líquidos está feito com um sistema de manuseamento de líquidos robótico. A composição da mesa de trabalho robô é apresentado na Figura 2. Todos os materiais de consumo são armazenados no carrossel de armazenamento, a menos que mencionado de outro modo. Apesar de toda a triagem automatizada etapas um manipulador robótico (RM) move os consumíveis, (placa poço profundo (DWP); placa de micro titulação (MTP); polimerase placa de reação em cadeia (PCR-placa) e assim por diante) entre as posições carrossel (CP ) e as posições worktable (ETA). Todos os passos são realizados de pipetas com uma pipeta-braço-96-canal, excepto se for indicado de outra forma. Todos os passos são programados e são realizadas automaticamente em formato de 96 poços.
- Estirpe de cultivo (Tarefa 1 na Figura 1)
Nota: Pega a inoculação das EPS putativos cepas produtoras e a selagem das placas de cultivo sob condições estéreis (fluxo laminar). o automatizadotriagem rápida pode lidar com quatro placas de 96 poços por corrida. Diferentes estirpes de diversos géneros já foram testados 6.- inocular manualmente a pré-cultura (1 ml EPS-media em um DWP) com um replicador de 96 pinos a partir de uma placa de 96 poços estoque de glicerol. Cobrir a placa com uma película de selagem respirável para evitar a evaporação e para permitir arejamento. Incubar a 30 ° C durante 48 horas a 1000 rpm num agitador MTP-.
- Inocular o principal-cultura (990 ul EPS-media numa DWP) transferindo 10 ul da pré-cultura utilizando um multi-pipeta 50 ul de 12 canais e incubar sob as mesmas condições que a pré-cultura. Tome nota de todas as estirpes que não crescem.
- Preparação do robô Worktable eo carrossel de armazenamento
- Fornecer todos os consumíveis listados nos materiais e equipamentos para a posição correta no carrossel de armazenamento. Adicionar 990 uL de água duplamente destilada (ddH 2 O) em cada poço da DWP para as diluições de 1: 100 para the glicose-ensaio (posição do carrossel para 4-1 4-4).
- Organizar uma 250 ml tina contendo 150 ml de ddH2O na posição mesa de trabalho (ETA) 11.
- Depositar uma calha 250 ml contendo 50 ml de glucose-reagente de ensaio de mistura (4 ml de fosfato de potássio 500 mM (pH 5,7), 1,5 ml de 50 mM de 2,2-azinobis- (3ethylbenzthiazoline) -6-sulfónico, 2 mL de 100 U glucose oxidase, 10 ul de 1000 L de peroxidase de rábano e 42,49 ml ddH2O) na posição WTP 1-2.
- Coloque dois MTPs F-bottom manequim vazios na posição WTP por 3-1 e 3-2.
- Retire a película de selagem respirável, alocar os principais-culturas nas posições carrossel (CP) 1-1 a 1-4 e iniciar o programa robótico automatizado.
- O equilíbrio das placas de gel-filtração
Nota: As placas de filtração de gel que são utilizadas durante esta triagem pode ser reutilizado. Para isso, lavar e centrifugação, três vezes cada uma com 150 uL de ddH2O a 2000 xg durante 2 min a 20 ° C. Em seguida, armazenar a 4° C com 75 mL de 20% de etanol e cubra com um tapete de tampa de silício.- Mova a 250 ml calha (CP 5-7) com tampão de 5 mM de acetato de amónio (pH 5,6) para o WTP 3-3.
- Transferir as placas de filtração em gel (CP 1-6, 1-7, 2-6 e 2-7) a partir do carrossel para o ETAs 4-1 a 4-4.
- Aspirar 150 ul de tampão de acetato de amónio, utilizando 200 ul dicas e dispensar para o centro de todas as placas de filtração em gel para equilíbrio.
- Transferir as placas de filtração em gel no centrifugador (2000 xg durante 2 min a 20 ° C).
- Transferir as placas de volta para a mesa de trabalho, repita os passos 1.3.3, 1.3.4 e 1.3.3. Não se repetir o passo de centrifugação para evitar a desidratação das placas de filtração em gel. Armazenar as placas de filtração em gel equilibrada de volta dentro do carrossel.
- A remoção de células por meio de centrifugação (Tarefa 1 na Figura 1)
Nota: A fim de assegurar um fundo de baixo dentro da abordagem de triagem, analisar celular gratuitamenteEPS contendo sobrenadantes única e remover as células por centrifugação após o cultivo.- Transferir a cultura principal-DWP do carrossel (1-1 a 1-4) no centrifugador (4300 x g durante 30 min a 20 ° C).
- Prepare a mesa de trabalho através da RM para processar a cultura principal.
Nota: Para os passos 1.4.2 a 1.4.3.5 o sistema sempre lida com duas placas em paralelo e, em seguida, repete todas as medidas com as próximas duas placas.- Para a precipitação antes da filtração mover o MTP da CP 6-1 e 6-2 para WTP 4-1 e 5-1. Mova os MTPs indicador de pH da CP 7-1 e 7-2 para WTP 4-2 e 5-2.
- Transferir a placa de filtração, juntamente com a placa coletora do CP 2-1 e 2-2 para WTP 4-3 e 5-3. Mudaria a principal cultura DWP 1-1 e 1-2 da centrífuga para WTP 4-4 e 5-4.
- Prepare os módulos de análise.
Nota: Tome 200 dicas ul do armazenamento de ponta (posição 2-1 a 2-4). A fim de reduzir os consumíveis, use o mesmo tip-set para a etapa 1.4.3.1.- Transferir 180 ul do sobrenadante da cultura principal para a placa de filtração. Aspirar 150 mL do sobrenadante da cultura principal e dispensar 50 ul para o MTP para a precipitação antes da filtração e 100 ul para a placa de indicador de pH.
Nota: O pH-determinação não é essencial; No entanto, após a adição de 12,5 ml de metil indicador vermelho (50 mg em 50 ml de etanol) em cada poço com uma pipeta multi-passo que indica estirpes produtoras de ácido elevadas. Esta informação pode ser útil para evitar a inibição do crescimento (a pH baixo) para novas culturas, por exemplo, para um segundo rastreio com maior concentração de tampão. Além disso, o baixo pH também pode induzir a produção de EPS, a fim de proteger a célula contra o ambiente ácido. - Repita o passo 1.4.3.1 para a segunda placa de cultura principal. Use uma ponta-jogo fresco.
- Mover as placas de filtração para a centrífuga e remover todos os outros pratos da mesa de trabalho de volta para suas posições de origem no carousel.
- Repita o 1.4.2.1 passos para 1.4.3.3 para a terceira e quarta placa-cultura principal.
- Dê uma nota desses caldos de fermentação, que mostram diminuição de sedimentação após a centrifugação das principais placas de cultura, quando eles são transferidos de volta para o carrossel (controle de viscosidade).
- Transferir 180 ul do sobrenadante da cultura principal para a placa de filtração. Aspirar 150 mL do sobrenadante da cultura principal e dispensar 50 ul para o MTP para a precipitação antes da filtração e 100 ul para a placa de indicador de pH.
- De 96 poços de filtração para a remoção completa das células (Tarefa 2 na Figura 1)
Nota: Para assegurar a remoção de células a partir do caldo de fermentação viscosa um passo de filtração está incluído na triagem.- Centrifugar as placas de filtração a 3000 xg durante 10 min a 20 ° C e trazê-los de volta à sua posição inicial carrossel.
- Preparar as placas de filtração em gel.
- Mover as placas de filtração em gel equilibrada do carrossel para a centrífuga e centrifugação a 1000 xg durante 2 min a 20 ° C.
- Transferir as placas de gel-filtração a partir da centrifugação a ETA 4-1 a 44.
- Mova o gel frescoplacas de coletor -filtration da CP (3-1 para 3-4) para WTP (5-1 para 5-4).
- Transferir as placas de filtração em gel equilibrada (WTP 4-1 para 4-4) para placas de coletor frescos (5-1 para 5-4).
- Limpar a mesa de trabalho, exceto as posições 5-1 e 5-2 e mover a posição 5-1 para a posição 4-1.
- Preparar a mesa de trabalho por meio da RM para processar os filtrados.
Nota: Para obter as etapas 1.5.3 para 1.6.3.5 o sistema lida com duas placas em paralelo e repete todas as medidas com as próximas duas placas.- Mover dicas 50 ul do carrossel (06/04 e 07/04) para ETA 3-3 e 3-4.
- Transferir as placas de filtração a partir de CP 3-1 a 3-2 para a mesa de trabalho (4-4 e 5-4).
- Reposicione a DWP (diluição 1: 100) para a detecção do consumo de glicose a partir da CP 4-1 e 4-2 a 4-2 e 5-1 ETA.
- Mova o MTP para a segunda precipitação após a filtração da CP 8-1 e 8-2 para WTP 4-3 e 5-3.
- Levantar as placas de filtração a partir da placa colectoras (ETA 4-4 e 5-4) e movê-los para WTP por 3-1 e 3-2.
- Prepare os módulos de análise após a filtração. A fim de reduzir os consumíveis, use o mesmo tip-set para as etapas 1.5.4.1 e 1.5.4.3.
- Tomar 50 ul dicas e pipetar uma aliquota de 10 uL do filtrado para o DWP (diluição 1: 100) para a glicose-ensaio (consumo de glucose).
- Pipetar 35 ul de filtrado para o centro da placa de filtração em gel equilibrada e 50 ul para o MTP que é utilizado para a precipitação.
- Repita os passos para 1.5.4.1 1.5.4.2 para a segunda placa de filtração.
- Mover as placas de filtração em gel para a centrífuga e mover-se todas as outras placas a partir da mesa de trabalho de volta para as posições de repouso no carrossel.
- Repita os passos 1.5.3.1 a 1.5.4.4 para a terceira e quarta placa de filtração.
- Após armazenamento de todas as placas de novo na no carrossel de tomar conhecimento das sobrenadantes altamente viscosos, como indicado pelos resíduos na placa de filtro (v altaiscosidade controlo após o passo de filtração). A falta de filtrado pode levar a resultados falsos negativos nos seguintes módulos analíticos.
- A remoção da glicose através de 96 poços de filtração em gel (Tarefa 3 na Figura 1)
- Centrifugar as placas de gel-filtração a 1000 xg durante 2 min a 20 ° C.
- Preparar a mesa de trabalho, através do manipulador robótico para processar os filtrados em gel.
- Fornecer 50 dicas ul do carrossel (5-3 e 5-4) para WTP 3-3 e 3-4.
- Para a determinação da glucose remanescente após filtração em gel mover dois PTMs de CP 9-1 e 9-2 a 4-1 e 5-1 ETA.
- Para o método de fenol-sulfúrico ácido mover duas MTPs da CP 8-5 e 8-6 para WTP 4-2 e 5-2.
- Transferência de duas placas de gel-filtração a partir da centrifugação a ETA (4-3 e 5-3).
- Levante as placas de filtração em gel da placa de recolha (4-3 e 5-3) e movê-los para WTP por 3-1 e 3-2.
- Preparar a mesa de trabalho, através do manipulador robótico para processar os filtrados em gel.
Nota: A fim de reduzir os consumíveis, use a ponta definido para etapas 1.6.3.1 e 1.6.3.2 mesma.- Para detectar os restantes glicose após filtração em gel (1:10) tomar 50 dicas ul e transferir 25 mL de DDH 2 O (WTP 1-1) a uma MTP fresca. Aspirar 20 uL de ddH2O (WTP 1-1), 5 ul de ar e 5 ul de gel filtrado e Distribui-se a mesma placa.
- Para a pipeta-ácido sulfúrico-ácido-fenol método 20 ul de gel filtrado para o MTP.
- Repita os passos 1.6.3.1 e 1.6.3.2 para a segunda placa de gel-filtrado.
- Transferir todos os pratos da mesa de trabalho de volta para as posições de origem no seu carrossel.
- Repetir a 1.6.2.1 1.6.3.4 passos a para a terceira e quarta placa de filtração em gel.
- Módulos de ensaio de glucose-
- Preparar a mesa de trabalho, através do manipulador robótico para realizar a glicose como-dizer.
- Realocar o DWP (diluição 1: 100) a partir do CP 4-1 e 4-4 para WTP 5-1 e 5-4.
- Mova todos MTPs da CP 9-5 e 9-8 para WTP 4-1 e 4-4.
- Tome 200 ul dicas e misturar a diluição por aspiração e distribuição de dez vezes o volume de 180 uL. Em seguida, pipetar uma alíquota de 50 ul à MTP.
- Repita os passos 1.7.1.2 e 1.7.1.3, para todos os quatro DWPs (diluição 1: 100).
- Remova todas as DWPs (5-1 para 5-4) a partir da mesa de trabalho.
- Preparar a mesa de trabalho para iniciar a glicose-ensaio.
- Para a determinação da glucose remanescente após a transferência de gel-filtração a partir de todos os PTMs CP (9-1 a 9-4) a ETA (5-1 a 5-4).
- Mover a placa de calibragem de glucose-ensaio - contendo três vezes com 50 ul de as seguintes concentrações de glucose (90, 45, 18, 9, 4,5, 1,8, 0,9, 0,45 e 0 mg / l) - a partir de CP 9-9 de 3- WTP 3.
- Tome 200 dicas ul e aspirado de 50 ul de glucose-ensaio reagente mix de WTP 1-2, para iniciar o primeiro ensaio. Mover os PTMs na incubadora (30 ° C a 150 rpm durante 30 min).
- Defina o horário para iniciar o programa com 5 min de atraso entre as placas.
- Após 30 min de incubação mover as placas da incubadora para o leitor de MTP-e absorvância ficha a 418 e 480 nm.
- Após a medição mover as placas para a sua posição inicial no carrossel.
- Preparar a mesa de trabalho, através do manipulador robótico para realizar a glicose como-dizer.
- Preparação da precipitação
Nota: A fim de avaliar a produção de EPS efectuar uma precipitação do sobrenadante com 2-propanol antes e após o primeiro passo de filtração. Além disso, avaliar a adsorção do polímero na membrana de filtro pela observação de fibras e de flocos no primeiro, mas não na segunda precipitação.
Cuidado: Pega 2-propanol como um líquido inflamável estritamente sob uma coifa.- Remova todas as placas de precipitação (CP 6-1 para 6-4 e 8-1 para 8-4) do carrossel. E adicionemanualmente 150 ul de 2-propanol para cada poço com uma pipeta de multi-etapa 12,5.
- Cobrir todas as MTPs com um tapete de silicone tampa e agitar à temperatura ambiente (RT) (10 min a 900 rpm). Observar visualmente formações de fibra ou floco após agitação que indicam a produção de EPS.
- Método do fenol-ácido sulfúrico-ácido
Cuidado: Pega sulfúrico-ácido concentrado e fenol sob uma coifa. O fenol é um agente corrosivo e mutagênico.- Para o método do fenol-ácido sulfúrico-ácido, remover as placas (CP 8-5 a 8-8) a partir do carrossel e colocá-las no sistema de manuseamento de líquidos (posição 4-8). Incluem a placa de calibragem com 20 ul de diferentes concentrações de glucose (10; 5; 2,5; 1; 0,5; 0,25; 0,1; 0,05; 0 g / L) em triplicado.
- Coloque um recipiente de resíduos na posição 1, uma caixa de ponta de 200 ul na posição 2 e uma calha de 250 ml com 110 ml de fenol-ácido sulfúrico-ácido (preparada imediatamente em gelo with18.3 ml de fenol a 5% (w / v) em ddH2O e 91,7 ml de ácido clorídrico cone. sácido ulfuric) na posição 3.
- Use uma pipeta de 8 canais com 300 dicas ul e transferir 180 ul de fenol-sulfúrico-ácido para cada linha de todas as placas.
- Cobrir todas as MTPs com tampas, misturá-los por agitação (5 min a 900 rpm, RT) e incubar durante 35 min a 80 ° C num forno por reacção cor. Depois de arrefecer sob um exaustor, medir a extinção a 480 nm.
- Selecção de EPS sobrenadantes positiva (Tarefa 4 na Figura 1)
- Para a avaliação da produção de EPS, selecione essas cepas do rastreio automatizado que cumprir pelo menos dois dos três critérios como positivos (controle de viscosidade 2.6.1 e 2.6.2, a detecção de polímero 2.6.3, glicose equivalente 2.6.5). Transferir os filtrados provenientes dos restantes resultados positivos para uma nova MTP para processamento adicional.
Nota: Quando as placas são cobertas com uma película de selagem de alumínio que pode ser armazenado a -20 ° C durante pelo menos uma semana. Dentro deste tempo o Determinação da impressão digital de hidratos de carbono necessita de ser realizada.
- Para a avaliação da produção de EPS, selecione essas cepas do rastreio automatizado que cumprir pelo menos dois dos três critérios como positivos (controle de viscosidade 2.6.1 e 2.6.2, a detecção de polímero 2.6.3, glicose equivalente 2.6.5). Transferir os filtrados provenientes dos restantes resultados positivos para uma nova MTP para processamento adicional.
2. Carboidratos Fingerprint
Nota: Todos os passos para a impressão digital de hidrato de carbono são realizadas manualmente.
- Filtração em gel dos sobrenadantes positiva (Tarefa 5 na Figura 1)
Nota: de filtração em gel é necessária, como não há filtrado à esquerda do rastreio automatizado. Filtração em gel com um volume de mais de 35 ul resultados na diminuição da eficiência da purificação.- Prepare o equilíbrio das placas de filtração em gel por distribuição de 150 ul de tampão de acetato de amónio em todas as cavidades por meio de uma pipeta de multi-etapa 12,5.
- Transferir a placa de filtração em gel no centrifugador (2000 xg durante 2 min a 20 ° C).
- Repita os passos 2.1.1, 2.1.2 e 2.1.1 novamente. Centrifugar a placa de gel-filtração a 1000 xg durante 2 min a 20 ° C antes de posterior utilização.
- Pipetar 35 ul de filtrado parao centro da placa de filtração em gel utilizando um 12-canal 50 ul pipeta.
- Centrifugar a placa de gel-filtração a 1000 xg durante 2 min a 20 ° C e, em seguida, levantá-la da placa de recolha.
- Prepare a glicose-ensaio antes da hidrólise: Executar uma diluição de 1:10, adicionando 45 mL de DDH 2 O e 5 ul de gel-filtrado com um ul pipeta de 12 canais 50 e cobrir os MTPs com uma esteira cap silicone.
Nota: Para a determinação correcta do valor de glicose do polímero, medir o teor de glicose antes da hidrólise e subtrai-lo a partir do teor de glicose quantificados após a etapa de hidrólise. - Prepara-se o piruvato-ensaio antes da hidrólise: Efectuar uma diluição de 1:20 utilizando um de 12 canais 200 ul pipeta para adicionar 95 uL de ddH2O, 5 ul de transferência de gel, filtrado a cada poço e selar o PTM com uma esteira de tampa de silício .
- 96 poços Micro Hidrólise (Tarefa 6 na Figura 1)
Nota: Aqueçao forno de incubação (incluindo um banho de areia) a 121 ° C durante pelo menos 1,5 h antes de usar. Um dispositivo de aperto especial foi desenvolvido para evitar a evaporação durante o passo de hidrólise em escala pequena.- Tome um novo PCR-placa e transferir 20 l de gel-filtrado com um ul pipeta de 12 canais 50.
Cuidado: o ácido trifluoroacético é um ácido corrosivo e tóxico. solução de amônio é corrosivo. Lidar com ambos os produtos químicos, sob uma coifa. - Adicionar 20 ul de ácido trif luoroacético com 4 M de 1,25 ml de uma pipeta multi-passo para cada poço. Em seguida, cobrir o PCR-placa com um elastómero termoplástico (TPE) esteira de tampa e colocar a placa de PCR-No dispositivo de fixação especial.
- Misturar as soluções através de inverter o dispositivo de aperto dez vezes. Coloque a PCR-placa em uma centrífuga e girar a 2.000 xg durante 2 min para recolher todo o líquido na parte inferior. Colocar a placa de PCR-volta para o dispositivo de aperto e segurar o dispositivo com parafusos.
- Coloque odispositivo de fixação segura no banho de areia pré-aquecida e incubar durante 90 min a 121 ° C.
- Retirar o dispositivo de fixação do banho de areia e deixe-o arrefecer até à temperatura ambiente.
- Retirar os parafusos e girar novamente numa centrífuga a 2000 xg durante 2 min a fim de recolher todo o condensado no fundo dos poços e para evitar a contaminação cruzada durante a remoção da tampa de esteira.
- Adicionar uma solução de amoníaco 3,2% para ajustar o pH para aprox. 8 utilizando um de 12 canais 200 ul pipeta. Cubra a PCR-placa com um tapete cap TPE e agitá-lo manualmente utilizando o dispositivo de fixação.
- Após neutralização centrifugar o PCR-placa a 2000 xg durante 2 min.
- Tome um novo PCR-placa e transferir 20 l de gel-filtrado com um ul pipeta de 12 canais 50.
- High-throughput-1-fenil-3-metil-5-pirazolona (PMP-HT) -derivatization de os hidratos de carbono (Tarefa 7 na Figura 1)
- Transferir 25 uL de o hidrolisado neutralizado numa PCR-placa de fresco utilizando uma pipeta de 12 canais de 50 ul.
Nota: Depois de tirar a alíquota, verificar o neutrzação do líquido que permanece na placa de hidrólise por meio de adição de 12,5 ul de indicador vermelho de fenol (0,05 g de vermelho de fenol em 5 ml de 20% de etanol) com uma pipeta de 1,25 multi-passo. Todos os poços que não se transformam em cor-de-rosa (pH 8) não são correctamente derivados. - Adicionar 75 ul de reagente de derivatização-mistura (125 mg PMP, 7 mL de metanol, 3,06 mL ddH2O, e 438 ul de solução de amónio 3,2%) e cobrir a placa com uma esteira de tampão TPE.
- Depois de agitar a PCR-placa na centrífuga dispositivo de aperto da placa a 2000 xg durante 2 min a acumular-se todo o líquido na parte inferior.
- Para lugar a derivatização do PCR-placa numa PCR-cycler, a 70 ° C durante 100 minutos, seguido por arrefecimento para 20 ° C.
- Transferir uma alíquota de 20 ul para um novo MTP utilizando um 12-canal 50 ul pipeta. Em seguida, usar um canal 12-200 ul pipeta e adicionar 130 uL de 19,23 mM de ácido acético (0,962 ml de ácido acético 1M + 49.038 ml ddH2O) para cada linha. Misture diretamente através aspiratção e de distribuição (mínimo de seis vezes) e transferir todo o líquido para uma placa de filtro de 0,2 um com uma placa de colector de MTP.
- Centrifugar a placa (1000 xg durante 5 min), remover a placa de filtro, selar o PTM com uma esteira de tampão de silicone e coloque o MTP para o UHPLC-UV-ESI-MS para a determinação da impressão digital 14 hidrato de carbono.
- Transferir 25 uL de o hidrolisado neutralizado numa PCR-placa de fresco utilizando uma pipeta de 12 canais de 50 ul.
- Preparação do ensaio de glucose-
- Efectuar uma diluição 1:10 através de adição de 45 uL de ddH2O e 5 ul de hidrolisado neutralizado usando uma pipeta de 12 uL de canal 50 e cobrir as MTPs com uma esteira de tampão de silicone. Adicionar três vezes com 50 ul de diferentes padrões de glicose (500, 250, 100, 50, 25, 10, 5, 2,5 e 0 uM) para uma nova MTP utilizados para a calibração.
- Adicionar 50 ul de glucose-reagente de ensaio de mistura (step1.2.3 receita) utilizando uma pipeta de 12 uL de canal 50. Em seguida, cobrir as placas com um tapete de tampa de silício e incuba-se a 30 ° C e 400 rpm durante 30 min num MTP-incubadora.
- Imediatamente após a incubação fazer uma absorção lido em uma MTP-reader em 418 e 480 nm em uma MTP-reader. Para o cálculo da concentração de glucose realizar uma calibração linear, como realizado no passo 2.6.4.
- Preparação da Piruvato-ensaio
- Executar uma diluição de 1:20 usando um de 12 canais 200 mL pipeta. Adicionar 95 mL de DDH 2 O e transferência de 5 l de hidrolisado neutralizado a cada poço. Cubra o MTP com um tapete de tampa de silício.
- Adicionar 100? L de piruvato-ensaio de reagente de mistura (3 mL de 1 mM de N - (carboximetilamino-carbonil) -4.4'-bis (dimetilamino) sal de sódio -diphenylamine (DA-64), 300 ul de 10 mM de pirofosfato de tiamina, 60 jil 100 mM de cloreto de magnésio hexa-hidratado, 2,4 ml de 500 mM de fosfato de potássio soprador (pH 5,7), 30 ul de 100 L de piruvato oxidase, 12 ul de 1000 L de peroxidase de rábano e 24,19 ml ddH2O) utilizando uma pipeta de 200 uL de 12 canais.
- Cubra as placas com uma tampa de silicone mat umND incubar a 37 ° C e 150 rpm durante 30 min. Directamente após a absorvância medida a incubação num leitor de MTP-a 727 e 540 nm.
- Avaliação de todos os resultados da triagem automatizada eo Carboidratos impressões digitais.
- Tome nota dessas amostras que mostram diminuição de sedimentação após as principais placas de cultura foram centrifugadas e armazenadas de volta para o carrossel (passo de controlo da viscosidade 1.4.1). As amostras que não apresentam formação de peletes são positivos (critério 1 para a triagem automatizada).
- Tomar nota da sobrenadantes altamente viscosos, que são indicadas pelos resíduos na placa de filtro, após o passo de filtração (alta viscosidade etapa de controlo 1.5.4.6). A falta de filtrado pode levar a um resultado falso negativo nos seguintes módulos analíticos. As amostras que mantêm sobrenadantes de cultura no filtro poços são positivos (também critério 1 para a triagem automatizada).
- Observar visualmente fibra ou floco formação após a incubação. Tome notas como thseja indica polissacáridos. Classifique nenhuma precipitação com (-); baixa precipitação de fibras ou flocos com (+) e alta precipitação com (++). Além disso, detectar a adsorção do polímero na membrana de filtro via observação de fibras e de flocos no primeiro, mas não na segunda precipitação (2 critério para o rastreio automatizado).
- Executar uma calibração linear para o cálculo da concentração de glucose.
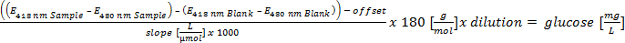
Por favor clique aqui para ver uma versão maior desta equação. - Realizar a calibração linear (absorção sobre concentração) entre 5 e 0,1 g / L de glicose. O cálculo do equivalente de glucose dos polímeros hidrolisados e avaliar pelo seguintes parâmetros: glicose equivalente:> 700 mg / L = positivo; 300-700 mg / L = putativo positivo; <300 mg / L = negativo em relação de formato EPSiónica (3 critério para o rastreio automatizado).
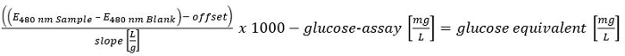
Por favor clique aqui para ver uma versão maior desta equação. - Quantificar todos os carboidratos determinados com o método HT-PMP. Soma-se a todas as quantidades e avaliar o seguinte:> 300 mg / L (positiva); 150-300 mg / L (putativa positivo) e <150 mg / L (negativo).
- Para o cálculo da concentração de piruvato de realizar uma calibração linear (100, 50, 25, 10, 5, 2,5, 1, 0,5 e 0 pM). Para excluir a piruvato restante no sobrenadante, corrigir o teor de piruvato após hidrólise com base no teor de piruvato antes da hidrólise.
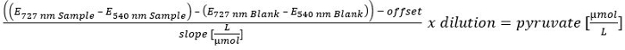
Por favor clique aqui para ver uma versão maior desta equatíon.
Resultados
A validação do método do fenol-ácido sulfúrico-ácido mostraram bons resultados com um coeficiente de determinação (R) de 0,9998 (Tabela 2). Para a 5 g de concentração / L, o coeficiente de variação (CV) e a precisão mostrou um bom desempenho com 1,8% e erro de 2,2%, mas o desempenho inferior para a 0,25 g padrão / L com 5,3% (CV) e erro de 6,1% ( Viés).
Os coeficientes de determinação das duas curvas de calibração piruvato-ensaio (com e sem matriz) foram> 0,9999 em uma gama de calibração de 150 uM (Tabela 3). Os coeficientes de variação (CV) para o nível de calibração maior ea menor foram <4,6% ea precisão mostrou um bom desempenho ao longo da gama de calibração completa com o erro inferior a 3,9%. Assim, a matriz a partir do passo de hidrólise mostrou qualquer influência sobre o ensaio enzimático, que é, por conseguinte, capaz de measure piruvato antes e depois da hidrólise.
A Tabela 4 mostra os resultados detalhados das três novas estirpes exemplares como identificadas com sucesso com a plataforma de triagem. A parte esquerda da tabela apresenta os resultados dos módulos de rastreio automatizados diz respeito à formação de viscosidade, a produção de polímero e o equivalente de glucose a partir da hidrólise total, que foram usados como parâmetros de avaliação para uma análise detalhada de hidratos de carbono de impressões digitais. A impressão digital de hidratos de carbono com base em açúcares calibrados, bem como açúcares desconhecidos, dímeros e substituintes são dadas na parte direita da tabela. Por utilização desta informação a composição monomérica pode ser calculada e comparada com as estruturas de polímero já conhecidos. Além disso, um rastreio alvo de composições monoméricas interessantes e hidratos de carbono raras pode ser realizada.
O elevado desempenho da microhidrólise escala e o HT-PMP-derivação foram demonstrados em nosso trabalho anterior 14. Além disso, a validação do gel-filtração e a impressão digital de hidratos de carbono para vários géneros foram descritos em outra publicação 6. Em suma, a plataforma de rastreio com a sua estrutura modular pode facilmente ser modificadas e adaptadas aos requisitos individuais do utilizador. O rastreio automatizado da plataforma permite que um oito vezes maior rendimento e dá resultados fiáveis. módulos analíticos novos, como o piruvato-ensaio pode ser integrado e em combinação com a análise de carboidratos de impressões digitais que fornecem informações muito detalhadas sobre os EPS identificados. Desse modo, a plataforma de triagem é essencial na busca de ambas as variantes EPS ligeiramente modificados e completamente novos.
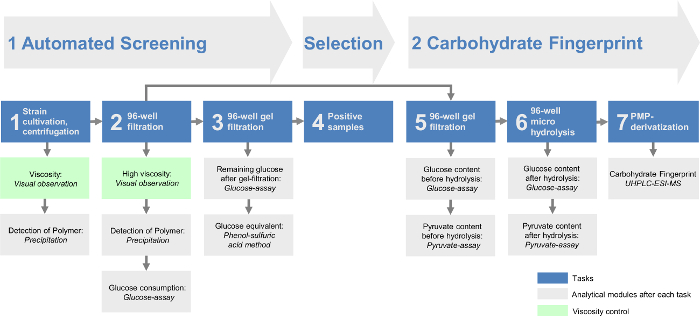
Figura 1: Esquema geral da h modularigh throughput screening plataforma exopolissac�ido. A triagem automatizada inclui as três primeiras tarefas. Depois de as bactérias são cultivadas em placas de 96 poços, as células são removidas por centrifugação (tarefa 1) e uma filtração de 96 poços (tarefa 2). Em seguida, os restantes açúcares monoméricos a partir de meios de crescimento são removidos através de uma filtração em gel de 96 poços (tarefa 3). Os EPS contendo as amostras são avaliadas em tarefa 4. A impressão digital de hidratos de carbono da plataforma de rastreio contém os últimos três tarefas. O filtrado restante dos resultados positivos de tarefa 2 fornece a base para o gel-filtrado em tarefa 5. Após a hidrólise em 6 tarefa a impressão digital de hidratos de carbono podem ser analisados através do método de HT-PMP (high-throughput 1-fenil-3-metil -5-pirazolona, tarefa 7). Todas as tarefas são seguidos por diferentes módulos analíticos e / ou um controle de viscosidade. Por favor clique aqui para ver uma versão maior desta figura.
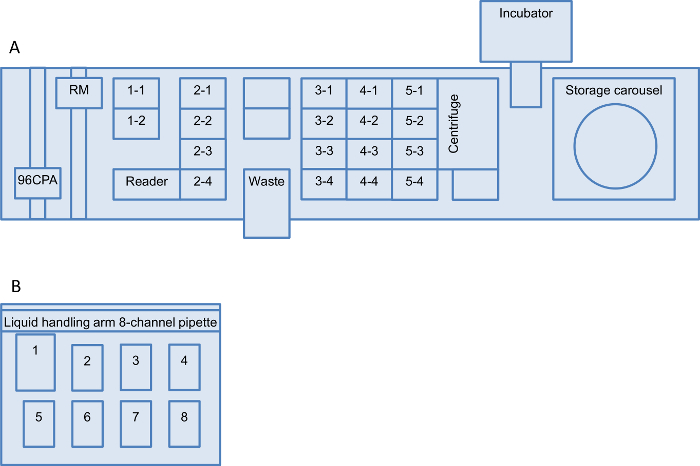
Figura 2: Robot configuração mesa de trabalho para a plataforma de triagem Layouts de ambos os líquidos manipulação worktables robô são mostrados:. (A) sistema de manipulação de líquidos robótico e da estação de tratamento (B) líquido. (A) A instalação consiste de um transportador de microplacas com duas posições (posições 1-1 a 1-2), um transportador para pontas descartáveis com quatro posições (posições 2-1 a 2-4) e três transportadores de microplacas com quatro posições de cada (posições 3-1 a 3-4, 4-1 a 4-4 e 5-1 para 5-4). Além disso, há um carrossel de armazenamento com cinco operadoras de hotel (1 a 5) cada para sete placas poço profundo (DWP) e quatro operadoras de hotéis (6-9) cada para 21 micro-titulação placas. O hardware instalado no robô de manipulação de líquidos é um 96-channel-pipeta de-braço para uso com pontas descartáveis e um manipulador robótico (RM) que se move placas / equipamentos between a mesa de trabalho, o carrossel de armazenamento, o MTP-reader, a centrífuga e-incubadora de agitação. (B) A estação de manuseamento de líquidos está equipada com um braço de manuseamento de líquidos e uma de 8 canais pipeta de 300 uL, de um recipiente de resíduos na posição 1, um adaptador selectivo de ponta com 300 pontas ul (posição 2), um adaptador de altura 30 com 250 ml calha (posição 3) e cinco altura adaptador 60 para MTPs (posição 4-8). A numeração das posições é designado neste protocolo. Mesas de trabalho alternativos também pode ser usado se houver configurações equivalentes disponível. Por favor clique aqui para ver uma versão maior desta figura.
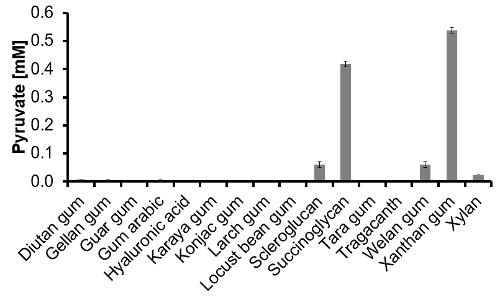
Figura 3: conteúdo Piruvato de 16 polímeros disponíveis comercialmente determinados através de piruvato-ensaio. Depois da solução de polímero de 1 g / Ls foram hidrolisados e neutralizado, o piruvato-ensaio foi realizado a partir de uma diluição de 1:10 (n = 3). Por favor clique aqui para ver uma versão maior desta figura.
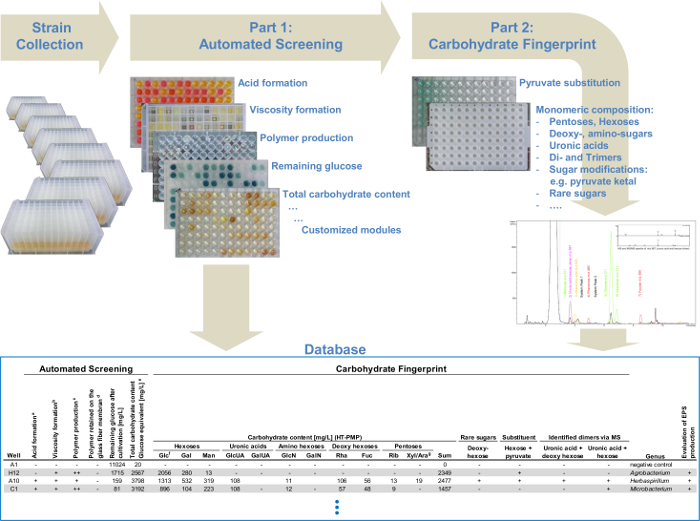
Figura 4: Diagrama de fluxo da plataforma modular de rastreio de alto rendimento. O sistema automatizado de triagem, que combina diferentes módulos de detecção polissacarídeo: a análise de formação de viscosidade, a produção de polímero e a determinação do teor total de hidratos de carbono. A segunda parte apresenta uma análise detalhada monosaccharide para todos os produtores de EPS selecionados identificados na primeira parte. Todos os dados do rastreio automatizado e os dados da impressão digital carboidratos via UHPLC-ESI-MS são coletados em um banco de dados e permitir a identificação simples de variantes estruturalmente relacionados de already conhecido EPS ou novos EPS e, portanto, uma triagem direcionada. Por favor clique aqui para ver uma versão maior desta figura.
| Etapa principal / módulo Analytical | Fluxo de Trabalho | Observação / Descrição |
| O cultivo das estirpes | 1 ml EPS-forma um Pré-cultura de 48 horas, 30 ° C, 1000 rpm, um Main-cultura de 48 horas, 30 ° C, de 1.000 rpm a | Produção de EPS |
| Remoção de células / viscosidade | Centrifugação: 30 min a 4300 xg | N = sedimento aumento da viscosidade = positiva |
| Detecção de polímero: Precipitação | 50 ul supernatant + 150 ul de 2-propanol b Apertar a 10 min à temperatura ambiente e 900 rpm b | Visual: Fibras e flocos = precipitação positiva de polímero |
| Remoção de células / alta viscosidade | 180 sobrenadante ul de main-cultura Centrifugação: 10 min a 3000 xg membrana de fibra de vidro de 1,0 uM | Nenhuma passagem filter = alta viscosidade = positivo |
| Detecção de polímero: Precipitação | 50 ul de filtrado + 150 ul de 2-propanol b Apertar a 10 min à temperatura ambiente e 900 rpm b | Visual: Fibras e flocos = precipitação positiva de polímero |
| consumo de glucose: Glicose-ensaio | A diluição 1: 100: 10 ul de filtrado + 990 ul ddH2O 50 ul + 50 ul alíquota Reagent-mix Incubação de 30 min a 30 ° C, 150 rpm Medição 418-480 nm | Restante da glicose após o cultivo |
| Filtração em gel | Equilíbrio: 3 x 150 mL de NH 4 -acetat tampão de pH 5,6 2 x 2 min a 2000 xg 1 x 2 min a 1000 xg Filtração em gel: 35 ul de filtrado, 2 min a 1000 xg Lavando: 3 x 150 ml de ddH2O, 2 min a 2000 xg 75 ul de etanol a 20% para armazenamento | purificação de polímero: A remoção de sais, piruvato, glicose e outros monómeros de açúcar a partir de sobrenadante de cultura |
| Restante glicose após filtração em gel Glicose-ensaio | Diluição 1:10: 25 ul de ddH2O + 20 ul ddH2O e 5 ul filtrado + 50 ul de reagente de mistura incubação de 30 min a 30 ° C, 150 rpm Medição 418-480 nm | A subtracção de glicose remanescente depois de filtração em gel do método do fenol-ácido sulfúrico-ácido |
| glicose equivalente: Método do fenol-ácido sulfúrico ácido c | 20 ul de gel filtrado + 180 ul de fenol-ácido sulfúrico-ácido (30 ul de 5% (w / v) de fenol em ddH2O + 150 ul de ácido clorídrico cone. De H 2 SO 4 (ρ = 1,84 g / ml)) Apertar a 5 min a 900 rpm Incubação de 35 min a 80 ° C Medição a 480 nm | glicose equivalente: Δ (valor de fenol-sulfúrico-ácido - permanecendo glicose após filtração em gel) <300 mg / L negativo > 300 e <700 mg / L putativo positiva > 700 mg / L positiva |
| uma feita manualmente em condições estéreis (fluxo laminar). | ||
| Líquido inflamável b feita manualmente sob uma coifa. | ||
| c fenol-ácido sulfúrico ácido manuseados com Marca Liquid Handling Station (LHS) sob uma coifa. | ||
Tabela 1:. Fluxo de trabalho completa do prescreening automatizado com o sistema de manipulação de líquidos robótico e da estação de manipulação de líquidos Visão geral de todos os parâmetros para os módulos analíticos automatizados.
| linearidade | LOD | LOQ | ||
| r² um | Slope um | compensar uma | mg / L | mg / L |
| 0,9998 | 0,0007 | -0,021 | 50 | 100 |
| Padrão | b significa | Precision b | precisão b | |
| mg / L | mg / L | CV% | Viés (% de erro) | |
| 5.000 | 5112 | 1.8 | 2.2 | |
| 250 | 265 | 5.3 | 6.1 | |
| uma média de oito medições de calibração, com seis níveis de glucose de 0,1 a 5 g / L | ||||
| b Realizada com um teste t de Student (α = 0,05; n = 8). | ||||
| LOD: o limite de determinação, LOQ: limite de quantificação, CV: coeficiente de variação. | ||||
Mesa 2:Validação do método do fenol-ácido sulfúrico-ácido foi realizado com a estação de manuseamento de líquidos. A linearidade foi calculada com base na calibração seis ponto (n = 8). Média, precisão e exatidão de duas concentrações de glicose exemplarmente escolhidos são dadas aqui.
| linearidade | LOQ | |||
| r² um | Slope um | compensar uma | ? M | |
| sem matriz | 0,99999 | 0,0223 | -0,0019 | 1 |
| 01:10 matriz diluída | 0,99999 | 0,0221 | -0,0011 | 1 |
| Padrão | b significa | Precision b | precisão b | |
| ? M | ? M | CV% | Viés (% de erro) | |
| sem matriz | 50 | 49.96 | 3.05 | -0.09 |
| 1 | 1,04 | 2.95 | 3,86 | |
| 01:10 matriz diluída | 50 | 49,98 | 0,44 | -0.04 |
| 1 | 1.00 | 4,58 | 0,33 | |
| Uma média de três medições, calibração, com seis concentrações de piruvato de 1 a 50? M. | ||||
| b (n = 3) | ||||
| LOQ: limite de quantificação, CV: coeficiente de variação. | ||||
Tabela 3:. Validação da piruvato-ensaio com e sem ácido trifluoroacético-matriz-neutralizada diluída 1:10 duas calibrações e seis pontos (n = 3) com e sem a avaliação foram realizados de influências da matriz. Média, precisão e exatidão de duas concentrações de piruvato exemplarmente escolhidos com e sem efeitos de uma diluição de 1:10 foram calculados.

Tabela 4:.. Os resultados das três estirpes exemplares selecionados com a plataforma de dados coletados a partir da triagem automatizada e a impressão digital de carboidratos favor clamber aqui para baixar esta tabela como um arquivo do Microsoft Excel.
| hidrato de carbono | Absorção max [nm] | A absorção a 480 nm média ± DP | A absorvância relativa à glicose [%] | |
| gum Diutan | 470 | 0,342 | ± 0,010 | 187 |
| A goma de gelano | 472 | 0,334 | ± 0,002 | 183 |
| Goma de guar | 478 | 0,387 | ± 0,017 | 212 |
| Gummi arábica | 476 | 0,393 | ± 0,034 | 215 |
| Ácido hialurônico | 484 | 0,231 | ± 0,011 | 126 |
| A goma karaya | 478 | 0,455 | ± 0,023 | 249 |
| goma konjac | 480 | 0,297 | ± 0,009 | 163 |
| gum larch | 480 | 0,337 | ± 0,032 | 185 |
| goma de alfarroba | 478 | 0,354 | ± 0,033 | 194 |
| escleroglucano | 484 | 0,168 | ± 0,010 | 92 |
| succinoglicano | 482 | 0,168 | ± 0,005 | 92 |
| A goma de tara | 480 | 0,318 | ± 0,016 | 174 |
| tragacanto | 478 | 0,513 | ± 0,003 | 281 |
| goma Welan | 472 | 0,226 | ± 0,016 | 124 |
| Xylan | 472 | 0,567 | ± 0,007 | 311 |
| A goma de xantano | 482 | 0,245 | ± 0,021 | 134 |
| Glicose | 484 | 0,191 | ± 0,014 | 100 |
| SD: desvio padrão | ||||
Tabela 5:. Os resultados tal como obtida pelo método do fenol-ácido sulfúrico-ácido durante 16 polímeros disponíveis comercialmente e glicose O máximo de absorção e de absorção a 480 nm de 16 polímeros disponíveis comercialmente (1 g / l), assim como de glucose (1 g / L ) foram medidos a aplicação do método do fenol-ácido sulfúrico-ácido. Calculou-se a absorvância relativa a glicose de todos os polímeros.
| Padrão | Significar a | Precision um | precisão uma | |
| mg / L | mg / L | CV% | Viés (% de erro) | |
| diluição 1:10 | 450 | 460 | 1.01 | 2.14 |
| 45 | 44,7 | 1.41 | -0.70 | |
| Diluição de 100: 1 | 4.500 | 5026 | 1,19 | 11,6 |
| 450 | 471 | 1.16 | 4.55 | |
| b Realizada com um teste t de Student (α = 0,05; n = 8). | ||||
| CV: coeficiente de variação. | ||||
Tabela 6:. Validação da diluição automatizado para a glicose-ensaio A diluição para a glicose-ensaio após cultivo (1: 100) e, depois de filtração em gel (01:10) foram validados. Duas concentrações de glucose (n = 8) foram diluídos através do sistema de manuseamento de líquidos e avaliadas. Média, precisão e exatidão foram calculados.
| Valor de glicose teórica | Coberta com tapete de silicone cap | Teste de evaporação (descoberto) | |||||
| significar uma | Precision um | precisão uma | significar uma | Precision um | Precisão a </ Strong> | Evaporação | |
| mg / L | mg / L | CV % | Viés (% de erro) | mg / L | CV % | Viés (% de erro) | %erro |
| 45,0 | 45,2 | 0,69 | 0,44 | 46,0 | 0.66 | 2.05 | 1,60 |
| 18,0 | 17,7 | 0.80 | -1,68 | 18,0 | 0,72 | -0.01 | 1,69 |
| 9 | 8,74 | 1.20 | -2,98 | 8,92 | 0,81 | -0.95 | 2.09 |
| 4,5 | 4.50 | 1,26 | -0.04 | 4,58 | 1,57 | 1,76 | 1.80 |
| 1.8 | 1.85 | 0,74 | 2.90 | 2.01 | 2,82 | 11,6 | 8,48 |
| 0,9 | 1,03 | 1,43 | 14.1 | 1.16 | 3,52 | 28,3 | 12.4 |
| A (n = 4) | |||||||
| CV: coeficiente de variação. | |||||||
Tabela 7:. Avaliação do efeito de evaporação de MTP Seis diferentes padrões cobertas e descobertas de glicose (n = 4) foram armazenados no carrossel durante 3,5 h à temperatura ambiente. O efeito da evaporação foi avaliada utilizando descoberto bem como (esteira de silício) coberto amostras padrão. Média, precisão, exatidão e a evaporação em erro% foram calculados.
Antes de filtração em gel| Depois de filtração em gel | Restante glicose após filtração em gel | ||||
| significar uma | SD um | significar uma | SD um | ||
| mg / L | mg / L | mg / L | mg / L | % | |
| 1 | 8647 | 110 | 259 | 121 | 3.00 |
| 2 | 5108 | 56 | 116 | 37 | 2.27 |
| 3 | 2.014 | 12 | 50,8 | 14 | 2.52 |
| 4 | 1015 | 12 | 25,1 | 8.1 | 2,47 |
| 5 | 510 | 4.9 | 12,8 | 4.3 | 2.51 |
| 6 | 223 | 8.6 | 6.6 | 1,5 | 2,94 |
| 7 | 122 | 5.6 | 4.3 | 0,9 | 3,48 |
| 8 | 75 | 6 | 3.1 | 0,3 | 4.18 |
| A (n = 8) | |||||
| SD: desvio padrão | |||||
Tabela 8:. Os resultados da eficiência de filtração em gel oito Padrões de glucose diferentes foram determinadas antes e depois da filtração em gel, para avaliar a eficácia da filtração em gel. A média, o desvio padrão e restante glicose após filtração em gel em% foram calculados.
Discussão
Detecção de polissacárido com o método do fenol-ácido sulfúrico-ácido: Diferentes monossacáridos mostram diferentes máximos de absorção e coeficientes de extinção molar por utilização deste método 9. Isto resulta em diferentes máximos de absorção de polímeros, que contêm vários açúcares em quantidades diferentes. Os diferentes comprimentos de onda de absorção máxima para 16 polímeros disponíveis comercialmente diferentes são dadas na Tabela 5. Os polímeros foram dissolvidos (1 g / L) em ddH2O, agitada (150 rpm) durante a noite e medida com o-ácido-método do fenol-ácido sulfúrico . gum Diutan apresentou o menor absorção máxima a 470 nm ácido e escleroglucano e hialurônico a mais alta em 484 nm. Com base nestes resultados 480 nm foi escolhido para esta plataforma de triagem. A absorvância relativa dos polímeros foi calculado com base na absorvância obtida com 1 g / L de glucose (estabelecida como 100%). Os menores resultados foram obtidos com escleroglucano e succinoglicano, ambos com 92%. Este foi expected escleroglucano porque contém apenas glicose e succinoglicano contém glucose e de galactose numa razão de 7: 1. Ambos os polímeros comerciais têm diferentes perdas de secagem e diferentes teores de cinzas, esta é a razão pela qual o valor teórico de ~ 110% não foi atingida. Xylan apresentou a maior absorvância relativa com 311%. A razão para isto é o coeficiente de extinção molar elevada conseguida a partir de xilose, devido à forma de furanose mais dominante. A um nível de 0,1 g / L de glucose ao limite de quantificação foi alcançada, bem como o limite de detecção, a uma concentração <0,05 g / L. No entanto, o limite de detecção para as estirpes positivas no rastreio é maior do que 0,7 g / L e, por conseguinte, o ensaio mostrou um bom desempenho. A fim de obter resultados fiáveis, os restantes de glicose após filtração em gel foi determinada com um ensaio de glucose-e este valor foi subtraído o valor do método do fenol-ácido sulfúrico-ácido.
diluição glucose-ensaio automatizado: O desempenhoda determinação da glucose depois de cultivo (diluição 1: 100) foi investigada. Por isso, 10 ul de sobrenadante foram transferidos para 990 jil de ddH2O numa placa de poços profundos e misturados através de dez vezes de distribuição de aspiração e 180 ul para fora desta diluição. O segundo passo crítico foi a pipetagem correcta de apenas 5 ul alíquota para a diluição de 1:10 da glicose-ensaio depois de filtração em gel. A fim de gerar a diluição de 25 uL de ddH2O, foram transferidos com uma ponta 50 ul-início, depois 20 uL de ddH2O e 5 ul de gel filtrado foram aspirados em conjunto. Isto garante uma melhor remoção da alíquota de 5 ul para fora da ponta. Ambos os passos de diluição foram verificados com várias normas de glicose por meio de um ensaio de glucose-. Os resultados para duas concentrações exemplares são dadas na Tabela 6, O. 1: 100 de diluição para a determinação do teor de glucose após cultivo mostraram alta precisão para ambos os padrões, com um CV & #60; 1,2%. Ao mesmo tempo, a precisão para o padrão mais elevado era até 11,6 (erro%). No entanto, esta é insignificante como a determinação da glicose representa apenas o teor de glucose remanescente após o cultivo e, portanto, não é importante para a detecção de polímero. A diluição de 1:10 para o restante da glicose após filtração em gel mostrou resultados muito confiáveis com um CV <1,4% e uma precisão <2,1% de erro.
Consideração da evaporação: O rastreio requer 3,5 horas a partir do primeiro passo para o primeiro glicose-ensaio. A fim de descobrir se este período de tempo tem uma influência sobre o armazenamento MTP uncapped, 50 ul de padrões de calibração de glicose-ensaio foram armazenadas com e sem cobertura para 3,5 horas no carrossel robô. Na gama de calibração (45 a 4,5 mg / L) a concentração da amostra não aumentou. Um aumento - causado por evaporação - estava abaixo de 2,1% e apenas para as duas concentrações mais baixas (1,8 e 0,9 mg / L) chegou-se a 12,4% ( Tabela 7).
Filtração em gel: Quantidades elevadas de glicose metabolizada não perturbar a detecção quantitativa de glicose a partir do polímero hidrolisado. Portanto, um passo de filtração em gel foi necessário para remover o remanescente de glucose após o cultivo. Além disso, o gel-filtração purifica o polímero contendo sobrenadante a partir de sais de hidratos de carbono e compostos monoméricos, outros do que a glicose, para minimizar o fundo na análise analítica monómero. No passo de filtração em gel de 35 ul de filtrado foram colocados no centro do poço. Para a validação da robustez de filtração em gel no sistema automatizado, oito padrões de calibração a partir de 0,045 até 9 g / L de glucose foram filtrados (n = 8). A glicose de cada concentração foi sempre reduzida em mais de 95% do valor inicial (Tabela 8). Ao fazê-lo, a filtração em gel, mostrou resultados muito bons para várias concentrações de glucose. Além disso, o restante da glicose após gel-filtration também foi determinada com um ensaio de glucose-e subtraída a partir da determinação de fenol-ácido sulfúrico-ácido para receber a quantidade correcta de equivalente de glucose para o polímero hidrolisado.
Piruvato-ensaio: Em primeiro lugar, investigou-se se o neutralizada e diluída (1:10) de TFA-matriz a partir do passo de hidrólise interfere com a reacção enzimática. Portanto, o ensaio completo foi realizado duas vezes, uma vez com e uma vez sem matriz e mostrou resultados fiáveis. Finalmente, o teor de piruvato de 16 polímeros disponíveis comercialmente foi medida com sucesso e está representado na Figura 3. É do conhecimento geral que a partir desses polímeros única succinoglicano 16 e xantano contêm naturalmente piruvato. Com o nosso ensaio de piruvato-ambos estes polímeros foram correctamente identificadas. Em escleroglucano, goma welan e piruvato xilano também foi detectada em quantidades significativas. Em geral, a capacidade de a abordagem foi validado e a piruvato-ensaio showed um alto desempenho. Está provado ser capaz de detectar o piruvato em polímeros diferentes após hidrólise.
impressão digital de carboidratos: Após a realização de todos os módulos analíticos na triagem automatizada, foram selecionados produtores de EPS potenciais para a análise de carboidratos impressão digital. Para isso, foram aplicados diversos critérios: 1) a observação positiva da viscosidade após a centrifugação e / ou após a filtração. 2) precipitação antes e depois da filtração. fibras observadas e flocos foram avaliados como positivos. 3) valor de equivalente de glucose a partir do método do fenol-ácido sulfúrico-ácido. Valores de> 700 mg / L foram classificados como positivo e valores entre 300 e 700 mg / L foram classificados como produtores de EPS putativos. Quando dois ou três critérios foram avaliados como positivos, foram selecionadas as linhagens para posterior análise de impressões digitais de carboidratos. Os critérios pode ser personalizado para o efeito individual do EPS (por exemplo, rastreio EPS baixa viscosidade). A nossa abordagem com vista a encontrar efficient EPS produtores. Ao procurar por cepas que produzem apenas pequenas quantidades de EPS o limite de avaliação da glicose equivalente deve ser reduzida.
benefício técnico e aplicações futuras: Uma característica interessante deste protocolo é o caráter modular das etapas e os diferentes módulos analíticos. Eles podem ser combinados de maneiras diferentes, ajustado aos requisitos individuais e novos módulos pode ser facilmente implementado. Além disso, os módulos de análise pode ser usado separadamente, por exemplo, o módulo de hidrólise em combinação com o módulo de HT-PMP-derivatização é capaz de realizar uma análise de composição monomérica a partir de soluções de polímeros diferentes (1 g / l) em formato de 96 poços. Para laboratórios sem ter acesso a um sistema de manipulação de líquidos ao rastreio completo possa ser manipulado manualmente, sem qualquer alteração no esquema de pipetagem. No entanto, usando um sistema de manuseamento de líquidos aumenta a taxa de transferência de até 768 estirpes (em vez de 192 estirpes se screened manualmente) por dia. O protocolo que é descrito aqui é capaz de uma triagem para géneros diferentes e, portanto, para a triagem de grandes coleções de tensão para identificar produtores novas EPS e analisar a sua impressão digital de carboidratos em uma abordagem (Figura 4). Além disso, um rastreio alvo de polissacarídeos contendo açúcares raros como fucose, ácidos urónicos ou mesmo açúcares desconhecidos pode ser realizada através da análise de monossacarídeos detalhado. Além disso, diferentes combinações de açúcar em proporções definidas podem ser detectados. Isso permite que a simples identificação de variantes estruturalmente relacionados de EPS já conhecidos ou novos EPS.
Divulgações
We have nothing to disclose.
Agradecimentos
We sincerely thank Thomas Howe and Jörg Carsten for the programming and technical support with the liquid handling systems.
Materiais
| Name | Company | Catalog Number | Comments |
| 96 well deep well plate 2.0 ml (DWP) | Greiner Bio-One | 780271 | Main-culture (CP 1-1 to 1-4), equilibration plates for gel-filtration (CP 1-6, 1-7, 2-6 and 2-7), 1:100 dilution for the glucose assay (CP 4-1 to 4-4) containing 990 µl of ddH2O |
| Breathable Sealing Film | Axygen | BF-400-S | Incubation film for pre- and main-culture DWP |
| Aluminum Sealing Film | Axygen | PCR-AS-200 | -80 °C storage film for glycerol-stock plates |
| MCA96 Nested Disposable Tips 200 µl | TECAN | 30038619 | Worktable position (WTP 2-1 to 2-4) |
| A/B glass-filter-plate 1 µm | Pall Corporation | PN 8031 | Stored on collector plate (CP 2-1 to 2-4) |
| 96-well micro titer plate V-Bottom | Greiner Bio-One | 651201 | Collector plate for filtration plate (CP 2-1 to 2-4) |
| 96-well SpinColumn G-25 | Harvard Apparatus | 74-5612 | Stored on washing DWP (CP 1-6, 1-7, 2-6 and 2-7) |
| 96-well micro titer plate V-Bottom | Nunc | 249944 | Collector plate for gel-filtration plate (CP 3-1 to 3-4) |
| Nested Disposable Tips SBS 50 µl tips | TECAN | 30038609 | Carousel position (CP 4-6, 4-7 and 5-1 to 5-6) |
| Trough 250 ml | Axygen | Res-SW96-HP | Water WTP 1-1, Glucose assay reagent-mix WPT 1-2, ammonium-acetate buffer pH 5.6 (CP 5-7) |
| 96-well micro titer plate F-Bottom (MTP) | Greiner Bio-One | 655101 | precipitation 1 (CP 6-1 to 6-4), pH-value (CP 7-1 to 7-4), precipitation 2 (CP 8-1 to 8-4), phenol-sulfuric-acid method (CP 8-5 to 8-8), glucose-assay (CP 9-1 to 9-9), dummy plates (WTP 3-1, 3-2) |
| 96-well silicon cap mat | Whatmann | 7704-0105 | Cover mat for MTP |
| 200 µl pipette tips | Sarstedt | 70.760.002 | For manually handling |
| 1,000 µl pipette tips | Sarstedt | 70.762 | For manually handling |
| 96-well-PCR micro titer plate | Brand | 781350 | Hydrolysis, PMP-derivatisation |
| TPE (thermoplastic elastomer) cap mat | Brand | 781405 | Hydrolysis, PMP-derivatisation |
| Filter plate 0.2 µm Supor | Pall Corporation | PN 8019 | Filtration of samples for UHPLC-ESI-MS analysis with a MTP collector plate |
| Pipette Tips LHS 5-300 µl | Brand | 732150 | Brand LHS system |
| Glucose oxidase | Sigma-Aldrich | G2133 | Glucose-assay |
| Horseradish peroxidase | Sigma-Aldrich | P6782 | Glucose-assay, pyruvat-assay |
| DA-64 (N-(Carboxymethylaminocarbonyl)-4.4'-bis(dimethylamino)-diphenylamine sodium salt) | Wako Chemicals GmbH | 043-22351 | Pyruvat-assay |
| Pyruvate oxidase | Sigma-Aldrich | P4591 | Pyruvat-assay |
| Potassium phosphate dibasic | Carl-Roth | P749.3 | Pyruvat- and glucose-assay |
| Potassium phosphate monobasic | Carl-Roth | 3904.3 | Pyruvat- and glucose-assay |
| Thiamine pyrophosphate | Sigma-Aldrich | C8754 | Pyruvat-assay |
| Magnesium chloride hexahydrate | Sigma-Aldrich | 31413 | Pyruvat-assay |
| 2-Propanol | VWR | 20922.466 | Precipitation |
| Phenol | VWR | 20599.231 | Phenol-sulfuric-acid method |
| Sulfuric acid | Carl-Roth | 4623.4 | Phenol-sulfuric-acid method |
| Trifluoroacetic acid | Sigma-Aldrich | T6508 | Hydrolysis |
| Ammonium solution | Carl-Roth | P093.1 | Hydrolysis, PMP-derivatization |
| Ethanol absolut | VWR | 20821.321 | Hydrolysis, PMP-derivatization |
| Phenol red | Alfa Aesar | B21710 | Hydrolysis, PMP-derivatization |
| 1-Phenyl-3-methyl-5-pyrazolone | Sigma-Aldrich | M70800 | PMP-derivatization |
| Methanol LC-MS | VWR | 83638.320 | PMP-derivatization |
| Acetonitril LC-MS | VWR | 83040.320 | PMP-derivatization |
| Acetic acid | Sigma-Aldrich | 338826 | PMP-derivatization |
| Ethanol absolut | VWR | 20821.321 | PMP-derivatization |
| Methyl red | Alfa Aesar | 36667 | pH-value |
| Robotic liquid handling system | Tecan | Freedom EVO | Worktable setup in Figure 2 |
| Liquid handling station LHS | Brand | 709400 | Worktable setup in Figure 2 |
| Tip-Adapter | Brand | 709434 | Worktable setup in Figure 2 |
| Liquid Ends MC 20-300 µl | Brand | 709416 | Worktable setup in Figure 2 |
| Adapter 60 mm | Brand | 709430 | Worktable setup in Figure 2 |
Referências
- Milani, J., Maleki, G., Valdez, B. Ch. 2, Hydrocolloids in Food Industry. Food Industrial Processes - Methods and Equipment. 2, (2012).
- Thibodeau, A. Protecting the skin from environmental stresses with an exopolysaccharide formulation. Cosmet Toiletries. 120 (12), 81-90 (2005).
- Prajapati, V. D., Jani, G. K., Zala, B. S., Khutliwala, T. A. An insight into the emerging exopolysaccharide gellan gum as a novel polymer. Carbohydr Polym. 93 (2), 670-678 (2013).
- Schmidt, W., Brouwers, H. J. H., Kuehne, H. C., Meng, B. The working mechanism of starch and diutan gum in cementitious and limestone dispersions in presence of polycarboxylate ether superplasticizers. Appl. Rheol. 23 (5), 52903 (2013).
- Srinivasan, R. Natural Polysaccharides as Treatment Agents for Wastewater. Green Materials for Sustainable Water Remediation and Treatment. , 51-81 (2013).
- Rühmann, B., Schmid, J., Sieber, V. High throughput exopolysaccharide screening platform: From strain cultivation to monosaccharide composition and carbohydrate fingerprinting in one day. Carbohydr Polym. 122, 212-220 (2015).
- Ortega-Morales, B. O., et al. Characterization of extracellular polymers synthesized by tropical intertidal biofilm bacteria. J Appl Microbiol. 102 (1), 254-264 (2007).
- Xu, R., Ma, S., Wang, Y., Liu, L., Li, P. Screening identification and statistic optimization of a novel exopolysaccharide producing Lactobacillus paracasei HCT. Afr. J. Microbiol. Res. 4 (9), 783-795 (2010).
- Dubois, M., Gilles, K. A., Hamilton, J. K., Rebers, P. A., Smith, F. Colorimetric method for determination of sugars and related substances. Anal. Chem. 28 (3), 350-356 (1956).
- Masuko, T., et al. Carbohydrate analysis by a phenol-sulfuric acid method in microplate format. Anal Biochem. 339 (1), 69-72 (2005).
- Geater, C. W., Fehr, W. R., Wilson, L. A., Robyt, J. F. A more rapid method of total sugar analysis for soybean seed. Crop Sci. 41 (1), 250-252 (2001).
- Sutherland, I. W., Dumitriu, S. Ch 16, Microbial Exopolysaccharides. Polysaccharides Structural Diversity and Functional Versatility. , 431-457 (2005).
- Wingender, J., Neu, T. R., Flemming, H. C., Wingender, J., Neu, T. R., Flemming, H. C. What are Bacterial Extracellular Polymeric Substances?. Microbial extracellular polymeric substances: characterization, structure and function. , 258 (1999).
- Rühmann, B., Schmid, J., Sieber, V. Fast carbohydrate analysis via liquid chromatography coupled with ultra violet and electrospray ionization ion trap detection in 96-well format. J. Chromatogr. A. 1350, 44-50 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados