Method Article
자동화 모듈 높은 처리량 엑소 폴리 사카 라이드 심사 플랫폼은 매우 민감한 탄수화물 지문 분석과 결합
요약
We present an automated modular high-throughput-method for the identification and characterization of microbial exopolysaccharides in small scale. This method combines a fast preselection to analyze the total amount of secreted polysaccharides with a detailed carbohydrate fingerprint to enable the fast screening of newly isolated bacterial strains or entire strain collections.
초록
많은 미생물 생산 및 의료 분야, 식품 응용 프로그램 또는 석유 기반 화학 물질의 교체에 중요한 영향을 미칠 엑소 폴리 사카 라이드 (EPS)을 분비 할 수있다. 우리는 유형 및 미생물에 의해 생성 된 EPS 량의 빠르고 신뢰성 분석을 가능하게하는 액체 핸들링 시스템을 자동화 할 수있는 분석 플랫폼을 기술한다. 이것은 사용자가 새로운 천연 미생물 엑소 폴리 사카 라이드의 생산을 확인하는 고 처리율 (HT)에 하루 내에 해당 중합체의 탄수화물 지문 분석을 가능하게한다. 이 플랫폼을 사용, 엔지니어링 접근 방법에서 얻을 수 있습니다 변형 컬렉션뿐만 아니라 변형 변종의 라이브러리를 스크리닝 할 수있다. 이 플랫폼은 두 개의 주요 부분으로 프로토콜의 분리를 할 수있는 모듈 설정을 가지고 있습니다. 첫째, 다른 다당류 검출 모듈을 결합한 자동 선별 시스템이있다 : viscosit의 반 정량 분석원심 분리 공정과, 알코올 침전 법을 통해 형성 중합체의 분석 및 페놀 황산 변환을 통해 총 탄수화물 함량의 측정을 통해 Y 형성. 여기서, 실행 당 384 균주까지 선별 할 수있다. 두 번째 부분은 두 개의 핵심 모듈을 조합하여 처음 부분에서 식별 된 모든 선택된 EPS 생산자 상세한 단당류 분석을 제공한다 : 자외선 및 전기 분무 이온화 이온 트랩 검출 (결합 초 고성능 액체 크로마토 그래피를 통해 전체 단량체 조성물의 분석 UHPLC-UV-ESI-MS) 및 색상 형성에 결합되는 효소 적 산화를 통해 중합체 치환기 (피루브산 케탈 존재)로서 피루브산의 결정. 이 스크리닝 플랫폼의 전체 분석 모듈은 다른 방법으로 결합 된 개별 요건에 조정될 수있다. 또한, 그들 모두는 수동으로 처리되거나 액체 핸들링 시스템으로 수행 될 수있다. 이에 따라, 심사 괞 찮아다양한 EPS에서 폼을 식별하기 위해 큰 유연성을 가능하게한다.
서문
미생물 엑소 폴리 사카 라이드 (EPS)은 다양한 생물학적 기능을 수행 고분자의 구조적으로 매우 다양한 그룹입니다. 그들은 일반적으로 다른 단량체의 종류 (설탕, 설탕 유도체, 설탕 산), 이들 단량체 및 대체 사이의 결합에 의해 구별된다 복잡한 반복 단위의 내장되어 있습니다. 미생물 다당류의 구조적 다양성은 음식 1 등 다양한 분야에서 자신의 응용 프로그램을 수 있도록이 분자 클래스, 화장품, 3, 건설 화학 4 물 처리 (5)의 회원들에게 오히려 다른 특성을 부여한다. 상기 신규 한 자연 미생물 다당류의 식별뿐만 아니라 구조적 변형 엔지니어링 유망한 접근법을 대표 이러한 바이오 기초 및 지속 고분자의 응용 분야를 확장한다. 어느 쪽의 방법은, 빠른 스크리닝 방법을 신속하게 파묻혀에 대한 미생물 균주의 광대 한 수를 스캔하는 데 필요R 다당류 형성하고, 자신의 제품을 분석. 따라서, 최근 단량체 조성물 (6)의 식별을 포함하는 천연의 분리 물 또는 조작 된 변이체 균주의 미생물 다당류 생산의 분석을 위해 96- 웰 HT-스크리닝 플랫폼을 개발했다.
~ 500 천연 균주의 제 선별 라운드이 플랫폼에 적용하는 것은 우리가 EPS를 생성 할 수있는 바와 같이 약 10 %의 절연 균주 20를 식별 할 수 (데이터는 보이지 않음). 이 분석 균주 80-90 %의인가 조건하에 EPS 생성되지 않았고, 따라서, 상세한 탄수화물 지문의 추가적인 분석이 필요없는 것을 의미한다. 단량체 조성물이 고도의 식별로서 특히 데이터 분석을 위해 빠르고 사전 스크리닝 방법은, EPS 생산 양성 균주를 식별하는 효율을 대폭 증가하는 시간 소모적 인 과정이다. 또한, 시약,UHPLC-UV-ESI-MS에서 소모품 및 측정 시간을 단축 할 것이다. 한편 상기 방법은 매우 신뢰성있는 반면 또한, 상이한 분석 모듈, 병렬로 두 개 이상의 96- 웰 플레이트의 수동 조작이 복잡 한편이며, 같은 방법의 모든 가능성을 제한한다. 이러한 이유로, 우리는 자동 검사 플랫폼을 개발하기로 결정했다. 따라서 흡광도 측정에 기초하여, 전체 당 함량의 전자동 고속 검출 방법 기존 탄수화물 지문 기술의 모듈 형식 조합.
페놀 황산 방법은 아직 세균과 식물 다당류 7,8의 전체 탄수화물 함량의 빠른 측정을위한 선택의 방법을 나타낸다. 이 방법은 먼저 96 웰 플레이트 10, 11에서도 작은 규모에 대해, 다른 응용 프로그램 및 샘플 크기에 뒤부아 등. (9)에 의해 기술 및 적응했다. 프NOL - 황산 방법은 모든 모노머, 올리고머 및 폴리머 샘플의 탄수화물을 합하여, 하나의 값에 의해 전체 탄수화물 함량을 측정한다.
고려 이러한 측면을 고려하여 적합한 배양 배지의 선택은이 방법을 적용하는 것이 필수적이다. 올리고머 또는 효모 추출물 등의 탄수화물 고분자 화합물을 함유하는 복합 미디어 변경된 중합체 함량을 초래할 수도 있으므로, 엄밀 피해야한다. 또한, 설탕의 높은 금액은 균주의 배양을위한 C 소스로 사용됩니다. 배양 과정에서 남은 탄수화물 높은 수준의 부정적인 EPS 함량의 측정을 방해 할 수있다.
따라서, 정의 된 순수한 당류의 사용이 권장된다. 실험에서는 세포의 배양을 위해 포도당을 사용 하였다. 배양 후 남은 글루코스는 겔 여과를 통해 감소 및 혈당 분석을 통해 측정 하였다. 마지막으로, 포도당 당량다당류들 페놀 황산 방법에 의해 검출되었다 전체 탄수화물 함량에서 겔 여과 후 남은 글루코스를 뺌으로써 계산 하였다. 페놀 - 황산 방법과 함께 젤 여과 및 포도당 분석은 신뢰할 수있는 결과를 보장하고 우리의 첫 번째, 완전히 자동화 탐지 시스템 인 할 수있다.
침전 점도 증가의 관찰 : 두 개의 새로운 분석 모듈은 EPS 검출 시스템에서의 정보의 양을 증가시키기 위해 자동화 된 스크리닝 플랫폼으로 하였다.
다양한 EPS - succinoglycan 예, 크 산탄 및 결장 산 12 - 당 위치 C4 및 C6에 비 탄수화물 피루브산 케탈로 변형되는 것으로보고되어있다. (단 숙시 반 에스테르 또는 우 론산 등) 그 피루브산 케탈 물리적 prope에 따라서 음이온 성질에 기여2가 양이온의 다리 (13)를 통해 상호 작용함으로써 중합체 rties. 그 특정 중합체를 식별하기 위해서 피루 베이트의 결정은 또 다른 추가 분석 모듈로 설립되었다. 이 다당류 치환기 잠재적 거시적 성질에 대한 정보를 증가시킨다.
모든 모듈을 결합하면 다른 EPS의 식별뿐만 아니라 EPS 생산의 신속하고 효율적인 결정을 할 수 있습니다. 그 방법으로 심사 플랫폼은 두 개의 주요 부품 (그림 1)으로 구분 될 수있다. 자동 검사 (파트 I) 워크 플로가 완전 자동화 발생 이내 (표 1) 신속 균주를 생산하는 EPS를 미리 선택합니다. 탄수화물 지문 분석 (파트 II)를 정량적으로 미리 선택된 균주에 의해 생성 된 EPS의 단량체 조성물을 결정한다. 이에 따라, 데이터 분석은 큰 변형 모음 스크리닝을 최적화하기 위해 최소화되었다. 이하나의 자동화 된 검사 실행에 하루 768 균주의 하루 가능 2 실점으로 384 균주를 분석 할 수있는 가능성을 제공합니다. 또한, 탄수화물 지문 분석은 모든 확인 된 EPS의 더욱 상세한 개요를 제공합니다. 이 감독 분석 및 EPS의 이미 설명한 화학 구조에 비해 약간 다른 EPS 변형 또는 완전히 새로운 식별 할 수 있습니다.
프로토콜
1. 자동 검사
주 : 모든 액체 처리 단계는 로봇 액체 핸들링 시스템으로 수행된다. 로봇 작업대의 구성은도 2에 제시된다. 특별히 언급되지 않는 한 모든 소모품 스토리지 컨베이어에 저장된다. (CP 회전 목마 위치 사이의 모든 자동화 된 검사를위한 로봇 매니퓰레이터 (RM) 소모품 이동, (그래서 중합 효소 연쇄 반응 플레이트 (PCR 플레이트)과; 마이크로 타이 터 플레이트 (MTP) 깊은 우물 판 (DWP))를 단계 ) 및 작업대 위치 (WTP). 모든 피펫 단계는 특별히 언급 된 경우를 제외하고, 96 채널 피펫 암에 수행된다. 모든 단계는 프로그래밍 된 96 웰 형식으로 자동으로 수행된다.
- 스트레인 재배 (그림 1의 작업 1)
참고 : 균주를 생산하는 추정 EPS의 접종 및 멸균 조건 (층류)에서 배양 판의 밀봉을 처리합니다. 자동화빠른 검사는 실행 당 네 개의 96 웰 플레이트를 처리 할 수 있습니다. 여러 장군의 다른 균주는 이미 6을 시험 하였다.- 수동 96 웰 글리세롤 재고 플레이트에서 96 핀 복제와 사전 문화 (A DWP 1 ML의 EPS 미디어) 접종. 증발을 방지하기 위해 통기 할 수 있도록 통기 밀봉 막과 커버 플레이트. MTP-통에 1,000 rpm에서 48 시간 동안 30 ° C에서 품어.
- 50 μl를 12 채널 다중 피펫을 사용하여 예비 - 배양과 동일한 조건 하에서 배양한다 예비 배양의 10 μl를 전달함으로써 주 문화 (a DWP 990 μL의 EPS 매체)을 접종한다. 성장하지 않는 모든 균주의 메모를 가져 가라.
- 로봇 작업 테이블과 저장 회전 목마의 준비
- 저장 회전 목마에서 올바른 위치에 자재 및 장비에 나열된 모든 소모품을 제공합니다. 제 100 희석 : 1의 DWP의 각 웰에 두 번 증류수 990 μL (O DDH 2)를 추가전자 포도당 분석 (회전 목마 위치 4-1 4-4).
- 작업대 위치 (WTP) (11) DDH 2 O 150 ㎖를 포함하는 250 ㎖의 골을 정렬합니다.
- 50 ml의 글루코스 측정 시약 믹스 (4 ml의 500 mM의 인산 칼륨 (PH 5.7), 1.5 ㎖의 50 mM의 2.2 azinobis- (3ethylbenzthiazoline) -6- 술폰산 2 ml를 100 U 글루코스 옥시 다제를 포함하는 250 ㎖의 홈통을 침착 10 ㎕의 1000 U의 고추 냉이 퍼 옥시 다제 및 위치 WTP 1-2에서 42.49 ML의 DDH 2 O).
- 위치 WTP 3-1과 3-2에서 두 개의 빈 더미 F-바닥 MTPs를 놓습니다.
- , 통기성 밀봉 필름을 제거 1-1 1-4 회전 목마 위치 (CP)의 주 문화를 할당하고 자동화 된 로봇 프로그램을 시작합니다.
- 젤 여과 플레이트의 평형
주 :이 선별시 사용하는 겔 여과 플레이트를 재사용 할 수있다. 이를 위해, 20 ° C에서 2 분 동안 2,000 XG에 DDH 2 O의 150 ㎕를 각 세척 및 원심 분리기 세 번. 그 후, 4에 저장20 % 에탄올 75 μL와 C를 ° 및 실리콘 캡 매트 커버.- WTP 3-3 5mM의 아세트산 암모늄 완충액 (pH 5.6)을 250 ml의 트로프 (CP 5-7)를 이동.
- 4-4로 WTPs 4-1 회전 목마에서 겔 여과 판 (CP 1-6, 1-7, 2-6 및 2-7)를 전송합니다.
- 대기음 초산 암모늄 완충액 150 ㎕를 200 ㎕의 팁을 사용하여 평형화 모든 겔 여과 판의 중심으로 분배.
- (20 ° C에서 2000 × g으로 2 분) 원심 분리로 겔 여과 플레이트를 옮긴다.
- 단계 1.3.3, 1.3.4과 1.3.3를 반복 작업 테이블로 다시 접시를 전송합니다. 겔 여과 판의 탈수를 방지하기 위해, 원심 분리 단계를 반복하지 않는다. 다시 회전 목마 내에서 평형 겔 여과 판을 보관하십시오.
- 원심 분리를 통해 세포 제거 (그림에서 작업 한 1)
, 심사 방법 내에서 낮은 배경을 보장하기 위해 무료로 세포를 분석 참고 :EPS는 상층 액 만 포함하고 배양 한 후 원심 분리를 통해 세포를 제거합니다.- (20 ° C에서 4,300 XG에 30 분) 원심 분리기에 회전 목마 (1-4 1-1)에서 주요 문화 DWP를 전송합니다.
- 주 문화를 처리하기 위해 RM을 통해 작업 테이블을 준비합니다.
참고 : 단계 1.4.2를 들어 시스템이 항상 병렬로 두 판을 처리하고 다음 두 판의 모든 단계를 반복 1.4.3.5 할 수 있습니다.- 여과 전에 강수량의 경우 4-1과 5-1 WTP하는 CP (6-1, 6-2)에서 MTP를 이동합니다. 4-2 및 5-2 WTP하는 CP 7-1과 7-2에서 pH의 표시 MTPs를 이동합니다.
- 4-3 및 5-3 WTP 위해 CP (2-1, 2-2)에서, 집 전판과 함께 여과 플레이트를 옮긴다. 4-4 및 5-4 WTP하기 위해 원심 분리기에서 주요 문화 DWP 1-1과 1-2를 변경합니다.
- 분석 모듈을 준비합니다.
참고 : 팁 저장 (위치 2-4 2-1) 200 μl의 팁을 가져 가라. 소모품을 감소시키기 위해, 단계 1과 동일한 팁 세트를 사용.4.3.1.- 여과 판에 주 배양 상층 액 180 μl를 전송합니다. 대기음 150 주 문화 뜨는에서 ㎕를 여과 전에 침전에 대한 MTP로 50 μL와 pH에 표시 플레이트에 100 μl를 분배.
참고 : pH의 결정이 필수적인 것은 아니다; 그러나, 다단계 피펫으로 각 웰에 12.5 ml의 메틸 레드 인디케이터 (50 ㎖ 에탄올 중 50 mg)을 첨가 한 후에는 높은 산 생산 균주를 나타낸다. 이 정보는 상위 버퍼의 농도를 갖는 제 2 스크리닝 예 더 배양에서, 대 (낮은 pH에서) 성장 억제를 방지하는데 유용 할 수있다. 또한, 낮은 pH는 산성 환경에 대해 세포를 보호하기 위해 EPS 생산을 유도 할 수있다. - 제 2 주 배양 접시 단계를 반복 1.4.3.1. 신선한 팁 세트를 사용합니다.
- 원심 분리기에 여과 판을 이동하고 carous에 자신의 홈 위치로 다시 작업 테이블에서 다른 모든 플레이트를 제거엘자.
- 세 번째와 네 번째 주 문화 판에 대한 1.4.3.3로 단계 1.4.2.1를 반복합니다.
- 그들은 회전 목마 (점도 제어)로 다시 전송하는 경우 쇼, 주요 문화 판의 원심 분리 후 침전 감소하는 발효 국물의 메모를 가져 가라.
- 여과 판에 주 배양 상층 액 180 μl를 전송합니다. 대기음 150 주 문화 뜨는에서 ㎕를 여과 전에 침전에 대한 MTP로 50 μL와 pH에 표시 플레이트에 100 μl를 분배.
- 전체 셀 제거 96 웰 여과 (그림 1의 작업 2)
주 : 여과 단계는 상기 검사에 포함되는 점성 발효액으로부터 세포 제거를 보장하기 위해.- 20 ° C에서 10 분 동안 3,000 XG에서 여과 플레이트를 원심 분리하여 다시 자신 컨베이어 홈 위치로 가져온다.
- 겔 여과 판을 준비합니다.
- 20 ° C에서 2 분 동안 1,000 XG에서 원심 분리기와 스핀의 회전 목마에서 평형 겔 여과 판을 이동합니다.
- (44)에 WTP 4-1 원심 분리기에서 겔 여과 판을 전송합니다.
- 신선한 젤 이동WTP에 CP에서 (3-1 3-4) -filtration 집 플레이트 (5-1 5-4).
- 신선한 집 전판 (5-4 5-1)으로 (4-4에 WTP 4-1)을 평형 겔 여과 판을 전송합니다.
- 위치 5-1과 5-2를 제외하고 작업 테이블을 청소하고 4-1의 위치를 위치를 5-1로 이동합니다.
- 여액을 처리하기 위해 RM을 통해 작업 테이블을 준비합니다.
참고 : 시스템을 1.6.3.5하기위한 단계 1.5.3은 병렬로 두 판을 처리하고 다음 두 판의 모든 단계를 반복합니다.- WTP 3-3과 3-4에 회전 목마 (4-6 및 4-7)에서 50 μl의 팁을 이동합니다.
- 작업대 (4-4 및 5-4)에 3-2로 CP (3-1)에서 여과 판을 전송합니다.
- 4-2 및 5-1 WTP하기 위해 CP 4-1과 4-2에서 포도당 소비 검출 : (100 희석 1) DWP를 변경합니다.
- 4-3 및 5-3 WTP하는 CP 8-1과 8-2에서 여과 한 후 두 번째 강수량의 MTP를 이동합니다.
- 집 전판에서 여과 판을 들어 올려의 (WTP 4-4 및 5-4)와 WTP 3-1과 3-2로 이동합니다.
- 여과 후 분석 모듈을 준비합니다. 소모품을 감소시키기 위하여, 단계 1.5.4.1 및 1.5.4.3에 동일한 팁 세트를 사용한다.
- 포도당 - 분석 (포도당 소비)에 대한 50 μl의 팁을 타고 DWP에 여과 액의 10 μL 나누어지는 피펫 (100 희석 1).
- 피펫 평형화 된 겔 여과 판의 중심 여액 35 μL 침전에 사용되는 MTP 50 μL.
- 반복 초 여과 판에 대한 1.5.4.2에 1.5.4.1 단계를 반복합니다.
- 원심 분리기에 겔 여과 판을 이동하고 회전 목마의 홈 위치로 다시 작업 테이블에서 다른 판을 이동합니다.
- 반복 세 번째와 네 번째 여과 판에 대한 1.5.4.4에 1.5.3.1 단계를 반복합니다.
- 필터 플레이트에 잔류으로 표시된 바와 같이 점성이 높은 상층 액의 회전 목마 걸릴 노트, 다시 모든 판의 저장 (높은 V 후여과 단계 후에 점성도 제어). 여과 액의 부족은 다음과 같은 분석 모듈에서 위음성 결과로 이어질 수 있습니다.
- 96 웰 젤 여과를 통해 포도당의 제거 (그림에서 작업 3 1)
- 20 ℃에서 2 분 동안 1,000 XG에서 겔 여과 플레이트를 원심 분리기.
- 겔 여과 액을 처리 로봇 머니퓰레이터 통해 작업대를 준비한다.
- WTP 3-3과 3-4에 회전 목마 (5-3 및 5-4)에서 50 μl의 팁을 제공합니다.
- 겔 여과 후 남은 포도당의 결정에 대해 4-1과 5-1 WTP하는 CP 9-1과 9-2에서 두 MTPs 이동합니다.
- 페놀 - 황산 방법의 경우 4-2과 5-2 WTP하는 CP 8-5과 8-6에서 두 MTPs 이동합니다.
- WTP (4-3 및 5-3)로 원심 분리기에서 두 겔 여과 판을 전송합니다.
- 집 전판 (4-3 및 5-3)에서 겔 여과 판을 들어 올려 3-1, 3-2 WTP로 이동.
- 겔 여과 액을 처리 로봇 머니퓰레이터 통해 작업대를 준비한다.
참고 : 소모품을 줄이기 위해 사용하는 것과 동일한 팁 - 설정 단계 1.6.3.1 및 1.6.3.2에 대해.- 겔 여과 (1시 10분 희석) 후 남은 포도당을 감지하기 위해 50 μl의 팁을 가지고 새로운 MTP에 DDH 2 O (WTP 1-1)의 25 μl를 전송합니다. DDH 2 O의 대기음 20 μL (WTP 1-1), 공기의 5 μL 5 겔 여과 액의 μL과 같은 접시에 분배.
- 페놀 - 황산 - 방법 피펫 MTP에로 겔 여과 액의 20 μl를하십시오.
- 반복 1.6.3.1 및 제 겔 여과 플레이트 1.6.3.2 단계를 반복합니다.
- 그들의 회전 목마의 홈 위치로 다시 작업 테이블에서 모든 접시를 전송합니다.
- 세 번째와 네 번째 겔 여과 판에 대한 1.6.3.4로 단계 1.6.2.1를 반복합니다.
- 포도당 - 분석 모듈
- 로 포도당 - 더를 수행하는 로봇 매니퓰레이터를 통해 작업 테이블을 준비말하다.
- 5-1 및 5-4 WTP하는 CP 4-1과 4-4에서 다음 DWP (100 희석 1) 이전 할 의향.
- 4-1 및 4-4 WTP하는 CP 9-5과 9-8에서 모든 MTPs 이동합니다.
- 200 μl의 팁을 가지고 흡입 180 μL의 10 배 볼륨을 분배하여 희석 혼합한다. 그런 다음, MTP에 50 μL 나누어지는을 피펫.
- (100 희석 1) 반복 네 DWPs에 대한 1.7.1.2 및 1.7.1.3 단계를 반복합니다.
- 작업 테이블에서 모든 DWPs (5-4 5-1)를 제거합니다.
- 포도당 - 분석을 시작하기 위해 작업 테이블을 준비합니다.
- WTP로 겔 여과 전송 CP 모든 MTPs (9-4 9-1) (5-1 내지 5-4) 후 남은 글루코스를 결정하기위한.
- 3- WTP하는 CP 9-9에서 - 세 배가 다음 글루코오스 농도 50 μL (90, 45, 18, 9, 4.5, 1.8, 0.9, 0.45 및 0 ㎎ / ℓ)을 함유 - 글루코오스 분석 교정 판 이동 삼.
- 200 μl의 팁과 흡인 W에서 혈당 측정 시약 믹스 50 μl를 타고TP 1-2, 첫 번째 분석을 시작합니다. 인큐베이터 (30 분간 150 rpm에서 30 ° C)에 MTPs 이동합니다.
- 판 사이에 5 분 지연 프로그램을 시작하는 시간 일정을 설정합니다.
- 배양 30 분 후 418 및 480 nm에서의 MTP 리더 기록 흡광도에 인큐베이터에서 접시를 이동합니다.
- 측정 후, 회전 목마에서 자신의 홈 위치로 판을 이동합니다.
- 로 포도당 - 더를 수행하는 로봇 매니퓰레이터를 통해 작업 테이블을 준비말하다.
- 침전의 준비
주 : EPS 생산 전에 제 여과 단계 후에 2- 프로판올로 상청액의 침전을 수행 평가하기 위해. 뿐만 아니라 제 강수, 제의 섬유 부스러기의 관찰에 의해, 여과막에 폴리머의 흡착을 평가한다.
주의 : 엄격 흄 후드 인화성 액체로서 2- 프로판올을 처리합니다.- (CP 6-1 6-4 및 8-1 8-4에) 회전 목마의 모든 침전 플레이트를 제거합니다. 그리고 추가12.5 ml의 다단계 피펫 각 웰에 2- 프로판올 150 ㎕의 수동.
- 실리콘 캡 매트 모든 MTPs을 덮고 실온 (RT) (900 rpm에서 10 분)에서 흔들. 시각 EPS 생산을 나타내는 것을 흔들어 후 섬유 또는 플레이크 형성을 관찰합니다.
- 페놀 - 황산 방법
주의 : 흄 후드 아래에 진한 황산과 페놀을 처리합니다. 페놀은 부식성 및 돌연변이 에이전트입니다.- 페놀 - 황산 방법의 경우, 회전 목마에서 (CP 8-8로 8-5) 판을 제거하고 액체 핸들링 시스템 (8 위치 4)에 배치합니다. (5, 2.5, 1, 0.5, 0.25, 0.1, 0.05, 0g / L 10) 삼중 다른 포도당 농도의 20 μL와 교정 판을 포함합니다.
- 위치 1 위치 2에서 200 μl의 팁 상자와 갓 (얼음 with18.3 ml의 페놀에 5 %를 제조 한 110 ㎖의 페놀 - 황산 (와 250 ml의 골을 폐기물 용기를 놓습니다 승 / v)의 DDH 2 O 진한 및 91.7 ml의.의3 번 위치에 ulfuric 산).
- 300 μL 팁 8- 채널 피펫을 사용하여 모든 플레이트의 각 행에 페놀 - 황산을 180 μL를 옮긴다.
- , 뚜껑 모두 MTPs 커버 (900 rpm으로 RT에서 5 분)을 흔들어 섞는다 컬러 반응 오븐에서 80 ℃에서 35 분 동안이를 부화. 흄 후드 아래로 냉각 한 후, 480 nm에서 흡광을 측정한다.
- EPS 긍정적 인 상층 액의 선택 (그림에서 작업 4 1)
- EPS 생산의 평가를 위해, (동등한 혈당 점도 제어 2.6.1과 2.6.2, 폴리머 2.6.3 검출, 2.6.5) 긍정적으로 세 가지 기준 중 적어도 두 가지를 충족 자동 선별 검사에서 해당 균주를 선택합니다. 추가 처리를 위해 새로운 MTP에 포지티브 히트에서 남은 여액을 전송.
주 : 매가 최소 1 주일 동안 -20 ℃에서 저장 될 수있는 알루미늄 밀봉 막으로 피복하는 경우. 그 시간 determina 내탄수화물 기 지문이 수행 될 필요가있다.
- EPS 생산의 평가를 위해, (동등한 혈당 점도 제어 2.6.1과 2.6.2, 폴리머 2.6.3 검출, 2.6.5) 긍정적으로 세 가지 기준 중 적어도 두 가지를 충족 자동 선별 검사에서 해당 균주를 선택합니다. 추가 처리를 위해 새로운 MTP에 포지티브 히트에서 남은 여액을 전송.
2. 탄수화물 지문
참고 : 탄수화물 지문의 모든 단계를 수동으로 수행된다.
- (그림 1의 작업 5) 양의 상층 액의 겔 여과
주 : 자동 선별에서 남은 여액이 없기 때문에 겔 여과가 필요하다. 감소 정화 효율에 35 개 이상의 μL 결과의 볼륨 젤 여과.- 12.5 ml의 다단계 피펫을 통해 모든 웰에 초산 암모늄 완충액 150 μL를 분배하여 겔 여과 평형 판을 준비한다.
- (20 ° C에서 2000 × g으로 2 분) 원심 분리로 겔 여과 플레이트를 옮긴다.
- 반복 2.1.1, 2.1.2 다시 2.1.1 단계를 반복합니다. 또 사용하기 전에 20 ℃에서 2 분 동안 1,000 XG에서 겔 여과 플레이트를 원심 분리기.
- 피펫 여과 액 35 μL로12 채널 50 μL 피펫을 사용하여 겔 여과 판의 중앙.
- 20 ° C에서 2 분 동안 1,000 XG에서 겔 여과 판을 원심 분리 한 후 집 전판에서 들어 올립니다.
- 12 채널 50 μl를 피펫으로 DDH 2 O 45 μL 및 겔 여과 액의 5 μl를 추가하여 1:10 희석을 수행하고 실리콘 캡 매트와 MTPs을 포함합니다 : 가수 분해하기 전에 혈당 분석을 준비합니다.
주 : 중합체의 혈당 값의 정확한 판정이, 가수 분해 전의 당 함량을 측정하고, 가수 분해 단계 후에 정량 글루코스 콘텐츠를 빼기 위해. - 각 웰에 DDH 2 O 95 μL, 전송 겔 여과 액의 5 μl를 추가하려면 12 채널 200 μL 피펫을 사용하여 1:20 희석을 수행하고 실리콘 캡 매트와 MTP를 밀봉 : 가수 분해하기 전에 피루브산-분석을 준비 .
- 96 웰 (그림 1의 작업 6) 마이크로 가수 분해
참고 : 가열사용하기 전에 적어도 1.5 시간 동안 121 ° C에 (모래 목욕 포함) 배양 오븐. 특별한 체결 장치는 작은 스케일 가수 분해 단계에서 증발을 방지하기 위해 개발되었다.- 새로운 PCR 플레이트를 타고 12 채널 50 μl를 피펫으로 겔 여과 액의 20 μl를 전송합니다.
주의 : 트리 플루오로 아세트산은 부식성 산 및 독성이다. 암모늄 용액은 부식성이. 만 흄 후드에서 모두 화학 물질을 처리합니다. - 물론 각각에 1.25 ml의 여러 단계 피펫 4 M 트리 플루오로 아세트산의 20 μl를 추가합니다. 그리고 열가소성 엘라스토머 (TPE) 캡 매트와 PCR 플레이트를 커버하고 특별 클램핑 장치의 PCR 플레이트를 놓습니다.
- 클램프 장치 10 번 반전을 통해 용액을 혼합한다. 2 분은 아래에있는 모든 액체를 수집하기 위해 2,000 XG에 원심 분리기와 스핀에서 PCR 플레이트를 넣습니다. 다시 클램핑 장치에 PCR 플레이트를 넣고 나사를 사용하여 장치를 고정합니다.
- 놓고예열 모래 욕 보안 클램핑 장치는 121 ℃에서 90 분 동안 배양한다.
- 모래 목욕 클램프 장치를 제거하고 실온까지 냉각 할 수 있습니다.
- 나사를 제거하고 웰의 바닥에있는 모든 응축액을 수집하기 위해 2 분 동안 2000 × g으로 원심 분리에 다시 회전하고, 캡 제거시 매트의 교차 오염을 방지 할 수있다.
- 약 산도로를 조정하는 3.2 %의 암모니아 용액을 추가합니다. 8 12 채널 200 μL 피펫을 사용하여. TPE 캡 매트와 PCR 플레이트를 덮고 수동 클램프 장치를 사용하여 진탕.
- 중화 후 2 분 동안 2,000 XG에서 PCR 플레이트를 원심 분리기.
- 새로운 PCR 플레이트를 타고 12 채널 50 μl를 피펫으로 겔 여과 액의 20 μl를 전송합니다.
- 높은 처리량 -1- 페닐 -3- 메틸 -5- 피라 졸론 (도 1에서 태스크 7) 탄수화물 (HT-PMP) -derivatization
- 이전 50 12 채널 μL 피펫을 사용하여 신선한 PCR 플레이트의 중화 가수 분해물의 25 μL.
참고 : 분취 량을 복용 한 후, neutr을 확인1.25 mL의 다단계 피펫 12.5 ㎕의 페놀 레드 인디케이터 (5 ml의 20 % 에탄올 중의 0.05 g의 페놀 레드)를 첨가를 통해 가수 분해 접시에 남은 액체 세계화가. 핑크 색상 (산도 8)로 설정하지 않는 모든 우물이 제대로 유도하지 않습니다. - 75 μl의 유도체 화 시약 믹스 (125 mg을 PMP, 7 ml의 메탄올, 3.06 ML의 DDH 2 O, 및 438 ㎕를 3.2 % 암모늄 수용액)을 추가하고 TPE 캡 매트와 함께 접시를 커버.
- 2000 XG에 클램프 장치 원심 분리기에 플레이트를 PCR 플레이트를 진탕 한 후 2 분은 아래의 모든 액체를 축적하기 위해서는.
- 유도체 장소 100 분 동안 70 ° C에서 PCR-자전거 타는 사람에 PCR-판은 20 ° C로 냉각 하였다.
- 12 채널 50 μL 피펫을 사용하여 새 MTP로 20 μL 나누어지는을 전송합니다. 그런 다음 12 채널 200 μL 피펫을 사용하여 각 라인에 130 ㎕의 19.23 밀리미터에게 아세트산 (0.962 ml의 1 M 아세트산 + 49.038 ML의 DDH 2 O)를 추가합니다. aspirat를 통해 직접 믹스보내고과 (최소 여섯 번) 분배 및 MTP 집 전판으로 0.2 μm의 필터 플레이트에 모든 액체를 전송합니다.
- 원심 분리기는 플레이트 (5 분 1,000 XG), 필터 플레이트를 제거 실리콘 캡 매트와 MTP를 밀봉하고, 탄수화물 지문 (14)의 결정에 대한 UHPLC-UV-ESI-MS에 MTP를 놓습니다.
- 이전 50 12 채널 μL 피펫을 사용하여 신선한 PCR 플레이트의 중화 가수 분해물의 25 μL.
- 글루코오스 분석의 준비
- DDH 2 O 45 μL와 12 채널 50 μL 피펫을 사용하여 중화 가수 분해물의 5 μl를 추가로 1:10 희석을 수행하고 실리콘 캡 매트와 MTPs 커버. 교정에 사용되는 새로운 MTP에 세 번 서로 다른 포도당 표준 (500, 250, 100, 50, 25, 10, 5, 2.5 0 μM)의 50 μl를 추가합니다.
- 12 채널 50 μL 피펫을 사용하여 포도당 분석 시약 믹스 (레시피 step1.2.3)의 50 μl를 추가합니다. 그런 다음 실리콘 캡 매트 플레이트를 커버하고 30 ° C 및 MTP-인큐베이터에서 30 분 동안 400 rpm으로 배양한다.
- 직접 배양 후 MTP-리더 418 및 480 nm의에서 MTP 리더에서 읽은 흡광도를 확인합니다. 단계 2.6.4에서 수행로서 글루코스 농도의 계산 선형 보정을 수행한다.
- 피루 베이트 - 분석의 준비
- 12 채널 200 μL 피펫을 사용하여 1:20 희석을 수행합니다. 각 웰에 중화 가수 분해물의 DDH 2 O의 95 μl를 전송할 5 μl를 추가합니다. 실리콘 캡 매트와 MTP를 커버.
- (carboxymethylamino 카르 보닐) -4.4' 비스 (디메틸 아미노) -diphenylamine 나트륨 염 (DA-64), 300 ㎕의 10 mM의 티아민 피로 인산, 60 μL 100 - 피루 베이트-분석 시약 믹스 (3 ㎖의 1 mM의 N 100 μl를 추가 mM의 염화 마그네슘 육수화물, 2.4 ml의 500 mM의 인산 칼륨 호흡기 (PH 5.7) 30 μL를 100 U 피루 베이트 옥시 다제, 12 ㎕의 1000 U 냉이 퍼 옥시 다제 및 12 채널 200 μL 피펫을 사용하여 24.19 ML의 DDH 2 O).
- 실리콘 캡 매트 A의 번호판을 커버차 37 ° C와 30 분 동안 150 rpm으로 배양한다. 직접 727 및 540 nm의에서 MTP-리더 배양 측정 흡광도 후.
- 자동화 된 검사 및 탄수화물 지문의 모든 결과의 평가.
- 주요 문화 판을 원심 분리 회전 목마 (점도 제어 단계 1.4.1)에 다시 저장 한 후 침전을 감소 보여 그 샘플을 기록해 둡니다. 펠릿 형성을 표시하지 않습니다 샘플 (자동 선별 기준 1) 긍정적이다.
- 여과 공정 (높은 점도 제어 단계 1.5.4.6) 후 필터 플레이트에 잔류으로 표시됩니다 점성이 높은 상층 액, 기록해 둡니다. 여과 액의 부족은 다음과 같은 분석 모듈에서 위음성 결과로 이어질 수 있습니다. 필터 웰에 배양 상층 액을 유지 샘플 (또한 자동화 된 검사 1을 기준) 긍정적이다.
- 시각적으로 배양 후 섬유 또는 플레이크 형성을 관찰합니다. 번째로 메모를IS는 다당류를 나타냅니다. 아무 침전 평가 없음 (을 -); (+)와 섬유 또는 조각의 낮은 강수량과 높은 강수량 (++). 뿐만 아니라 제 침전 (자동 선별 기준 2)에서는, 먼저 섬유 부스러기의 관찰을 통해 필터 멤브레인의 중합체의 흡착을 검출한다.
- 글루코스 농도의 산출에 대한 선형 보정을 수행한다.
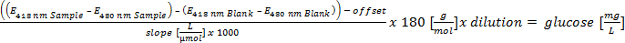
이 방정식의 큰 버전을 보려면 여기를 클릭하십시오. - 5 0.1 g / L 포도당 사이의 선형 교정 (농도 이상 흡수)를 수행합니다. 가수 분해 된 중합체의 글루코오스 당량을 계산하고 다음의 파라미터에 의해 평가 : 포도당 당량 :> 700 ㎎ / ℓ를 포지티브 =; 300-700 밀리그램 / L = 추정 긍정적 인;
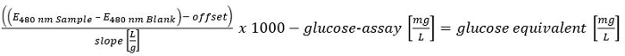
이 방정식의 큰 버전을 보려면 여기를 클릭하십시오. - HT-PMP 방법으로 결정 모든 탄수화물을 정량화. 모든 수량을 요약하면 다음과 같이 평가 :> 300 ㎎ / ℓ (양); 150-300 밀리그램 / L (추정 긍정적 인)와 <150 ㎎ / ℓ (음).
- 피루 베이트의 농도 계산을 위해 선형 캘리브레이션 (100, 50, 25, 10, 5, 2.5, 1, 0.5 및 0 μM)을 수행한다. 상등액에 남아있는 피루 베이트를 제외하려면, 가수 분해 전에 피루 베이트의 콘텐츠를 통해 가수 분해 후 피루브산 내용을 수정합니다.
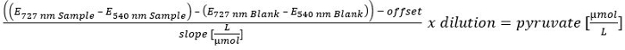
이 equat의 더 큰 버전을 보려면 여기를 클릭하십시오이온.
결과
페놀 황산 방법의 유효성은 0.9998 (표 2)의 결정 (R²)의 계수가 양호한 결과를 보였다. 5 g / L 농도 변화 (CV)의 계수와 정확도 5.3 % (CV)와 6.1 %의 오류와 0.25 g / L의 표준 1.8 %와 2.2 %의 오류,하지만 낮은 성능과 좋은 성능을 (보여 주었다 바이어스).
(매트릭스와없이) 모두 피루 베이트 세이 검량선의 판정의 계수는 150 μM (표 3)의 보정 범위> 0.9999이었다. 최고 및 최저 보정 레벨 변동 (CV)의 계수는 <4.6 %이었다하고 정밀도가 3.9 % 미만의 오차 완전한 교정 범위에서 매우 우수한 성능을 보였다. 따라서, 가수 분해 단계에서 매트릭스 MEAS하는 것이 가능한 효소 분석에 아무런 영향을 나타내지 않았다URE 피루 베이트 전 가수 분해 후.
표 4는 성공적으로 심사 플랫폼으로 확인 된 세 가지 예시적인 새로운 균주의 자세한 결과를 보여줍니다. 테이블의 좌측 부분은 점도 형성 중합체 생산 및 상세한 탄수화물 지문 분석 평가 파라미터로서 사용 된 총 가수 분해 포도당 당량 관한 자동 선별 모듈의 결과를 표시한다. 보정 당뿐 아니라 알려지지 않은 당, 다이머 치환기에 기초하여 탄수화물 지문 테이블의 우측에 제시되어있다. 이 정보를 이용하여, 단량체 조성물을 산출 이미 알려진 고분자 구조물과 비교 될 수있다. 또한, 흥미로운 단량체 조성물 및 희귀 탄수화물에 대한 표적 스크리닝을 수행 할 수 있습니다.
마이크로의 고성능규모의 가수 분해와 HT-PMP-유도체는 우리의 이전 작업 (14)에서 증명되었다. 또한, 겔 여과 및 다양한 장군 대한 탄수화물 지문의 검증은 다른 출판물 6에 기재되어있다. 요약하면, 모듈 식 구조 스크리닝 플랫폼은 용이하게 변형 될 수 있고, 사용자의 개별적인 요구에 적합. 플랫폼의 자동화 된 검사는 8 배 높은 처리량을 가능하게하고 신뢰할 수있는 결과를 제공합니다. 피루 베이트 세이 같은 신규 분석 모듈은 통합 될 수 있고, 탄수화물 지문 분석과 조합들은 식별 된 EPS 대한 매우 상세한 정보를 제공한다. 모두 약간 수정 완전히 새로운 EPS 변종을 검색 할 때 이것에 의해, 심사 플랫폼은 필수적이다.
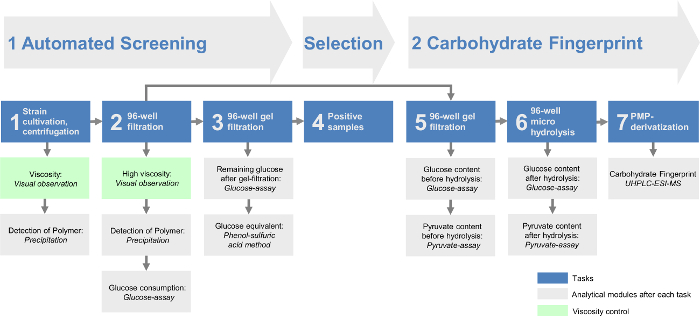
그림 1 : 모듈 시간의 전체 계획고등학교의 처리량 엑소 폴리 사카 라이드 검사 플랫폼. 자동화 된 검사는 처음 세 개의 작업이 포함됩니다. 세균은 96 웰 플레이트에서 배양 한 후, 세포를 원심 분리 (태스크 1), 96 웰 여과 (과제 2)에 의해 제거된다. 이어서, 성장 배지에 남아있는 단량체 당 96- 웰 겔 여과 (태스크 3)을 통해 제거된다. 샘플을 포함하는 EPS는 선별 플랫폼의 탄수화물 지문 지난 3 작업이 포함 작업 4. 평가됩니다. 과제 2에서 포지티브 히트 남은 여액 탄수화물 지문은 HT-PMP 방법을 통해 분석 될 수있는 작업 6에서 가수 분해 후, 작업 5와 겔 여과 (높은 처리량 1- 페닐 -3- 메틸위한 기초를 제공한다 -5- 피라 졸론, 작업 7). 모든 작업은 서로 다른 분석 모듈 및 / 또는 점도 제어가옵니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
: FO 아가씨 = "jove_content" 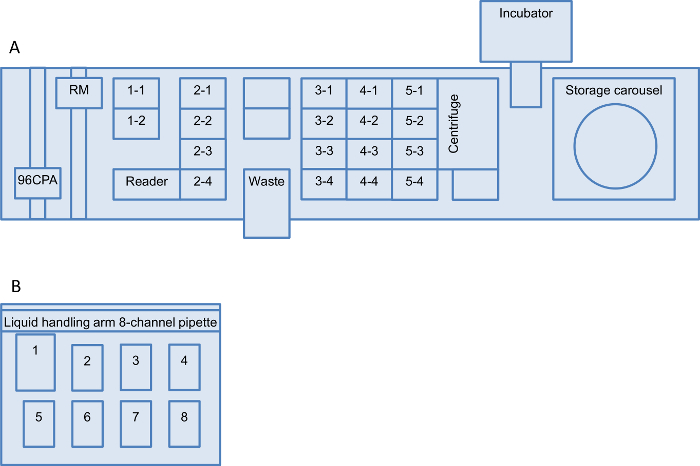
그림 2 : 심사 플랫폼을위한 로봇 작업대 설치 모두 액체 처리 로봇 작업 테이블의 레이아웃이 표시됩니다. (A) 로봇 액체 처리 시스템 및 (B) 액체 취급 역. (가) 설정은 두 위치 (위치 1-2 1-1), 4 개의 위치 각각 4 개의 위치 (위치 2-4 2-1)와 세 개의 마이크로 캐리어와 일회용 팁 캐리어와 마이크로 캐리어로 구성 (위치 3-1 4-1 5-4 4-4과 5-1, 3-4). 또한, 21 마이크로 역가 플레이트에 대한 일곱 깊은 웰 플레이트 (DWP)와 네 호텔 캐리어 (6-9) 각각에 대한 오 호텔 캐리어 (1 ~ 5) 각각 저장 회전 목마가있다. 액체 핸들링 로봇에 설치된 하드웨어 일회용 팁 betwee 플레이트 / 장비 이동 로봇 머니퓰레이터 (RM)와 함께 사용하기위한 96- 채널 피펫 암 인n은 작업 테이블, 저장 회전 목마의 MTP 리더, 원심 분리기 및 진동 - 인큐베이터. (B) 액체 핸들링 스테이션 액체 취급 아암 장착되고 8 채널 300 μL 피펫, 위치 1에서의 폐액 용기, 250 ㎖의 300 ㎕의 팁 (위치 2)의 높이가 어댑터 (30) 선단 어댑터 MTPs에 대한 통 (위치 3) 다섯 높이 어댑터 (60) (8 위치 4). 위치의 번호는이 프로토콜에 걸쳐 언급된다. 동등한 설정을 사용할 수있는 경우 대체 작업 테이블도 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
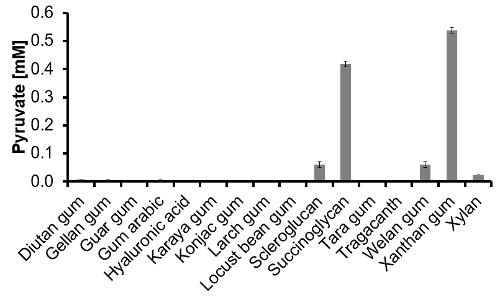
그림 3 : 피루브산-분석을 통해 결정 16 상업적으로 이용 가능한 폴리머의 피루브산 콘텐츠입니다. 1 ㎍ / L 중합체 용액 후의 가수 분해 및 중화하고, 피루 베이트-분석은 1:10 희석에서 수행되었다 (N = 3). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
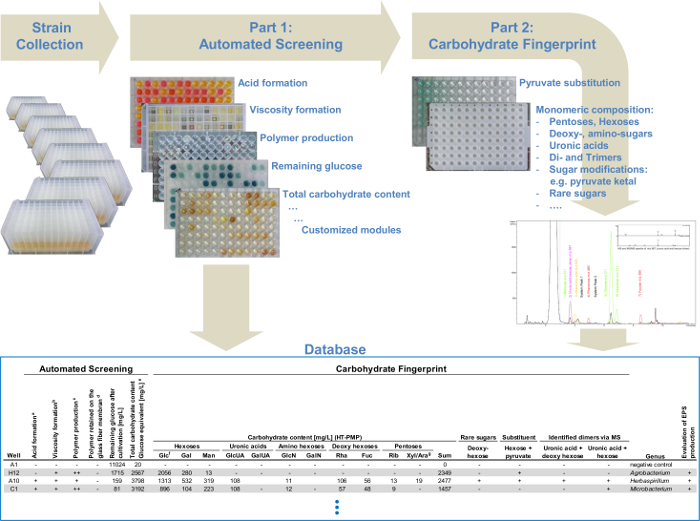
그림 4 : 모듈 높은 처리량 스크리닝 플랫폼의 플로우 차트. 다른 다당류 검출 모듈을 결합하여 자동 선별 시스템에있어서, 점도 형성 중합체 생산 전체 탄수화물 함량을 결정 분석. 두 번째 부분은 첫 번째 부분에서 식별 된 모든 선택된 EPS 생산자에 대한 자세한 단당류 분석을 제공합니다. UHPLC-ESI-MS를 통해 탄수화물, 지문의 자동 선별의 모든 데이터와 상기 데이터를 데이터베이스에 수집 ALR의 구조적으로 관련된 변이체의 간단한 식별을 가능하게되고eady는 EPS 또는 새로운 EPS 알려져 있으므로, 표적 스크리닝. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 주요 단계 / 분석 모듈 | 워크 플로우 | 관측 / 설명 |
| 균주의 배양 | 1 ML의 EPS-매체 사전 문화 48 시간, 30 ° C, 1,000 rpm으로 a를 주요 문화 48 시간, 30 ° C, 1,000 rpm으로 a를 | EPS의 생산 |
| 셀 제거 / 점도 | 원심 분리 : 4,300 XG에 30 분 | 아니 펠렛 = 점도가 증가 = 긍정적 |
| 폴리머의 검출 : 강수 | 50 μL 스와pernatant + 150 ㎕의 2- 프로판올의 B 실온에서 10 분, 900 rpm으로 B를 떨고 | 시각 : 섬유 및 조각 = 폴리머의 양의 침전 |
| 셀 제거 / 고점도 | 주요 문화 180 μl의 상층 액 원심 분리 : 3,000 XG에 10 분 1.0 ㎛의 유리 섬유 멤브레인 | 어떤 필터를 통과 = 고점도 = 긍정적 없다 |
| 폴리머의 검출 : 강수 | 여액 50 μL + 150 ㎕의 2- 프로판올 B 실온에서 10 분, 900 rpm으로 B를 떨고 | 시각 : 섬유 및 조각 = 폴리머의 양의 침전 |
| 포도당 소비 : 포도당 - 분석 | 희석 1 : 100 : 10 μl를 여과 + 990 μL의 DDH 2 O 50 μL 나누어지는 + 50 μL의 reag엔트 믹스 인큐베이션 30 분, 30 ° C에서 150 rpm으로 측정 418-480 nm의 | 배양 후 포도당 남은 |
| 젤 여과 | 평형: 3 × 150 μl의 NH 4 -acetat 완충액 pH 5.6 2,000 XG에 2 × 2 분 1,000 XG에 1 × 2 분 젤 여과 : 35 μL 여과 액 1,000 XG에 2 분 세탁: 3 × 150 μL의 DDH 2 O, 2,000 XG에 2 분 저장을 위해 75 ㎕의 20 % 에탄올 | 고분자 정화 : 배양 상등액으로부터 염, 피루브산, 글루코스 및 다른 당 단량체의 제거 |
| 겔 여과 후 남은 포도당 포도당 - 분석 | 희석 1시 10분 : 25 μL의 DDH 2 O + 20 μl의 DDH 2 O 5 ㎕를 여과 + 50 μL 시약 믹스 부화 30 분, 150 rpm으로 측정 418-480 nm의 | 페놀 황산 방법에서 겔 여과 후 남은 글루코스 빼기 |
| 포도당 당량 페놀 황산 방법 C | 20 ㎕를 겔 여과 + 180 ㎕의 페놀 - 황산 (30 ㎕의 5 % (DDH에서 w / v)의 페놀 2 O + 150 μL 진한. H 2 SO 4 (ρ = 1.84 g / ㎖)) 900 rpm에서 5 분을 흔들어 부화 35 분 80 ° C에서 480 nm에서 측정 | 포도당 당량 Δ (페놀 - 황산 값 - 겔 여과 후 남은 글루코스) <300 ㎎ / ℓ 마이너스 > 300 긍정적 추정 <700 ㎎ / ℓ > 700 밀리그램 / 긍정적 인 L |
| a는 수동으로 멸균 조건 (층류)에서 취급. | ||
| 나 인화성 액체는 흄 후드에서 수동으로 처리. | ||
| C 페놀 - 황산 브랜드 액체 흄 후드 역 (좌)을 취급 취급. | ||
표 1. 자동 분석 모듈에 대한 모든 파라미터의 로봇 액체 핸들링 시스템과 액체 핸들링 스테이션 자동 사전 선별의 전체 워크 플로우 개요.
| 선형성 | LOD | LOQ | ||
| R² | 경사 | 오프셋 (offset) | ㎎ / ℓ | ㎎ / ℓ |
| 0.9998 | 0.0007 | -0.021 | (50) | (100) |
| 표준 | B 평균 | 정밀 B | 정확도 나 | |
| ㎎ / ℓ | ㎎ / ℓ | 이력서% | 바이어스 (% 오차) | |
| 5,000 | 5,112 | 1.8 | 2.2 | |
| (250) | (265) | 5.3 | 6.1 | |
| 0.1 ~ 5g / L에 팔 측정, 6 단계 포도당과 교정의 평균 | ||||
| B 학생의 t-test로 수행 (α = 0.05, N = 8). | ||||
| LOD : 결정의 한계, LOQ : 정량 한계, CV : 변동 계수. | ||||
표 2 :페놀 황산 방법의 유효성이 액체 처리 스테이션을 행했다. 선형성은 여섯 포인트 보정에 기초하여 산출 하였다 (N = 8). 평균, 정밀도와 두 개의 예시 선택 포도당 농도의 정확도는 다음과 같다.
| 선형성 | LOQ | |||
| R² | 경사 | 오프셋 (offset) | μM | |
| 매트릭스없이 | 0.99999 | 0.0223 | -0.0019 | 1 |
| 1시 10분 희석 행렬 | 0.99999 | 0.0221 | -0.0011 | 1 |
| 표준 | B 평균 | 정밀 B | 정확도 나 | |
| μM | μM | 이력서% | 바이어스 (% 오차) | |
| 매트릭스없이 | (50) | 49.96 | 3.05 | -0.09 |
| 1 | 1.04 | 2.95 | 3.86 | |
| 1시 10분 희석 행렬 | (50) | 49.98 | 0.44 | -0.04 |
| 1 | 1.00 | 4.58 | 0.33 | |
| 3 회 측정, 1 ~ 50 μM에 피루 베이트의 여섯 농도 교정의 평균. | ||||
| B (N = 3) | ||||
| LOQ : 정량 한계, CV : 변동 계수. | ||||
표 3 :.와 1:10 희석 중화 트리 플루오로 산 매트릭스없이 피루 베이트 - 분석의 유효성 두 여섯 점 교정 (N = 3)와 매트릭스 영향 평가를 수행 하였다없이. 평균, 정밀도와 1:10 희석 효과가없는 두 개의 예시 선택 피루브산 농도의 정확도를 계산 하였다.

표 4 :.. 플랫폼과 스크린 세 가지 대표적인 균주의 결과 데이터 자동 검사 및 탄수화물 지문에서 수집 하시기 바랍니다 다Microsoft Excel 파일이 표를 다운로드하려면 여기를 핥아.
| 탄수화물 | 흡수 최대 [나노] | 480 nm의 평균 ± SD에서 흡수 | 흡광도 상대는 [%] 포도당합니다 | |
| Diutan 검 | (470) | 0.342 | 0.010 ± | 187 |
| 젤란 검 | 472 | 0.334 | 0.002 ± | 183 |
| 구아 검 | 478 | 0.387 | 0.017를 ± | (212) |
| 구미 아랍어 | 476 | 0.393 | 0.034를 ± | (215) |
| 히알루 론산 | 484 | 0.231 | 0.011를 ± | (126) |
| 카라 야 검 | 478 | 0.455 | 0.023를 ± | 249 |
| 곤약 껌 | 480 | 0.297 | 0.009를 ± | (163) |
| 낙엽송 검 | 480 | 0.337 | 0.032를 ± | (185) |
| 로커스트 빈 검 | 478 | 0.354 | 0.033를 ± | (194) |
| Scleroglucan | 484 | 0.168 | 0010을 ± | (92) |
| Succinoglycan | (482) | 0.168 | 0.005 ± | (92) |
| 타라 검 | 480 | 0.318 | 0.016를 ± | (174) |
| 트라가 칸트 | 478 | 0.513 | 0.003 ± | 281 |
| 웰란 검 | 472 | 0.226 | 0.016를 ± | (124) |
| 크 실란 | 472 | 0.567 | 0.007 ± | (311) |
| 산탄 검 | (482) | 0.245 | 0.021를 ± | (134) |
| 포도당 | 484 | 0.191 | 0.014를 ± | (100) |
| SD : 표준 편차 | ||||
표 5. 결과 16 시판 중합체 및 글루코오스 페놀 황산 방법에 의해 얻어진 최대 흡수 흡수 16 시판 중합체 (1g / L) 480 nm에서뿐 아니라 포도당 (1g / L ) 페놀 황산 방법을 적용 측정 하였다. 모든 중합체의 포도당에 대하여 흡광도를 산출 하였다.
| 표준 | 평균 를 | 정밀 | 정확도 | |
| ㎎ / ℓ | ㎎ / ℓ | 이력서% | 바이어스 (% 오차) | |
| 1시 10분 희석 | (450) | (460) | 1.01 | 2.14 |
| (45) | 44.7 | 1.41 | -0.70 | |
| 1 : 100 희석 | 4,500 | 5,026 | 1.19 | 11.6 |
| (450) | 471 | 1.16 | 4.55 | |
| B 학생의 t-test로 수행 (α = 0.05, N = 8). | ||||
| CV : 변동 계수. | ||||
도표 6 :. 포도당 - 분석을위한 자동 희석의 검증 재배 (1 : 100) 후 포도당 분석에 대한 희석 및 겔 여과 (1시 10분) 후 유효성을 검사 하였다. 두 글루코스 농도 (N = 8), 액체 핸들링 시스템으로 희석하고, 평가 하였다. 평균, 정밀도 및 정확도를 산출 하였다.
| 이론 혈당 값 | 실리콘 캡 매트 덮여 | 증발 시험 (발견) | |||||
| 평균 | 정밀 | 정확도 | 평균 | 정밀 | 정확성은 <> / 강해 | 증발 | |
| ㎎ / ℓ | ㎎ / ℓ | 이력서 % | 바이어스 (% 오차) | ㎎ / ℓ | 이력서 % | 바이어스 (% 오차) | %오류 |
| 45.0 | 45.2 | 0.69 | 0.44 | 46.0 | 0.66 | 2.05 | 1.60 |
| 18.0 | 17.7 | 0.80 | -1.68 | 18.0 | 0.72 | -0.01 | 1.69 |
| 9.0 | 8.74 | 1.20 | -2.98 | 8.92 | 0.81 | -0.95 | 2.09 |
| 4.5 | 4.50 | 1.26 | -0.04 | 4.58 | 1.57 | 1.76 | 1.80 |
| 1.8 | 1.85 | 0.74 | 2.90 | 2.01 | 2.82 | 11.6 | 8.48 |
| 0.9 | 1.03 | 1.43 | 14.1 | 1.16 | 3.52 | 28.3 | 12.4 |
| A (N = 4) | |||||||
| CV : 변동 계수. | |||||||
표 7. 덮여 발견 MTP 6 다른 혈당 수준의 증발 효과의 평가는 (N = 4)을 실온에서 3.5 시간 동안 회전식 저장 하였다. 증발의 효과는 표준 샘플을 발견뿐만 아니라 커버 (실리콘 매트)를 사용하여 평가 하였다. 평균, 정밀도, 정확도 %의 오류가 증발 계산 하였다.
겔 여과 전에| 겔 여과 후 | 겔 여과 후 남은 포도당 | ||||
| 평균 | SD | 평균 | SD | ||
| ㎎ / ℓ | ㎎ / ℓ | ㎎ / ℓ | ㎎ / ℓ | % | |
| 1 | 8,647 | (110) | 259 | (121) | 3.00 |
| 이 | 5,108 | (56) | (116) | (37) | 2.27 |
| 삼 | 2,014 | (12) | 50.8 | (14) | 2.52 |
| 4 | 1,015 | (12) | 25.1 | 8.1 | 2.47 |
| (5) | (510) | 4.9 | 12.8 | 4.3 | 2.51 |
| 6 | (223) | 8.6 | 6.6 | 1.5 | 2.94 |
| (7) | (122) | 5.6 | 4.3 | 0.9 | 3.48 |
| 8 | (75) | 6.0 | 3.1 | 0.3 | 4.18 |
| A (N = 8) | |||||
| SD : 표준 편차 | |||||
표 8. 겔 여과 효율 결과는 8 개의 글루코오스 표준 겔 여과의 효율을 평가하기 전에 겔 여과 후 측정 하였다. %의 겔 여과 계산 된 표준 편차 남은 포도당 후, 의미한다.
토론
페놀 - 황산 방법 다당류 감지 : 다른 단당류는이 방법 (9)를 이용하여 서로 다른 최대 흡수와 몰 흡광 계수를 보여줍니다. 이것은 상이한 양의 여러 당류를 함유 중합체, 다양한 최대 흡수를 초래한다. 16 다른 시판 중합체의 최대 흡수의 상이한 파장을 표 5에 나타내었다. 중합체 (1 ㎍ / L)에 용해시켰다 DDH 2 O로 (150 RPM) 밤새 교반 페놀 황산 - 방법으로 측정 . Diutan 검 470 nm 내지 scleroglucan 히알루 론산 484 nm에서 최고 최저 최대 흡수를 보였다. 이러한 결과를 바탕으로 480 nm의이 선별 플랫폼에 대한 선택되었다. 중합체의 상대적인 흡광도 (100 %로 설정) 1g / L의 글루코스 얻어진 흡광도에 기초하여 산출 하였다. 최저 결과는 92 %로 모두 scleroglucan 및 succinoglycan 수득 하였다. 이 특급했다scleroglucan는 포도당을 포함하고 succinoglycan 7의 비율로 포도당과 갈락토오스가 포함되어 있기 때문에 반사된다 : 1. 상업용 폴리머 건조 및 다른 회분 함량 다른 손실을 가지고, 이것은 ~ 110 %의 이론적 인 값에 도달하지 않은 이유이다. 자일란 311 %의 높은 상대 흡광도를 나타냈다. 이러한 이유 때문에 보이면서 퓨 라노스 형태 자일 로스로 달성 높은 몰 흡광 계수이다. 0.1 g / L의 글루코스의 수준 정량 한계에 도달하고,뿐만 아니라 농도 <0.05 g / L의 검출 한계. 그러나, 스크리닝에서 양성 균주에 대한 검출 한계 이상 0.7 g / L이고, 따라서, 상기 분석은 우수한 성능을 보였다. 신뢰성있는 결과를 얻기 위해, 겔 여과 후 남은 글루코스는 글루코스 세이로 측정하고,이 값은 페놀 - 황산 방법의 값으로부터 감산한다.
자동화 된 포도당 분석 희석 : 성능재배 (희석 1 : 100) 후에 글루코스 판정 조사 하였다. 이를 위해, 10 μL의 상등액을 흡인하고,이 희석액 180 ㎕를 디스 펜싱을 통하여 열 배 깊은 웰 플레이트 DDH 2 O 990 μL에 옮기고, 혼합 하였다. 두번째 중요한 단계는 겔 여과 후 글루코오스 분석에서 1시 10분 희석 5 μL 분취 정확한 피펫 팅 하였다. DDH 2 O의 희석액 25 μl를 생성하기 위해 제 50 μL 팁으로 옮기고, DDH 2 O 5 ㎕를 겔 여과 후 20 μL 함께 흡입 하였다. 이것은 선단에서 5 μL 분취 더 나은 제거를 보장한다. 두 희석 단계가 포도당 분석을 통해 다양한 포도당 표준을 확인 하였다. 두 실시 농도에 대한 결과를 표 6에 제시되어있다 : 1. 100 희석 포도당 함량의 측정을위한 배양은 CV & # 함께 모두 표준 고정밀 나타났다 후에60 1.2 %. 동시에, 높은 표준 정확도는 11.6 (% 에러)까지이다. 글루코오스 판정 배양 후에 만 남은 글루코스 콘텐츠를 나타내고, 따라서 중합체 검출 중요하지 않다하지만, 이는 무시할 수있다. 겔 여과 후 남은 포도당의 1시 10분 희석은 CV <1.4 %와 정확도 <2.1 %의 오류와 함께 매우 신뢰할 수있는 결과를 보여 주었다.
증발의 고려 사항 : 심사는 최초의 포도당 분석하는 첫 번째 단계에서 3.5 시간이 필요합니다. 이 기간은 캡핑 MTP 저장소에 영향을 미치는 것인지, 알아 내기 위해, 글루코오스 분석 교정 표준의 50 μL 함께 로봇 컨베이어에서 3.5 시간 동안 커버없이 저장 하였다. 교정 범위 (45-4.5 ㎎ / ℓ)에서 시료 농도는 거의 증가하지 않는다. 증가 - 증발에 의해 발생은 - 2.1 % 이하 만이 가장 낮은 농도 (1.8 및 0.9 ㎎ / ℓ)은 12.4 %까지 도달 (위해이었다 표 7).
겔 여과 : 비 글루코스 대사의 많은 양이 가수 분해 중합체 글루코오스 정량 검출을 방해. 따라서, 겔 여과 단계 배양 후 남은 글루코스를 제거해야한다. 또한, 겔 여과 단량체 분석 분석 백그라운드를 최소화하기 위해, 글루코스보다 염 및 탄수화물 단량체 화합물 등으로부터 상층 액을 함유하는 중합체를 정화한다. 겔 여과 단계에서 여과 액 35 μL를 웰의 중앙에 배치했다. 자동화 된 시스템의 겔 여과의 안정성 검증을 위해, 9g / L 포도당 최대 0.045에서 팔 교정 표준을 여과 하였다 (N = 8). 모든 농도의 글루코스는 항상 초기 값 (표 8)의 95 % 이상 감소 하였다. 이 과정에서 겔 여과 포도당의 다양한 농도에 매우 좋은 결과를 보여 주었다. 또한, 잔류 글루코스 겔 F 후iltration 또한 글루코오스 분석으로 결정되고 가수 분해 중합체 포도당 당량의 정확한 양을 수신 페놀 황산 판정로부터 감산 하였다.
피루 베이트 세이 : 첫째는, 상기 가수 분해 단계에서 중화 희석 (1시 10분) TFA 매트릭스는 효소 반응을 방해하는지 여부를 조사 하였다. 따라서, 전체 분석은 한 시간과 한 번 매트릭스없이, 두 번 수행하고 신뢰할 수있는 결과를 보여 주었다. 마지막으로, 16 개의 시판되는 중합체의 피루브산 콘텐츠 성공적 측정하고,도 3에 도시되어있다. 일반적으로 이들 중합체에서 16 만 succinoglycan 잔탄 자연스럽게 피루브산을 함유하는 것이 알려져있다. 우리 피루브산 시험 법으로 이들 중합체는 모두 정확하게 식별되었다. scleroglucan에서, 웰란 검 및 크 실란 피루 베이트는 상당한 양의 검출되었다. 전반적으로, 접근 방식의 기능을 검증하고, 피루 베이트 - 분석의 한높은 성능을 howed. 이 가수 분해 후, 다른 중합체의 피루브산을 검출 할 것을 알았다.
탄수화물 지문 : 자동화 된 검사의 모든 분석 모듈을 수행 한 후, 잠재적 EPS 생산은 탄수화물 지문 분석을 위해 선정되었다. 이를 위해 여러 가지 기준을 적용 하였다 : 점도 1) 포지티브 관찰 원심 분리 및 / 또는 여과 후. 2) 강수 전 여과 후. 관측 된 섬유 조각은 긍정적으로 평가 하였다. 페놀 - 황산 방법 3) 포도당 해당하는 값입니다. > 700 ㎎ / ℓ 값은 긍정적으로 평가하고, 300 및 700 ㎎ / ℓ 사이의 값을 추정 EPS 생산 업체로 평가되었다. 두 개 또는 세 개의 기준이 포지티브로 계산 된 경우, 상기 균주 탄수화물 지문 분석을 위해 선별 하였다. 기준은 EPS 검사 (예를 들어 저점 EPS)의 개별 목적으로 사용자 정의 할 수 있습니다. 우리의 접근 방식은 effici 발견을 목표로엔트는 생산자 EPS. 단지 EPS 소량 생산 균주를 검색 할 때 포도당 당량의 평가 제한이 감소한다.
기술 이익과 미래의 응용 프로그램이 프로토콜의 한 가지 흥미로운 기능은 단계와 다른 분석 모듈의 모듈 식 문자입니다. 이들은 개별 요구 조정, 다양한 방식으로 조합 될 수 있고, 신규 모듈은 쉽게 구현 될 수있다. 또한, 상기 분석 모듈은 개별적으로 사용될 수있다 예를 들어 HT-PMP-유도체 모듈과 함께 가수 분해 모듈은 96 웰 포맷에서 다른 중합체 용액 (1g / L)에서 단량체 조성 분석을 수행 할 수있다. 전체 검사가 피펫 방식의 변경없이 직접 처리 할 수있는 액체 처리 시스템에 접속하지 않고도 실험실. 그러나, 액체 핸들링 시스템을 이용하여 최대 768 균주 (대신 screene 경우 192 균주 처리량을 증가하루에) 수동 d를. 여기에서 설명하는 프로토콜은 서로 다른 장군에 대한 선별 할 수 있고, 따라서, 신규 EPS 생산자를 확인하고 하나의 접근 방법 (그림 4)에서 자신의 탄수화물 지문을 분석하는 큰 변형 컬렉션의 심사합니다. 또한, 푸 코스 등 희소 당, 우 론산 또는 미지의 당을 함유 폴리 사카 라이드에 대한 표적 스크리닝 상세한 단당류 분석을 통해 수행 될 수있다. 또한, 정의 된 비율이 다른 당 조합을 검출 할 수있다. 이것은 이미 알려진 EPS 또는 새로운 EPS의 구조적으로 관련된 변종의 단순한 식별 할 수 있습니다.
공개
We have nothing to disclose.
감사의 말
We sincerely thank Thomas Howe and Jörg Carsten for the programming and technical support with the liquid handling systems.
자료
| Name | Company | Catalog Number | Comments |
| 96 well deep well plate 2.0 ml (DWP) | Greiner Bio-One | 780271 | Main-culture (CP 1-1 to 1-4), equilibration plates for gel-filtration (CP 1-6, 1-7, 2-6 and 2-7), 1:100 dilution for the glucose assay (CP 4-1 to 4-4) containing 990 µl of ddH2O |
| Breathable Sealing Film | Axygen | BF-400-S | Incubation film for pre- and main-culture DWP |
| Aluminum Sealing Film | Axygen | PCR-AS-200 | -80 °C storage film for glycerol-stock plates |
| MCA96 Nested Disposable Tips 200 µl | TECAN | 30038619 | Worktable position (WTP 2-1 to 2-4) |
| A/B glass-filter-plate 1 µm | Pall Corporation | PN 8031 | Stored on collector plate (CP 2-1 to 2-4) |
| 96-well micro titer plate V-Bottom | Greiner Bio-One | 651201 | Collector plate for filtration plate (CP 2-1 to 2-4) |
| 96-well SpinColumn G-25 | Harvard Apparatus | 74-5612 | Stored on washing DWP (CP 1-6, 1-7, 2-6 and 2-7) |
| 96-well micro titer plate V-Bottom | Nunc | 249944 | Collector plate for gel-filtration plate (CP 3-1 to 3-4) |
| Nested Disposable Tips SBS 50 µl tips | TECAN | 30038609 | Carousel position (CP 4-6, 4-7 and 5-1 to 5-6) |
| Trough 250 ml | Axygen | Res-SW96-HP | Water WTP 1-1, Glucose assay reagent-mix WPT 1-2, ammonium-acetate buffer pH 5.6 (CP 5-7) |
| 96-well micro titer plate F-Bottom (MTP) | Greiner Bio-One | 655101 | precipitation 1 (CP 6-1 to 6-4), pH-value (CP 7-1 to 7-4), precipitation 2 (CP 8-1 to 8-4), phenol-sulfuric-acid method (CP 8-5 to 8-8), glucose-assay (CP 9-1 to 9-9), dummy plates (WTP 3-1, 3-2) |
| 96-well silicon cap mat | Whatmann | 7704-0105 | Cover mat for MTP |
| 200 µl pipette tips | Sarstedt | 70.760.002 | For manually handling |
| 1,000 µl pipette tips | Sarstedt | 70.762 | For manually handling |
| 96-well-PCR micro titer plate | Brand | 781350 | Hydrolysis, PMP-derivatisation |
| TPE (thermoplastic elastomer) cap mat | Brand | 781405 | Hydrolysis, PMP-derivatisation |
| Filter plate 0.2 µm Supor | Pall Corporation | PN 8019 | Filtration of samples for UHPLC-ESI-MS analysis with a MTP collector plate |
| Pipette Tips LHS 5-300 µl | Brand | 732150 | Brand LHS system |
| Glucose oxidase | Sigma-Aldrich | G2133 | Glucose-assay |
| Horseradish peroxidase | Sigma-Aldrich | P6782 | Glucose-assay, pyruvat-assay |
| DA-64 (N-(Carboxymethylaminocarbonyl)-4.4'-bis(dimethylamino)-diphenylamine sodium salt) | Wako Chemicals GmbH | 043-22351 | Pyruvat-assay |
| Pyruvate oxidase | Sigma-Aldrich | P4591 | Pyruvat-assay |
| Potassium phosphate dibasic | Carl-Roth | P749.3 | Pyruvat- and glucose-assay |
| Potassium phosphate monobasic | Carl-Roth | 3904.3 | Pyruvat- and glucose-assay |
| Thiamine pyrophosphate | Sigma-Aldrich | C8754 | Pyruvat-assay |
| Magnesium chloride hexahydrate | Sigma-Aldrich | 31413 | Pyruvat-assay |
| 2-Propanol | VWR | 20922.466 | Precipitation |
| Phenol | VWR | 20599.231 | Phenol-sulfuric-acid method |
| Sulfuric acid | Carl-Roth | 4623.4 | Phenol-sulfuric-acid method |
| Trifluoroacetic acid | Sigma-Aldrich | T6508 | Hydrolysis |
| Ammonium solution | Carl-Roth | P093.1 | Hydrolysis, PMP-derivatization |
| Ethanol absolut | VWR | 20821.321 | Hydrolysis, PMP-derivatization |
| Phenol red | Alfa Aesar | B21710 | Hydrolysis, PMP-derivatization |
| 1-Phenyl-3-methyl-5-pyrazolone | Sigma-Aldrich | M70800 | PMP-derivatization |
| Methanol LC-MS | VWR | 83638.320 | PMP-derivatization |
| Acetonitril LC-MS | VWR | 83040.320 | PMP-derivatization |
| Acetic acid | Sigma-Aldrich | 338826 | PMP-derivatization |
| Ethanol absolut | VWR | 20821.321 | PMP-derivatization |
| Methyl red | Alfa Aesar | 36667 | pH-value |
| Robotic liquid handling system | Tecan | Freedom EVO | Worktable setup in Figure 2 |
| Liquid handling station LHS | Brand | 709400 | Worktable setup in Figure 2 |
| Tip-Adapter | Brand | 709434 | Worktable setup in Figure 2 |
| Liquid Ends MC 20-300 µl | Brand | 709416 | Worktable setup in Figure 2 |
| Adapter 60 mm | Brand | 709430 | Worktable setup in Figure 2 |
참고문헌
- Milani, J., Maleki, G., Valdez, B. Ch. 2, Hydrocolloids in Food Industry. Food Industrial Processes - Methods and Equipment. 2, (2012).
- Thibodeau, A. Protecting the skin from environmental stresses with an exopolysaccharide formulation. Cosmet Toiletries. 120 (12), 81-90 (2005).
- Prajapati, V. D., Jani, G. K., Zala, B. S., Khutliwala, T. A. An insight into the emerging exopolysaccharide gellan gum as a novel polymer. Carbohydr Polym. 93 (2), 670-678 (2013).
- Schmidt, W., Brouwers, H. J. H., Kuehne, H. C., Meng, B. The working mechanism of starch and diutan gum in cementitious and limestone dispersions in presence of polycarboxylate ether superplasticizers. Appl. Rheol. 23 (5), 52903 (2013).
- Srinivasan, R. Natural Polysaccharides as Treatment Agents for Wastewater. Green Materials for Sustainable Water Remediation and Treatment. , 51-81 (2013).
- Rühmann, B., Schmid, J., Sieber, V. High throughput exopolysaccharide screening platform: From strain cultivation to monosaccharide composition and carbohydrate fingerprinting in one day. Carbohydr Polym. 122, 212-220 (2015).
- Ortega-Morales, B. O., et al. Characterization of extracellular polymers synthesized by tropical intertidal biofilm bacteria. J Appl Microbiol. 102 (1), 254-264 (2007).
- Xu, R., Ma, S., Wang, Y., Liu, L., Li, P. Screening identification and statistic optimization of a novel exopolysaccharide producing Lactobacillus paracasei HCT. Afr. J. Microbiol. Res. 4 (9), 783-795 (2010).
- Dubois, M., Gilles, K. A., Hamilton, J. K., Rebers, P. A., Smith, F. Colorimetric method for determination of sugars and related substances. Anal. Chem. 28 (3), 350-356 (1956).
- Masuko, T., et al. Carbohydrate analysis by a phenol-sulfuric acid method in microplate format. Anal Biochem. 339 (1), 69-72 (2005).
- Geater, C. W., Fehr, W. R., Wilson, L. A., Robyt, J. F. A more rapid method of total sugar analysis for soybean seed. Crop Sci. 41 (1), 250-252 (2001).
- Sutherland, I. W., Dumitriu, S. Ch 16, Microbial Exopolysaccharides. Polysaccharides Structural Diversity and Functional Versatility. , 431-457 (2005).
- Wingender, J., Neu, T. R., Flemming, H. C., Wingender, J., Neu, T. R., Flemming, H. C. What are Bacterial Extracellular Polymeric Substances?. Microbial extracellular polymeric substances: characterization, structure and function. , 258 (1999).
- Rühmann, B., Schmid, J., Sieber, V. Fast carbohydrate analysis via liquid chromatography coupled with ultra violet and electrospray ionization ion trap detection in 96-well format. J. Chromatogr. A. 1350, 44-50 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유