Method Article
Automated Modular High Throughput exopolysaccharide plateforme de criblage Couplé avec très sensible Analyse Glucides d'empreintes digitales
Dans cet article
Résumé
We present an automated modular high-throughput-method for the identification and characterization of microbial exopolysaccharides in small scale. This method combines a fast preselection to analyze the total amount of secreted polysaccharides with a detailed carbohydrate fingerprint to enable the fast screening of newly isolated bacterial strains or entire strain collections.
Résumé
De nombreux micro-organismes sont capables de produire et de sécréter exopolysaccharides (EPS), qui ont des implications importantes dans le domaine médical, les applications alimentaires ou dans le remplacement des produits chimiques à base pétrochimiques. Nous décrivons une plate-forme d'analyse à un système automatisé de manipulation de liquide qui permet une analyse rapide et fiable du type et de la quantité d'EPS produite par des micro-organismes. Il permet à l'utilisateur d'identifier de nouveaux producteurs naturels exopolysaccharide microbiennes et d'analyser l'empreinte des hydrates de carbone polymères correspondants à moins d'un jour à haut débit (HT). L'utilisation de cette plate-forme, collections de souches ainsi que des banques de variants de souches qui pourraient être obtenus dans les approches d'ingénierie peuvent être criblés. La plate-forme présente une configuration modulaire, ce qui permet une séparation du protocole en deux parties principales. Tout d'abord, il existe un système de contrôle automatique, qui combine différents modules de détection de polysaccharide: une analyse semi-quantitative de viscositformation de y par une étape de centrifugation, une analyse de la formation de polymère par précipitation à l'alcool et la détermination de la teneur totale en glucides par l'intermédiaire d'une transformation phénol-acide sulfurique. Ici, il est possible de filtrer jusqu'à 384 souches par cycle. La deuxième partie présente une analyse monosaccharide détaillée pour tous les producteurs EPS sélectionnés identifiés dans la première partie en combinant deux modules essentiels: l'analyse de la composition de monomère complète par chromatographie liquide ultra-haute performance couplée à ultra-violet et la détection de piège à ions d'ionisation électrospray ( CLUHP UV-ESI-MS) et la détermination du pyruvate en tant que substituant polymérique (présence de pyruvate cétal) par oxydation enzymatique qui est couplée à une formation de couleur. Tous les modules analytiques de cette plate-forme de criblage peuvent être combinés de différentes manières et ajusté aux exigences individuelles. En outre, ils peuvent tous être manipulés manuellement ou réalisés avec un système de manipulation de liquide. Ainsi, le pla de dépistagetform permet une grande flexibilité afin d'identifier les différents EPS.
Introduction
exopolysaccharides microbiens (EPS) sont un groupe structurellement très diversifié de polymères qui remplissent diverses fonctions biologiques. Ils sont généralement construits de motifs répétitifs complexes, qui se distinguent par différents types de monomères (sucre, dérivés de sucre, des acides de sucre), les liaisons entre ces monomères et leurs substitutions. La diversité structurale des polysaccharides microbiens confère plutôt des caractéristiques différentes aux membres de cette classe de molécule, ce qui permet leur application dans différents domaines tels que la nourriture 1, cosmétiques 2,3, la construction de la chimie 4 ou traitement de l' eau 5. Pour étendre le champ d'application de ces polymères durables à base biologique et de tels l'identification de nouveaux polysaccharides microbiens naturels ainsi que l'ingénierie des variantes structurelles représente des approches prometteuses. De toute façon, une méthode de dépistage rapide est nécessaire pour analyser rapidement un grand nombre de souches microbiennes pour Their la formation d'un polysaccharide, et d'analyser leurs produits. Par conséquent, nous avons récemment développé une plate - forme de 96 puits HT-criblage pour l'analyse de la production microbienne de polysaccharides à partir d' isolats naturels ou variants de souches modifiées qui comprend l'identification de la composition de monomère 6.
L'application de cette plate-forme pour un premier tour de dépistage de ~ 500 isolats naturels nous a permis d'identifier seulement environ 10 à 20% des souches isolées comme étant capable de produire des EPS (données non présentées). Cela signifie que 80 à 90% des souches analysées ne produisait pas EPS dans les conditions appliquées, et par conséquent, une nouvelle analyse des hydrates de carbone détaillée empreinte n'a pas été nécessaire. Comme cette identification très sophistiquée de la composition monomère est un processus qui prend du temps, en particulier pour l'analyse des données, une méthode de pré-criblage rapide pour identifier les souches positives dans la production d'EPS, augmenterait considérablement l'efficacité. En outre, les réactifs,consommables et temps de mesure à l'UHPLC-UV-ESI-MS seraient réduits. En outre, les différents modules d'analyse, alors que d'une part rendre la méthode très fiable, sont d'autre part ce qui complique la manutention manuelle de plus de deux plaques à 96 puits en parallèle, et en tant que telle restreindre le plein potentiel de la méthode. Pour ces raisons, nous avons décidé de développer une plateforme de criblage automatisé. Par conséquent, on a combiné le format modulaire de la technique existante d'hydrate de carbone d'empreinte digitale avec une méthode de détection rapide entièrement automatique de la teneur en sucres totaux, fondé sur la mesure d'absorbance.
La méthode phénol-acide sulfurique représente encore la méthode de choix pour la détermination rapide de la teneur totale en glucides des polysaccharides bactériens et végétales 7,8. Cette méthode a été décrite par Dubois et al. 9 et adapté pour différentes applications et la taille des échantillons, même pour petite échelle dans des plaques à 96 puits 10,11. Le phéProcédé nol-acide sulfurique mesure la teneur totale en hydrates de carbone par une valeur sommant tous les monomères, oligomères et polymères d'hydrates de carbone des échantillons.
En prenant en compte ces aspects, le choix d'un milieu de culture approprié est essentiel d'appliquer cette méthode. Des milieux complexes contenant des composés oligomères ou polymères glucidiques comme extrait de levure pourrait conduire à une teneur en polymère modifié et, par conséquent, doivent absolument être évités. En outre, des quantités élevées de sucres sont utilisés en tant que source de carbone pour la culture des souches. Des niveaux élevés d'hydrates de carbone restants du processus de culture peuvent interférer négativement avec la mesure de la teneur en EPS.
Par conséquent, l'utilisation de sucres purs définis et est conseillée. Dans nos expériences, nous avons utilisé le glucose pour la culture des cellules. Le glucose restant après la culture a été réduit par l'intermédiaire d'un gel-filtration et déterminé par un glucose-dosage. Enfin, l'équivalent de glucoses des polysaccharides ont été calculées en soustrayant le glucose restant après la filtration sur gel à partir de la teneur totale en glucides qui ont été détectées par la méthode phénol-acide sulfurique. La filtration sur gel et la glucose-dosage en combinaison avec la méthode phénol-acide sulfurique garantissent des résultats fiables et sont capables d'être notre premier système de détection, entièrement automatisé.
Deux nouveaux modules d'analyse ont été inclus dans la plate-forme de criblage automatisé pour augmenter la quantité d'informations provenant du système de détection d'EPS: la précipitation et l'observation d'une augmentation de la viscosité.
Beaucoup EPS différents - par exemple succinoglycane, xanthane et colique acide 12 - sont signalés à être modifié avec un non-hydrate de carbone pyruvate cétal sur les positions de sucre C4 et C6. Ces cétals pyruvate (tout comme les esters succinyl demi et acides uroniques) contribuent à la nature polyanionique et donc, à la prope physiquerties du polymère par interaction par l' intermédiaire de ponts de cations divalents 13. Afin d'identifier ces polymères particuliers la détermination du pyruvate a été établi comme un autre module d'analyse supplémentaire. Cela augmente les informations sur les substituants de polysaccharides et de leurs propriétés macroscopiques potentiels.
La combinaison de tous les modules permet l'identification des différents EPS ainsi qu'une détermination rapide et efficace des producteurs EPS. Par cette approche , la plate - forme de dépistage pourrait être divisé en deux grandes parties (figure 1). Dans le criblage automatisé (partie I) le flux de travail se produit entièrement automatisé (tableau 1) pour présélectionner rapidement les EPS produisant des souches. L'analyse des glucides d'empreintes digitales (partie II) détermine quantitativement la composition de monomère des EPS produits par les souches présélectionnées. De ce fait, l'analyse des données a été réduite au minimum afin d'optimiser le criblage de grandes collections de souches. Ceoffre la possibilité d'analyser 384 souches en un seul passage de criblage automatisé et avec deux points qui sont possibles par jour de 768 souches par jour. En outre, l'analyse des glucides d'empreintes digitales donne un aperçu encore plus détaillé de tous les EPS identifiés. Cela permet l'analyse et l'identification des variantes légèrement différentes EPS ou complètement nouveaux par rapport aux structures chimiques déjà décrites des EPS dirigée.
Protocole
1. Dépistage automatisé
Remarque: toutes les étapes de manipulation de liquide sont réalisées avec un système de manipulation de liquide robotisée. La composition de la table de travail du robot est présenté à la figure 2. Tous les consommables sont stockés dans le carrousel de stockage, sauf mention contraire. Pour tout le criblage automatisé étapes d'un robot manipulateur (RM) déplace les consommables, (plaque de puits profond (DWP); micro plaque de titration (MTP); polymerase plaque de réaction en chaîne (PCR-plaque) et ainsi de suite) entre les positions de carrousel (CP ) et les positions worktable (WTP). Toutes les étapes de pipette sont réalisées avec un canal 96-pipette-bras, sauf si elle est mentionnée autrement. Toutes les étapes sont programmées et sont effectuées automatiquement au format 96 puits.
- Culture souche (Tâche 1 sur la figure 1)
Remarque: Manipulez l'inoculation des EPS putatifs produisant des souches et l'étanchéité des plaques de culture dans des conditions stériles (flux laminaire). automatiséle dépistage rapide peut gérer quatre plaques à 96 puits par cycle. Différentes souches de plusieurs genres ont déjà été testés 6.- Manuellement inoculer le pré-culture (1 ml EPS-media dans un DWP) avec un réplicateur à 96 broches à partir d'un stock de glycérol plaque de 96 puits. Couvrir la plaque avec un film d'étanchéité perméable à l'air pour éviter l'évaporation et pour permettre l'aération. Incuber à 30 ° C pendant 48 heures à 1000 rpm sur un MTP-agitateur.
- Inoculer la culture principale (990 ul EPS dans un support DWP) en transférant 10 ul de la préculture à l'aide d'une pipette à plusieurs 50 ul de 12 canaux et incuber dans les mêmes conditions que la préculture. Prenez note de toutes les souches qui ne poussent pas.
- Préparation du Robot Worktable et le carrousel de stockage
- Fournir tous les consommables énumérés dans les matériaux et l'équipement pour la bonne position dans le carrousel de stockage. Ajouter 990 ul d'eau distillée deux fois (DDH 2 O) dans chaque puits de la DWP pour les 1: 100 dilutions pour ee glucose-dosage (position de carrousel 4-1 à 4-4).
- Disposer un bac de 250 ml contenant 150 ml de ddH 2 O à la position de table de travail (WTP) 11.
- Déposer une cuve de 250 ml contenant 50 ml de glucose-test réactif mélange (4 ml 500 mM de phosphate de potassium (pH 5,7), 1,5 ml de 50 2,2-azinobis- (3ethylbenzthiazoline) -6-acide sulfonique mM, 2 ml 100 U de glucose oxydase, 10 pi 1000 U peroxydase de raifort et 42.49 ml ddH 2 O) en position WTP 1-2.
- Placez deux dummy PMT F-fond vide à la position WTP 3-1 et 3-2.
- Retirez le film d'étanchéité perméable à l'air, allouer les principales-cultures dans les positions du carrousel (CP) 1-1 à 1-4 et lancer le programme robotique automatisé.
- Équilibration du gel-filtration Plaques
Remarque: Les plaques de filtration sur gel qui sont utilisés lors de ce dépistage peuvent être réutilisés. Pour cela, laver et centrifuger trois fois chacune avec 150 ul de ddH 2 O à 2000 xg pendant 2 min à 20 ° C. Ensuite, stocker à 4° C avec 75 ul de 20% d'éthanol et couvrir avec un tapis de bouchon de silicium.- 250 ml de déplacer le bac (CP 5-7) avec 5 mM de tampon d'acétate d'ammonium (pH 5,6) à la VDP 3-3.
- Transférer les plaques de gel-filtration (CP 1-6, 1-7, 2-6 et 2-7) du carrousel à l'WTPs 4-1 à 4-4.
- Aspirer 150 pi de tampon d'acétate d'ammonium à l'aide de 200 conseils ul et distribuer dans le centre de toutes les plaques de gel-filtration pour équilibration.
- Transférer les plaques de gel de filtration dans la centrifugeuse (2 000 x g pendant 2 min à 20 ° C).
- Transférer les plaques retour à la table de travail, répétez les étapes 1.3.3, 1.3.4 et 1.3.3. Ne répétez pas l'étape de centrifugation pour éviter la déshydratation des plaques de gel-filtration. Stocker les plaques de gel-filtration équilibrée retour dans le carrousel.
- Cellule enlèvement par centrifugation (Tâche 1 sur la figure 1)
Remarque: Afin de garantir un fond bas dans l'approche de dépistage, d'analyser sans celluleEPS surnageants contenant seulement et éliminer les cellules par centrifugation après culture.- Transférer la culture principale DWP du carrousel (1-1 à 1-4) dans la centrifugeuse (4 300 x g pendant 30 min à 20 ° C).
- Préparer la table de travail via le RM pour traiter la culture principale.
Remarque: Pour les étapes 1.4.2 à 1.4.3.5 le système gère toujours deux plaques en parallèle et puis répète toutes les étapes avec les deux prochaines plaques.- Pour la précipitation avant filtration déplacer le MTP du CP 6-1 et 6-2 à WTP 4-1 et 5-1. Déplacez les PMT pH-indicateur du CP 7-1 et 7-2 à WTP 4-2 et 5-2.
- Transférer la plaque de filtration conjointement avec la plaque de collecteur du CP 2-1 et 2-2 à WTP 4-3 et 5-3. Repositionner la principale culture DWP 1-1 et 1-2 de la centrifugeuse à WTP 4-4 et 5-4.
- Préparer les modules d'analyse.
Note: Prendre 200 conseils ul du stockage de pointe (position 2-1 à 2-4). Afin de réduire les consommables, utilisez la même pointe-set pour l'étape 1.4.3.1.- Transférer 180 pi du surnageant de la culture principale à la plaque de filtration. Aspirer 150 pi du surnageant principale culture et distribuer 50 ul dans le MTP pour la précipitation avant filtration et 100 pi à la plaque indicateur de pH.
Remarque: Le pH-détermination est pas indispensable; Toutefois, après addition de 12,5 ml de méthyle indicateur rouge (50 mg dans 50 ml d'éthanol) dans chaque puits avec une pipette à plusieurs étapes, il indique que les souches productrices d'acide élevé. Cette information peut être utile pour éviter l' inhibition de la croissance (à un pH bas) pour d' autres cultures, par exemple pour un deuxième criblage avec une concentration en tampon supérieur. En outre, un pH bas peut également induire la production de EPS afin de protéger la cellule contre l'environnement acide. - Répétez l'étape 1.4.3.1 pour la seconde plaque principale culture. Utiliser un embout-set frais.
- Déplacer les plaques de filtration à la centrifugeuse et enlever toutes les autres plaques de la table de travail à leurs positions d'origine dans le carousel.
- Répétez les étapes 1.4.2.1 à 1.4.3.3 pour la troisième et quatrième plaque principale culture.
- Prenez note de ces bouillons de fermentation, qui montrent diminué la sédimentation après centrifugation des principales plaques de culture, quand ils sont transférés vers le carrousel (contrôle de la viscosité).
- Transférer 180 pi du surnageant de la culture principale à la plaque de filtration. Aspirer 150 pi du surnageant principale culture et distribuer 50 ul dans le MTP pour la précipitation avant filtration et 100 pi à la plaque indicateur de pH.
- 96 puits Filtration pour Complete Mobile Removal (Tâche 2 sur la figure 1)
Remarque: Pour assurer l'élimination des cellules du bouillon de fermentation visqueuse une étape de filtration est inclus dans le dépistage.- Centrifuger les plaques de filtration à 3000 xg pendant 10 min à 20 ° C et les ramener à leur position d'origine du carrousel.
- Préparer les plaques de gel-filtration.
- Déplacer les plaques de gel-filtration équilibrée du carrousel à la centrifugeuse et centrifuger à 1000 g pendant 2 min à 20 ° C.
- Transférer les plaques de gel-filtration de la centrifugeuse à WTP 4-1 à 44.
- Déplacer le gel fraisplaques d'ultra-filtration de collecteur de CP (3-1 à 3-4) à WTP (5-1 à 5-4).
- Transférer les plaques de gel-filtration équilibrée (WTP 4-1 à 4-4) pour des plaques collectrices fraîches (5-1 à 5-4).
- Nettoyer la table de travail, sauf les positions 5-1 et 5-2 et déplacer la position 5-1 à la position 4-1.
- Préparer la table de travail via le RM pour traiter les filtrats.
Remarque: Pour les étapes 1.5.3 à 1.6.3.5 le système gère deux plaques en parallèle et répète toutes les étapes avec les deux prochaines plaques.- Déplacer 50 conseils ul du carrousel (4-6 et 4-7) pour WTP 3-3 et 3-4.
- Transférer les plaques de filtration de CP 3-1 à 3-2 sur la table de travail (4-4 et 5-4).
- Relocaliser le DWP (dilution 1: 100) pour la détection de la consommation de glucose par le CP 4-1 et 4-2 à WTP 4-2 et 5-1.
- Déplacer le MTP pour la deuxième précipitation après filtration du CP 8-1 et 8-2 à WTP 4-3 et 5-3.
- Soulever les plaques de filtration de la plaque de collecteurs (WTP 4-4 et 5-4) et les déplacer vers WTP 3-1 et 3-2.
- Préparer les modules analytiques après filtration. Afin de réduire les consommables, utilisez la même pointe-set pour les étapes 1.5.4.1 et 1.5.4.3.
- Prenez 50 conseils pi et la pipette une partie aliquote de 10 ul du filtrat au DWP (dilution 1: 100) pour le glucose-test (consommation de glucose).
- Introduire à la pipette 35 ul de filtrat au centre de la plaque de filtration sur gel équilibrée et 50 ul de la MTP qui est utilisé pour la précipitation.
- Répétez les étapes 1.5.4.1 à 1.5.4.2 pour la deuxième plaque de filtration.
- Déplacer les plaques de gel-filtration à la centrifugeuse et de déplacer toutes les autres plaques de la table de travail vers les positions d'origine dans le carrousel.
- Répétez les étapes 1.5.3.1 à 1.5.4.4 pour la troisième et la quatrième plaque de filtration.
- Après le stockage de toutes les plaques avant dans le carrousel de prendre note des surnageants très visqueux, comme indiqué par les résidus de la plaque de filtre (haute vle contrôle de iscosité après l'étape de filtration). Un manque de filtrat peut conduire à des résultats faux négatifs dans les modules analytiques suivants.
- L' élimination du glucose par 96 puits filtration sur gel (Tâche 3 sur la figure 1)
- Centrifuger les plaques de gel-filtration à 1000 g pendant 2 min à 20 ° C.
- Préparer la table de travail via le manipulateur robotisé pour traiter le gel-filtrats.
- Fournir 50 conseils ul du carrousel (5-3 et 5-4) pour WTP 3-3 et 3-4.
- Pour la détermination du glucose restant après la filtration sur gel déplacer deux PMT du CP 9-1 et 9-2 à WTP 4-1 et 5-1.
- Pour la méthode phénol-acide sulfurique déplacer deux PMT du CP 8-5 et 8-6 à WTP 4-2 et 5-2.
- Transférer deux plaques de gel-filtration de la centrifugeuse à WTP (4-3 et 5-3).
- Soulevez les plaques de gel-filtration de la plaque de collecteur (4-3 et 5-3) et les déplacer vers WTP 3-1 et 3-2.
- Préparer la table de travail via le manipulateur robotisé pour traiter le gel-filtrats.
Remarque: Afin de réduire les consommables, utilisez la pointe-set pour les étapes 1.6.3.1 et 1.6.3.2 même.- Pour détecter le glucose restant après la filtration sur gel (dilution 1:10) prendre 50 conseils pi et transférer 25 pl de ddH 2 O (WTP 1-1) à une nouvelle MTP. Aspirer 20 pl de ddH 2 O (WTP 1-1), 5 pi d'air et 5 ul de gel-filtrat et distribuer dans la même plaque.
- Pour le phénol-acide sulfurique-méthode pipette 20 ul de gel-filtrat du MTP.
- Répétez les étapes 1.6.3.1 et 1.6.3.2 pour la deuxième plaque de gel-filtrat.
- Transférer toutes les plaques de la table de travail vers les positions d'origine dans leur carrousel.
- Répétez les étapes 1.6.2.1 à 1.6.3.4 pour la troisième et quatrième plaque de filtration sur gel.
- Modules de dosage du glucose-
- Préparer la table de travail via le manipulateur robotisé pour effectuer le glucose, commedire.
- Relocaliser le DWP (dilution 1: 100) du CP 4-1 et 4-4 à WTP 5-1 et 5-4.
- Déplacer tous les PMT du CP 9-5 et 9-8 à WTP 4-1 et 4-4.
- Prenez 200 conseils pi et mélanger la dilution par aspiration et la distribution de dix fois le volume de 180 ul. Puis la pipette une partie aliquote de 50 pi à la MTP.
- Répétez les étapes 1.7.1.2 et 1.7.1.3 pour tous les quatre (PSD 1: 100 dilution).
- Supprimer tous les PSD (5-1 à 5-4) de la table de travail.
- Préparer la table de travail pour démarrer le glucose-test.
- Pour la détermination du glucose restant après le transfert de filtration sur gel toutes les microplaques du CP (9-1 à 9-4) pour WTP (5-1 à 5-4).
- Déplacer la plaque d'étalonnage glucose-test - contenant trois fois 50 pi des concentrations suivantes de glucose (90, 45, 18, 9, 4,5, 1,8, 0,9, 0,45 et 0 mg / L) - du CP 9-9 à WTP 3- 3.
- Prenez 200 conseils pi et aspirée 50 pi de glucose-test réactif mélange de WTP 1-2, pour démarrer le premier essai. Déplacer les microplaques dans l'incubateur (30 ° C à 150 tpm pendant 30 minutes).
- Définir le calendrier pour démarrer le programme avec 5 min de retard entre les plaques.
- Après 30 min d'incubation déplacer les plaques de l'incubateur du MTP-lecteur et enregistrer l'absorbance à 418 et 480 nm.
- Après la mesure de déplacer les plaques dans leur position d'origine dans le carrousel.
- Préparer la table de travail via le manipulateur robotisé pour effectuer le glucose, commedire.
- Préparation de la précipitation
Remarque: Afin d'évaluer la production d'EPS effectuer une précipitation du surnageant avec du 2-propanol avant et après la première étape de filtration. En outre, évaluer l'adsorption du polymère sur la membrane filtrante par l'observation des fibres et des flocons dans la première, mais pas dans la seconde précipitation.
Attention: Manipuler 2-propanol comme un liquide inflammable strictement sous une hotte.- Retirez toutes les plaques de précipitation (CP 6-1 à 6-4 et 8-1 à 8-4) du carrousel. Et ajoutermanuellement, 150 pi de 2-propanol à chaque puits avec un ml d'une pipette à plusieurs étapes 12.5.
- Couvrir tous les PMT avec un tapis de bouchon en silicone et agiter à la température ambiante (RT) (10 min à 900 rpm). Visuellement observer fibres ou flocons formations après agitation qui indiquent la production d'EPS.
- Méthode Phénol-acide sulfurique
Attention: Manipuler l'acide sulfurique concentré et de phénol sous une hotte. Le phénol est un agent corrosif et mutagène.- Pour la méthode phénol-acide sulfurique, enlever les plaques (CP 8-5 à 8-8) du carrousel et les placer dans le système de traitement des liquides (position 4 à 8). Inclure la plaque d'étalonnage avec 20 pl de concentrations de glucose différentes (10; 5; 2,5; 1; 0,5; 0,25; 0,1; 0,05; 0 g / L) en triple exemplaire.
- Placez un conteneur à déchets en position 1, une boîte de pointe de 200 pi en position 2 et 250 ml auge avec 110 ml de phénol-acide sulfurique (fraîchement préparée sur with18.3 glacée ml de phénol 5% (p / v) dans ddH 2 O et 91,7 ml d'acide sulfurique concentré. sl'acide ulfuric) à la position 3.
- Utiliser une pipette à 8 canaux avec 300 conseils de pi et de transférer 180 ul de phénol-acide sulfurique dans chaque rangée de toutes les plaques.
- Couvrir tous les PMT avec des couvercles, les mélanger en secouant (5 min à 900 rpm, RT) et les incuber pendant 35 min à 80 ° C dans un four pour la réaction de couleur. Après refroidissement sous une hotte, mesurer l'extinction à 480 nm.
- Sélection des EPS positive surnageants (Tâche 4 sur la figure 1)
- Pour l'évaluation de la production d'EPS, sélectionner les souches du dépistage automatisé qui remplissent au moins deux des trois critères positifs (contrôle de la viscosité 2.6.1 et 2.6.2, la détection de polymère 2.6.3, équivalent glucose 2.6.5). Transférer les filtrats restants des résultats positifs à un nouveau PMT pour un traitement ultérieur.
Note: Lorsque les plaques sont recouvertes d'un film d'operculage en aluminium, ils peuvent être stockés à -20 ° C pendant au moins une semaine. Dans cette époque, le Determination de l'hydrate de carbone empreinte digitale doit être effectuée.
- Pour l'évaluation de la production d'EPS, sélectionner les souches du dépistage automatisé qui remplissent au moins deux des trois critères positifs (contrôle de la viscosité 2.6.1 et 2.6.2, la détection de polymère 2.6.3, équivalent glucose 2.6.5). Transférer les filtrats restants des résultats positifs à un nouveau PMT pour un traitement ultérieur.
2. Glucides d'empreintes digitales
Remarque: Toutes les étapes de l'hydrate de carbone empreintes digitales sont effectuées manuellement.
- Filtration sur gel des surnageants positifs (Groupe 5 sur la figure 1)
Remarque: Gel-filtration est nécessaire car il n'y a pas de filtrat gauche du criblage automatisé. La filtration sur gel avec un volume de plus de 35 ul dans des résultats d'efficacité d'épuration réduite.- Préparer équilibration des plaques de gel-filtration en distribuant 150 pi de tampon d'acétate d'ammonium dans tous les puits par l' intermédiaire d' un ml à étapes multiples pipette 12,5.
- Transférer la plaque de filtration sur gel dans la centrifugeuse (2 000 x g pendant 2 min à 20 ° C).
- Répétez les étapes 2.1.1, 2.1.2 et 2.1.1 à nouveau. Centrifuger la plaque de filtration sur gel à 1000 g pendant 2 min à 20 ° C avant une nouvelle utilisation.
- Introduire à la pipette 35 ul de filtrat dansle centre de la plaque de filtration sur gel en utilisant un 12 canal 50 ul de la pipette.
- Centrifuger la plaque de filtration sur gel à 1000 g pendant 2 min à 20 ° C, puis le soulever de la plaque de collecteur.
- Préparer le glucose-test avant l' hydrolyse: Effectuer une dilution 1:10 en ajoutant 45 ul de ddH 2 O et 5 pi de gel-filtrat avec une pipette de 12 canaux 50 et couvrir les PMT avec un tapis de bouchon de silicone.
Remarque: Pour la détermination correcte de la valeur de glucose du polymère, de mesurer la teneur en glucose avant l'hydrolyse et la soustraire de la teneur en glucose quantifiée après l'étape d'hydrolyse. - Préparer la pyruvate-test avant l' hydrolyse: Effectuer une dilution de 1/20 à l' aide d' un 12 canal 200 ul pipette pour ajouter 95 pl de ddH 2 O, transfert 5 pl de gel-filtrat à chaque puits et sceller le MTP avec un tapis de bouchon de silicium .
- 96 puits Micro Hydrolyse (Tâche 6 sur la figure 1)
Remarque: Chaufferle four d'incubation (y compris un bain de sable) à 121 ° C pendant au moins 1,5 heure avant l'utilisation. Un dispositif de serrage spécial a été développé pour éviter l'évaporation au cours de la petite étape d'hydrolyse écaillé.- Prenez une nouvelle PCR-plaque et transférer 20 pl de gel-filtrat avec une pipette de 12 canaux 50.
Attention: trifluoroacétique acide est un acide corrosif et toxique. solution d'ammonium est corrosive. Manipulez les produits chimiques que sous une hotte. - Ajouter 20 ul de 4 M d'acide trifluoroacétique avec 1,25 ml d'une pipette à plusieurs étapes à chaque puits. Puis couvrir le PCR-plaque avec un élastomère thermoplastique (TPE) tapis de bouchon et placer le PCR-plaque dans le dispositif de serrage spécial.
- Mélanger les solutions par l'intermédiaire d'inversion du dispositif de serrage dix fois. Mettre le PCR-plaque dans une centrifugeuse et un essorage à 2000 g pendant 2 min pour recueillir tout le liquide sur le fond. Mettez le PCR-plaque arrière au dispositif de serrage et fixer le dispositif avec des vis.
- Placer ledispositif de serrage garanti dans le bain de sable pré-chauffé et incuber pendant 90 min à 121 ° C.
- Retirer le dispositif de serrage du bain de sable et laissez-le refroidir à la température ambiante.
- Retirez les vis et tourner à nouveau dans une centrifugeuse à 2000 xg pendant 2 minutes afin de recueillir toutes les condensats au fond des puits et pour prévenir la contamination croisée pendant l'enlèvement du tapis de bouchon.
- Ajouter une solution d'ammoniaque à 3,2% pour ajuster le pH à env. 8 en utilisant un 12 canaux 200 pi pipette. Couvrir la PCR-plaque avec un tapis de bouchon de TPE et agiter manuellement en utilisant le dispositif de serrage.
- Après neutralisation centrifuger la PCR-plaque à 2.000 xg pendant 2 min.
- Prenez une nouvelle PCR-plaque et transférer 20 pl de gel-filtrat avec une pipette de 12 canaux 50.
- Haut Débit-1-phényl-3-méthyl-5-pyrazolone (HT-PGR) -derivatization des carbohydrates (Tâche 7 sur la figure 1)
- Transfert 25 pl de l'hydrolysat neutralisé dans une PCR-plaque fraîche à l'aide d'une pipette de pi 12 canaux 50.
Remarque: Après avoir pris l'aliquote, vérifiez le Neutrlisation du liquide restant dans la plaque d'hydrolyse par l'addition de 12,5 ul de phénol indicateur rouge (0,05 g rouge de phénol dans 5 ml d'éthanol à 20%) avec un ml d'une pipette à plusieurs étapes 1,25. Tous les puits qui ne se transforment pas en couleur rose (pH 8) ne sont pas correctement dérivatisés. - Ajouter 75 ul dérivatisation réactif mélange (125 mg PMP, 7 ml de méthanol, 3,06 ml ddH 2 O et 438 ul solution d'ammonium 3,2%) et couvrir la plaque avec un tapis de bouchon de TPE.
- Après avoir secoué le PCR-plaque dans la centrifugeuse de dispositif de serrage de la plaque à 2000 g pendant 2 min pour accumuler la totalité du liquide au fond.
- Pour dérivatisation lieu le PCR-plaque dans une PCR-cycleur à 70 ° C pendant 100 min suivi d'un refroidissement à 20 ° C.
- Transférer une partie aliquote de 20 ul dans un nouveau PMT en utilisant un 12-canal 50 ul pipette. Ensuite , utilisez un 12 canaux 200 ul pipette et ajouter 130 ul 19,23 mM d' acide acétique (0,962 ml 1 M d' acide acétique + 49.038 ml ddH 2 O) à chaque ligne. Mélanger directement via aspirattion et de distribution (minimum six fois) et transférer tout le liquide à une plaque de 0,2 um filtre avec une plaque MTP de collecteur.
- Centrifugeuse la plaque (1000 xg pendant 5 min), retirer la plaque filtrante, sceller le MTP avec un tapis de bouchon de silicone et placez le MTP dans le UHPLC-UV-ESI-MS pour la détermination de l'hydrate de carbone empreinte 14.
- Transfert 25 pl de l'hydrolysat neutralisé dans une PCR-plaque fraîche à l'aide d'une pipette de pi 12 canaux 50.
- Préparation du glucose-dosage
- Effectuer une dilution 1:10 par l' ajout de 45 ul de ddH 2 O et 5 pi d'hydrolysat neutralisé à l' aide d' une pipette de 12 canaux 50 et couvrir les PMT avec un tapis de bouchon de silicone. Ajouter trois fois 50 pl de différentes normes de glucose (500, 250, 100, 50, 25, 10, 5, 2,5 et 0 pM) à une nouvelle MTP utilisées pour l'étalonnage.
- Ajouter 50 pi de glucose-test réactif-mix (recette step1.2.3) à l'aide d'une pipette de 12 canaux 50. Puis couvrir les plaques avec un tapis de bouchon de silicium et incuber à 30 ° C et 400 rpm pendant 30 min dans un MTP-incubateur.
- Directement après l'incubation faire une absorbance lue dans un MTP-reader à 418 et 480 nm dans un MTP-lecteur. Pour le calcul de la concentration de glucose effectuer un étalonnage linéaire réalisée à l'étape 2.6.4.
- Préparation de la pyruvate-essai
- Effectuer une dilution de 1/20 à l'aide d'un 12 canal 200 pi pipette. Ajouter 95 ul de ddH 2 O et transfert 5 pi d'hydrolysat neutralisé à chaque puits. Couvrir le MTP avec un tapis de bouchon de silicium.
- Ajouter 100 ul de réactif de dosage du pyruvate-mélange (3 ml 1 mM de N - (carboxyméthylamino-carbonyle) -4.4'-bis (diméthylamino) de sel de sodium -diphenylamine (DA-64), 300 pi de 10 mM de thiamine pyrophosphate, 60 100 ul mM de chlorure de magnésium hexahydraté, 2,4 ml de 500 mM de phosphate de potassium décolleur (pH 5,7), 30 ul de 100 U de pyruvate oxydase, 12 ul de 1000 U peroxydase de raifort et 24.19 ml ddH 2 O) en utilisant un 12 canal 200 ul de la pipette.
- Couvrir les plaques avec un capuchon en silicone mat une incuber à 37 ° C et à 150 tpm pendant 30 min. Directement après la mesure d'incubation absorbance dans un MTP-reader à 727 et 540 nm.
- Évaluation de tous les résultats du dépistage automatisé et l'Glucides Fingerprints.
- Prenez note de ces échantillons qui montrent diminué la sédimentation après les principales plaques de culture ont été centrifugés et stockés vers le carrousel (étape de contrôle de la viscosité 1.4.1). Les échantillons qui ne présentent pas la formation de granulés sont positifs (critère 1 pour le criblage automatisé).
- Prenez note de surnageants très visqueux, qui sont indiquées par des résidus dans la plaque de filtration après l'étape de filtration (haute viscosité de l'étape de contrôle 1.5.4.6). Un manque de filtrat peut conduire à un résultat négatif faux dans les modules analytiques suivants. Les échantillons qui maintiennent surnageants de culture dans les filtres des puits sont positifs (critère également 1 pour le criblage automatisé).
- Visuellement observer fibre ou flocons formation après incubation. Prenez des notes que thest-indique les polysaccharides. Noter aucune précipitation avec (-); faibles précipitations de fibres ou de flocons avec (+) et de fortes précipitations avec (++). En outre, la détection d'adsorption du polymère sur la membrane filtrante par l'observation des fibres et des flocons dans le premier, mais pas dans la deuxième précipitation (critère 2 pour le criblage automatisé).
- Effectuer un étalonnage linéaire pour le calcul de la concentration de glucose.
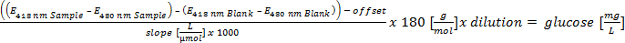
S'il vous plaît cliquer ici pour voir une version plus grande de cette équation. - Effectuer l'étalonnage linéaire (absorption sur la concentration) de 5 à 0,1 g / L de glucose. Calcul de l'équivalent de glucose dans des polymères hydrolyses et évaluer par les paramètres suivants: le glucose équivalent:> 700 mg / L = positif; 300-700 mg / L = putative positif; <300 mg / L = négatif à l'égard du format EPSion (critère 3 pour le criblage automatisé).
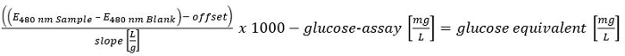
S'il vous plaît cliquer ici pour voir une version plus grande de cette équation. - Quantifier tous les hydrates de carbone déterminés avec la méthode HT-PMP. Résumez toutes les quantités et évaluer comme suit:> 300 mg / L (positive); 150-300 mg / L (putative positif) et <150 mg / L (négatif).
- Pour le calcul de la concentration en pyruvate effectuer un étalonnage linéaire (100, 50, 25, 10, 5, 2,5, 1, 0,5 et 0 pM). Pour exclure le pyruvate restant dans le surnageant, corriger le contenu du pyruvate après hydrolyse par la teneur en pyruvate avant l'hydrolyse.
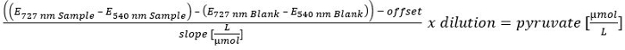
S'il vous plaît cliquer ici pour voir une version plus grande de cette EQUATIONion.
Résultats
La validation de la méthode phénol-acide sulfurique a montré de bons résultats avec un coefficient de détermination (R²) de 0,9998 (tableau 2). Pour la 5 g / L concentration du coefficient de variation (CV) et la précision a montré une bonne performance avec 1,8% et 2,2% d'erreur, mais la performance plus faible pour le 0,25 g / L en standard avec 5,3% (CV) et 6.1% d'erreur ( Bias).
Les coefficients de détermination des deux courbes d'étalonnage pyruvate-essai (avec et sans matrice) étaient> 0,9999 dans la gamme d'étalonnage de 150 pM (tableau 3). Les coefficients de variation (CV) pour le niveau d'étalonnage le plus élevé et le plus faible étaient <4,6% et la précision ont montré une très bonne performance sur la gamme complète d'étalonnage avec une erreur inférieure à 3,9%. Ainsi, la matrice de l'étape d'hydrolyse n'a montré aucune influence sur le dosage enzymatique, qui est donc capable de measure pyruvate avant et après hydrolyse.
Le tableau 4 présente les résultats détaillés de trois nouvelles souches exemplaires comme identifiées avec succès avec la plate - forme de criblage. La partie gauche de la table affiche les résultats des modules de criblage automatisées concernant la formation de la viscosité, la production de polymère et l'équivalent de glucose à partir de l'hydrolyse totale qui ont été utilisés en tant que paramètres d'évaluation pour l'analyse détaillée des glucides d'empreintes digitales. L'hydrate de carbone empreinte à base de sucres calibrés, ainsi que des sucres inconnus, des dimères et des substituants sont donnés dans la partie droite de la table. Par l'utilisation de ces informations, la composition de monomère peut être calculée et comparée à des structures polymères déjà connues. En outre, un dépistage ciblé pour les compositions monomères intéressants et les hydrates de carbone rares peut être effectuée.
La haute performance du microhydrolyse à grande échelle et le HT-PMP-dérivatisation ont été démontrées dans nos travaux précédents 14. En outre, la validation de la filtration sur gel et l'hydrate de carbone pour différents genres d' empreintes digitales ont été décrits dans une autre publication 6. En somme, la plate-forme de criblage avec sa structure modulaire peut facilement être modifié et adapté aux besoins individuels de l'utilisateur. Le criblage automatisé de la plate-forme permet à un huit fois plus de débit et donne des résultats fiables. modules analytiques nouveaux comme le pyruvate-test peuvent être intégrés et en combinaison avec l'analyse des glucides d'empreintes digitales, ils fournissent des informations très détaillées sur les EPS identifiés. Ainsi, la plate-forme de dépistage est essentiel lors de la recherche pour les deux variantes d'EPS légèrement modifiés et complètement nouveaux.
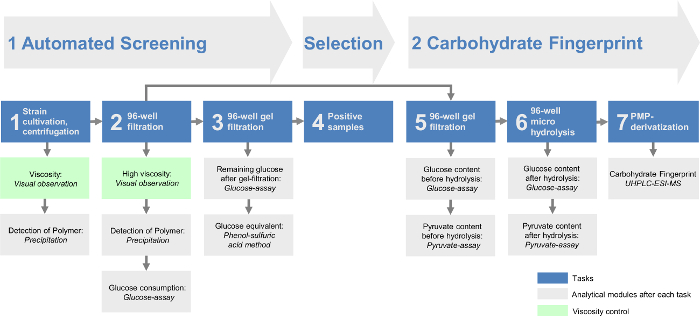
Figure 1: Schéma global de l'h modulaireaute-débit plateforme de criblage exopolysaccharide. Le criblage automatisé comprend les trois premières tâches. Après que les bactéries sont cultivées dans des plaques à 96 puits, les cellules sont éliminées par centrifugation (groupe 1) et d'une filtration à 96 puits (groupe 2). Ensuite, les sucres monomères restants à partir du milieu de croissance sont éliminées par l'intermédiaire d'une filtration sur gel à 96 puits (tâche 3). L'EPS contenant des échantillons sont évalués dans la tâche 4. L'hydrate de carbone empreinte digitale de la plate-forme de criblage comprend les trois dernières tâches. Le filtrat restant des résultats positifs de la tâche 2 fournit la base pour le gel-filtrat dans la tâche 5. Après l'hydrolyse dans la tâche 6 l'hydrate de carbone empreinte digitale peut être analysée par la méthode HT-PMP (haut débit 1-phényl-3-méthyl -5-pyrazolone, la tâche 7). Toutes les tâches sont suivies par les différents modules d' analyse et / ou un contrôle de la viscosité. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
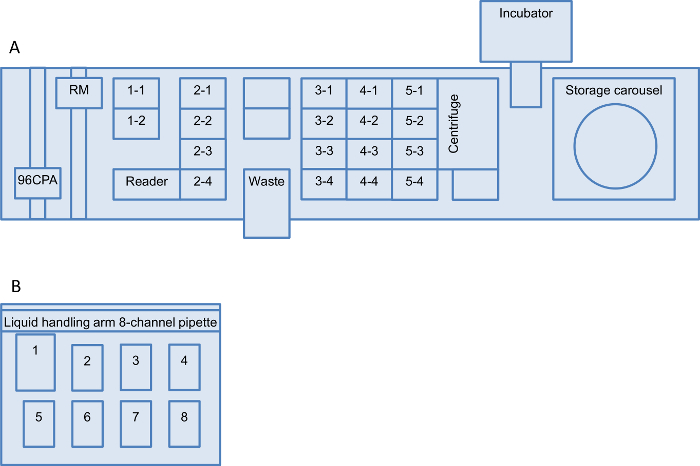
Figure 2: configuration de la table de travail de robot pour la plateforme de criblage Layouts des deux liquides de traitement des tables de travail du robot sont représentés:. (A) robotique système de manipulation de liquides et de la station de traitement (B) de liquide. (A) La configuration se compose d'un support de microplaque avec deux positions (positions 1-1 à 1-2), un support pour embouts jetables avec quatre positions (positions 2-1 à 2-4) et trois transporteurs de microplaques avec quatre positions chacun (positions 3-1 à 3-4, 4-1 à 4-4 et 5-1 à 5-4). En outre, il y a un carrousel de stockage avec cinq transporteurs d'hôtel (1 à 5) chacun pour sept plaques profondes de puits (DWP) et quatre transporteurs d'hôtel (6-9) pour chaque 21 micro-titer plaques. Le matériel installé sur le robot de manipulation de liquide est un canal de 96 pipette bras pour une utilisation avec des embouts jetables et un manipulateur robotisé (RM) qui se déplace plaques / équipements between la table de travail, le carrousel de stockage, le MTP-lecteur, la centrifugeuse et l'incubateur secouant. (B) La station de traitement des liquides est équipé d'un bras de manutention liquide et un 8 canaux 300 ul pipette, un conteneur de déchets en position 1, un adaptateur de pointe avec 300 conseils pi (position 2), un adaptateur de hauteur 30 avec 250 ml auge (position 3), et cinq hauteur adaptateur 60 pour microplaques (position 4 à 8). La numérotation des positions est désignée dans le présent protocole. Worktables alternatives peuvent également être utilisées s'il y a des configurations équivalentes disponibles. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
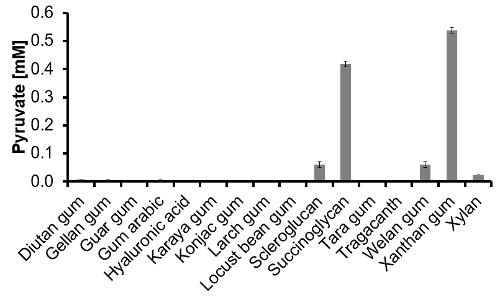
Figure 3: contenu pyruvate de 16 polymères disponibles dans le commerce déterminés via pyruvate-dosage. Une fois la solution à 1 g / l de polymères ont été hydrolyses et neutralisés, la pyruvate-test a été réalisé à partir d' une dilution de 1:10 (n = 3). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
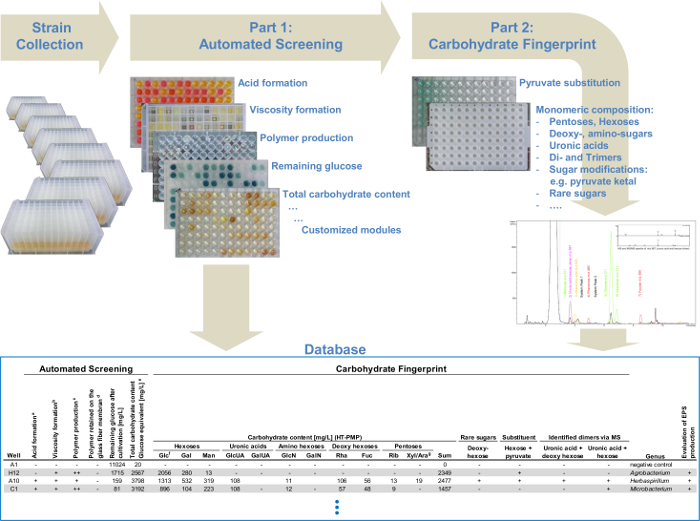
Figure 4: Diagramme de la plate - forme de criblage à haut débit modulaire. Le système automatisé de contrôle, qui combine les différents modules de détection de polysaccharide: l'analyse de la formation de la viscosité, la production de polymère et la détermination de la teneur totale en glucides. La deuxième partie présente une analyse détaillée monosaccharide pour tous les producteurs EPS sélectionnés identifiés dans la première partie. Toutes les données du dépistage automatisé et les données de l'hydrate de carbone empreinte via UHPLC-ESI-MS sont collectées dans une base de données et permettent l'identification simple des variantes de structure apparentée de already EPS ou de nouveaux EPS connu et , par conséquent, un dépistage ciblé. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Étape principale / module analytique | flux de travail | Observation / Description |
| La culture des souches | 1 ml EPS-moyen d' un Pré-culture de 48 h, 30 ° C, 1000 rpm a Main-culture de 48 h, 30 ° C, 1000 rpm a | Production de EPS |
| Prélèvement de cellules / viscosité | Centrifugation: 30 min à 4300 xg | Aucune pastille = augmentation de la viscosité = positif |
| Détection du polymère: Précipitation | 50 pi supernatant + 150 pi 2-propanol b Secouer 10 min à température ambiante et 900 rpm b | Visuel: Fibres et flocons = précipitation positive de polymère |
| Prélèvement de cellules / haute viscosité | 180 pi de surnageant principale culture Centrifugation: 10 min à 3000 xg 1,0 um membrane en fibre de verre | Aucun filtre passe = viscosité élevée = positif |
| Détection du polymère: Précipitation | 50 ul filtrat + 150 pi 2-propanol b Secouer 10 min à température ambiante et 900 rpm b | Visuel: Fibres et flocons = précipitation positive de polymère |
| La consommation de glucose: Dosage du glucose- | Dilution 1: 100: 10 ul de filtrat + 990 ul ddH 2 O 50 aliquote pi + 50 pi REAGent-mix Incubation pendant 30 min à 30 ° C, 150 tpm Mesure 418-480 nm | Glucose restant après la culture |
| Gel-filtration | équilibration: 3 x 150 pi NH 4 -acetat tampon à pH 5,6 2 x 2 min à 2000 xg 1 x 2 min à 1000 xg Gel-filtration: 35 filtrat pi, 2 min à 1000 xg La lessive: 3 x 150 pi ddH 2 O, 2 min à 2000 xg éthanol 75 ul de 20% pour le stockage | Polymère purification: L'élimination des sels, pyruvate, du glucose et d'autres monomères de sucre de culture surnageant |
| Restant glucose après filtration sur gel Dosage du glucose- | Dilution 1:10: 25 ul ddH 2 O + 20 ul ddH 2 O et 5 pi filtrat + 50 pi de réactif mélange Incubation 30 min à 30 ° C, 150 tpm Mesure 418-480 nm | Soustraction du glucose restant après la filtration sur gel par la méthode phénol-acide sulfurique |
| équivalent glucose: Méthode Phénol-acide sulfurique c | 20 ul de gel filtrat + 180 ul de phénol-acide sulfurique (30 ul de 5% (p / v) de phénol dans ddH 2 O + 150 ul Conc. De H 2 SO 4 (ρ = 1,84 g / ml)) Secouer 5 min à 900 rpm Incubation 35 min à 80 ° C, Mesure à 480 nm | équivalent glucose: Δ (valeur de phénol-acide sulfurique - restant glucose après filtration sur gel) <300 mg / L négatif > 300 et <700 mg / L putative positif > 700 mg / L positif |
| un manipulé manuellement dans des conditions stériles (flux laminaire). | ||
| Liquide inflammable b manipulé manuellement sous une hotte. | ||
| c Phénol-acide sulfurique manipulé avec Brand Liquid Handling Station (LHS) sous une hotte. | ||
Tableau 1:. Flux complet de la présélection automatique avec le système de manipulation de liquide robotisé et la station de traitement des liquides Vue d'ensemble de tous les paramètres des modules analytiques automatisés.
| Linéarité | LOD | LQ | ||
| r² un | pente un | Offset une | mg / L | mg / L |
| 0,9998 | 0,0007 | -0,021 | 50 | 100 |
| Standard | b moyenne | Precision b | Précision b | |
| mg / L | mg / L | CV% | Bias (% d'erreur) | |
| 5000 | 5112 | 1.8 | 2.2 | |
| 250 | 265 | 5.3 | 6.1 | |
| une moyenne de huit mesures, d' étalonnage avec six niveaux de glucose à partir de 0,1 à 5 g / L | ||||
| b Exécutée avec le test t de Student (α = 0,05; n = 8). | ||||
| LOD: limite de détermination, LQ: limite de quantification, CV: coefficient de variation. | ||||
Tableau 2:Validation de la méthode phénol-acide sulfurique a été effectuée avec la station de traitement des liquides. La linéarité a été calculée en se basant sur un étalonnage en six points (n = 8). Moyenne, la précision et l'exactitude des deux concentrations exemplairement choisies de glucose sont donnés ici.
| Linéarité | LQ | |||
| r² un | pente un | Offset une | iM | |
| sans matrice | 0,99999 | 0,0223 | -0,0019 | 1 |
| 01:10 matrice diluée | 0,99999 | 0,0221 | -0,0011 | 1 |
| Standard | b moyenne | Precision b | Précision b | |
| iM | iM | CV% | Bias (% d' erreur) | |
| sans matrice | 50 | 49,96 | 3.05 | -0.09 |
| 1 | 1.04 | 2.95 | 3.86 | |
| 01:10 matrice diluée | 50 | 49,98 | 0,44 | -0.04 |
| 1 | 1.00 | 4,58 | 0,33 | |
| une moyenne de trois mesures, d' étalonnage avec six concentrations de pyruvate de 1 à 50 uM. | ||||
| b (n = 3) | ||||
| LQ: limite de quantification, CV: coefficient de variation. | ||||
. Tableau 3: Validation du pyruvate essai avec et sans acide trifluoroacétique matrice neutralisé dilué 1:10 deux calibrages six points (n = 3) avec et sans influence l' évaluation de la matrice ont été réalisées. Moyen, la précision et l'exactitude des deux concentrations en pyruvate exemplairement choisies avec et sans les effets d'une dilution à 1:10 ont été calculées.

Tableau 4:.. Les résultats de trois souches exemplaires dépistées avec la plate - forme de données collectées à partir de la projection automatisée et l'hydrate de carbone empreinte S'il vous plaît clécher ici pour télécharger ce tableau sous forme de fichier Microsoft Excel.
| Glucides | Absorption max [nm] | Absorption à 480 nm moyenne ± SD | Absorbance par rapport au glucose [%] | |
| gum diutane | 470 | 0,342 | ± 0,010 | 187 |
| la gomme gellane | 472 | 0,334 | ± 0,002 | 183 |
| La gomme de guar | 478 | 0,387 | ± 0,017 | 212 |
| Gummi arabic | 476 | 0,393 | ± 0,034 | 215 |
| Acide hyaluronique | 484 | 0,231 | ± 0,011 | 126 |
| Karaya gum | 478 | 0,455 | ± 0,023 | 249 |
| la gomme konjac | 480 | 0,297 | ± 0,009 | 163 |
| Larch gum | 480 | 0,337 | ± 0,032 | 185 |
| La gomme de caroube | 478 | 0,354 | ± 0,033 | 194 |
| scléroglucane | 484 | 0,168 | ± 0,010 | 92 |
| succinoglycane | 482 | 0,168 | ± 0,005 | 92 |
| la gomme de tara | 480 | 0,318 | ± 0,016 | 174 |
| Tragacanth | 478 | 0,513 | 0,003 | 281 |
| la gomme welan | 472 | 0,226 | ± 0,016 | 124 |
| Xylan | 472 | 0,567 | ± 0,007 | 311 |
| la gomme de xanthane | 482 | 0,245 | ± 0,021 | 134 |
| Glucose | 484 | 0,191 | ± 0,014 | 100 |
| SD: écart-type | ||||
Tableau 5:. Les résultats ainsi obtenus par la méthode phénol-acide sulfurique pour 16 polymères et de glucose disponibles dans le commerce Le maximum d'absorption et l' absorption à 480 nm de 16 polymères disponibles dans le commerce (1 g / l) ainsi que du glucose (1 g / L ) ont été mesurées en appliquant la méthode phénol-acide sulfurique. L'absorbance du glucose par rapport à l'ensemble des polymères a été calculée.
| Standard | Signifier | précision d' un | Précision d' un | |
| mg / L | mg / L | CV% | Bias (% d' erreur) | |
| dilution 1:10 | 450 | 460 | 1.01 | 2.14 |
| 45 | 44,7 | 1.41 | -0.70 | |
| Dilution 1: 100 | 4500 | 5026 | 1.19 | 11.6 |
| 450 | 471 | 1.16 | 4.55 | |
| b Exécutée avec le test t de Student (α = 0,05; n = 8). | ||||
| CV: coefficient de variation. | ||||
. Tableau 6: Validation de la dilution automatique pour le dosage du glucose et la dilution du dosage du glucose-après culture (1: 100) , et après filtration sur gel (01:10) a été validée. Deux concentrations de glucose (n = 8) ont été dilués par l'intermédiaire du système de manipulation de liquides et évalués. Moyen, la précision et l'exactitude ont été calculées.
| Valeur théorique du glucose | Couvert avec un tapis de bouchon de silicone | Essai d'évaporation (non couvert) | |||||
| moyenne une | précision d' un | Précision d' un | moyenne une | précision d' un | Précision d' un </ Strong> | Évaporation | |
| mg / L | mg / L | CV % | Bias (% d' erreur) | mg / L | CV % | Bias (% d' erreur) | %Erreur |
| 45,0 | 45.2 | 0.69 | 0,44 | 46,0 | 0,66 | 2.05 | 1.60 |
| 18,0 | 17,7 | 0,80 | -1.68 | 18,0 | 0,72 | -0.01 | 1.69 |
| 9.0 | 8,74 | 1.20 | -2.98 | 8,92 | 0,81 | -0.95 | 2.09 |
| 4.5 | 4.50 | 1,26 | -0.04 | 4,58 | 1,57 | 1.76 | 1.80 |
| 1.8 | 1.85 | 0,74 | 2.90 | 2.01 | 2.82 | 11.6 | 8,48 |
| 0,9 | 1.03 | 1,43 | 14.1 | 1.16 | 3.52 | 28,3 | 12.4 |
| a (n = 4) | |||||||
| CV: coefficient de variation. | |||||||
Tableau 7:. Evaluation de l'effet de l' évaporation de MTP six étalons de glucose différentes couvertes et non couvertes (n = 4) ont été stockées dans le carrousel pendant 3,5 h à température ambiante. L'effet de l'évaporation a été évaluée en utilisant à découvert, ainsi que couverts (tapis de silicium) échantillons standard. Moyenne, la précision, l'exactitude et l'évaporation en erreur% ont été calculés.
Avant de filtration sur gel| Après filtration sur gel | Restant glucose après filtration sur gel | ||||
| moyenne une | SD a | moyenne une | SD a | ||
| mg / L | mg / L | mg / L | mg / L | % | |
| 1 | 8647 | 110 | 259 | 121 | 3.00 |
| 2 | 5108 | 56 | 116 | 37 | 2.27 |
| 3 | 2,014 | 12 | 50,8 | 14 | 2.52 |
| 4 | 1015 | 12 | 25.1 | 8.1 | 2.47 |
| 5 | 510 | 4.9 | 12.8 | 4.3 | 2.51 |
| 6 | 223 | 8.6 | 6.6 | 1.5 | 2.94 |
| 7 | 122 | 5.6 | 4.3 | 0,9 | 3,48 |
| 8 | 75 | 6.0 | 3.1 | 0,3 | 4.18 |
| a (n = 8) | |||||
| SD: écart-type | |||||
Tableau 8:. Les résultats de l'efficacité de filtration sur gel Huit normes différentes de glucose ont été déterminées avant et après la filtration sur gel afin d' évaluer l'efficacité de la filtration sur gel. Moyenne, écart-type et restant glucose après filtration sur gel en% ont été calculés.
Discussion
Détection polysaccharidique avec la méthode phénol-acide sulfurique: monosaccharides différents présentent des maxima d'absorption différentes et des coefficients d'extinction molaires par l' utilisation de ce procédé 9. Il en résulte des différents maxima d'absorption des polymères, qui contiennent plusieurs sucres dans des quantités différentes. Les différentes longueurs d'ondes des maxima d'absorption pour les 16 polymères disponibles dans le commerce différents sont donnés dans le tableau 5. Les polymères ont été dissous (1 g / L) dans le trou DDH 2 O, sous agitation (150 tpm) pendant une nuit et mesurée avec le phénol-acide sulfurique, procédé . la gomme diutane a montré les maxima d'absorption la plus faible à 470 nm, et l'acide hyaluronique, le scléroglucane et le plus élevé à 484 nm. Sur la base de ces résultats 480 nm a été choisie pour cette plate-forme de criblage. L'absorbance relative des polymères a été calculé sur la base absorbance obtenue avec 1 g / L de glucose (défini comme 100%). Les résultats les plus faibles ont été obtenus avec scléroglucane et succinoglycane, tous deux avec 92%. Cela a été expète parce scléroglucane ne contient que le glucose et le succinoglycane contient du glucose et du galactose dans un rapport de 7: 1. Les deux polymères commerciaux ont des pertes de séchage et des teneurs en cendres, c'est la raison pour laquelle la valeur théorique de ~ 110% n'a pas été atteint. Xylan a montré l'absorbance relative la plus élevée avec 311%. La raison pour cela est le coefficient d'extinction molaire élevée obtenue à partir du xylose en raison de la forme furanose plus dominante. À un niveau de 0,1 g / litre de glucose à la limite de quantification a été atteinte, ainsi que la limite de détection à une concentration <0,05 g / l. Cependant, la limite de détection pour les souches positives dans le criblage est supérieure à 0,7 g / L et, par conséquent, l'essai a montré une bonne performance. Afin d'obtenir des résultats fiables, le glucose restant après la filtration sur gel a été déterminée par un dosage du glucose-et cette valeur a été soustraite de la valeur de la méthode phénol-acide sulfurique.
Automated dilution glucose-test: La performancela détermination du glucose après la culture (dilution 1: 100) a été étudiée. Pour ce faire , 10 pl de surnageant ont été transférés dans 990 pl de ddH 2 O dans une plaque de puits profonds et mélangés par l' intermédiaire de dix fois aspirer et distribuer 180 ul de cette dilution. La deuxième étape critique a été le pipetage correct de seulement 5 aliquote ul pour la dilution 1:10 du glucose-test après filtration sur gel. Afin de générer la dilution 25 pi de ddH 2 O ont été transférés avec un pl-tip 50 d' abord, après , 20 pl de ddH 2 O et 5 pi gel filtrat ont été aspirés ensemble. Ceci assure une meilleure évacuation de l'aliquote de 5 ul de la pointe. Les deux étapes de dilution ont été vérifiées avec différentes normes de glucose via un glucose-dosage. Les résultats pour deux concentrations exemplaires sont donnés dans le Tableau 6 1:. 100 dilution pour la détermination de la teneur en glucose après la culture a montré une grande précision pour les deux normes avec un CV & #60; 1,2%. Dans le même temps, la précision de la norme plus élevée était à 11,6 (erreur%). Cependant, ceci est négligeable devant la détermination du glucose ne représente que la teneur en glucose restant après la culture et par conséquent, n'a pas d'importance pour la détection du polymère. La dilution 1:10 pour le glucose restant après la filtration sur gel a montré des résultats très fiables avec un CV <1,4% et une précision
Examen de l'évaporation: La projection nécessite 3,5 heures de la première étape à la première glucose-test. Pour savoir, si ce laps de temps a une influence sur le stockage des MTP non plafonnés, 50 pl d'étalons glucose-test ont été stockés avec et sans couvercle pendant 3,5 heures dans le carrousel de robot. Dans la gamme d'étalonnage (45 à 4,5 mg / L), la concentration de l'échantillon à peine augmenté. Une augmentation - causée par l'évaporation - était inférieur à 2,1%, et seulement pour les deux concentrations les plus faibles (1,8 et 0,9 mg / L), il a atteint jusqu'à 12,4% ( Tableau 7).
Filtration sur gel: Des quantités élevées de glucose non métabolisé perturbent la détection quantitative du glucose à partir du polymère hydrolyse. Par conséquent, une étape de filtration sur gel a été nécessaire pour éliminer le glucose restant après la culture. En outre, la filtration sur gel purifie le polymère contenant du surnageant à partir des sels et des composés d'hydrates de carbone monomères, autres que le glucose, afin de minimiser l'arrière-plan analytique dans l'analyse du monomère. Lors de l'étape de filtration sur gel de 35 ul de filtrat ont été placés au centre du puits. La validation de la robustesse de la filtration sur gel dans le système automatisé, huit étalons de calibrage de 0,045 jusqu'à 9 g / L de glucose ont été filtrés (n = 8). Le glucose de chaque concentration a toujours été réduite de plus de 95% de la valeur initiale (tableau 8). Ce faisant, la filtration sur gel a montré de très bons résultats pour diverses concentrations de glucose. En outre, le glucose restant après gel filtration a également été déterminée avec un glucose-titrage et soustraite de la détermination de phénol-acide sulfurique pour recevoir la bonne quantité de glucose équivalente pour le polymère hydrolysé.
Pyruvate-essai: Tout d'abord, on a cherché à savoir si le (1:10) TFA matrice neutralisée et diluée à l'étape d'hydrolyse interfère avec la réaction enzymatique. Par conséquent, le test complet a été effectué deux fois, une fois avec et sans matrice une fois et a donné des résultats fiables. Enfin, la teneur en pyruvate de 16 polymères disponibles dans le commerce a été mesurée avec succès et est représenté sur la figure 3. Il est généralement connu que , sur ces 16 polymères ne succinoglycane et xanthane contiennent naturellement du pyruvate. Avec notre pyruvate-dosage de ces deux polymères ont été correctement identifiés. En scléroglucane, la gomme welan et xylane pyruvate a aussi été détecté dans des quantités importantes. Dans l'ensemble, la capacité de l'approche a été validée et la pyruvate-test showed une haute performance. Il est avéré être capable de détecter le pyruvate dans différents polymères après l'hydrolyse.
empreintes digitales Glucides: Après avoir effectué tous les modules analytiques dans le criblage automatisé, les producteurs EPS potentiels ont été sélectionnés pour l'analyse des glucides d'empreintes digitales. Pour cela, plusieurs critères ont été appliqués: 1) l'observation positive de la viscosité après centrifugation et / ou après la filtration. 2) Les précipitations avant et après filtration. fibres et flocons observés ont été évalués comme positifs. 3) une valeur équivalente de glucose par la méthode phénol-acide sulfurique. Valeurs> 700 mg / L ont été jugés positifs et des valeurs comprises entre 300 et 700 mg / L ont été classés en tant que producteurs EPS putatifs. Lorsque deux ou trois critères ont été évalués comme positifs, les souches ont été sélectionnées pour une analyse ultérieure d'empreintes digitales glucides. Les critères peuvent être personnalisés vers le but individuel de l'examen des EPS (par exemple , faible viscosité EPS). Notre approche vise à trouver efficient EPS producteurs. Lors de la recherche pour les souches qui ne produisent que de petites quantités d'EPS la limite d'évaluation de l'équivalent de glucose doit être réduite.
avantages techniques et applications futures: Une caractéristique intéressante de ce protocole est le caractère modulaire des étapes et des différents modules d'analyse. Ils peuvent être combinés de différentes manières, ajustée aux besoins individuels et de nouveaux modules peuvent être facilement mis en oeuvre. Par ailleurs, les modules d' analyse peuvent être utilisés séparément, par exemple le module d'hydrolyse en combinaison avec le module HT-PMP-dérivatisation est capable d'effectuer une analyse de la composition de monomère à partir de solutions de polymères différents (1 g / L) dans un format à 96 puits. Pour les laboratoires, sans avoir accès à un système de traitement des liquides du dépistage complet puisse être manipulé manuellement sans aucun changement dans le schéma de pipetage. Cependant, en utilisant un système de traitement des liquides augmente le débit jusqu'à 768 souches (au lieu de 192 souches si screeneD manuellement) par jour. Le protocole décrit ici est capable d'un dépistage de genres différents et donc, pour le criblage de grandes collections de souches pour identifier les producteurs nouveaux EPS et analyser leur empreinte glucides dans une approche (Figure 4). En outre, un dépistage ciblé pour les polysaccharides contenant des sucres rares comme fucose, les acides uroniques ou même des sucres inconnus peut être effectuée via l'analyse monosaccharide détaillée. En outre, différentes combinaisons de sucres dans des rapports définis peuvent être détectés. Cela permet de la simple identification des variants structurellement apparentés de EPS déjà connus ou nouveaux EPS.
Déclarations de divulgation
We have nothing to disclose.
Remerciements
We sincerely thank Thomas Howe and Jörg Carsten for the programming and technical support with the liquid handling systems.
matériels
| Name | Company | Catalog Number | Comments |
| 96 well deep well plate 2.0 ml (DWP) | Greiner Bio-One | 780271 | Main-culture (CP 1-1 to 1-4), equilibration plates for gel-filtration (CP 1-6, 1-7, 2-6 and 2-7), 1:100 dilution for the glucose assay (CP 4-1 to 4-4) containing 990 µl of ddH2O |
| Breathable Sealing Film | Axygen | BF-400-S | Incubation film for pre- and main-culture DWP |
| Aluminum Sealing Film | Axygen | PCR-AS-200 | -80 °C storage film for glycerol-stock plates |
| MCA96 Nested Disposable Tips 200 µl | TECAN | 30038619 | Worktable position (WTP 2-1 to 2-4) |
| A/B glass-filter-plate 1 µm | Pall Corporation | PN 8031 | Stored on collector plate (CP 2-1 to 2-4) |
| 96-well micro titer plate V-Bottom | Greiner Bio-One | 651201 | Collector plate for filtration plate (CP 2-1 to 2-4) |
| 96-well SpinColumn G-25 | Harvard Apparatus | 74-5612 | Stored on washing DWP (CP 1-6, 1-7, 2-6 and 2-7) |
| 96-well micro titer plate V-Bottom | Nunc | 249944 | Collector plate for gel-filtration plate (CP 3-1 to 3-4) |
| Nested Disposable Tips SBS 50 µl tips | TECAN | 30038609 | Carousel position (CP 4-6, 4-7 and 5-1 to 5-6) |
| Trough 250 ml | Axygen | Res-SW96-HP | Water WTP 1-1, Glucose assay reagent-mix WPT 1-2, ammonium-acetate buffer pH 5.6 (CP 5-7) |
| 96-well micro titer plate F-Bottom (MTP) | Greiner Bio-One | 655101 | precipitation 1 (CP 6-1 to 6-4), pH-value (CP 7-1 to 7-4), precipitation 2 (CP 8-1 to 8-4), phenol-sulfuric-acid method (CP 8-5 to 8-8), glucose-assay (CP 9-1 to 9-9), dummy plates (WTP 3-1, 3-2) |
| 96-well silicon cap mat | Whatmann | 7704-0105 | Cover mat for MTP |
| 200 µl pipette tips | Sarstedt | 70.760.002 | For manually handling |
| 1,000 µl pipette tips | Sarstedt | 70.762 | For manually handling |
| 96-well-PCR micro titer plate | Brand | 781350 | Hydrolysis, PMP-derivatisation |
| TPE (thermoplastic elastomer) cap mat | Brand | 781405 | Hydrolysis, PMP-derivatisation |
| Filter plate 0.2 µm Supor | Pall Corporation | PN 8019 | Filtration of samples for UHPLC-ESI-MS analysis with a MTP collector plate |
| Pipette Tips LHS 5-300 µl | Brand | 732150 | Brand LHS system |
| Glucose oxidase | Sigma-Aldrich | G2133 | Glucose-assay |
| Horseradish peroxidase | Sigma-Aldrich | P6782 | Glucose-assay, pyruvat-assay |
| DA-64 (N-(Carboxymethylaminocarbonyl)-4.4'-bis(dimethylamino)-diphenylamine sodium salt) | Wako Chemicals GmbH | 043-22351 | Pyruvat-assay |
| Pyruvate oxidase | Sigma-Aldrich | P4591 | Pyruvat-assay |
| Potassium phosphate dibasic | Carl-Roth | P749.3 | Pyruvat- and glucose-assay |
| Potassium phosphate monobasic | Carl-Roth | 3904.3 | Pyruvat- and glucose-assay |
| Thiamine pyrophosphate | Sigma-Aldrich | C8754 | Pyruvat-assay |
| Magnesium chloride hexahydrate | Sigma-Aldrich | 31413 | Pyruvat-assay |
| 2-Propanol | VWR | 20922.466 | Precipitation |
| Phenol | VWR | 20599.231 | Phenol-sulfuric-acid method |
| Sulfuric acid | Carl-Roth | 4623.4 | Phenol-sulfuric-acid method |
| Trifluoroacetic acid | Sigma-Aldrich | T6508 | Hydrolysis |
| Ammonium solution | Carl-Roth | P093.1 | Hydrolysis, PMP-derivatization |
| Ethanol absolut | VWR | 20821.321 | Hydrolysis, PMP-derivatization |
| Phenol red | Alfa Aesar | B21710 | Hydrolysis, PMP-derivatization |
| 1-Phenyl-3-methyl-5-pyrazolone | Sigma-Aldrich | M70800 | PMP-derivatization |
| Methanol LC-MS | VWR | 83638.320 | PMP-derivatization |
| Acetonitril LC-MS | VWR | 83040.320 | PMP-derivatization |
| Acetic acid | Sigma-Aldrich | 338826 | PMP-derivatization |
| Ethanol absolut | VWR | 20821.321 | PMP-derivatization |
| Methyl red | Alfa Aesar | 36667 | pH-value |
| Robotic liquid handling system | Tecan | Freedom EVO | Worktable setup in Figure 2 |
| Liquid handling station LHS | Brand | 709400 | Worktable setup in Figure 2 |
| Tip-Adapter | Brand | 709434 | Worktable setup in Figure 2 |
| Liquid Ends MC 20-300 µl | Brand | 709416 | Worktable setup in Figure 2 |
| Adapter 60 mm | Brand | 709430 | Worktable setup in Figure 2 |
Références
- Milani, J., Maleki, G., Valdez, B. Ch. 2, Hydrocolloids in Food Industry. Food Industrial Processes - Methods and Equipment. 2, (2012).
- Thibodeau, A. Protecting the skin from environmental stresses with an exopolysaccharide formulation. Cosmet Toiletries. 120 (12), 81-90 (2005).
- Prajapati, V. D., Jani, G. K., Zala, B. S., Khutliwala, T. A. An insight into the emerging exopolysaccharide gellan gum as a novel polymer. Carbohydr Polym. 93 (2), 670-678 (2013).
- Schmidt, W., Brouwers, H. J. H., Kuehne, H. C., Meng, B. The working mechanism of starch and diutan gum in cementitious and limestone dispersions in presence of polycarboxylate ether superplasticizers. Appl. Rheol. 23 (5), 52903 (2013).
- Srinivasan, R. Natural Polysaccharides as Treatment Agents for Wastewater. Green Materials for Sustainable Water Remediation and Treatment. , 51-81 (2013).
- Rühmann, B., Schmid, J., Sieber, V. High throughput exopolysaccharide screening platform: From strain cultivation to monosaccharide composition and carbohydrate fingerprinting in one day. Carbohydr Polym. 122, 212-220 (2015).
- Ortega-Morales, B. O., et al. Characterization of extracellular polymers synthesized by tropical intertidal biofilm bacteria. J Appl Microbiol. 102 (1), 254-264 (2007).
- Xu, R., Ma, S., Wang, Y., Liu, L., Li, P. Screening identification and statistic optimization of a novel exopolysaccharide producing Lactobacillus paracasei HCT. Afr. J. Microbiol. Res. 4 (9), 783-795 (2010).
- Dubois, M., Gilles, K. A., Hamilton, J. K., Rebers, P. A., Smith, F. Colorimetric method for determination of sugars and related substances. Anal. Chem. 28 (3), 350-356 (1956).
- Masuko, T., et al. Carbohydrate analysis by a phenol-sulfuric acid method in microplate format. Anal Biochem. 339 (1), 69-72 (2005).
- Geater, C. W., Fehr, W. R., Wilson, L. A., Robyt, J. F. A more rapid method of total sugar analysis for soybean seed. Crop Sci. 41 (1), 250-252 (2001).
- Sutherland, I. W., Dumitriu, S. Ch 16, Microbial Exopolysaccharides. Polysaccharides Structural Diversity and Functional Versatility. , 431-457 (2005).
- Wingender, J., Neu, T. R., Flemming, H. C., Wingender, J., Neu, T. R., Flemming, H. C. What are Bacterial Extracellular Polymeric Substances?. Microbial extracellular polymeric substances: characterization, structure and function. , 258 (1999).
- Rühmann, B., Schmid, J., Sieber, V. Fast carbohydrate analysis via liquid chromatography coupled with ultra violet and electrospray ionization ion trap detection in 96-well format. J. Chromatogr. A. 1350, 44-50 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon