Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Evaluación del huso meiótico en ovocitos de ratón por silenciamiento siRNA mediada
En este artículo
Resumen
A continuación, presentamos un protocolo para el agotamiento de ARNm siRNA mediada específico seguido por análisis de inmunofluorescencia para evaluar ensamblaje del huso meiótico y la organización de los ovocitos de ratón. Este protocolo es adecuado para el agotamiento de las transcripciones in vitro y la evaluación funcional de los diferentes husillo y / o factores MTOC asociada en ovocitos.
Resumen
Errors in chromosome segregation during meiotic division in gametes can lead to aneuploidy that is subsequently transmitted to the embryo upon fertilization. The resulting aneuploidy in developing embryos is recognized as a major cause of pregnancy loss and congenital birth defects such as Down’s syndrome. Accurate chromosome segregation is critically dependent on the formation of the microtubule spindle apparatus, yet this process remains poorly understood in mammalian oocytes. Intriguingly, meiotic spindle assembly differs from mitosis and is regulated, at least in part, by unique microtubule organizing centers (MTOCs). Assessment of MTOC-associated proteins can provide valuable insight into the regulatory mechanisms that govern meiotic spindle formation and organization. Here, we describe methods to isolate mouse oocytes and deplete MTOC-associated proteins using a siRNA-mediated approach to test function. In addition, we describe oocyte fixation and immunofluorescence analysis conditions to evaluate meiotic spindle formation and organization.
Introducción
La meiosis es un proceso de división único que ocurre en gametos (ovocitos y espermatozoides) y consiste en dos divisiones sucesivas sin intervenir la síntesis de ADN para segregar los cromosomas homólogos y cromátidas hermanas durante la meiosis I y meiosis II, respectivamente 1. Los errores en la segregación cromosómica durante la división meiótica en ovocitos pueden dar lugar a aneuploidía, que se hereda por el embrión durante la fertilización. En particular, la incidencia de la aneuploidía en embriones en desarrollo aumenta con el avance de la edad materna y es una causa importante de defectos congénitos, así como la pérdida del embarazo en mujeres 1,2, por lo tanto, lo que subraya una importante necesidad de comprender la base molecular de la aneuploidía durante la división meiótica .
Durante la división celular, la segregación cromosómica depende crucialmente de montaje del huso mitótico microtúbulos y el establecimiento de interacciones del cromosoma microtúbulos estables para el correcto apego a husillo opuestopolos. Es importante destacar que la formación del huso meiótico en ovocitos de mamíferos difiere de la mitosis en las células somáticas, y está regulado por los centros de organización de microtúbulos (COMT) únicas que carecen de centriolos 3,4. Proteínas esenciales necesarios para la nucleación de microtúbulos y organización localizar a COMT ovocitos, incluyendo γ-tubulina que cataliza ensamblaje de los microtúbulos. Además, pericentrina funciona como un andamio de proteínas esenciales, que se une y anclajes gamma-tubulina, así como otros factores en COMT 5. En particular, nuestros estudios demuestran que el agotamiento de las proteínas asociadas-MTOC clave interrumpe organización huso meiótico y conduce a errores en la segregación cromosómica ovocitos, que no se resuelven por completo por el punto de control de ensamblaje del huso (SAC) 6,7. Por lo tanto, los defectos en la estabilidad del huso, que no provocan la detención meiótica, plantean un riesgo significativo para contribuir a la aneuploidía. A pesar de su papel esencial en el montaje y organización del huso, prot MTOC ovocitocomposición y función ein sigue siendo poco conocida.
Prueba de la función de las proteínas diana específicas en ovocitos de mamíferos es un reto, ya que las células se vuelven transcripcionalmente inactiva poco antes de la reanudación de la meiosis 8,9. Por lo tanto, los ovocitos pre-ovulatorios se basan en tiendas de mRNA maternos para reanudar la meiosis y apoyan la división meiótica, así como las primeras divisiones de escisión después de la fertilización 10,11. La eficacia de la interferencia de ARN (RNAi) mediada por la degradación de transcritos de ARNm en ovocitos de mamíferos está bien establecido y RNAs maternas reclutados para la traducción durante la maduración meiótica son particularmente susceptibles de siRNA dirigidos 12-14. Por lo tanto, la microinyección de RNAs de interferencia cortos (siRNAs) en oocitos proporciona un enfoque valioso para agotar los ARNm diana para el ensayo funcional.
A continuación, describimos los métodos para el aislamiento de los ovocitos de ratón y el agotamiento de siRNA mediada por transcri específicapts para probar la función de una proteína esencial asociada a MTOC, pericentrina. Además, se describen condiciones de análisis de inmunofluorescencia para evaluar la formación del huso meiótico en ovocitos.
Protocolo
Este protocolo fue aprobado por el Cuidado y Uso de Animales Comité Institucional (IACUC) de la Universidad de Georgia.
1. Preparativos
- Para el cultivo de los ovocitos, compra o recién preparar Medio Esencial Mínimo (MEM) y complementar con 3 mg / ml de albúmina de suero bovino (BSA) como se indica en la Tabla 1. Coloque una botella de poliestireno en un equilibrio de carga (tara a cero). Añadir todos los reactivos, excepto BSA, en orden y que aparezca el volumen final con MQ-agua en peso a un total de 250 g. A continuación, agregue la BSA, deje que se disuelva y esterilizar filtro.
Nota: El medio MEM descrito requiere de equilibración y la incubación de células con una mezcla de gases médica de 5% de CO 2, 5% O 2 y 90% N 2. Sin embargo, otros medios de comunicación (por ejemplo, CZB) se pueden usar que permiten la incubación de las células en 5% de CO 2 en condiciones atmosféricas. - Para la microinyección de ovocitos, comprar o preparar medio M2.
- Preparar pgonadotropina de suero de yegua reinante (PMSG) a una concentración de 5 UI / 100 l.
- Compra y reconstituir las reservas siRNA a una concentración de trabajo de 1 mM.
2. ratón ovocitos Colección
- DÍA 1: Para estimular el desarrollo del folículo ovárico y aumentar el número de folículos pre-ovulatorios, administrar 5 UI de PMSG por vía intraperitoneal a ratones hembra de 48 horas antes de la recolección de los ovocitos.
- DÍA 3: Para la recolección de los ovocitos y la cultura, estableció placas de cultivo de 35 mm con 3 ml de MEM / BSA suplementado con 1 mg / ml milrinona. Este inhibidor de la fosfodiesterasa mantiene los ovocitos en profase I arreste y evita la ruptura de la vesícula germinal (GVBD). Equilibrar las placas de cultivo en una mezcla de gases médica durante al menos 15 min.
Se requiere Milrinona medio suplementado en toda la colección de ovocitos, así como la microinyección de ovocitos y el 24 horas de retención cultura período posterior siRNA: Nota. - Recuperar los ovarios de los ratones hembra utilizando laboratorio establecido prácticas 15 y traslado a una nueva placa de cultivo con pre-calentado y se equilibró MEM / BSA / milrinona.
- Coloque la placa de cultivo en el escenario de un microscopio estereoscópico para la recolección de los ovocitos. Lanzamiento de cúmulo-ovocito complejos (COC de) perforando manualmente los folículos antrales con 27 G agujas. Fijar un ovario a la parte inferior de la placa de cultivo, con una aguja de 27 G unida a una jeringa de 1 ml, y utilizar una segunda aguja para perforar todos los folículos grandes. Repita el procedimiento para cada ovario.
- Usando procedimientos boca pipeteo estándar u otros medios de aspiración de ovocitos, recoger todos los ovocitos que están rodeados por 2 o más capas de células del cumulus compactos. Transferir el COC de un nuevo plato y se incuba a 37 ° C durante 1 hora.
- Retire con cuidado las células del cumulus que rodean por repetido pipeteo suave con una pipeta 1 ml ajustado a un volumen de aspiración de 750 l. Repita el paso de pipeteo cerca de 12 vecesy permitir que los ovocitos se recuperen durante 5 min. Continúe de esta manera hasta que todos o la mayoría de las células del cúmulo se han eliminado. La transferencia de los ovocitos denudados a otra placa de cultivo y permitir que se equilibre a 37 ° C durante 15 minutos.
- Asignar los ovocitos denudados en tres grupos experimentales que se utilizarán para: (i) la microinyección de siRNAs específicos contra el blanco de interés, (ii) la microinyección de (control) siRNAs inespecíficos, y (iii) un grupo no inyectada de control para tener en cuenta condiciones de cultivo.
3. La microinyección de ovocitos
- Establecer placas de cultivo con 3 ml de medio M2 suplementado con milrinona (1 mg / ml) para la microinyección de ovocitos. Preparar placas de cultivo que contenían MEM / BSA / milrinona para el lavado y la posterior cultura de ovocitos inyectados.
Nota: medio M2 contiene HEPES tampón y requiere pre-calentamiento a 37 ° C durante 15 minutos en condiciones atmosféricas. MEM requiere pre-calentamiento y el equilibrio usando gases medicinales como describird arriba. - Prepare el sistema de microinyección. Cargue la aguja de inyección con 5 l de solución de siRNA 1 M. Asegure la pipeta de sujeción y la aguja de inyección para micromanipuladores del sistema de microinyección y configurar la unidad de inyección con el volumen y la presión calibrada.
- Coloque un 200 l micro-gota de medios M2 en el interior de la tapa de una placa de cultivo de 3 cm y añadir un ovocito para configurar y alineación del sistema de microinyección.
- Utilizando el ovocito como guía, ajuste las posiciones de la explotación y de inyección de agujas. Aplicar presión negativa a la pipeta de sujeción para fijar suavemente el ovocito y ajustar la posición de la aguja de inyección con el diámetro más ancho de la célula. Ajustar la configuración para permitir que la microinyección de aproximadamente 10 pl de la solución de siRNA en cualquier lugar en el citoplasma del ovocito.
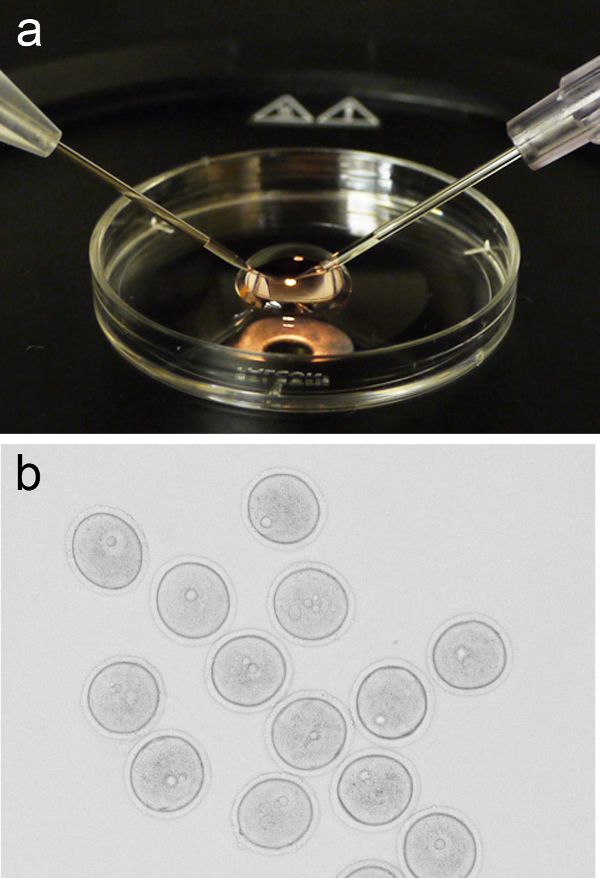
Figura 1. ovocitos microinyección creó. ( A) imagen representativa de una micro-200 l gota de medios de comunicación M2 colocado en la tapa de una placa de cultivo de 3 cm, con la aguja de sujeción de la pipeta y la inyección colocado a la izquierda y derecha, respectivamente. (B) Grupo de la profase I arrestado ovocitos (GV-etapa) antes de la microinyección. Por favor haga clic aquí para ver una versión más grande de esta figura. - Devuelva la tapa para la etapa de microscopio estereoscópico y añadir un 200 l micro-gota de medios M2 fresco. Añadir un grupo de ovocitos (~ 10) a la micro-gota mediante pipeteo boca, o métodos alternativos, a continuación, devolver la tapa con micro-gota a la etapa de microinyección.
- Proceda a microinyectar los ovocitos individuales. Asegurar un ovocito con la pipeta tenencia, introduzca lentamente la punta de la aguja de inyección en el citoplasma y expulsar el volumen de inyección de la solución de siRNA. Retraer con cuidado la aguja de inyección y move el oocito inyectado a una posición en la parte inferior de la micro-drop. Mueva ovocitos inyectados, sin éxito, a una posición en la parte superior de la micro-drop.
- Repita el procedimiento de microinyección con cada ovocito. Para mantener la viabilidad de oocitos óptima, microinyectar sólo un pequeño número de ovocitos a la vez. Asegúrese de que este proceso no toma más de unos pocos minutos para evitar que la temperatura y pH cambios en la micro-drop.
- Aspirar inyecta éxito ovocitos o mover con cuidado la tapa con el micro-gota de ovocitos inyectados con el microscopio estereoscópico. La transferencia de los ovocitos viables inyectados con la pipeta boca o métodos alternativos, al MEM / BSA medio / milrinona de lavar y equilibrar a 37 ° C.
- El uso de otro grupo de ovocitos, repita el proceso de microinyección con una nueva aguja de inyección cargado con siRNAs no específicos para el grupo de control. Lave los ovocitos en MEM / BSA / milrinona y traslado a una placa de cultivo separado.
- Cultura todos los grupos deovocitos durante 24 horas en MEM / BSA / milrinona a 37 ° C en una atmósfera de gas médico.
Nota: Se necesita el periodo de cultivo 'bloque milrinona' para la meta eficiente agotamiento ARNm / proteína.
4. ovocitos de la cultura para la maduración meiótica
- DÍA 4: Para cada grupo experimental de ovocitos configuración 4 placas de cultivo (35 mm) con 3 ml de MEM / BSA. Suplemento un plato medios por grupo con 10% de suero bovino fetal (de alta calidad) (FBS) a utilizar para la maduración de ovocitos. Permitir que todos los platos de cultivo se equilibren a 37 ° C con la mezcla de gases medicinales.
- Para liberar ovocitos de "bloque milrinona ', secuencialmente lavar los ovocitos tres veces en platos que contienen MEM / BSA y luego transferir los ovocitos al plato que contiene la maduración de medios con 10% de FBS. Cultura todos los grupos de ovocitos de 17 horas a 37 ° C, para permitir la reanudación y la progresión de la meiosis.
- DÍA 5: Preparar soluciones para fixa ovocitoción, incluyendo: (i) 4% de paraformaldehído (PFA) en tampón PEM (TUBOS 100 mM [pH 6,9], 1 mM de MgCl 2, 1 mM EGTA) con 0,5% de Triton-X 100, y (ii) PBS suplementado con 5 % de FBS que se utilizarán para lavar y bloquear los ovocitos.
Nota: Estas soluciones requieren pre-calentamiento a 37 ° C antes de la fijación de los ovocitos. - Para la fijación de los ovocitos (después del cultivo 17 hr), con rapidez transferir cada grupo experimental de los oocitos mediante pipeteado boca o métodos alternativos en los pocillos individuales (de un plato de 4 pocillos) que contiene 750 l de pre-calentado solución PFA 4% y se incuba a 37 ° C durante 1 hora. Posteriormente lavar cada grupo de ovocitos 3 veces (15 min cada uno) en 750 l de PBS precalentado que contienen 5% de FBS.
- Ovocitos bloque en 200 l de PBS / 5% de FBS O / N a 4 ° C para minimizar la unión inespecífica del anticuerpo.
Análisis 5. Inmunofluorescencia
- DÍA 6:
Nota: La inmunotinción se realiza en una placa multi-pocillo y la OOCytes se transfieren en serie a los pocillos secuenciales, que contiene respectivas soluciones de anticuerpos y de lavado. Cualquiera de 48 o 96 pocillos placas se pueden usar, simplemente ajustar el volumen de la solución basada en el tamaño también. Para placas de 96 pocillos utilizar 200 l por pocillo. Los ovocitos se transfieren a las diferentes soluciones en el orden siguiente: solución de anticuerpo primario - 3 pozos de lavado - solución de anticuerpo secundario - 3 pozos de lavado. Para limitar exposición a la luz de la placa se puede cubrir con papel de aluminio.
Preparar fresco PBS / 5% de FBS y utilizar esta solución para preparar diluciones de anticuerpos (por ejemplo, conejo anti-pericentrina (1 / 1.000), ratón anti-tubulina (1 / 1.000)). - La transferencia de los ovocitos fijos de cada grupo experimental a los pocillos individuales que contienen 200 l (o 100 l, si se desea menos volumen) de la solución de anticuerpo primario y tapar el pozo con parafilm. Incubar acuerdo con las condiciones óptimas de anticuerpo específico (por ejemplo, 37 ° C durante 1 hr, o 4 ° CO / N).
Nota: El anticuerpo primario dilution así como el tiempo de incubación y la temperatura específica requieren pruebas para determinar las condiciones óptimas para diferentes anticuerpos utilizados. - Después de la incubación con el anticuerpo primario, se lavan los ovocitos tres veces en PBS / FBS al 5% (10-15 min cada uno).
- La transferencia de los ovocitos en la solución que contiene anticuerpos secundarios conjugados con fluorescencia (por ejemplo, 1 / 1.000 de dilución de anticuerpos anti-conejo y anti-ratón conjugado con fluorocromos de diferentes longitudes de onda). Incubar durante 1 hora a 37 ° C.
- Lavar los ovocitos tres veces en PBS / FBS al 5% (10 - 15 min cada uno).
- Tras la etapa de lavado final, la transferencia de los ovocitos en un portaobjetos de vidrio limpio y suavemente aspirar cualquier exceso de solución de lavado. Esto inmovilizar los ovocitos en la superficie de vidrio. Añadir 8 l de los medios de comunicación (que contiene DAPI) montaje y superponer cuidadosamente los medios de montaje con un 22 mm x 22 mm cubreobjetos. Baje el cubreobjetos lentamente para evitar atrapar burbujas de aire y / o dañar los ovocitos.
Nota: Como alternativa, para mantener las propiedades 3-dimensionales de los ovocitos para el análisis de microscopía confocal, añadir un pequeño volumen de 100 cuentas de vidrio micras (mezclado con vaselina) a las esquinas de la hoja de la cubierta antes de montar en la diapositiva. - Diapositivas se almacenan a 4 ° C, o proceder a la evaluación de la progresión meiótica, así como el análisis de los niveles de expresión y localización subcelular de proteínas utilizando un microscopio de fluorescencia equipado con los filtros necesarios para que coincida con los anticuerpos secundarios utilizados.
Resultados
La microinyección de siRNAs proporciona un enfoque eficaz para la degradación del ARNm y el agotamiento de la proteína posterior en oocitos, que permite a las pruebas funcionales eficiente y altamente específica de diferentes factores diana in vitro. Posteriormente, la inmunofluorescencia se utiliza para el análisis específico fenotipo, así como para validar el agotamiento de la proteína en oocitos inyectados con siRNA. En el ejemplo actual, marcaje fluorescente de ovocitos individuales con DAPI junto c...
Discusión
Si bien hay varios métodos para la transferencia de ácido nucleico exógeno en las células somáticas, tales como la electroporación y la transfección, microinyección es el método óptimo para la entrega de moléculas de RNA en oocitos de ratón transcripcionalmente quiescentes. El protocolo actual ofrece un enfoque eficaz para el agotamiento in vitro de ARNm específicos que permiten a las pruebas funcionales de diferente huso y / o factores MTOC asociada en ovocitos. Este enfoque se traduce en el agota...
Divulgaciones
The authors have nothing to disclose
Agradecimientos
This research was supported in part by the University of Georgia, and a grant (HD071330) from the National Institutes of Health to MMV.
Materiales
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Pregnant Mare's Serum Gonadotropin (PMSG) | EMD Biosciences | 367222 | |
| Minimal Essential Medium (MEM) | *Recipe outlined in Table 1 | ||
| Earle's Balanced Salt Solution (10x) | Sigma | E-7510 | |
| Sodium Bicarbonate | Sigma | S-5761 | |
| Pyruvic Acid, sodium salt | Sigma | P-5280 | |
| Penicillin G, potassium salt | Sigma | P-7794 | |
| Streptomycin Sulfate | Sigma | S-9137 | |
| L-Glutamine | Sigma | G-8540 | |
| EDTA, disodium salt dihydrate | Sigma | E-4884 | |
| Essential Amino Acids (50x) | Gibco | 11130-051 | |
| MEM Vitamin Mixture (100x) | Sigma | M-6895 | |
| Phenol Red solution | Sigma | P-0290 | |
| Bovine Serum Albumin (BSA) | Sigma | A1470 | |
| Milrinone | Sigma | M4659 | |
| Fetal Bovine Serum (FBS) | Hyclone | SH30070.01 | |
| EmbryoMax M2 Media with Hepes | EMD Millipore | MR-015-D | |
| siRNAs targeting Pericentrin | Qiagen | GS18541 | |
| Negative control siRNAs | Qiagen | SI03650318 | |
| Paraformaldehyde (16% solution) | Electron Microscopy Sciences | 15710 | |
| Triton-X | Sigma | T-8787 | |
| Phosphate Buffered Saline (PBS) | Hyclone | SH30028.02 | |
| Anti-Pericentrin (rabbit) | Covance | PRB-432C | |
| Anti-acetylated a-tubulin (mouse) | Sigma | T-6793 | |
| Goat anti-rabbbit Alexa Fluor 488 | Invitrogen | A-21430 | |
| Goat anti -mouse Alexa Fluor 555 | Invitrogen | A-11017 | |
| Major Equipment | |||
| Stereomicroscope (SMZ 800) | Nikon | ||
| Upright Fluorescent Microscope | Leica Microsystems | ||
| Inverted Microscope | Nikon | ||
| Femtojet Micro-injections System | Eppenforf | ||
| Micro manipulators | Eppendorf | ||
| Micro-injection needles (femtotips) | Eppendorf | 930000035 | |
| Holding pipettes (VacuTip) | Eppendorf | 930001015 | |
| Plasticware | |||
| 35 mm culture dishes | Corning Life Sciences | 351008 | |
| 4-well plates | Thermo Scientific | 176740 | |
| 96 well plates | Corning Life Sciences | 3367 | |
| 0.45 mm CA Filter System | Corning Life Sciences | 430768 |
Referencias
- Nagaoka, S. I., Hassold, T. J., Hunt, P. A. Human aneuploidy: mechanisms and new insights into an age-old problem. Nat Rev Genet. 13 (7), 493-504 (2012).
- Hassold, T. J., Hunt, P. A. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Szollosi, D., Calarco, P., Donahue, R. P. Absence of Centrioles in the First and Second Meiotic Spindles of Mouse Oocytes. J Cell Sci. 11 (2), 521-541 (1972).
- Manandhar, G., Schatten, H., Sutovsky, P. Centrosome Reduction During Gametogenesis and Its Significance. Biol Reprod. 72 (1), 2-13 (2005).
- Zimmerman, W. C., Sillibourne, J., Rosa, J., Doxsey, S. J. Mitosis-specific anchoring of gamma tubulin complexes by pericentrin controls spindle organization and mitotic entry. Mol Biol Cell. 15 (8), 3642-3647 (2004).
- Ma, W., Baumann, C., Viveiros, M. M. NEDD1 is crucial for meiotic spindle stabilty and accurate chromosome segregation in mammalian oocytes. Dev Biol. 339 (439-450), (2010).
- Ma, W., Viveiros, M. M. Depletion of pericentrin in mouse oocytes disrupts microtubule organizing center function and meiotic spindle organization. Mol Reprod Dev. 81 (11), 1019-1029 (2014).
- Bouniol-Baly, C., et al. Differential Transcriptional Activity Associated with Chromatin Configuration in Fully Grown Mouse Germinal Vesicle Oocytes. Biol Reprod. 60 (3), 580-587 (1999).
- De La Fuente, R., Eppig, J. J. Transcriptional Activity of the Mouse Oocyte Genome: Companion Granulosa Cells Modulate Transcription and Chromatin Remodeling. Dev Biol. 229 (1), 224-236 (2001).
- Hodgman, R., Tay, J., Mendez, R., Richter, J. D. CPEB phosphorylation and cytoplasmic polyadenylation are catalyzed by the kinase IAK1/Eg2 in maturing mouse oocytes. Development. 128 (14), 2815-2822 (2001).
- De La Fuente, R. Chromatin modifications in the germinal vesicle (GV) of mammalian oocytes. Dev Biol. 292 (1), 1-12 (2006).
- Wianny, F., Zernicka-Goetz, M. Specific interference with gene function by double-stranded RNA in early mouse development. Nat Cell Biol. , 270-275 (2000).
- Svoboda, P., Stein, P., Hayashi, H., Schultz, R. M. Selective reduction of dormant maternal mRNAs in mouse oocytes by RNA interference. Development. 127 (19), 4147-4156 (2000).
- Svoboda, P. Renaissance of mammalian endogenous RNAi. FEBS Letters. 588 (15), 2550-2556 (1016).
- Behringer, R., Gertsenstein, M., Nagy, K., Nagy, A. . Manipulating the Mouse Embryo: A Laboratory Manual. , (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados