É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Meiotic Avaliação de fuso em oócitos mouse por silenciamento mediado por siRNA
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para esgotamento específico mRNA mediado por siRNA seguido por análise de imunofluorescência para avaliar a formação do fuso meiótico e organização em oócitos de camundongos. Este protocolo é adequado para in vitro esgotamento das transcrições e avaliação funcional dos diferentes fuso e / ou fatores associados à MTOC em oócitos.
Resumo
Errors in chromosome segregation during meiotic division in gametes can lead to aneuploidy that is subsequently transmitted to the embryo upon fertilization. The resulting aneuploidy in developing embryos is recognized as a major cause of pregnancy loss and congenital birth defects such as Down’s syndrome. Accurate chromosome segregation is critically dependent on the formation of the microtubule spindle apparatus, yet this process remains poorly understood in mammalian oocytes. Intriguingly, meiotic spindle assembly differs from mitosis and is regulated, at least in part, by unique microtubule organizing centers (MTOCs). Assessment of MTOC-associated proteins can provide valuable insight into the regulatory mechanisms that govern meiotic spindle formation and organization. Here, we describe methods to isolate mouse oocytes and deplete MTOC-associated proteins using a siRNA-mediated approach to test function. In addition, we describe oocyte fixation and immunofluorescence analysis conditions to evaluate meiotic spindle formation and organization.
Introdução
A meiose é um processo de divisão única que ocorre em gametas (óvulos e espermatozóides) e envolve duas divisões sucessivas sem intervir síntese de DNA para separar cromossomos homólogos e cromátides irmãs durante a meiose-I e meiose-II, respectivamente 1. Erros na segregação dos cromossomos durante a divisão da meiose em oócitos pode resultar em aneuploidia, que é herdado pelo embrião durante a fertilização. Notavelmente, a incidência de aneuploidia em embriões em desenvolvimento aumenta com o avançar da idade materna e é uma causa principal de defeitos congénitos congénitas, bem como a perda da gravidez em mulheres 1,2, assim, uma necessidade importante sublinhar a compreender a base molecular de aneuploidia durante a divisão meiótica .
Durante a divisão celular, a segregação cromossômica depende fundamentalmente da montagem do aparelho do fuso microtúbulos e estabelecimento de interações cromossômicas-microtúbulos estáveis para a correta fixação ao eixo opostopólos. É importante ressaltar que a formação do fuso meiótico em ovócitos de mamíferos difere da mitose em células somáticas, e é regulada por centros de organização de microtúbulos únicos (MTOCs) que não possuem centríolos 3,4. Proteínas essenciais necessárias para a nucleação de microtúbulos e organização para localizar MTOCs ovócitos, incluindo γ-tubulina que catalisa a montagem de microtúbulos. Além disso, pericentrin funciona como uma proteína essencial andaime, que se liga e âncoras y-tubulina, bem como de outros factores na MTOCs 5. Notavelmente, os nossos estudos mostram que a depleção de proteínas principais associadas interrompe-MTOC organização fuso meiótico e conduz a erros de segregação cromossoma em oócitos, que não são inteiramente resolvidas pelo posto de montagem do eixo (SAC) 6,7. Portanto, defeitos de estabilidade do fuso, que não provocam detenção meiótica, representam um risco significativo na contribuição para a aneuploidia. Apesar de seu papel essencial na montagem do fuso e organização, prot MTOC oócitocomposição e função ein permanece pouco compreendida.
Testando a função de proteínas alvo específicas em oócitos de mamíferos é um desafio, como as células tornam-se transcricionalmente quiescente pouco antes do recomeço da meiose 8,9. Assim, os oócitos pré-ovulatórios dependem lojas de ARNm maternais para retomar a meiose e a apoiar divisão meiótica, bem como as primeiras divisões de clivagem após a fertilização 10,11. A eficácia de interferência de RNA (RNAi) degradação mediada de transcritos de mRNA em oócitos de mamíferos está bem estabelecida e RNAs maternas recrutados para a tradução durante a maturação meiótica são particularmente passível de siRNA alvejando 12-14. Portanto, a microinjecção de RNAs interferentes curtas (siARN) em oócitos fornece uma ferramenta valiosa para esgotar mRNAs alvo para testes funcionais.
Aqui, descrevemos métodos para o isolamento de oócitos de camundongos e esgotamento mediado por siRNA de transcri específicopts para testar a função de uma proteína essencial MTOC-associado, pericentrin. Além disso, descreve-se as condições de análise de imunofluorescência para avaliar a formação do fuso meiótica em oócitos.
Protocolo
Este protocolo foi aprovado pelo Comitê de Cuidado e Uso Institucional Animal (IACUC) da Universidade da Geórgia.
1. Preparativos
- Para a cultura de oócitos, ou acabado de preparar a compra Meio Essencial Mínimo (MEM) e completar com 3 mg / ml de albumina de soro bovino (BSA) tal como delineado na Tabela 1. Colocar uma garrafa de poliestireno em um equilíbrio de carga (tara a zero). Adicionar todos os reagentes, exceto BSA, em ordem e trazer o volume final com o MQ-água, em peso, para um total de 250 g. Em seguida, adicionar o BSA, para permitir dissolver e esterilizar filtro.
Nota: O meio MEM descrito requer equilíbrio e a incubação de células com uma mistura de gases medicinais de 5% de CO 2, 5% de O2 e 90% de N2. No entanto, outros meios de comunicação (por exemplo, CZB) pode ser usado para permitir que a incubação de células em 5% de CO2 sob condições atmosféricas. - Para microinjeção de oócitos, comprar ou preparar o meio M2.
- Prepare pde soro de gonadotropina de égua reinante (PMSG) a uma concentração de 5 IU / 100 ul.
- Compra e reconstituir estoques de siRNA para uma concentração de trabalho de 1 uM.
2. Rato Oocyte Colecção
- DIA 1: Para estimular o desenvolvimento folicular ovariano e aumentar o número de folículos pré-ovulatórios, administrar 5 IU de PMSG intraperitoneal a ratos do sexo feminino de 48 horas antes da coleta de oócitos.
- DIA 3: Para a coleta de oócitos e cultura, um aumento de 35 mm placas de cultura com 3 ml de MEM / BSA suplementado com 1 mg / ml milrinona. Este inibidor da fosfodiesterase mantém os oócitos em prophase-I prender e evita rompimento da vesícula germinativa (GVBD). Equilibrar as placas de cultura de uma mistura de gases medicinais para, pelo menos, 15 min.
Nota: Milrinona meio suplementado é necessária durante todo coleta de oócitos, bem como a microinjeção de oócitos e a 24 hr cultura hold período pós siRNA. - Recuperar os ovários de camundongos fêmeas usando laboratório estabelecido pratica 15 e transfira para uma nova cultura prato com pré-aquecido e equilibrada MEM / BSA / milrinona.
- Coloque a placa de cultura no palco de um microscópio estereoscópico para coleta de ovócitos. Datas de cumulus-oócito (COC-complexos de) por punção manualmente os folículos antrais com 27 agulhas G. Fixar um ovário para a parte inferior da placa de cultura, com uma agulha de 27 G ligada a uma seringa de 1 ml, e utilizar uma segunda agulha para perfurar todos os folículos grandes. Repita o procedimento para cada ovário.
- Usando procedimentos boca pipetagem padrão ou outros meios de aspiração de oócitos, recolher todos os oócitos que são cercados por 2 ou mais camadas de células do cumulus compactas. Transferir a COC de novo para um prato e incubar a 37 ° C durante 1 h.
- Remova cuidadosamente os cercam as células do cumulus por pipetagem suave repetido com uma pipeta 1 ml ajustado para um volume de aspiração de 750 mL. Repita o passo de pipetagem cerca de 12 vezese permitir que os oócitos a recuperar durante 5 min. Continuar dessa maneira até que todas ou a maioria das células do cumulus foram removidas. Transferir os oócitos desnudadas para outro prato de cultura e deixar equilibrar a 37 ° C durante 15 min.
- Atribuir os oócitos desnudados em três grupos experimentais a ser utilizado para: (i) microinjecção de siRNAs específicos contra o alvo de interesse, (ii) microinjecção de inespecíficas (controlo) siRNAs, e (iii) um grupo não-injectados de controlo para contabilizar condições de cultura.
3. Oocyte Microinjection
- Colocação em placas de cultura com 3 ml de meio M2 suplementado com milrinona (1 ug / ml) para microinjecção de oócitos. Prepare pratos de cultura contendo MEM / BSA / milrinone para lavar e cultura subsequente de oócitos injectados.
Nota: meio M2 contém tampão HEPES e requer pré-aquecimento a 37 ° C durante 15 minutos, sob condições atmosféricas. MEM exige pré-aquecimento e de equilíbrio utilizando gás medicinal como descreverd acima. - Prepara-se o sistema de micro-injecção. Coloque a agulha de injeção com 5 ml de solução de siRNA específico 1 �. Fixe a pipeta de exploração e agulha de injeção para micromanipuladores do sistema de microinjeção e configurar a unidade de injeção com volume e pressão calibrada.
- Coloque uma micro-gota de 200 mL de suporte M2 no interior da tampa de um prato de cultura de 3 cm e adicionar um oócito para configurar e de alinhamento do sistema de micro-injecção.
- Usando o oócito como um guia, ajustar as posições da exploração e de injeção de agulhas. Aplicar pressão negativa para a pipeta de retenção para fixar suavemente o oócito e ajustar a posição da agulha de injecção para o maior diâmetro da célula. Ajustar configurações para permitir a microinjecção de cerca de 10 ul da solução de siRNA em qualquer lugar no citoplasma dos oócitos.
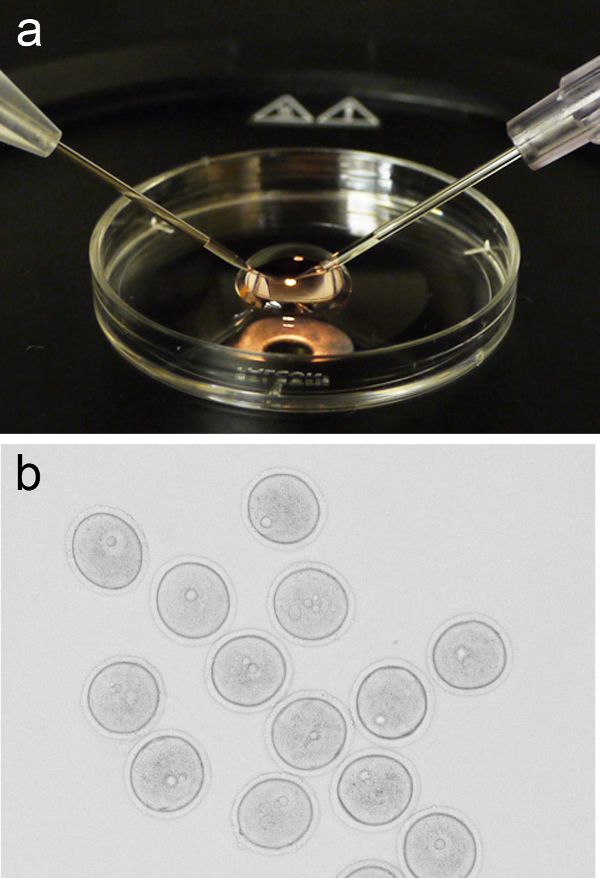
Figura 1. Oocyte microinjeção configurar. ( A) Imagem representativa de uma micro-gota de M2 meios 200 ul colocado sobre a tampa de uma placa de cultura de 3 cm, com a pipeta de retenção da agulha e de injecção posicionados à esquerda e à direita, respectivamente. (B) Grupo de prophase-I preso oócitos (GV-estágio) antes da microinjeção. Por favor clique aqui para ver uma versão maior desta figura. - E volta a tampa para a fase estereomicroscópio e adicionar uma micro-gota de 200 mL de suporte M2 fresco. Adicionar um grupo de oócitos (~ 10) para o micro-gota a pipeta boca, ou métodos alternativos, em seguida, retornar a tampa com micro-gota para a fase de microinjeção.
- Prossiga para microinject os oócitos individuais. Fixar um ovócito com a pipeta, segurando, inserir-se lentamente a ponta da agulha de injecção para dentro do citoplasma e expulsar o volume de injecção de solução de siRNA. Retraia cuidadosamente a agulha de injeção e move o oócito injectado para uma posição, na parte inferior do micro-gota. Mover os oócitos injectados, sem sucesso, para uma posição no topo do micro-gota.
- Repita o procedimento de microinjeção com cada ovócito. Para manter a viabilidade dos oócitos óptima, microinject apenas um pequeno número de oócitos de cada vez. Assegure-se que este processo não leva mais do que alguns minutos, para evitar mudanças de temperatura e pH no micro-gota.
- Aspirar oócitos injectados com sucesso ou mover-se cuidadosamente a tampa com o micro-gota de oócitos injectados com o estereomicroscópio. Transferir os oócitos viáveis injectados por pipetagem boca ou métodos alternativos, para MEM / BSA a forma / milrinona para lavar e equilibrar-se a 37 ° C.
- Usando um outro grupo de oócitos, repita o processo de microinjeção com uma nova agulha de injeção carregado com siRNAs não específicas para o grupo controle. Lavar os ovócitos em MEM / BSA / milrinona e transferência para uma cultura prato separado.
- Cultura todos os grupos deoócitos durante 24 horas em MEM / BSA / milrinona a 37 ° C sob uma atmosfera de gás médico.
Nota: O período de cultura 'bloco milrinona' é necessário para alvo eficiente esgotamento mRNA / proteína.
4. Oocyte Cultura para maturação meiótica
- Dia 4: Para cada grupo experimental de oócitos set-up 4 pratos de cultura (35 mm) com 3 ml de MEM / BSA. Suplemento um prato meios por grupo com 10% (alta qualidade) de soro fetal de bovino (FBS) a ser usado para a maturação do oócito. Permitir que todos os pratos de cultura para equilibrar a 37 ° C com mistura de gases medicinais.
- Para libertar a partir de oócitos 'bloco milrinona', sequencialmente lavar os oócitos três vezes em placas contendo MEM / BSA e depois transferir os oócitos para o prato de maturação contendo meio com FBS a 10%. Todos os grupos de cultura de oócitos durante 17 horas a 37 ° C, para permitir a retomada e progressão da meiose.
- Dia 5: Preparar soluções para FIXA oócitoção, incluindo: (i) 4% de paraformaldeído (PFA) em tampão PEM (100 mM PIPES [pH 6,9], MgCl 2 1 mM, EGTA 1 mM) com 0,5% de Triton-X 100, e (ii) de PBS suplementado com 5 % de FBS que vai ser usada para lavar e bloquear os oócitos.
Nota: Estas soluções requerem pré-aquecimento a 37 ° C, antes da fixação do oócito. - Para a fixação do oócito (após a cultura de 17 horas), rapidamente transferir cada grupo experimental de oócitos por pipetagem boca ou métodos alternativos em poços individuais (de um 4-bem prato) contendo 750 ul de pré-aquecido solução PFA a 4% e incubar a 37 ° C durante 1 h. Subsequentemente lavar cada grupo de oócitos de 3 vezes (15 minutos cada) em 750 ul de PBS pré-aquecido contendo 5% de FBS.
- Oócitos de bloco em 200 ul de PBS / FBS a 5% O / N a 4 ° C para minimizar a ligação não específica de anticorpos.
5. Análise de imunofluorescência
- DIA 6:
Nota: A imunocoloração é feito de uma placa multi-poços e o OOCytes são serialmente transferidos para poços sequenciais, contendo as respectivas soluções de anticorpos e de lavagem. 48 ou placas de 96 poços pode ser usado, basta ajustar o volume da solução com base no tamanho bem. Para placas de 96 poços utilizar 200 ul por poço. Os oócitos são transferidos para as diferentes soluções pela seguinte ordem: solução de anticorpo primário - 3 - da solução de lavagem de poços anticorpo secundário - 3 poços de lavagem. Para limitar a exposição à luz a placa pode ser coberto com a folha.
Preparar uma solução de PBS / 5% de FBS e usar esta solução para preparar as diluições de anticorpos (por exemplo, de coelho anti-pericentrin (1 / 1.000), de ratinho anti-tubulina (1 / 1.000)). - Transferir os oócitos fixos de cada grupo experimental para poços individuais contendo 200 uL (ou 100 uL, se é desejada menos volume) da solução de anticorpo primário e cobrir o poço com parafilme. Incubar de acordo com as condições específicas do anticorpo óptimas (por exemplo, 37 ° C durante 1 hora, ou 4 ° CO / N).
Nota: O anticorpo primário dilution, bem como o tempo de incubação específico e temperatura exigem testes para determinar as condições ideais para diferentes anticorpos utilizados. - Após a incubação com o anticorpo primário, os oócitos lavar três vezes em PBS / FBS a 5% (10-15 min cada).
- Transferir os oócitos na solução contendo anticorpos secundários conjugados com fluorescência (por exemplo, 1 / 1.000 a diluição dos anticorpos anti-coelho e anti-murganho conjugados com fluorocromos de diferentes comprimentos de onda). Incubar durante 1 hora a 37 ° C.
- Lavar os oócitos três vezes em PBS / FBS a 5% (10 - 15 min cada).
- Após o passo final de lavagem, transferir os oócitos em uma lâmina de vidro limpa e delicadamente aspirar qualquer solução de lavagem em excesso. Isto vai imobilizar os oócitos na superfície do vidro. Adicionar 8 mL de mídia (contendo DAPI) de montagem e sobrepor cuidadosamente a mídia de montagem com uma 22 mm x 22 milímetros lamela. Abaixe a lamela lentamente para evitar bolhas de interceptação e / ou danificar os ovócitos.
Nota: Alternativamente, para manter as propriedades de 3-dimensionais do oócito para análise de microscopia confocal, adicionar um pequeno volume de esferas de vidro de 100 uM (misturado com geleia de petróleo) para os cantos da lâmina de cobertura antes da montagem sobre a lâmina. - Armazenar as lâminas a 4 ° C, ou prosseguir para a avaliação de progressão meiótica, bem como a análise dos níveis de expressão e localização subcelular da proteína utilizando um microscópio de fluorescência equipado com os filtros necessárias para coincidir com os anticorpos secundários utilizados.
Resultados
A microinjecção de siRNAs proporciona uma abordagem eficaz para a degradação de ARNm e proteína subsequente depleção em oócitos, que permite o teste funcional eficiente e altamente específico de diferentes factores alvo in vitro. Subsequentemente, a imunofluorescência é utilizado para a análise de fenótipo específico, bem como para validar a depleção de proteínas em oócitos injectados com siRNA. No exemplo atual, marcação fluorescente de oócitos individuais com DAPI em conjunto com anticorp...
Discussão
Embora existam vários métodos para a transferência de ácido nucleico exógeno em células somáticas, tais como a electroporação e a transfecção, microinjecção é o método ideal para a administração de moléculas de ARN em oócitos de rato transcricionalmente quiescentes. O protocolo atual fornece uma abordagem eficaz para in vitro esgotamento de mRNAs específicos que permitem que o teste funcional de diferentes fuso e / ou fatores associados à MTOC em oócitos. Esta abordagem resulta em esgotame...
Divulgações
The authors have nothing to disclose
Agradecimentos
This research was supported in part by the University of Georgia, and a grant (HD071330) from the National Institutes of Health to MMV.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Pregnant Mare's Serum Gonadotropin (PMSG) | EMD Biosciences | 367222 | |
| Minimal Essential Medium (MEM) | *Recipe outlined in Table 1 | ||
| Earle's Balanced Salt Solution (10x) | Sigma | E-7510 | |
| Sodium Bicarbonate | Sigma | S-5761 | |
| Pyruvic Acid, sodium salt | Sigma | P-5280 | |
| Penicillin G, potassium salt | Sigma | P-7794 | |
| Streptomycin Sulfate | Sigma | S-9137 | |
| L-Glutamine | Sigma | G-8540 | |
| EDTA, disodium salt dihydrate | Sigma | E-4884 | |
| Essential Amino Acids (50x) | Gibco | 11130-051 | |
| MEM Vitamin Mixture (100x) | Sigma | M-6895 | |
| Phenol Red solution | Sigma | P-0290 | |
| Bovine Serum Albumin (BSA) | Sigma | A1470 | |
| Milrinone | Sigma | M4659 | |
| Fetal Bovine Serum (FBS) | Hyclone | SH30070.01 | |
| EmbryoMax M2 Media with Hepes | EMD Millipore | MR-015-D | |
| siRNAs targeting Pericentrin | Qiagen | GS18541 | |
| Negative control siRNAs | Qiagen | SI03650318 | |
| Paraformaldehyde (16% solution) | Electron Microscopy Sciences | 15710 | |
| Triton-X | Sigma | T-8787 | |
| Phosphate Buffered Saline (PBS) | Hyclone | SH30028.02 | |
| Anti-Pericentrin (rabbit) | Covance | PRB-432C | |
| Anti-acetylated a-tubulin (mouse) | Sigma | T-6793 | |
| Goat anti-rabbbit Alexa Fluor 488 | Invitrogen | A-21430 | |
| Goat anti -mouse Alexa Fluor 555 | Invitrogen | A-11017 | |
| Major Equipment | |||
| Stereomicroscope (SMZ 800) | Nikon | ||
| Upright Fluorescent Microscope | Leica Microsystems | ||
| Inverted Microscope | Nikon | ||
| Femtojet Micro-injections System | Eppenforf | ||
| Micro manipulators | Eppendorf | ||
| Micro-injection needles (femtotips) | Eppendorf | 930000035 | |
| Holding pipettes (VacuTip) | Eppendorf | 930001015 | |
| Plasticware | |||
| 35 mm culture dishes | Corning Life Sciences | 351008 | |
| 4-well plates | Thermo Scientific | 176740 | |
| 96 well plates | Corning Life Sciences | 3367 | |
| 0.45 mm CA Filter System | Corning Life Sciences | 430768 |
Referências
- Nagaoka, S. I., Hassold, T. J., Hunt, P. A. Human aneuploidy: mechanisms and new insights into an age-old problem. Nat Rev Genet. 13 (7), 493-504 (2012).
- Hassold, T. J., Hunt, P. A. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Szollosi, D., Calarco, P., Donahue, R. P. Absence of Centrioles in the First and Second Meiotic Spindles of Mouse Oocytes. J Cell Sci. 11 (2), 521-541 (1972).
- Manandhar, G., Schatten, H., Sutovsky, P. Centrosome Reduction During Gametogenesis and Its Significance. Biol Reprod. 72 (1), 2-13 (2005).
- Zimmerman, W. C., Sillibourne, J., Rosa, J., Doxsey, S. J. Mitosis-specific anchoring of gamma tubulin complexes by pericentrin controls spindle organization and mitotic entry. Mol Biol Cell. 15 (8), 3642-3647 (2004).
- Ma, W., Baumann, C., Viveiros, M. M. NEDD1 is crucial for meiotic spindle stabilty and accurate chromosome segregation in mammalian oocytes. Dev Biol. 339 (439-450), (2010).
- Ma, W., Viveiros, M. M. Depletion of pericentrin in mouse oocytes disrupts microtubule organizing center function and meiotic spindle organization. Mol Reprod Dev. 81 (11), 1019-1029 (2014).
- Bouniol-Baly, C., et al. Differential Transcriptional Activity Associated with Chromatin Configuration in Fully Grown Mouse Germinal Vesicle Oocytes. Biol Reprod. 60 (3), 580-587 (1999).
- De La Fuente, R., Eppig, J. J. Transcriptional Activity of the Mouse Oocyte Genome: Companion Granulosa Cells Modulate Transcription and Chromatin Remodeling. Dev Biol. 229 (1), 224-236 (2001).
- Hodgman, R., Tay, J., Mendez, R., Richter, J. D. CPEB phosphorylation and cytoplasmic polyadenylation are catalyzed by the kinase IAK1/Eg2 in maturing mouse oocytes. Development. 128 (14), 2815-2822 (2001).
- De La Fuente, R. Chromatin modifications in the germinal vesicle (GV) of mammalian oocytes. Dev Biol. 292 (1), 1-12 (2006).
- Wianny, F., Zernicka-Goetz, M. Specific interference with gene function by double-stranded RNA in early mouse development. Nat Cell Biol. , 270-275 (2000).
- Svoboda, P., Stein, P., Hayashi, H., Schultz, R. M. Selective reduction of dormant maternal mRNAs in mouse oocytes by RNA interference. Development. 127 (19), 4147-4156 (2000).
- Svoboda, P. Renaissance of mammalian endogenous RNAi. FEBS Letters. 588 (15), 2550-2556 (1016).
- Behringer, R., Gertsenstein, M., Nagy, K., Nagy, A. . Manipulating the Mouse Embryo: A Laboratory Manual. , (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados