このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
siRNA媒介サイレンシングによるマウス卵母細胞における減数分裂紡錘体の評価
要約
ここでは、マウス卵母細胞で減数分裂スピンドルアセンブリと組織を評価するために、免疫蛍光分析に続いて、特定のsiRNA媒介mRNAの枯渇のためのプロトコルを提示します。このプロトコルは、転写物のin vitroでの枯渇と異なるスピンドルおよび/ または卵母細胞におけるMTOC関連因子の機能評価に適しています。
要約
Errors in chromosome segregation during meiotic division in gametes can lead to aneuploidy that is subsequently transmitted to the embryo upon fertilization. The resulting aneuploidy in developing embryos is recognized as a major cause of pregnancy loss and congenital birth defects such as Down’s syndrome. Accurate chromosome segregation is critically dependent on the formation of the microtubule spindle apparatus, yet this process remains poorly understood in mammalian oocytes. Intriguingly, meiotic spindle assembly differs from mitosis and is regulated, at least in part, by unique microtubule organizing centers (MTOCs). Assessment of MTOC-associated proteins can provide valuable insight into the regulatory mechanisms that govern meiotic spindle formation and organization. Here, we describe methods to isolate mouse oocytes and deplete MTOC-associated proteins using a siRNA-mediated approach to test function. In addition, we describe oocyte fixation and immunofluorescence analysis conditions to evaluate meiotic spindle formation and organization.
概要
減数分裂は、配偶子(卵母細胞および精子)で発生する独特の分割処理であり、それぞれ1、減数分裂Iと減数分裂IIの間に相同染色体と姉妹染色分体を分離するためにDNA合成を介在せずに2つの連続した部門が関与します。卵母細胞における減数分裂時の染色体分離におけるエラーは受精胚中に継承され異数性をもたらすことができます。特に、発展途上胚における異数性の発生率は、母体の加齢に伴って増加し、女性1,2における妊娠損失だけでなく、先天性の先天性欠損症の主な原因である、したがって、減数分裂時の異数性の分子基盤を理解するための重要な必要性を強調。
細胞分裂の間、染色体分離は反対スピンドルへの正しい取り付けのための微小管スピンドル装置と安定した染色体微小管の相互作用の確立の組み立てに決定的に依存していますポール。重要なことは、哺乳動物の卵母細胞における減数分裂紡錘体の形成は、体細胞での有糸分裂とは異なり、中心小体3,4を欠いているユニークな微小管組織化センター(MTOCs)によって規制されています。微小管の核形成と組織のために必要不可欠なタンパク質は、微小管集合を触媒するγチューブリンを含む卵母細胞MTOCs、に局在します。また、MTOCs 5でバインド必須の足場タンパク質として機能し、アンカーγチューブリン、ならびにその他の要因ペリセントリン。注目すべきことに、我々の研究は、キーMTOC関連タンパク質の枯渇が減数分裂紡錘体の組織を破壊し、完全に紡錘体チェックポイント(SAC)6,7によって解決されていない卵母細胞における染色体分離のエラーにつながることを示しています。したがって、減数分裂の停止を誘発しないスピンドル安定性の欠陥は、異数性に貢献において重要なリスクをもたらします。スピンドルアセンブリと組織内での重要な役割、卵母細胞MTOC protのにもかかわらず、EIN組成と機能が十分に理解されたままになります。
細胞が減数分裂まもなく8,9の再開前に、転写的に静止してしまうなどの哺乳動物の卵母細胞に特異的な標的タンパク質の機能をテストすることは、困難です。したがって、排卵前の卵母細胞が減数分裂を再開し、受精10,11の後に減数分裂と同様に最初の切断部門をサポートするために母性mRNAの店に依存しています。哺乳動物の卵母細胞中のmRNA転写物のRNA干渉(RNAi)介在性分解の有効性は、十分に確立され、減数分裂成熟の間の翻訳のために募集母性RNAは、siRNAが12-14を標的に特に適しています。したがって、卵母細胞への短い干渉RNA(siRNA)のマイクロインジェクションは、機能テストのために標的mRNAを枯渇させる貴重なアプローチを提供します。
ここでは、マウス卵母細胞及び特定transcriのsiRNA媒介枯渇を単離するための方法を記載PTSはペリセントリン、本質的なMTOC関連タンパク質の機能をテストします。加えて、我々は、卵母細胞における減数分裂紡錘体形成を評価するために免疫蛍光分析条件を記述する。
プロトコル
このプロトコルは、ジョージア大学の施設内動物管理使用委員会(IACUC)によって承認されました。
1.準備
- 卵母細胞培養、購入やたての最小必須培地(MEM)を調製し、 表1で説明したように3 mg / mlのウシ血清アルブミン(BSA)で補うために。ロードバランス(ゼロに風袋)にポリスチレンボトルを置きます。ためには、BSAを除き、全ての試薬を追加し、250グラムの合計重量のMQ水で最終体積を持ち出します。その後、BSAを追加し、溶解し、フィルター滅菌することができます。
注:記載のMEM培地を、5%CO 2、5%O 2および90%N 2の医療用ガスの混合物で平衡化し、細胞のインキュベーションを必要とします。しかしながら、他の媒体(例えば、CZB)は大気条件下、5%CO 2での細胞のインキュベーションを可能に使用することができます。 - 卵母細胞のマイクロインジェクションのために、購入またはM2培地を準備します。
- Pを準備します5 IU / 100μlの濃度に君臨するの牝馬の血清性性腺刺激ホルモン(PMSG)。
- 1μMの作業濃度に対するsiRNAの株式を購入し、再構成します。
2.マウス卵母細胞のコレクション
- 1日目:卵胞の発達を刺激し、排卵前卵胞の数を増やし、前卵母細胞のコレクションに雌マウスの腹腔内に48時間をPMSGの5 IUを管理します。
- 3日目:卵母細胞の収集および培養のためには、1 / mlのミルリノンを補足したMEM / BSAの3 mlを35mm培養皿を設定します。このホスホジエステラーゼ阻害剤は、前期-I停止に卵母細胞を維持し、胚胞崩壊(GVBD)を防ぐことができます。少なくとも15分間、医療ガス混合物中の培養皿を平衡化。
注:ミルリノン補充した培地は、卵母細胞の収集だけでなく、卵母細胞のマイクロインジェクション、24時間培養ホールド期間後のsiRNA全体で必要とされます。 - 15を実践確立実験室を使用した雌マウスから卵巣を取得し、予め温めておいて、新しい培養皿に移し、MEM / BSA /ミルリノンを平衡化しました。
- 卵母細胞の収集のための実体顕微鏡のステージ上で培養皿を置きます。リリース卵丘卵母細胞複合体(COCの)手動で27 G針で胞状卵胞を穿刺することによって。 1mlシリンジに取り付けた27 G針で、培養皿の底に1卵巣を修正し、すべての大型卵胞を穿刺するために第2の針を使用しています。各卵巣のために繰り返します。
- コンパクトな卵丘細胞の2以上の層に囲まれているすべての卵母細胞を収集し、標準的な口のピペット操作手順や卵母細胞吸引の他の手段を使用します。新しい皿にCOCのを移し、37℃で1時間インキュベートします。
- 慎重に750μlのの吸引量に設定した1mlピペットを用いて繰り返し穏やかにピペッティングすることにより周囲の卵丘細胞を除去。ピペッティングのステップを約12回繰り返します卵母細胞を5分間回復することができます。卵丘細胞のすべてまたは大部分が除去されるまで、このように続けます。別の培養皿に剥皮した卵母細胞を移し、37℃で15分間平衡化することができます。
- 使用される3つの実験群に露出した卵母細胞を割り当てる:目的の標的に対する特異的siRNA(I)のマイクロインジェクション、非特異的(対照)siRNAの(ii)のマイクロインジェクション、および(iii)非注射対照群を説明するために培養条件。
3.卵母細胞のマイクロインジェクション
- 卵母細胞のマイクロインジェクションのためのミルリノン(1μg/ ml)で補足した3ミリリットルM2培地で培養皿を設定します。洗浄、注入した卵母細胞のその後の培養のために、MEM / BSA /ミルリノンを含む培養皿を準備します。
注:M2培地は、HEPESバッファー含まれており、大気条件下で37℃で15分間プレ加温が必要です。 MEMは、説明するように、医療ガスを用いて予備温暖化と平衡化を必要とします上記日間。 - マイクロインジェクションシステムを準備します。 1μMの特異的siRNA溶液5μlの注射針をロードします。マイクロインジェクションシステムのマイクロマニピュレーターにホールディングピペットや注射針を固定し、較正容積と圧力で射出装置を設定します。
- 3センチメートル培養皿の蓋の内側にM2培地の200μlのマイクロドロップを置き、マイクロインジェクションシステムの設定や位置合わせのための卵母細胞を追加します。
- ガイドとして、卵母細胞を用いて、保持し、注射針の位置を調整します。優しく卵母細胞を固定し、セルの最も広い直径に注射針の位置を調整するホールディングピペットに負圧を適用します。どこでも卵母細胞の細胞質にsiRNA溶液の約10 PLのマイクロインジェクションを許可するように設定を調整します。
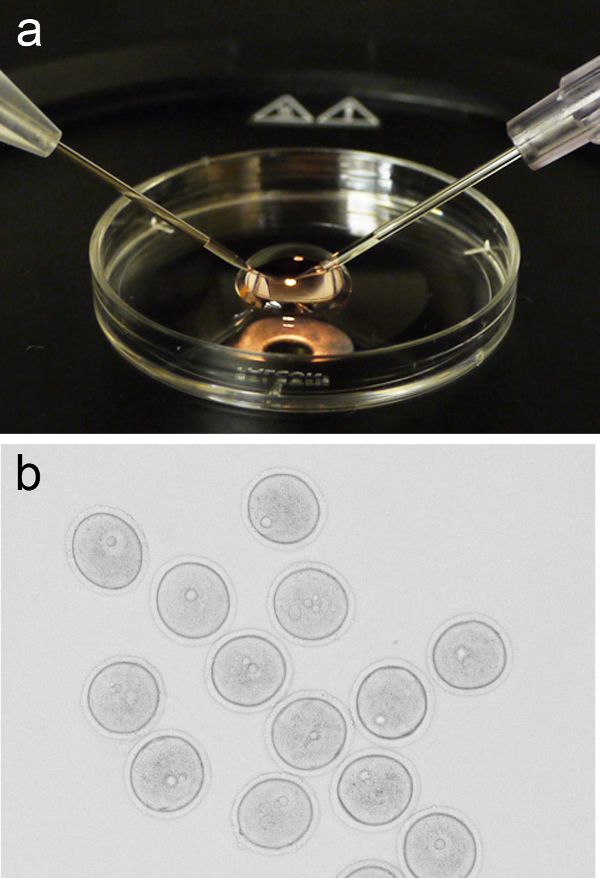
図1.卵母細胞のマイクロインジェクションは、設定します。( それぞれ左右、上に位置するホールディングピペットや注射針で3センチ培養皿から蓋に配置されたM2培地の200μlのマイクロドロップのA)代表画像。 (B)グループは、前期の-Iは、マイクロインジェクションの前に卵母細胞(GV段階)を逮捕した。 この図の拡大版をご覧になるにはこちらをクリックしてください。 - 実体顕微鏡のステージに蓋を戻し、新鮮M2培地200μlのマイクロドロップを追加します。マイクロインジェクションステージにマイクロドロップで蓋を戻した後、口のピペット操作によってマイクロドロップ、または代替方法に卵母細胞のグループ(〜10)を追加します。
- 個々の卵母細胞を顕微注入するために進んでください。ゆっくりと細胞質に注射針の先端を挿入し、保持ピペットで1卵母細胞を固定し、siRNA溶液の注入量を追放。慎重に注射針やMOを撤回マイクロドロップの底の位置に注入された卵母細胞をVEの。マイクロドロップの上部の位置に失敗した注入した卵母細胞を移動します。
- 各卵母細胞にマイクロインジェクションの手順を繰り返します。一度に最適な卵母細胞の生存率、卵母細胞の顕微注入するだけの小さな数を維持するために。このプロセスは、マイクロドロップ内の温度およびpH変化を防止するために、数分以上を取らないことを確認してください。
- 吸引除去に成功した卵母細胞を注射するか、または慎重に実体顕微鏡に注入した卵母細胞のマイクロドロップで蓋を移動します。 37℃で洗浄し、平衡化するMEM / BSA /ミルリノン媒体に、口のピペッティングまたは代替の方法で注入した卵母細胞生存能力を転送します。
- 卵母細胞の別のグループを使用して、対照群の非特異的なsiRNAを装填新しい注射針を用いてマイクロインジェクションプロセスを繰り返します。独立した培養皿にMEM / BSA /ミルリノン、転送中の卵母細胞を洗います。
- 文化すべてのグループ医療ガスの雰囲気下、37℃でMEM / BSA /ミルリノンで24時間卵母細胞。
注:「ミルリノンブロック「培養期間は、効率的な標的mRNA /タンパク質の枯渇のために必要とされます。
減数分裂成熟4.卵母細胞の培養
- 4日目:卵母細胞の各実験群については3ミリリットルMEM / BSAとセットアップ4培養皿(35ミリメートル)。卵母細胞の成熟のために使用する10%(高品質)ウシ胎児血清(FBS)とグループごとに1つのメディア皿を補います。すべての培養皿は、医療ガス混合物で、37℃で平衡化することを許可します。
- 「ミルリノンブロック」から卵母細胞を解放するには、順次、MEM / BSAを含む皿に卵母細胞を3回洗浄した後、10%FBSを含む培地を含む成熟皿に卵母細胞を移します。文化37℃で17時間、すべての卵母細胞群は、再開と減数分裂の進行を可能にします。
- 5日目:卵母細胞のFIXaのためのソリューションを準備ンを含む:(I)PEM緩衝液中の4%パラホルムアルデヒド(PFA)(100mMのPIPES [pHは6.9]、1mMのMgCl 2、1mMのEGTA)、0.5%のTriton-X 100、および(ii)PBS、5を補充したと卵母細胞を洗浄し、ブロックするために使用される%FBS。
注:これらのソリューションは、従来の卵母細胞の固定を37℃に予備加温する必要があります。 - (4ウェルディッシュの)卵母細胞の固定は(17時間の培養後)、速やかに個々のウェルに口ピペッティングまたは代替の方法により卵母細胞の各実験群を転送予め温めておいた4%PFA溶液を750μLを含有し、37℃でインキュベートについて1時間Cを°。その後、5%FBSを含む予め温めておいたPBS750μlの中で3回(各15分)の卵母細胞の各グループを洗います。
- 4℃で200μlのPBS / 5%FBS、O / Nでのブロックの卵母細胞は、非特異的結合する抗体を最小限に抑えることができます。
5.免疫蛍光分析
- 6日目:
注:免疫染色は、マルチウェルプレートとOOCで行われますytesが直列それぞれの抗体および洗浄溶液を含む、連続的なウェルに移しています。いずれかの48または96ウェルプレートを使用することができ、単によく大きさに基づいて液量を調整します。 96ウェルプレートについて、ウェル当たり200μlのを使用しています。 - 3洗浄ウェル - 二次抗体溶液 - 3洗浄井一次抗体溶液:卵母細胞は、次の順序でさまざまなソリューションに転送されます。露光量を制限するために、プレートをホイルで覆うことができます。
新しいPBS / 5%FBSを準備し、抗体希釈液(例えば、ウサギ抗ペリセントリン(1 /千)、マウス抗チューブリン(1 / 1,000))を調製し、この溶液を使用してください。 - 一次抗体溶液の(より少ない容量が必要な場合、または100μl)を200μLを含む個々のウェルに各実験群の固定卵母細胞を移し、よくパラフィルムでカバーしています。 (1時間、または4°のCO / Nのために例えば、37℃)、最適な抗体固有の条件に従ってインキュベートします。
注:一次抗体dilutioN並びに特定のインキュベーション時間および温度は、使用される種々の抗体についての最適な条件を決定するための試験を必要とします。 - 一次抗体とのインキュベーション後、PBS / 5%FBS(10〜15分毎)に卵母細胞を3回洗浄します。
- 蛍光結合二次抗体 (例えば、1 /千の異なる波長の蛍光色素と結合した抗ウサギおよび抗マウス抗体の希釈物)を含有する溶液中に卵母細胞を移します。 37℃で1時間インキュベートします。
- ( - 15分毎10)をPBS / 5%FBS中で卵母細胞を3回洗浄します。
- 最後の洗浄工程の後、清浄なガラススライド上に卵母細胞を転送し、優しく余分な洗浄液を吸引除去します。これは、ガラス表面上の卵母細胞を固定します。メディア(DAPIを含む)を搭載した8μlを添加して、慎重に22ミリメートル×22ミリメートルのカバースリップでマウントメディアを重ねます。気泡を捕捉および/または卵母細胞の損傷を防ぐために、ゆっくりとカバースリップを下げます。
注:または、前のスライドに取り付けるにカバースリップの角に(ワセリンと混合)100μmのガラスビーズの小さなボリュームを追加、共焦点顕微鏡分析のための卵母細胞の3次元特性を維持します。 - 4℃で保存したスライドは、または減数分裂の進行を評価するだけでなく、使用した二次抗体を一致させるために必要なフィルターを備えた蛍光顕微鏡を用いて発現レベルおよび細胞内タンパク質の局在の分析に進みます。
結果
siRNAのマイクロインジェクションは、in vitroで異なるターゲット因子の効率的かつ高度に特異的な機能テストを可能にした卵母細胞におけるmRNAの分解及びその後のタンパク質の枯渇に有効なアプローチを提供します。その後、免疫蛍光は、特定の表現型分析のために使用されるだけでなく、siRNAを注入した卵母細胞中のタンパク質の枯渇を検証します。現在の例では、抗チューブリン?...
ディスカッション
そのようなエレクトロポレーション及びトランスフェクションのような体細胞への外因性核酸の転写のための複数の方法があるが、マイクロインジェクションは、転写休止マウス卵母細胞へのRNA分子の送達のための最適な方法です。現在のプロトコルは、異なる主軸および/ または卵母細胞におけるMTOC関連因子の機能テストを可能にする特定のmRNAのインビトロ枯渇のための効果的...
開示事項
The authors have nothing to disclose
謝辞
This research was supported in part by the University of Georgia, and a grant (HD071330) from the National Institutes of Health to MMV.
資料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Pregnant Mare's Serum Gonadotropin (PMSG) | EMD Biosciences | 367222 | |
| Minimal Essential Medium (MEM) | *Recipe outlined in Table 1 | ||
| Earle's Balanced Salt Solution (10x) | Sigma | E-7510 | |
| Sodium Bicarbonate | Sigma | S-5761 | |
| Pyruvic Acid, sodium salt | Sigma | P-5280 | |
| Penicillin G, potassium salt | Sigma | P-7794 | |
| Streptomycin Sulfate | Sigma | S-9137 | |
| L-Glutamine | Sigma | G-8540 | |
| EDTA, disodium salt dihydrate | Sigma | E-4884 | |
| Essential Amino Acids (50x) | Gibco | 11130-051 | |
| MEM Vitamin Mixture (100x) | Sigma | M-6895 | |
| Phenol Red solution | Sigma | P-0290 | |
| Bovine Serum Albumin (BSA) | Sigma | A1470 | |
| Milrinone | Sigma | M4659 | |
| Fetal Bovine Serum (FBS) | Hyclone | SH30070.01 | |
| EmbryoMax M2 Media with Hepes | EMD Millipore | MR-015-D | |
| siRNAs targeting Pericentrin | Qiagen | GS18541 | |
| Negative control siRNAs | Qiagen | SI03650318 | |
| Paraformaldehyde (16% solution) | Electron Microscopy Sciences | 15710 | |
| Triton-X | Sigma | T-8787 | |
| Phosphate Buffered Saline (PBS) | Hyclone | SH30028.02 | |
| Anti-Pericentrin (rabbit) | Covance | PRB-432C | |
| Anti-acetylated a-tubulin (mouse) | Sigma | T-6793 | |
| Goat anti-rabbbit Alexa Fluor 488 | Invitrogen | A-21430 | |
| Goat anti -mouse Alexa Fluor 555 | Invitrogen | A-11017 | |
| Major Equipment | |||
| Stereomicroscope (SMZ 800) | Nikon | ||
| Upright Fluorescent Microscope | Leica Microsystems | ||
| Inverted Microscope | Nikon | ||
| Femtojet Micro-injections System | Eppenforf | ||
| Micro manipulators | Eppendorf | ||
| Micro-injection needles (femtotips) | Eppendorf | 930000035 | |
| Holding pipettes (VacuTip) | Eppendorf | 930001015 | |
| Plasticware | |||
| 35 mm culture dishes | Corning Life Sciences | 351008 | |
| 4-well plates | Thermo Scientific | 176740 | |
| 96 well plates | Corning Life Sciences | 3367 | |
| 0.45 mm CA Filter System | Corning Life Sciences | 430768 |
参考文献
- Nagaoka, S. I., Hassold, T. J., Hunt, P. A. Human aneuploidy: mechanisms and new insights into an age-old problem. Nat Rev Genet. 13 (7), 493-504 (2012).
- Hassold, T. J., Hunt, P. A. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Szollosi, D., Calarco, P., Donahue, R. P. Absence of Centrioles in the First and Second Meiotic Spindles of Mouse Oocytes. J Cell Sci. 11 (2), 521-541 (1972).
- Manandhar, G., Schatten, H., Sutovsky, P. Centrosome Reduction During Gametogenesis and Its Significance. Biol Reprod. 72 (1), 2-13 (2005).
- Zimmerman, W. C., Sillibourne, J., Rosa, J., Doxsey, S. J. Mitosis-specific anchoring of gamma tubulin complexes by pericentrin controls spindle organization and mitotic entry. Mol Biol Cell. 15 (8), 3642-3647 (2004).
- Ma, W., Baumann, C., Viveiros, M. M. NEDD1 is crucial for meiotic spindle stabilty and accurate chromosome segregation in mammalian oocytes. Dev Biol. 339 (439-450), (2010).
- Ma, W., Viveiros, M. M. Depletion of pericentrin in mouse oocytes disrupts microtubule organizing center function and meiotic spindle organization. Mol Reprod Dev. 81 (11), 1019-1029 (2014).
- Bouniol-Baly, C., et al. Differential Transcriptional Activity Associated with Chromatin Configuration in Fully Grown Mouse Germinal Vesicle Oocytes. Biol Reprod. 60 (3), 580-587 (1999).
- De La Fuente, R., Eppig, J. J. Transcriptional Activity of the Mouse Oocyte Genome: Companion Granulosa Cells Modulate Transcription and Chromatin Remodeling. Dev Biol. 229 (1), 224-236 (2001).
- Hodgman, R., Tay, J., Mendez, R., Richter, J. D. CPEB phosphorylation and cytoplasmic polyadenylation are catalyzed by the kinase IAK1/Eg2 in maturing mouse oocytes. Development. 128 (14), 2815-2822 (2001).
- De La Fuente, R. Chromatin modifications in the germinal vesicle (GV) of mammalian oocytes. Dev Biol. 292 (1), 1-12 (2006).
- Wianny, F., Zernicka-Goetz, M. Specific interference with gene function by double-stranded RNA in early mouse development. Nat Cell Biol. , 270-275 (2000).
- Svoboda, P., Stein, P., Hayashi, H., Schultz, R. M. Selective reduction of dormant maternal mRNAs in mouse oocytes by RNA interference. Development. 127 (19), 4147-4156 (2000).
- Svoboda, P. Renaissance of mammalian endogenous RNAi. FEBS Letters. 588 (15), 2550-2556 (1016).
- Behringer, R., Gertsenstein, M., Nagy, K., Nagy, A. . Manipulating the Mouse Embryo: A Laboratory Manual. , (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved