Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
SiRNA aracılı susturma Mouse Oositlerinin içinde mayoz Mili Değerlendirmesi
Bu Makalede
Özet
Burada, fare oosit mayoz mili montaj ve organizasyon değerlendirmek için immünoflüoresans analizi ile takip özgü siRNA aracılı mRNA tükenmesi için bir protokol mevcut. Bu protokol, transkript in vitro tükenmesi ve farklı mili ve / veya oositlerde MTOC ilişkili faktörler fonksiyonel değerlendirmesi için uygundur.
Özet
Errors in chromosome segregation during meiotic division in gametes can lead to aneuploidy that is subsequently transmitted to the embryo upon fertilization. The resulting aneuploidy in developing embryos is recognized as a major cause of pregnancy loss and congenital birth defects such as Down’s syndrome. Accurate chromosome segregation is critically dependent on the formation of the microtubule spindle apparatus, yet this process remains poorly understood in mammalian oocytes. Intriguingly, meiotic spindle assembly differs from mitosis and is regulated, at least in part, by unique microtubule organizing centers (MTOCs). Assessment of MTOC-associated proteins can provide valuable insight into the regulatory mechanisms that govern meiotic spindle formation and organization. Here, we describe methods to isolate mouse oocytes and deplete MTOC-associated proteins using a siRNA-mediated approach to test function. In addition, we describe oocyte fixation and immunofluorescence analysis conditions to evaluate meiotic spindle formation and organization.
Giriş
Mayoz gametlerin (oosit ve sperm) oluşur ve mayoz-I ve mayoz-II, sırasıyla 1 sırasında homolog kromozom ve kardeş kromatidler ayırmak için DNA sentezini müdahale olmadan iki ardışık bölümler içeren benzersiz bir bölünme sürecidir. Oositlerde öz değişmesine ait bölünme sırasında kromozomların dağılması hatalar fertilizasyon esnasında embriyo tarafından devralınır anoploidi, neden olabilir. Özellikle, gelişmekte olan embriyolarda anöploidi sıklığı anne yaşı ilerledikçe artar ve kadınlarda 1,2 gebelik kaybı yanı sıra konjenital doğum kusurları önemli bir nedenidir, bu nedenle, mayoz bölünme sırasında anöploidinin moleküler temelini anlamak için önemli bir ihtiyacı vurgulayan .
Hücre bölünmesi sırasında, kromozom ayrımı ters göbeğine doğru eki için mikrotübül mili aparatı ve istikrarlı kromozom-mikrotübül etkileşimlerin kurulması montajı ile ilgili hayati bağlıdırkutuplar. Önemli olarak, memeli oositlerinde öz değişmesine ait iğ formasyonu somatik hücrelerde mitoz farklıdır ve benzersiz mikrotübül organize merkezleri sentriyoller 3,4 eksikliği (MTOCs) tarafından düzenlenir. Mikrotübül çekirdeklenme ve organizasyon için gerekli esansiyel proteinler mikrotübül düzeneğini katalize γ-tubulin dahil oosit MTOCs, lokalize. Buna ek olarak, MTOCs 5 de bağlanan bir esas iskele proteini olarak işlev görür ve ankraj γ-tubulin gibi diğer faktörler pericentrin. Özellikle, çalışmalarımız önemli MTOC ilişkili proteinlerin tükenmesi mayoz iğ organizasyon bozar ve tam mili montaj kontrol noktasında (SAC) 6,7 tarafından çözüldü olmayan oosit kromozom ayrımı hataları neden olduğunu göstermektedir. Bu nedenle, mayoz tutuklanmasını tetiklemez iğ istikrar kusurları, anöploidi katkıda önemli bir risk oluşturmaktadır. Mili montaj ve organizasyon, oosit MTOC prot önemli rolleri rağmenein kompozisyon ve fonksiyon pek iyi anlaşılamamıştır.
Hücreler kısa mayoz 8,9 yeniden başlaması öncesinde transkripsiyonel sakin olmak gibi memeli oositlerinde belirli hedef proteinlerin fonksiyonlarını test zordur. Bu nedenle, ön-ovulatuar oosit mayoz devam etmek için anne mRNA mağazaları güveniyor ve mayoz bölünme yanı sıra gübreleme 10,11 sonra ilk bölünme bölünmeleri destekler. Memeli oositlerinde mRNA transkriptlerinin RNA interferans (RNAi) aracılı degradasyon etkinliği iyi bilinmektedir ve mayoz olgunlaşma sırasında çeviri için işe anne RNA'lar siRNA 12-14 hedefleme için özellikle uygundurlar. Bu nedenle, oosit içine kısa müdahale RNA'lar mikroenjeksiyon (siRNA) fonksiyonel test için hedef mRNA'ları tüketmek için değerli bir yaklaşım sağlar.
Burada, fare oositleri ve spesifik Transcri siRNA aracılı tükenmesi izolasyonu için yöntemleri tarif ederPTS pericentrin temel bir MTOC ilişkili proteinin fonksiyonunu test etmek. Buna ek olarak, oositlerde öz değişmesine ait iğ formasyonunun değerlendirmek için immünofloresan analiz koşulları açıklar.
Protokol
Bu protokol Georgia Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylanmıştır.
1. Hazırlıklar
- Taze oosit kültür, satın alma ya da için minimum temel ortam (MEM) hazırlanması ve Tablo 1 'de tarif edilen 3 mg / ml sığır serumu albümini (BSA) ile tamamlar. (Sıfıra dara), bir yükleme dengesine bir polistiren şişe yerleştirin. Amacıyla, BSA hariç tüm reaktif maddelerin ilave edin ve 250 g'lık bir toplam ağırlık ile MQ su ile son hacim getir. Ardından, BSA eklemek çözülür ve filtre sterilize izin verir.
Not: Açıklanan MEM ortamı,% 5 CO2,% 5 O2 ve% 90 N2 medikal gaz karışımı ile dengeye ve hücre inkübasyon gerektirmektedir. Bununla birlikte, diğer bir araç (örneğin, CZB) atmosferik şartlar altında% 5 CO2 hücre inkübasyon için izin veren kullanılabilir. - Oosit mikroenjeksiyon için, satın almak ya da M2 orta hazırlayın.
- P hazırlayın5 IU / 100 ul bir konsantrasyona kadar regnant kısrak serum gonadotropini (PMSG).
- Satınalma ve 1 mcM bir çalışma konsantrasyonu siRNA stoklarını sulandırmak.
2. Fare Oosit Toplama
- 1. GÜN: over folikül gelişimini teşvik ve ön ovulatuar folikül sayısını artırmak, periton oosit toplama 48 saat önce dişi farelere PMSG 5 IU yönetmek için.
- GÜN 3: Yumurta toplama ve kültür için 1 mcg / ml milrinon ile desteklenmiş MEM / BSA 3 ml 35 mm kültür kaplarına kurdu. Bu fosfodiesteraz inhibitörü olarak oosit tutar profaz-ı tutuklamak ve germinal vezikül dökümü (GVBD) engeller. En az 15 dakika boyunca tıbbi gaz karışımı içinde kültür kaplarına dengelenmesi.
Not: Milrinon desteklenmiş ortam oosit toplama ve oosit mikro enjeksiyon ve 24 saatlik kültür tutma sonrası dönem boyunca siRNA gereklidir. - 15 uygulamaları kurulan laboratuvar ile dişi farelerin yumurtalıkları almak ve önceden ısıtılmış olan yeni bir kültür çanak transfer ve MEM / BSA / milrinon dengelenmiş.
- Oosit toplanması için bir stereomikroskopta aşamasında kültür çanak yerleştirin. Yayın cumulus-oosit kompleksleri (COC) 'ın elle 27 G iğne ile antral folikülleri delinmesiyle. 1 ml şırınga bağlı 27 G iğne ile, kültür çanak tabanına bir yumurtalık saptamak ve tüm büyük folikül delinme için ikinci bir iğne kullanımı. Her yumurtalığın için tekrarlayın.
- Kompakt kümülüs hücrelerinin 2 veya daha fazla kat çevrili tüm oosit toplamak, standart ağız pipet prosedürleri veya oosit aspirasyonu diğer araçları kullanma. Yeni bir çanak COC en aktarın ve 1 saat boyunca 37 ° C'de inkübe edin.
- Dikkatle 750 ul'lik bir aspirasyon hacmi ayarlanmış bir 1 ml'lik pipet ile tekrar yumuşak pipetleme çevreleyen kümülüs hücreleri çıkarmak. Pipet adım yaklaşık 12 kez tekrarlayınve oositler 5 dakika süre kurtarmak için izin verir. Tamamını veya kümülüs hücrelerinin çoğu ortadan kadar bu şekilde devam edin. Başka bir kültür tabağına soyulmuş oositler aktarın ve 15 dakika boyunca 37 ° C'de dengelenmeye bırakın.
- Hesaba ilgili hedef karşı spesifik siRNA'lar (i), mikroenjeksiyon, spesifik olmayan (kontrol) siRNA'lar, (ii) mikroenjeksiyon, ve (iii) olmayan bir enjekte edilmiş kontrol grubu üç deneysel gruba soyulmuş oositler tahsis için kullanılacak Kültür koşulları.
3. Oosit Mikroenjeksiyon
- Oosit Mikroenjeksiyon için milrinon (1 ug / ml) ile takviye edilmiş 3 mi M2 medya ile kültür kaplarına ayarlayın. Yıkama ve enjekte edilen oositlerin daha sonra kültür için MEM / BSA / milrinon ihtiva eden kültür kaplarına hazırlayın.
Not: M2 ortamı HEPES tamponu içerir ve atmosferik koşullar altında, 15 dakika boyunca 37 ° C'de ön ısıtmaya gerektirir. MEM tarif tıbbi gaz kullanılarak ön ısınma ve dengeleme gerektirirYukarıda d. - Mikroenjeksiyon sistemi hazırlayın. 1 mcM belirli siRNA çözeltisi 5 ul enjeksiyon iğnesi yükleyin. Mikroenjeksiyon sistemi mikromanipülatörler tutma pipet ve enjeksiyon iğnesi Güvenli ve kalibre hacmi ve basınç Enjeksiyon Ünitesi kurmak.
- 3 cm kültür çanak kapağın iç tarafında M2 medya 200 ul mikro damla yerleştirin ve kurmak ve mikroenjeksiyon sistemi uyumu için bir oosit ekleyin.
- Bir kılavuz olarak oosit kullanarak, holding ve enjeksiyon iğneleri konumlarını ayarlayın. Nazikçe oosit güvenliğini sağlamak ve hücrenin en geniş çaplı enjeksiyon iğnesi konumunu ayarlamak için tutma pipet negatif basınç uygulayın. Her yerde oosit sitoplazmaya siRNA çözeltisi yaklaşık 10 ul mikroenjeksiyon izin ayarları yapın.
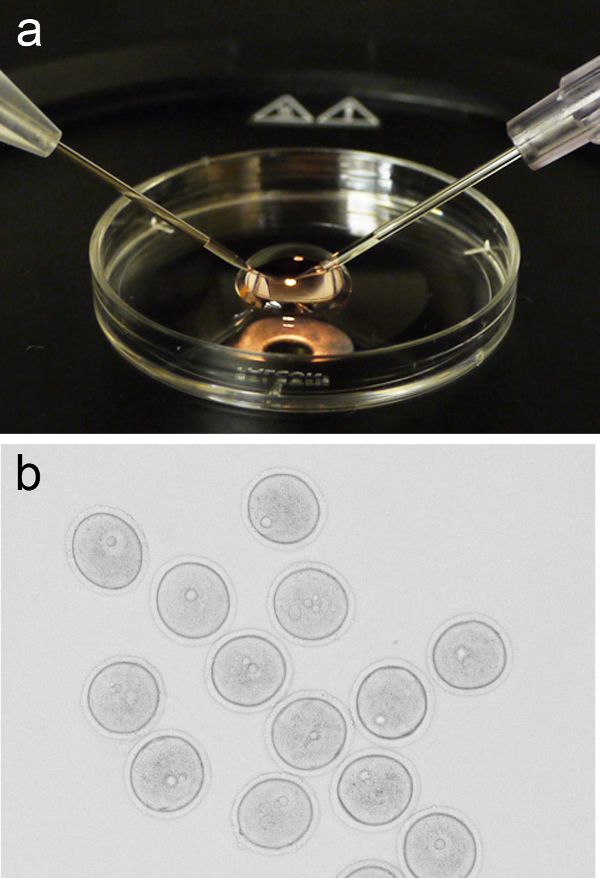
Şekil 1. Oosit mikroenjeksiyon kurdu. ( sırasıyla sol ve sağ, konumlandırılmış tutma pipet ve enjeksiyon iğnesi ile 3 cm kültür çanak kapağın üzerine yerleştirilmiş M2 medya 200 ul mikro-damla, A) Temsilcisi görüntü. (B) Grubu profaz-ı mikroenjeksiyon öncesinde oosit (GV-evresi) gözaltına aldı. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız. - Stereomikroskopta sahneye kapağı dönün ve taze M2 medya 200 ul mikro damla ekleyin. Ağız pipetle veya alternatif yöntemlerle mikro damlasına kadar oosit bir grup (~ 10) ekleyin, daha sonra mikroenjeksiyon aşamasına mikro damla ile kapağı dönün.
- Bireysel oosit Microinject geçin. Yavaş yavaş sitoplazmaya enjeksiyon iğne ucu yerleştirin tutan pipet ile tek oosit Güvenli ve siRNA çözümünün enjeksiyon hacmi sınırdışı. Dikkatle iğne ve mo gerimikro-damla altındaki bir pozisyonda enjekte oosit ziyaretinde. Mikro-damla üstünde bir konuma başarısız enjekte oosit taşıyın.
- Her oosit ile mikroenjeksiyon işlemi tekrarlayın. Her seferinde uygun oosit canlılığı, oosit Microinject az sayıda korumak için. Bu süreç mikro damla sıcaklık ve pH değişiklikleri önlemek için birkaç dakikadan fazla sürmüyor emin olun.
- Aspire başarıyla oosit enjekte veya dikkatlice stereomicroscope enjekte oosit mikro damla ile kapağı hareket ettirin. Yıkama ve 37 ° C'de dengelenmeye / BSA / milrinon orta MEM, ağız pipetleme ve alternatif metodlar ile enjekte uygulanabilir oosit aktarın.
- Oosit başka bir grup kullanarak, kontrol grubu için non-spesifik siRNA'lar yüklü yeni bir enjeksiyon iğnesi ile mikroenjeksiyon işlemi tekrarlayın. Ayrı bir kültür çanak MEM / BSA / milrinon ve transfer oosit yıkayın.
- Kültür tüm gruplarınTıbbi bir gaz atmosferi altında, 37 ° C'de MEM / BSA / milrinon 24 saat oocytes.
Not: 'milrinon blok' kültür dönemi verimli hedef mRNA / protein tükenmesi için gereklidir.
Mayotik Matürasyon 4. Oosit Kültürü
- GÜN 4: oosit oluşturduğu her bir deney grubu için 3 ml MEM / BSA ile kurulumu 4 kültür kaplarına (35 mm). Oosit olgunlaşması için kullanımı,% 10 (yüksek kalitede) cenin sığır serumu (FBS) ile birlikte grup başına bir ortam çanak Supplement. Tüm kültür tabakları tıbbi gaz karışımı ile 37 ° C 'de dengelenmeye bırakın.
- Sırayla, 'milrinon bloğu' dan oosit serbest MEM / BSA içeren yemekler oosit üç defa yıkamak ve daha sonra% 10 FBS ile ortamı içeren olgunlaşma çanak oosit aktarmak için. Kültür, 37 ° C'de 17 saat boyunca tüm oosit gruplan, yeniden başlamasını ve mayoz ilerlemesini sağlarlar.
- 5. GÜN: oosit çapraz ba¤ hazırlanın çözümlertion, aşağıdakileri içeren: (i) PEM tampon maddesi içinde% 4 paraformaldehid (PFA) (100 mM PIPES [pH 6.9], 1 mM MgCI2, 1 mM EGTA)% 0.5 Triton-X 100, ve (ii) PBS 5 ile takviye edilmiş olan yıkama ve oosit engellemek için kullanılacak% FBS.
Not: Bu çözümler öncesinde oosit tespitin 37 ° C-ısınma ön gerektirir. - (17 saat kültürden sonra) oositi tespit için, hızlı bir şekilde 750 ul ihtiva eden ağız pipetleme ya da (4-iyi bir çanak) bireysel çukurlar halinde alternatif yöntemler ile oosit oluşturduğu her bir deney grubu transferi% 4 PFA çözüm, önceden ısıtılmış ve 37 ° C'de inkübe 1 saat ° C. Daha sonra,% 5 FBS içeren önceden ısıtılmış PBS 750 ul, 3 kez (her biri 15 dakika) oositler, her grup yıkayın.
- 4 ° C'de 200 ul PBS /% 5 FBS O / N Blok oositler bağlama spesifik antikor en aza indirir.
5. İmmünofloresan Analizi
- GÜN 6:
Not: Bağışıklık boyaması bir çok-çukurlu plaka ve solüsyonu ° yapılırytes seri ilgili antikor ve yıkama çözümleri içeren sıralı yuvalara aktarılmıştır. Ya 48 ya da 96 oyuklu plakalar kullanılabilir sadece iyi boyutuna göre çözelti hacmini ayarlar. 96 oyuklu plakalar, oyuk başına 200 için ul kullanın. - 3 yıkanmaktadır - İkincil antikor çözeltisi - 3 yıkanmaktadır primer antikor çözeltisi: Oositler aşağıdaki sırayla farklı çözümler aktarılır. Plaka folyo ile kaplı olabilir ışık maruz kalma sınırı.
Taze PBS /% 5 FBS hazırlayın ve antikor çözeltiler elde etmek için, bu çözelti (örneğin, tavşan anti-pericentrin (1/1000), fare anti-tubulin (1/1000)). - Primer antikor solüsyonu (daha az hacim arzu edildiği takdirde veya 100 ul) 200 ul ihtiva eden tek tek oyuklara her bir deney grubu sabit oosit aktarın ve de parafilm ile kaplayın. Uygun antikor özel koşullara göre inkübe (örneğin 1 saat veya 4 ° CO / N 37 ° C).
Not: Primer antikor dilution yanı sıra, özel bir inkübasyon süresi ve sıcaklık, kullanılan farklı antikorlar için uygun koşulları belirlemek için test gerektirir. - Primer antikor ile inkübe edildikten sonra, PBS /% 5 FBS (10-15 dk) oosit üç kez yıkayın.
- Floresan-konjuge sekonder antikor ihtiva eden çözelti içine oosit aktarın (örneğin, farklı dalga boylarında florokromlar ile konjuge edilmiş anti-tavşan ve anti-fare antikorlarının 1/1000 seyrelti). 37 ° C 'de 1 saat süreyle inkübe edin.
- (- 15 dakika her biri 10) PBS /% 5 FBS oosit üç kez yıkayın.
- Son yıkama adımından sonra, temiz bir cam slayt üzerine oosit transferi ve hafifçe herhangi bir fazla yıkama solüsyonu aspire. Bu cam yüzey üzerinde oosit hareketsiz olacaktır. Medya (DAPI içeren) Montaj 8 ul ekleyin ve dikkatli bir 22 mm x 22 mm kapak kayma montaj ortamı kaplaması. Oosit, hava kabarcığı ve / veya zarar vermemek için yavaş yavaş lamel indirin.
Not: Alternatif olarak, konfokal mikroskopi analizi için oositin 3 boyutlu özelliklerini korumak önceki slaytta montajı için kapak kayma köşelerine 100 mikron cam boncuklar (vazelin ile karışık) küçük hacim eklemek için. - 4 ° C'de saklayın saydam ya öz değişmesine ait ilerlemesi değerlendirilmesi olarak kullanılan sekonder antikor eşleştirmek için gerekli olan filtreler ile donatılmış bir fluoresans mikroskopu kullanılarak ifade seviyeleri ve subsellüler protein lokalizasyonu analizine devam edin.
Sonuçlar
SiRNA'lar Mikroenjeksiyon in vitro farklı hedef faktörlerinin etkin ve yüksek düzeyde spesifik fonksiyonel test sağlar oositlerde mRNA bozulması ve daha sonra da protein tükenmesi için etkili bir yaklaşım sağlar. Daha sonra, belirli bir fenotip immünofloresan analizi için kullanılan olarak siRNA enjekte edilmiş oositlerde protein tükenmesi doğrulamak için. Mevcut örnekte, anti-tubulin ve anti-pericentrin antikorları ile birlikte DAPI ile ayrı oosit floresan etiketleme etkin: olarak peri...
Tartışmalar
Örneğin elektroporasyon transfeksiyon ve somatik hücreler, ekzojen nükleik asit aktarımı için çok sayıda yöntem vardır birlikte, mikro-enjeksiyon, transkripsiyonel olarak hareketsiz bir fare oositlerine RNA moleküllerinin verilmesi için uygun bir yöntemdir. Mevcut protokol farklı mili ve / veya oositlerde MTOC ilişkili faktörler fonksiyonel test sağlayan spesifik mRNA in vitro tükenmesi için etkili bir yaklaşım sağlar. Bu yaklaşım, verimli transkript tükenmesi ile sonuçlanır ve son d...
Açıklamalar
The authors have nothing to disclose
Teşekkürler
This research was supported in part by the University of Georgia, and a grant (HD071330) from the National Institutes of Health to MMV.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Pregnant Mare's Serum Gonadotropin (PMSG) | EMD Biosciences | 367222 | |
| Minimal Essential Medium (MEM) | *Recipe outlined in Table 1 | ||
| Earle's Balanced Salt Solution (10x) | Sigma | E-7510 | |
| Sodium Bicarbonate | Sigma | S-5761 | |
| Pyruvic Acid, sodium salt | Sigma | P-5280 | |
| Penicillin G, potassium salt | Sigma | P-7794 | |
| Streptomycin Sulfate | Sigma | S-9137 | |
| L-Glutamine | Sigma | G-8540 | |
| EDTA, disodium salt dihydrate | Sigma | E-4884 | |
| Essential Amino Acids (50x) | Gibco | 11130-051 | |
| MEM Vitamin Mixture (100x) | Sigma | M-6895 | |
| Phenol Red solution | Sigma | P-0290 | |
| Bovine Serum Albumin (BSA) | Sigma | A1470 | |
| Milrinone | Sigma | M4659 | |
| Fetal Bovine Serum (FBS) | Hyclone | SH30070.01 | |
| EmbryoMax M2 Media with Hepes | EMD Millipore | MR-015-D | |
| siRNAs targeting Pericentrin | Qiagen | GS18541 | |
| Negative control siRNAs | Qiagen | SI03650318 | |
| Paraformaldehyde (16% solution) | Electron Microscopy Sciences | 15710 | |
| Triton-X | Sigma | T-8787 | |
| Phosphate Buffered Saline (PBS) | Hyclone | SH30028.02 | |
| Anti-Pericentrin (rabbit) | Covance | PRB-432C | |
| Anti-acetylated a-tubulin (mouse) | Sigma | T-6793 | |
| Goat anti-rabbbit Alexa Fluor 488 | Invitrogen | A-21430 | |
| Goat anti -mouse Alexa Fluor 555 | Invitrogen | A-11017 | |
| Major Equipment | |||
| Stereomicroscope (SMZ 800) | Nikon | ||
| Upright Fluorescent Microscope | Leica Microsystems | ||
| Inverted Microscope | Nikon | ||
| Femtojet Micro-injections System | Eppenforf | ||
| Micro manipulators | Eppendorf | ||
| Micro-injection needles (femtotips) | Eppendorf | 930000035 | |
| Holding pipettes (VacuTip) | Eppendorf | 930001015 | |
| Plasticware | |||
| 35 mm culture dishes | Corning Life Sciences | 351008 | |
| 4-well plates | Thermo Scientific | 176740 | |
| 96 well plates | Corning Life Sciences | 3367 | |
| 0.45 mm CA Filter System | Corning Life Sciences | 430768 |
Referanslar
- Nagaoka, S. I., Hassold, T. J., Hunt, P. A. Human aneuploidy: mechanisms and new insights into an age-old problem. Nat Rev Genet. 13 (7), 493-504 (2012).
- Hassold, T. J., Hunt, P. A. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Szollosi, D., Calarco, P., Donahue, R. P. Absence of Centrioles in the First and Second Meiotic Spindles of Mouse Oocytes. J Cell Sci. 11 (2), 521-541 (1972).
- Manandhar, G., Schatten, H., Sutovsky, P. Centrosome Reduction During Gametogenesis and Its Significance. Biol Reprod. 72 (1), 2-13 (2005).
- Zimmerman, W. C., Sillibourne, J., Rosa, J., Doxsey, S. J. Mitosis-specific anchoring of gamma tubulin complexes by pericentrin controls spindle organization and mitotic entry. Mol Biol Cell. 15 (8), 3642-3647 (2004).
- Ma, W., Baumann, C., Viveiros, M. M. NEDD1 is crucial for meiotic spindle stabilty and accurate chromosome segregation in mammalian oocytes. Dev Biol. 339 (439-450), (2010).
- Ma, W., Viveiros, M. M. Depletion of pericentrin in mouse oocytes disrupts microtubule organizing center function and meiotic spindle organization. Mol Reprod Dev. 81 (11), 1019-1029 (2014).
- Bouniol-Baly, C., et al. Differential Transcriptional Activity Associated with Chromatin Configuration in Fully Grown Mouse Germinal Vesicle Oocytes. Biol Reprod. 60 (3), 580-587 (1999).
- De La Fuente, R., Eppig, J. J. Transcriptional Activity of the Mouse Oocyte Genome: Companion Granulosa Cells Modulate Transcription and Chromatin Remodeling. Dev Biol. 229 (1), 224-236 (2001).
- Hodgman, R., Tay, J., Mendez, R., Richter, J. D. CPEB phosphorylation and cytoplasmic polyadenylation are catalyzed by the kinase IAK1/Eg2 in maturing mouse oocytes. Development. 128 (14), 2815-2822 (2001).
- De La Fuente, R. Chromatin modifications in the germinal vesicle (GV) of mammalian oocytes. Dev Biol. 292 (1), 1-12 (2006).
- Wianny, F., Zernicka-Goetz, M. Specific interference with gene function by double-stranded RNA in early mouse development. Nat Cell Biol. , 270-275 (2000).
- Svoboda, P., Stein, P., Hayashi, H., Schultz, R. M. Selective reduction of dormant maternal mRNAs in mouse oocytes by RNA interference. Development. 127 (19), 4147-4156 (2000).
- Svoboda, P. Renaissance of mammalian endogenous RNAi. FEBS Letters. 588 (15), 2550-2556 (1016).
- Behringer, R., Gertsenstein, M., Nagy, K., Nagy, A. . Manipulating the Mouse Embryo: A Laboratory Manual. , (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır