È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Meiotic mandrino valutazione in mouse Ovociti mettendo a tacere siRNA-mediata
In questo articolo
Riepilogo
Qui, vi presentiamo un protocollo per le specifiche esaurimento mRNA siRNA-mediata seguita da analisi di immunofluorescenza per valutare il montaggio fuso meiotico e l'organizzazione in ovociti di topo. Questo protocollo è adatto a deplezione di trascritti in vitro e valutazione funzionale diverso mandrino e / o fattori MTOC associati in oociti.
Abstract
Errors in chromosome segregation during meiotic division in gametes can lead to aneuploidy that is subsequently transmitted to the embryo upon fertilization. The resulting aneuploidy in developing embryos is recognized as a major cause of pregnancy loss and congenital birth defects such as Down’s syndrome. Accurate chromosome segregation is critically dependent on the formation of the microtubule spindle apparatus, yet this process remains poorly understood in mammalian oocytes. Intriguingly, meiotic spindle assembly differs from mitosis and is regulated, at least in part, by unique microtubule organizing centers (MTOCs). Assessment of MTOC-associated proteins can provide valuable insight into the regulatory mechanisms that govern meiotic spindle formation and organization. Here, we describe methods to isolate mouse oocytes and deplete MTOC-associated proteins using a siRNA-mediated approach to test function. In addition, we describe oocyte fixation and immunofluorescence analysis conditions to evaluate meiotic spindle formation and organization.
Introduzione
La meiosi è un processo di divisione unica che si verifica in gameti (ovociti e spermatozoi) e coinvolge due divisioni successive senza intervenire sintesi del DNA per separare i cromosomi omologhi e cromatidi fratelli durante la meiosi I e meiosi II, rispettivamente, 1. Errori nella segregazione dei cromosomi durante la divisione meiotica in oociti possono causare aneuploidia, che viene ereditato dalla embrione durante la fecondazione. In particolare, l'incidenza di aneuploidie negli embrioni in via di sviluppo aumenta con l'avanzare dell'età materna, ed è una delle principali cause di difetti di nascita congeniti così come la perdita di gravidanza nelle donne 1,2, quindi, sottolineando l'importante necessità di comprendere le basi molecolari di aneuploidie durante la divisione meiotica .
Durante la divisione cellulare, la segregazione dei cromosomi è strettamente dipendente dalla assemblea degli apparati microtubuli fuso e la creazione di interazioni stabili cromosomiche-microtubuli per un corretto attaccamento al mandrino oppostopali. È importante sottolineare che la formazione del fuso meiotico in ovociti di mammiferi si differenzia da mitosi nelle cellule somatiche, ed è regolata da centri-microtubuli organizzare unici (MTOC) che mancano centrioli 3,4. Proteine essenziali necessari per microtubuli nucleazione e di organizzazione localizzano a MTOC ovociti, tra cui γ-tubulina che catalizza dei microtubuli. Inoltre, pericentrin funziona come una proteina essenziale impalcature, che lega e ancoraggi gamma-tubulina, nonché altri fattori in MTOC 5. In particolare, i nostri studi dimostrano che la deplezione delle proteine MTOC associate chiave interrompe organizzazione fuso meiotico e porta ad errori cromosoma segregazione in ovociti, che non sono completamente risolti con il checkpoint del fuso (SAC) 6,7. Pertanto, difetti di stabilità mandrino, che non attivano l'arresto meiotica, presentano un rischio significativo nel contribuire a aneuploidie. Nonostante il loro ruolo essenziale per il montaggio del mandrino e organizzazione, prot ovociti MTOCcomposizione e la funzione ein rimane poco compresa.
Testare la funzione di specifiche proteine bersaglio negli ovociti di mammiferi è impegnativo, in quanto le cellule diventano trascrizionalmente quiescenza poco prima della ripresa della meiosi 8,9. Quindi, ovociti pre-ovulatori si affidano a negozi mRNA materni per riprendere la meiosi e sostenere divisione meiotica così come le prime divisioni scissione dopo la fecondazione 10,11. L'efficacia di RNA interference (RNAi) la degradazione mediata di trascritti di mRNA negli ovociti di mammiferi è ben consolidata e RNA materni reclutati per la traduzione durante la maturazione meiotica sono particolarmente suscettibili di siRNA targeting per 12-14. Pertanto, la microiniezione di brevi RNA interferenti (siRNA) in ovociti offre un valido approccio per esaurire mRNA bersaglio per i test funzionali.
Qui, descriviamo i metodi per l'isolamento di ovociti di topo e di siRNA mediata esaurimento delle transcri specificopts per testare la funzione di una proteina essenziale MTOC-associata, pericentrin. Inoltre, si descrivono le condizioni di analisi di immunofluorescenza per valutare la formazione del fuso meiotico in ovociti.
Protocollo
Questo protocollo è stato approvato dalla cura e l'uso Comitato istituzionale animali (IACUC) presso l'Università della Georgia.
1. Preparativi
- Per la cultura ovocita, acquisto o appena preparare Minimal Essential Medium (MEM) e integrare con 3 mg / ml di albumina sierica bovina (BSA) come indicato nella tabella 1. Mettere una bottiglia di polistirene su una bilancia di carico (tara a zero). Aggiungi tutti i reagenti, ad eccezione di BSA, in ordine e portare il volume finale con MQ-acqua, in peso, per un totale di 250 g. Quindi aggiungere il BSA, permettere di sciogliere e filtro sterilizzare.
Nota: Il mezzo MEM descritto richiede equilibrio e l'incubazione delle cellule con una miscela di gas medicali 5% CO 2, 5% O 2 e 90% N 2. Tuttavia, altri mezzi (ad esempio, czb) possono essere utilizzate per consentire per l'incubazione delle cellule in 5% CO 2 in condizioni atmosferiche. - Per ovocita microiniezione, acquistare o preparare M2 media.
- Preparare psiero gonadotropina di cavalla regnante (PMSG) ad una concentrazione di 5 UI / 100 ml.
- Acquisto e ricostituire le scorte siRNA ad una concentrazione di lavoro di 1 micron.
2. mouse ovociti Collection
- 1 ° GIORNO: per stimolare lo sviluppo del follicolo ovarico e aumentare il numero di follicoli pre-ovulatori, amministrare 5 UI di PMSG intraperitoneale a topi femmina 48 ore prima della raccolta degli ovociti.
- GIORNO 3: Per la raccolta e la cultura degli ovociti, istituito 35 mm piatti della cultura con 3 ml di MEM / BSA integrato con 1 mg / ml milrinone. Questo inibitore della fosfodiesterasi mantiene gli ovociti in profase-in arresto e impedisce ripartizione vescicola germinale (GVBD). Equilibrare le piastre di coltura in una miscela di gas medicali per almeno 15 min.
Nota: Milrinone supporto integrato è richiesta per tutto raccolta degli ovociti, così come ovocita microiniezione e la 24 ore cultura attesa periodo post siRNA. - Recuperare le ovaie dei topi femmina con laboratorio istituito pratica il 15 e il trasferimento ad un nuovo piatto cultura con pre-riscaldato ed equilibrato MEM / BSA / milrinone.
- Posizionare il piatto cultura sul palcoscenico di uno stereomicroscopio per la raccolta degli ovociti. Stampa cumulo-ovocita-complessi (COC di) da puntura manualmente i follicoli antrali con 27 aghi G. Fissare un ovaio al fondo del piatto di coltura, con un ago 27 G attaccato ad una siringa da 1 ml, e utilizzare un secondo ago per perforare tutti follicoli grandi. Ripetere per ogni ovaio.
- Utilizzando le procedure di pipette a bocca standard o altri mezzi di aspirazione dell'ovocita, raccogliere tutti gli ovociti che sono circondati da 2 o più strati di cellule del cumulo compatte. Trasferire il COC di un nuovo piatto e incubare a 37 ° C per 1 ora.
- Rimuovere con attenzione le cellule del cumulo circostanti di ripetuto pipettaggio gentile con una pipetta 1 ml impostato su un volume di aspirazione di 750 ml. Ripetere il passaggio pipettamento circa 12 voltee permettono di recuperare gli ovociti per 5 min. Continuare in questo modo fino a quando tutti o la maggior parte delle cellule del cumulo sono stati rimossi. Trasferire gli ovociti denudati all'altro piatto cultura e lasciar equilibrare a 37 ° C per 15 min.
- Assegnare gli ovociti denudati in tre gruppi sperimentali da utilizzare per: (i) la microiniezione di siRNA specifici contro il bersaglio di interesse, (ii) la microiniezione di aspecifici (controllo) siRNA, e (iii) un gruppo non-iniezione di controllo per tenere conto di condizioni di coltura.
3. Microiniezione degli ovociti
- Istituito piatti della cultura con 3 ml di mezzi M2 integrato con milrinone (1 mg / ml) per ovocita microiniezione. Preparare piatti della cultura contenenti MEM / BSA / milrinone per il lavaggio e la successiva cultura di ovociti iniettati.
Nota: M2 terreno contiene tampone HEPES e richiede pre-riscaldamento a 37 ° C per 15 minuti in condizioni atmosferiche. MEM richiede la pre-riscaldamento e equilibrio con gas medicali come descrittod sopra. - Preparare il sistema di microiniezione. Caricare l'ago di iniezione con 5 ml di soluzione di specifici siRNA 1 micron. Fissare la pipetta detenzione e ago per iniezione per micromanipolatori del sistema microiniezione e impostare l'unità di iniezione con il volume e la pressione calibrata.
- Inserire un 200 microlitri micro-goccia di M2 supporti sulla parte interna del coperchio di un piatto di coltura 3 cm e aggiungi ovocita per impostare e allineamento del sistema microiniezione.
- Utilizzando l'ovocita come guida, regolare le posizioni degli aghi holding e iniezione. Applicare pressione negativa alla pipetta tenuta per fissare delicatamente l'oocita e regolare la posizione dell'ago di iniezione al più ampio diametro della cellula. Regolare le impostazioni per consentire microiniezione di circa 10 pl della soluzione siRNA ovunque nel citoplasma dell'ovocita.
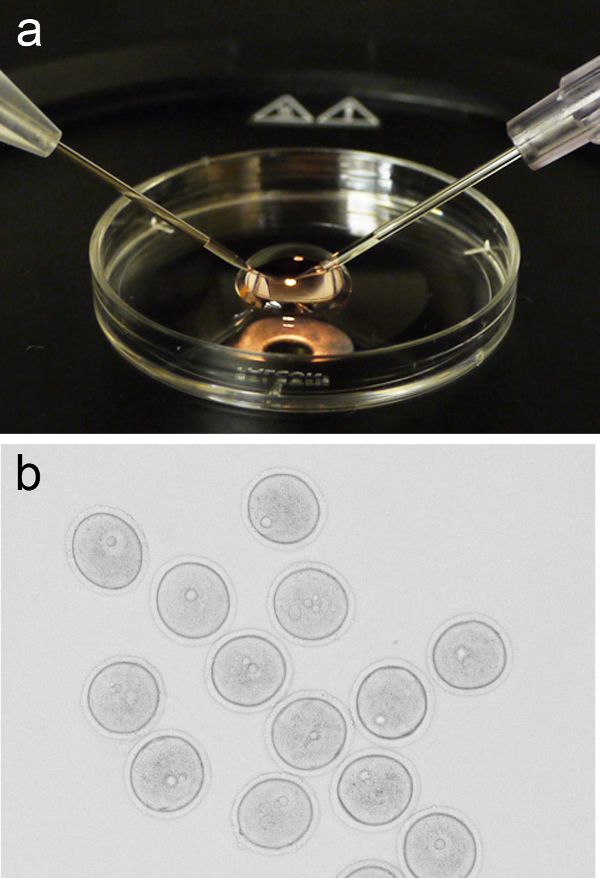
Figura 1. ovociti microiniezione istituito. ( A) di una immagine rappresentativa 200 microlitri micro-goccia di M2 multimediale presente sul coperchio di un piatto di coltura 3 cm, con la pipetta tenuta e iniezione ago posizionato sul rispettivamente a sinistra ea destra,. (B) Gruppo di profase-I arrestato ovociti (GV-stadio) prima microiniezione. Clicca qui per vedere una versione più grande di questa figura. - Riportare il coperchio alla fase stereomicroscopio e aggiungere 200 microlitri di micro-goccia di supporto M2 fresco. Aggiungere un gruppo di ovociti (~ 10) per il micro-goccia a pipette a bocca, o metodi alternativi, per poi tornare il coperchio con micro-drop per la fase di microiniezione.
- Procedere alla microinject singoli ovociti. Fissare un ovocita con la pipetta detenzione, inserire lentamente la punta di un ago per l'iniezione nel citoplasma ed espellere il volume di iniezione di soluzione di siRNA. Ritrarre con attenzione l'ago di iniezione e move l'ovocita iniettato in una posizione nella parte inferiore del micro-drop. Spostare ovociti iniettati senza successo ad una posizione in alto della micro-drop.
- Ripetere la procedura di microiniezione con ogni ovocita. Per mantenere la vitalità degli ovociti ottimale, microinject solo un piccolo numero di ovociti per volta. Assicurarsi che questo processo non richiede più di qualche minuto per evitare temperatura e pH cambiamenti nella micro-drop.
- Aspirare iniettato con successo ovociti o spostare con cautela il coperchio con il micro-goccia di ovociti iniettati al stereomicroscopio. Trasferire gli ovociti vitali iniettati per via orale pipettando o metodi alternativi, a MEM / BSA medio / milrinone per lavare ed equilibrare a 37 ° C.
- Utilizzando un altro gruppo di ovociti, ripetere il processo microiniezione con un nuovo ago per iniezione caricato con siRNA non specifici per il gruppo di controllo. Lavare gli ovociti in MEM / BSA / milrinone e trasferimento in un piatto di coltura separata.
- Cultura tutti i gruppi dioociti per 24 ore in MEM / BSA / milrinone a 37 ° C in atmosfera di gas medicale.
Nota: Il 'blocco milrinone' periodo di coltura è necessario per obiettivo efficiente mRNA / proteine esaurimento.
4. ovociti cultura per la maturazione meiotica
- 4 ° GIORNO: Per ogni gruppo sperimentale di ovociti set-up 4 capsule di Petri (35 mm) con 3 ml di MEM / BSA. Supplemento un piatto dei media per ogni gruppo con il 10% (di alta qualità) siero fetale bovino (FBS) da utilizzare per la maturazione degli ovociti. Consentire a tutti i piatti della cultura equilibrare a 37 ° C con miscela di gas medicali.
- Per rilasciare ovociti da 'blocco milrinone', sequenza lavare gli ovociti tre volte in piatti contenenti MEM / BSA e poi trasferire gli ovociti al piatto contenente la maturazione media con il 10% FBS. Cultura tutti i gruppi di ovociti per 17 ore a 37 ° C, per consentire la ripresa e la progressione della meiosi.
- GIORNO 5: Preparare soluzioni per ovocita fixazione, tra cui: (i) 4% paraformaldeide (PFA) in tampone PEM (TUBI 100 mM [pH 6,9], 1 mM MgCl 2, 1 mM EGTA) con 0,5% Triton-X 100, e (ii) PBS integrato con 5 % FBS che verranno utilizzati per il lavaggio e bloccare gli ovociti.
Nota: Queste soluzioni richiedono pre-riscaldamento a 37 ° C prima della fissazione degli ovociti. - Per ovocita fissaggio (dopo la cultura 17 ore), velocemente trasferire ogni gruppo sperimentale di ovociti da pipette a bocca o metodi alternativi in singoli pozzi (di un piatto 4-bene) contenente 750 ml di pre-riscaldato soluzione al 4% PFA e incubare a 37 ° C per 1 ora. Successivamente lavare ogni gruppo di ovociti 3 volte (15 min ciascuna) in 750 ml di PBS preriscaldata contenenti il 5% FBS.
- Ovociti Block in 200 l di PBS / 5% FBS O / N a 4 ° C per ridurre al minimo l'anticorpo aspecifico vincolante.
Analisi 5. immunofluorescenza
- GIORNO 6:
Nota: immunocolorazione è fatto in una piastra multi-pozzo e la OOCytes sono in serie trasferiti a pozzi sequenziali, contenente rispettive soluzioni di anticorpi e di lavaggio. O 48 o 96 pozzetti piastre possono essere utilizzate, è sufficiente regolare il volume della soluzione in base alle dimensioni ben. Per piastre a 96 pozzetti utilizzare 200 ml per pozzetto. Gli oociti vengono trasferiti alle diverse soluzioni nel seguente ordine: soluzione di anticorpo primario - 3 pozzi di lavaggio - soluzione di anticorpo secondario - 3 pozzi di lavaggio. Al fine di limitare l'esposizione alla luce la lastra può essere coperto con un foglio.
Preparare fresco PBS / 5% FBS e utilizzare questa soluzione per preparare diluizioni di anticorpi (ad esempio, di coniglio anti-pericentrin (1 / 1.000), topo anti-tubulina (1 / 1.000)). - Trasferire gli ovociti fissi di ogni gruppo sperimentale a singoli pozzetti contenenti 200 microlitri (o 100 microlitri, se si desidera un volume inferiore) della soluzione di anticorpo primario e coprire il pozzo con parafilm. Incubare secondo condizioni specifiche anticorpali ottimali (ad esempio, 37 ° C per 1 ora, o 4 ° CO / N).
Nota: dilutio anticorpo primarion così come il tempo e la temperatura di incubazione specifico richiedono test per determinare le condizioni ottimali per differenti anticorpi utilizzati. - Dopo l'incubazione con l'anticorpo primario, lavare gli ovociti tre volte in PBS / 5% FBS (10-15 min ciascuna).
- Trasferire gli ovociti nella soluzione contenente anticorpi secondari coniugati fluorescenza (ad esempio, 1 / 1.000 diluizione di anticorpi anti-coniglio e anti-topo coniugato con fluorocromi di diverse lunghezze d'onda). Incubare per 1 ora a 37 ° C.
- Lavare gli ovociti tre volte in PBS / 5% FBS (10 - 15 minuti ciascuna).
- Dopo la fase di lavaggio finale, di trasferire gli ovociti su un vetrino pulito e delicatamente aspirare qualsiasi soluzione di lavaggio in eccesso. Ciò immobilizzare gli ovociti sulla superficie del vetro. Aggiungere 8 ml di mezzi (contenente DAPI) montaggio e sovrapposizione con attenzione il supporto di montaggio con un x 22 mm polizza di copertura di 22 mm. Abbassare il vetrino lentamente per evitare di intrappolare bolle d'aria e / o danneggiare gli ovociti.
Nota: In alternativa, per mantenere le proprietà 3-dimensionali del ovocita per analisi microscopia confocale, aggiungere un piccolo volume di perline di vetro 100 micron (misti con vaselina) agli angoli del vetrino prima del montaggio sul vetrino. - Conservare i vetrini a 4 ° C, o procedere alla valutazione della progressione meiotica e l'analisi dei livelli di espressione e la localizzazione subcellulare di proteine usando un microscopio a fluorescenza dotato di filtri necessari a anticorpi secondari utilizzati.
Risultati
Microiniezione di siRNAs fornisce un approccio efficace per la degradazione dell'mRNA e successiva deplezione proteica in oociti, che consente efficiente e altamente specifico collaudo funzionale di diversi fattori bersaglio in vitro. Successivamente, immunofluorescenza viene utilizzato per l'analisi specifica fenotipo e convalidare deplezione proteica in ovociti siRNA-iniettato. Nell'esempio corrente, marcatura fluorescente di ovociti individuali con DAPI insieme con anticorpi anti-tubulina ed anti...
Discussione
Mentre ci sono diversi metodi per esogena trasferimento di acidi nucleici nelle cellule somatiche, come elettroporazione e transfezione, microiniezione è il metodo ottimale per la consegna di molecole di RNA in ovociti trascrizionalmente quiescenti del mouse. Il protocollo attuale prevede un approccio efficace per esaurimento in vitro di specifici mRNA che consentono il collaudo funzionale di diverso fuso e / o fattori MTOC associate in ovociti. Questo approccio si traduce in efficienza esaurimento trascrizion...
Divulgazioni
The authors have nothing to disclose
Riconoscimenti
This research was supported in part by the University of Georgia, and a grant (HD071330) from the National Institutes of Health to MMV.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Pregnant Mare's Serum Gonadotropin (PMSG) | EMD Biosciences | 367222 | |
| Minimal Essential Medium (MEM) | *Recipe outlined in Table 1 | ||
| Earle's Balanced Salt Solution (10x) | Sigma | E-7510 | |
| Sodium Bicarbonate | Sigma | S-5761 | |
| Pyruvic Acid, sodium salt | Sigma | P-5280 | |
| Penicillin G, potassium salt | Sigma | P-7794 | |
| Streptomycin Sulfate | Sigma | S-9137 | |
| L-Glutamine | Sigma | G-8540 | |
| EDTA, disodium salt dihydrate | Sigma | E-4884 | |
| Essential Amino Acids (50x) | Gibco | 11130-051 | |
| MEM Vitamin Mixture (100x) | Sigma | M-6895 | |
| Phenol Red solution | Sigma | P-0290 | |
| Bovine Serum Albumin (BSA) | Sigma | A1470 | |
| Milrinone | Sigma | M4659 | |
| Fetal Bovine Serum (FBS) | Hyclone | SH30070.01 | |
| EmbryoMax M2 Media with Hepes | EMD Millipore | MR-015-D | |
| siRNAs targeting Pericentrin | Qiagen | GS18541 | |
| Negative control siRNAs | Qiagen | SI03650318 | |
| Paraformaldehyde (16% solution) | Electron Microscopy Sciences | 15710 | |
| Triton-X | Sigma | T-8787 | |
| Phosphate Buffered Saline (PBS) | Hyclone | SH30028.02 | |
| Anti-Pericentrin (rabbit) | Covance | PRB-432C | |
| Anti-acetylated a-tubulin (mouse) | Sigma | T-6793 | |
| Goat anti-rabbbit Alexa Fluor 488 | Invitrogen | A-21430 | |
| Goat anti -mouse Alexa Fluor 555 | Invitrogen | A-11017 | |
| Major Equipment | |||
| Stereomicroscope (SMZ 800) | Nikon | ||
| Upright Fluorescent Microscope | Leica Microsystems | ||
| Inverted Microscope | Nikon | ||
| Femtojet Micro-injections System | Eppenforf | ||
| Micro manipulators | Eppendorf | ||
| Micro-injection needles (femtotips) | Eppendorf | 930000035 | |
| Holding pipettes (VacuTip) | Eppendorf | 930001015 | |
| Plasticware | |||
| 35 mm culture dishes | Corning Life Sciences | 351008 | |
| 4-well plates | Thermo Scientific | 176740 | |
| 96 well plates | Corning Life Sciences | 3367 | |
| 0.45 mm CA Filter System | Corning Life Sciences | 430768 |
Riferimenti
- Nagaoka, S. I., Hassold, T. J., Hunt, P. A. Human aneuploidy: mechanisms and new insights into an age-old problem. Nat Rev Genet. 13 (7), 493-504 (2012).
- Hassold, T. J., Hunt, P. A. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Szollosi, D., Calarco, P., Donahue, R. P. Absence of Centrioles in the First and Second Meiotic Spindles of Mouse Oocytes. J Cell Sci. 11 (2), 521-541 (1972).
- Manandhar, G., Schatten, H., Sutovsky, P. Centrosome Reduction During Gametogenesis and Its Significance. Biol Reprod. 72 (1), 2-13 (2005).
- Zimmerman, W. C., Sillibourne, J., Rosa, J., Doxsey, S. J. Mitosis-specific anchoring of gamma tubulin complexes by pericentrin controls spindle organization and mitotic entry. Mol Biol Cell. 15 (8), 3642-3647 (2004).
- Ma, W., Baumann, C., Viveiros, M. M. NEDD1 is crucial for meiotic spindle stabilty and accurate chromosome segregation in mammalian oocytes. Dev Biol. 339 (439-450), (2010).
- Ma, W., Viveiros, M. M. Depletion of pericentrin in mouse oocytes disrupts microtubule organizing center function and meiotic spindle organization. Mol Reprod Dev. 81 (11), 1019-1029 (2014).
- Bouniol-Baly, C., et al. Differential Transcriptional Activity Associated with Chromatin Configuration in Fully Grown Mouse Germinal Vesicle Oocytes. Biol Reprod. 60 (3), 580-587 (1999).
- De La Fuente, R., Eppig, J. J. Transcriptional Activity of the Mouse Oocyte Genome: Companion Granulosa Cells Modulate Transcription and Chromatin Remodeling. Dev Biol. 229 (1), 224-236 (2001).
- Hodgman, R., Tay, J., Mendez, R., Richter, J. D. CPEB phosphorylation and cytoplasmic polyadenylation are catalyzed by the kinase IAK1/Eg2 in maturing mouse oocytes. Development. 128 (14), 2815-2822 (2001).
- De La Fuente, R. Chromatin modifications in the germinal vesicle (GV) of mammalian oocytes. Dev Biol. 292 (1), 1-12 (2006).
- Wianny, F., Zernicka-Goetz, M. Specific interference with gene function by double-stranded RNA in early mouse development. Nat Cell Biol. , 270-275 (2000).
- Svoboda, P., Stein, P., Hayashi, H., Schultz, R. M. Selective reduction of dormant maternal mRNAs in mouse oocytes by RNA interference. Development. 127 (19), 4147-4156 (2000).
- Svoboda, P. Renaissance of mammalian endogenous RNAi. FEBS Letters. 588 (15), 2550-2556 (1016).
- Behringer, R., Gertsenstein, M., Nagy, K., Nagy, A. . Manipulating the Mouse Embryo: A Laboratory Manual. , (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon