A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Meiotic ציר ההערכה בעכבר ביציות על ידי השתקה בתיווך siRNA
In This Article
Summary
כאן, אנו מציגים פרוטוקול לדלדול mRNA ספציפי בתיווך siRNA אחרי ניתוח immunofluorescence להעריך הרכבה ציר meiotic וארגון בביציות עכבר. פרוטוקול זה מתאים לדלדול במבחנה של תמלילים והערכה תפקודית של ציר שונה ו / או גורמים הקשורים MTOC בביציות.
Abstract
Errors in chromosome segregation during meiotic division in gametes can lead to aneuploidy that is subsequently transmitted to the embryo upon fertilization. The resulting aneuploidy in developing embryos is recognized as a major cause of pregnancy loss and congenital birth defects such as Down’s syndrome. Accurate chromosome segregation is critically dependent on the formation of the microtubule spindle apparatus, yet this process remains poorly understood in mammalian oocytes. Intriguingly, meiotic spindle assembly differs from mitosis and is regulated, at least in part, by unique microtubule organizing centers (MTOCs). Assessment of MTOC-associated proteins can provide valuable insight into the regulatory mechanisms that govern meiotic spindle formation and organization. Here, we describe methods to isolate mouse oocytes and deplete MTOC-associated proteins using a siRNA-mediated approach to test function. In addition, we describe oocyte fixation and immunofluorescence analysis conditions to evaluate meiotic spindle formation and organization.
Introduction
מיוזה היא תהליך החלוקה ייחודי המתרחש בתאי מין (ביציות וזרע) וכולל שתי חטיבות רצופות ללא התערבות סינתזת DNA להפריד כרומוזומים הומולוגיים וchromatids האחות במהלך מיוזה-אני ומיוזה-השנייה, בהתאמה 1. שגיאות בהפרדת כרומוזום במהלך חלוקת meiotic בביציות יכולות לגרום aneuploidy, שעובר בירושה על ידי העובר במהלך הפריה. יש לציין, השכיחות של aneuploidy בעוברים מתפתחים עולה עם עלייה בגיל האם והיא אחד גורמים עיקריים למומים מולדים, כמו גם אובדן הריון בנשים 1,2, וכך, מדגיש את הצורך חשוב להבין את הבסיס המולקולרי של aneuploidy במהלך חלוקת meiotic .
במהלך חלוקת תא, הפרדה כרומוזום היא מכריע תלויה בהרכבה של מנגנון ציר microtubule והקמה של אינטראקציות כרומוזום-microtubule יציבה עבור התקשרות נכונה לציר הפוךקטבים. חשוב לציין, היווצרות ציר meiotic בביציות של יונקים שונים ממיטוזה בתאים סומטיים, ומוסדרת על ידי מרכזי ארגון-microtubule הייחודיים (MTOCs) שחסרי centrioles 3,4. חלבונים חיוניים נחוצים להתגרענות microtubule וארגון למקם לMTOCs ביצית, כולל γ טובולין שמזרז הרכבה microtubule. בנוסף, pericentrin פונקציות כמו חלבון פיגומים חיוני, אשר נקשר ועוגני γ טובולין, כמו גם גורמים אחרים בMTOCs 5. יש לציין, המחקרים שלנו מראים כי דלדול של חלבונים הקשורים-MTOC מפתח משבש ארגון ציר meiotic ומוביל לשגיאות הפרדת כרומוזום בביציות, שאינם מלא נפתרו על ידי מחסום ההרכבה ציר (SAC) 6,7. לכן, פגמים ביציבות ציר, שאינו מפעילים את מעצר meiotic, מהווים סיכון משמעותי בתרומה לaneuploidy. למרות התפקיד החיוני שלהם בהרכבת ציר וארגון, prot MTOC הביציתהרכב עין ותפקוד נשאר הבינו היטב.
בדיקת תפקודם של חלבוני יעד ספציפיים בביציות יונקים היא מאתגרת, כמו התאים להפוך לתעתיק שקטים זמן קצר לפני חידוש מיוזה 8,9. לפיכך, ביציות מראש ביוץ להסתמך על חנויות mRNA אימהיות לחדש מיוזה ותומכות בחלוקה meiotic כמו גם חטיבות המחשוף הראשונות לאחר ההפריה 10,11. היעילות של התערבות RNA השפלה (RNAi) בתיווך של תעתיקי mRNA בביציות יונקים היא מבוססת היטב וRNAs האימהי גויס לתרגום במהלך התבגרות meiotic במיוחד נוח לsiRNA מיקוד 12-14. לכן, microinjection של RNAs התערבות הקצר (siRNAs) לביציות מספק גישה רבת ערך לרוקן mRNAs היעד לבדיקה פונקציונלית.
כאן אנו מתארים שיטות לבידוד של ביציות עכבר ודלדול בתיווך siRNA של transcri הספציפינק 'כדי לבדוק את התפקוד של חלבון הקשורים MTOC חיוני, pericentrin. בנוסף, אנו מתארים תנאי ניתוח immunofluorescence להעריך היווצרות ציר meiotic בביציות.
Protocol
פרוטוקול זה אושר על ידי הוועדה המוסדית הטיפול בבעלי חיים והשימוש (IACUC) באוניברסיטת ג'ורג'יה.
1. הכנות
- לתרבות ביצית, רכישה או טרי להכין בינוני מינימאלי חיוני (ממ) ולהשלים עם 3 מ"ג / מיליליטר אלבומין בסרום שור (BSA) כפי שמתוארים בטבלה 1. הנח בקבוק קלקר על איזון טעינה (טרה לאפס). הוסף את כל חומרים כימיים, למעט ה- BSA, על מנת ולהביא את הנפח הסופי עם MQ-מים לפי משקל לסך של 250 גרם. לאחר מכן להוסיף את BSA, מאפשר לפזר ולעקר מסנן.
הערה: הבינוני ממ תאר דורש איזון ודגירת תא בתערובת גז רפואית של 5% CO 2, 5% O 2 ו- 90% N 2. עם זאת, כלי תקשורת אחרים (למשל, CZB) יכול לשמש המאפשרות לתא דגירה ב 5% CO 2 בתנאים אטמוספריים. - עבור microinjection ביצית, לרכוש או להכין מדיום M2.
- הכן עמ 'גונדוטרופין של סוסת מושלות בסרום (PMSG) לריכוז של 5 IU / 100 μl.
- רכישה ולשקם מניות siRNA לריכוז עבודה של 1 מיקרומטר.
2. ביצית אוסף עכבר
- יום 1: כדי לעורר התפתחות זקיק בשחלה ולהגדיל את מספר הזקיקים טרום ביוץ, לנהל 5 IU של PMSG intraperitoneally לנקבות עכברים 48 שעות לפני איסוף ביצית.
- יום 3: לאוסף ביצית ותרבות, להגדיר תרבות מנות 35 מ"מ עם 3 מיליליטר של ממ / BSA בתוספת 1 מיקרוגרם / מיליליטר milrinone. מעכב phosphodiesterase זה שומר על הביציות בprophase-לעצור ומונע התמוטטות נבטי שלפוחית (GVBD). לאזן את הכלים התרבות בתערובת גז רפואי לפחות 15 דקות.
הערה: התקשורת בתוספת של milrinone נדרשת בכל אוסף ביצית, כמו גם microinjection ביצית ולאחר תקופת ההמתנה תרבות 24 שעות siRNA. - אחזר השחלות מנקבות העכברים באמצעות מעבדה הוקמה מתרגל 15 ולהעביר לצלחת תרבות חדשה עם מראש התחממתי equilibrated ממ / BSA / milrinone.
- מניחים את צלחת התרבות על הבמה של סטראו לאוסף ביצית. שחרור קומולוס-ביצית מתחמים (COC של) על ידי ניקוב ידני זקיקי Antral עם 27 מחטי G. תקן שחלה אחת לתחתית צלחת התרבות, עם מחט 27 G מצורפת מזרק 1 מיליליטר, ולהשתמש במחט שנייה לנקב את כל הזקיקים הגדולים. חזור על פעולה עבור כל השחלה.
- באמצעות נהלי הפה pipetting סטנדרטיים או באמצעים אחרים של שאיפת ביצית, לאסוף את כל הביציות שמוקפות 2 שכבות או יותר של תאי קומולוס קומפקטיים. העבר את COC של למנה חדשה ולדגור על 37 מעלות צלזיוס במשך שעה 1.
- מוציא בזהירות את תאי קומולוס מקיפים על ידי pipetting העדין חזר עם טפטפת מיליליטר 1 מוגדר שאיפת נפח של 750 μl. חזור על שלב pipetting כ -12 פעמיםולאפשר לביציות להתאושש במשך 5 דקות. המשך בדרך זו עד שרוב תאי קומולוס הוסרו או כל. מעבירים את הביציות הערומות למנת תרבות אחרת ולאפשר לאזן על 37 מעלות צלזיוס במשך 15 דקות.
- להקצות את הביציות הערומות לשלוש קבוצות ניסוי שישמש ל: microinjection (i) של siRNAs הספציפי נגד היעד של עניין, (ii) microinjection של siRNAs נוקבים (שליטה), וכן (iii) קבוצת ביקורת-מוזרק אינה כדי להסביר תנאי תרבות.
3. הביצית Microinjection
- הגדרת תרבות מנות עם 3 מיליליטר תקשורת M2 בתוספת milrinone (1 מיקרוגרם / מיליליטר) לmicroinjection ביצית. להכין מנות תרבות המכילות ממ / BSA / milrinone לשטיפה והתרבות הבאה של ביציות מוזרקות.
הערה: בינוני M2 מכיל HEPES חיץ ודורש התחממות מראש על 37 מעלות צלזיוס למשך 15 דקות בתנאים אטמוספריים. ממ דורש התחממות מראש ואיזון באמצעות גז רפואי כלתארד לעיל. - הכן את מערכת microinjection. טען את מחט הזריקה עם 5 μl של פתרון siRNA ספציפי 1 מיקרומטר. Secure פיפטה האחזקה ומחט זריקה לmicromanipulators של מערכת microinjection והקים את יחידת ההזרקה עם נפח ולחץ מכוילים.
- הנח מיקרו טיפת 200 μl של תקשורת M2 בצד הפנימי של המכסה של צלחת תרבות 3 סנטימטר ולהוסיף ביצית להתקנה וליישור של מערכת microinjection.
- שימוש בביצית כמדריך, להתאים את העמדות של מחטי האחזקה והזרקה. החל לחץ שלילי לפיפטה ההחזקה לאבטח בעדינות את הביצית ולהתאים את המיקום של מחט הזריקה לקוטר הרחב ביותר של התא. התאם את הגדרות כדי לאפשר microinjection של כ 10 pl של פתרון siRNA בכל מקום לתוך הציטופלסמה הביצית.
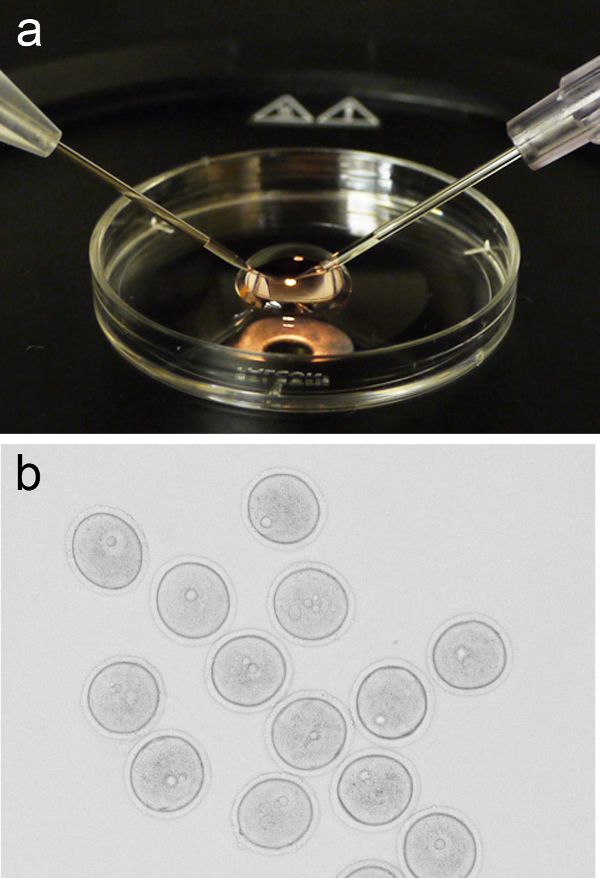
microinjection 1. ביצית איור להגדיר. ( תמונה) נציג של מיקרו-טיפת 200 μl של תקשורת M2 ממוקמת על המכסה מצלחת תרבות 3 סנטימטר, עם מחט פיפטה האחזקה והזרקה ממוקמת על ימין ועל השמאל, בהתאמה. (ב) קבוצה של prophase-עצרתי ביציות (GV-שלבים) לפני microinjection. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו. - החזר את המכסה לשלב סטראו ולהוסיף מיקרו-טיפת 200 μl של תקשורת M2 הטרי. להוסיף קבוצה של ביציות (~ 10) למייקרו-הטיפה על ידי הפה pipetting, או שיטות חלופיות, ואז לחזור למכסה עם מיקרו-טיפה לבמה microinjection.
- המשך microinject הביציות בודדות. Secure ביצית אחת עם פיפטה מחזיקה, הכנס באיטיות את קצה מחט ההזרקה לתוך הציטופלסמה ולגרש את עוצמת הזריקה של פתרון siRNA. לחזור מחט הזריקה ומו בזהירותיש ביצית שהוחדרו לעמדה בתחתית מיקרו הטיפה. הזז ביציות מוזרקות ללא הצלחה עמדה בראש מיקרו הטיפה.
- חזור על תהליך microinjection עם כל ביצית. כדי לשמור על כדאיות ביצית אופטימלית, microinject רק מספר קטן של ביציות בכל פעם. ודא שתהליך זה לא לוקח יותר מכמה דקות כדי למנוע טמפרטורה ו- pH שינויים במייקרו-הטיפה.
- לשאוב ביציות מוזרקות בהצלחה או להעביר בזהירות את המכסה עם מיקרו-הטיפה של ביציות הזריקו לסטראו. מעבירים את ביציות קיימא מוזרקים על ידי הפה pipetting או שיטות חלופיות, לממ / BSA בינוני / milrinone לשטוף ולאזן על 37 מעלות צלזיוס.
- שימוש בקבוצה אחרת של ביציות, לחזור על תהליך microinjection עם מחט זריקה חדשה עמוסה siRNAs שאינו ספציפי לקבוצת הביקורת. שטוף את הביציות בממ / BSA / milrinone והעברה לצלחת תרבות נפרדת.
- תרבות כל הקבוצות שלביציות במשך 24 שעות בממ / BSA / milrinone על 37 מעלות צלזיוס באווירה של גז רפואי.
הערה: תקופת התרבות 'בלוק milrinone' נחוצה לדלדול mRNA / חלבון מטרה יעילה.
4. ביצית תרבות להבשלת meiotic
- יום 4: לכל קבוצת ניסוי של ביציות הגדרת 4 מנות תרבות (35 מ"מ) עם 3 מיליליטר ממ / BSA. להשלים מנה אחת לכל קבוצת תקשורת עם 10% בסרום שור עוברי (באיכות גבוהה) (FBS) לשימוש עבור הבשלת ביצית. אפשר את כל מנות התרבות לאזן על 37 מעלות צלזיוס עם תערובת גז רפואית.
- לשחרר ביציות מ'בלוק milrinone ', ברצף לשטוף את הביציות שלוש פעמים במנות המכילות ממ / BSA ולאחר מכן להעביר את הביציות לצלחת ההתבגרות מכילה תקשורת עם 10% FBS. תרבות כל קבוצות הביצית במשך 17 שעות על 37 מעלות צלזיוס, כדי לאפשר חידוש והתקדמות של מיוזה.
- פתרונות היכונו fixa ביצית: יום 5tion, כולל: paraformaldehyde 4% (PFA) במאגר PEM (i) (100 צינורות מ"מ [pH 6.9], 1 מ"מ MgCl 2, 1 מ"מ EGTA) עם 0.5% Triton-X 100, וכן (ii) PBS בתוספת 5 FBS% שישמש כדי לשטוף ולחסום את הביציות.
הערה: פתרונות אלה דורשים מראש התחממות עד 37 מעלות צלזיוס לפני קיבוע ביצית. - לקיבעון ביצית (אחרי תרבות 17 שעות), במהירות להעביר את כל קבוצת ניסוי של ביציות על ידי הפה pipetting או שיטות חלופיות לבארות בודדות (של צלחת 4 היטב) המכיל 750 μl של טרום חימם 4% פתרון PFA ולדגור על 37 ° צלזיוס במשך שעה 1. בהמשך לכך לשטוף כל קבוצה של ביציות 3 פעמים (15 דקות כל אחד) ב -750 μl של PBS מראש חימם המכיל 5% FBS.
- ביציות בלוק בPBS / 5% FBS O / N 200 μl ב 4 ° C כדי למזער נוגדנים נוקבים מחייבות.
ניתוח 5. Immunofluorescence
- יום 6:
הערה: Immunostaining נעשה בצלחת רב גם וOOCytes מועברים באופן סדרתי לבארות רציפות, המכיל פתרונות נוגדן ולשטוף בהתאמה. או יכולים לשמש 48 או 96-גם צלחות, פשוט להתאים את הפתרון המבוסס על נפח גודל היטב. ל96-גם צלחות להשתמש 200 μl בכל טוב. ביציות מועברות לפתרונות השונים לפי הסדר הבא: פתרון נוגדן ראשוני - 3 בארות לשטוף - פתרון נוגדנים משני - 3 בארות לשטוף. כדי להגביל את החשיפה לאור הצלחת יכולה להיות מכוסות בנייר כסף.
הכן FBS / 5% הטריים PBS ולהשתמש בפתרון זה כדי להכין דילולים נוגדן (למשל, אנטי-pericentrin ארנב (1/1000), אנטי-טובולין עכבר (1/1000)). - מעבירים את הביציות קבועות של כל קבוצת ניסוי לבארות בודדות המכילות 200 μl (או 100 μl, אם פחות נפח רצוי) של פתרון הנוגדן הראשוני ולכסות היטב עם parafilm. דגירה על פי תנאי נוגדן ספציפי אופטימליים (למשל, C ° 37 עבור שעה 1, או 4 ° CO / N).
הערה: dilutio נוגדן ראשוניn כמו גם זמן דגירה ספציפי וטמפרטורה דורשים בדיקות כדי לקבוע את התנאים אופטימליים לנוגדנים שונים בשימוש. - לאחר דגירה עם הנוגדן הראשוני, לשטוף את הביציות שלוש פעמים PBS / 5% FBS (10-15 דקות כל אחד).
- מעבירים את הביציות לתמיסה המכילה נוגדנים משני fluorescently- מצומדות (למשל, 1 / 1,000 דילול של נוגדנים נגד ארנב ואנטי עכבר מצומדות עם fluorochromes של אורכי גל שונים). דגירה עבור שעה 1 על 37 מעלות צלזיוס.
- שטוף את הביציות שלוש פעמים PBS / 5% FBS (10 - 15 דקות כל אחד).
- לאחר השלב לשטוף הסופי, להעביר את הביציות על גבי זכוכית נקייה ולשאוב בעדינות כל פתרון לשטוף עודף. זה יהיה לשתק את הביציות על משטח הזכוכית. הוסף 8 μl של ההרכבה תקשורת (המכיל DAPI) וכיסוי בזהירות תקשורת ההרכבה עם כיסוי להחליק x 22 מ"מ 22 מ"מ. מנמיכים את coverslip לאט, כדי למנוע השמנה בועות אוויר ו / או נזק לביציות.
הערה: לחלופין, כדי לשמור על תכונות 3-מימדית של הביצית לניתוח מיקרוסקופיה confocal, להוסיף נפח קטן של 100 חרוזי זכוכית מיקרומטר (מעורבים עם וזלין) לפינות להחליק את המכסה לפני ההרכבה בשקופית. - שקופיות חנות ב 4 מעלות צלזיוס, או להמשיך להערכת התקדמות meiotic כמו גם הניתוח של רמות ביטוי ולוקליזציה חלבון subcellular באמצעות מיקרוסקופ פלואורסצנטי מצויד במסננים יש צורך להתאים את הנוגדנים משני בשימוש.
תוצאות
Microinjection של siRNAs מספק גישה יעילה לשפלת mRNA ודלדול חלבון שלאחר מכן בביציות, המאפשר בדיקה פונקציונלית יעילה ומאוד ספציפית של גורמי יעד שונים במבחנה. בהמשך לכך, immunofluorescence משמש לניתוח פנוטיפ ספציפי, כמו גם כדי לאמת את דלדול חלבון בביציות מוזרק siRNA. בדוגמא הנוכחית, תיוג ?...
Discussion
אמנם יש מספר שיטות להעברת חומצות גרעין אקסוגניים לתאים סומטיים, כגון electroporation וtransfection, microinjection הוא השיטה האופטימלית עבור משלוח של מולקולות RNA לביציות עכבר תעתיק שקטות. הפרוטוקול הנוכחי מספק גישה יעילה לדלדול במבחנה של mRNAs הספציפי המאפשר בדיקה הפונקציונלית של צי...
Disclosures
The authors have nothing to disclose
Acknowledgements
This research was supported in part by the University of Georgia, and a grant (HD071330) from the National Institutes of Health to MMV.
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Pregnant Mare's Serum Gonadotropin (PMSG) | EMD Biosciences | 367222 | |
| Minimal Essential Medium (MEM) | *Recipe outlined in Table 1 | ||
| Earle's Balanced Salt Solution (10x) | Sigma | E-7510 | |
| Sodium Bicarbonate | Sigma | S-5761 | |
| Pyruvic Acid, sodium salt | Sigma | P-5280 | |
| Penicillin G, potassium salt | Sigma | P-7794 | |
| Streptomycin Sulfate | Sigma | S-9137 | |
| L-Glutamine | Sigma | G-8540 | |
| EDTA, disodium salt dihydrate | Sigma | E-4884 | |
| Essential Amino Acids (50x) | Gibco | 11130-051 | |
| MEM Vitamin Mixture (100x) | Sigma | M-6895 | |
| Phenol Red solution | Sigma | P-0290 | |
| Bovine Serum Albumin (BSA) | Sigma | A1470 | |
| Milrinone | Sigma | M4659 | |
| Fetal Bovine Serum (FBS) | Hyclone | SH30070.01 | |
| EmbryoMax M2 Media with Hepes | EMD Millipore | MR-015-D | |
| siRNAs targeting Pericentrin | Qiagen | GS18541 | |
| Negative control siRNAs | Qiagen | SI03650318 | |
| Paraformaldehyde (16% solution) | Electron Microscopy Sciences | 15710 | |
| Triton-X | Sigma | T-8787 | |
| Phosphate Buffered Saline (PBS) | Hyclone | SH30028.02 | |
| Anti-Pericentrin (rabbit) | Covance | PRB-432C | |
| Anti-acetylated a-tubulin (mouse) | Sigma | T-6793 | |
| Goat anti-rabbbit Alexa Fluor 488 | Invitrogen | A-21430 | |
| Goat anti -mouse Alexa Fluor 555 | Invitrogen | A-11017 | |
| Major Equipment | |||
| Stereomicroscope (SMZ 800) | Nikon | ||
| Upright Fluorescent Microscope | Leica Microsystems | ||
| Inverted Microscope | Nikon | ||
| Femtojet Micro-injections System | Eppenforf | ||
| Micro manipulators | Eppendorf | ||
| Micro-injection needles (femtotips) | Eppendorf | 930000035 | |
| Holding pipettes (VacuTip) | Eppendorf | 930001015 | |
| Plasticware | |||
| 35 mm culture dishes | Corning Life Sciences | 351008 | |
| 4-well plates | Thermo Scientific | 176740 | |
| 96 well plates | Corning Life Sciences | 3367 | |
| 0.45 mm CA Filter System | Corning Life Sciences | 430768 |
References
- Nagaoka, S. I., Hassold, T. J., Hunt, P. A. Human aneuploidy: mechanisms and new insights into an age-old problem. Nat Rev Genet. 13 (7), 493-504 (2012).
- Hassold, T. J., Hunt, P. A. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Szollosi, D., Calarco, P., Donahue, R. P. Absence of Centrioles in the First and Second Meiotic Spindles of Mouse Oocytes. J Cell Sci. 11 (2), 521-541 (1972).
- Manandhar, G., Schatten, H., Sutovsky, P. Centrosome Reduction During Gametogenesis and Its Significance. Biol Reprod. 72 (1), 2-13 (2005).
- Zimmerman, W. C., Sillibourne, J., Rosa, J., Doxsey, S. J. Mitosis-specific anchoring of gamma tubulin complexes by pericentrin controls spindle organization and mitotic entry. Mol Biol Cell. 15 (8), 3642-3647 (2004).
- Ma, W., Baumann, C., Viveiros, M. M. NEDD1 is crucial for meiotic spindle stabilty and accurate chromosome segregation in mammalian oocytes. Dev Biol. 339 (439-450), (2010).
- Ma, W., Viveiros, M. M. Depletion of pericentrin in mouse oocytes disrupts microtubule organizing center function and meiotic spindle organization. Mol Reprod Dev. 81 (11), 1019-1029 (2014).
- Bouniol-Baly, C., et al. Differential Transcriptional Activity Associated with Chromatin Configuration in Fully Grown Mouse Germinal Vesicle Oocytes. Biol Reprod. 60 (3), 580-587 (1999).
- De La Fuente, R., Eppig, J. J. Transcriptional Activity of the Mouse Oocyte Genome: Companion Granulosa Cells Modulate Transcription and Chromatin Remodeling. Dev Biol. 229 (1), 224-236 (2001).
- Hodgman, R., Tay, J., Mendez, R., Richter, J. D. CPEB phosphorylation and cytoplasmic polyadenylation are catalyzed by the kinase IAK1/Eg2 in maturing mouse oocytes. Development. 128 (14), 2815-2822 (2001).
- De La Fuente, R. Chromatin modifications in the germinal vesicle (GV) of mammalian oocytes. Dev Biol. 292 (1), 1-12 (2006).
- Wianny, F., Zernicka-Goetz, M. Specific interference with gene function by double-stranded RNA in early mouse development. Nat Cell Biol. , 270-275 (2000).
- Svoboda, P., Stein, P., Hayashi, H., Schultz, R. M. Selective reduction of dormant maternal mRNAs in mouse oocytes by RNA interference. Development. 127 (19), 4147-4156 (2000).
- Svoboda, P. Renaissance of mammalian endogenous RNAi. FEBS Letters. 588 (15), 2550-2556 (1016).
- Behringer, R., Gertsenstein, M., Nagy, K., Nagy, A. . Manipulating the Mouse Embryo: A Laboratory Manual. , (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved