Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Мейоза шпинделя оценка в мышь ооцитов по миРНК-обеспечиваемого молчания
В этой статье
Резюме
Здесь мы приводим протокол для конкретного миРНК опосредованного мРНК истощения с последующим анализом иммунофлуоресценции оценить мейоза сборку и организацию шпинделя в ооцитах мыши. Этот протокол предназначен для разрушения в пробирке транскриптов и функциональной оценке различного шпинделя и / или ЦОМТ факторов, ассоциированных в ооцитах.
Аннотация
Errors in chromosome segregation during meiotic division in gametes can lead to aneuploidy that is subsequently transmitted to the embryo upon fertilization. The resulting aneuploidy in developing embryos is recognized as a major cause of pregnancy loss and congenital birth defects such as Down’s syndrome. Accurate chromosome segregation is critically dependent on the formation of the microtubule spindle apparatus, yet this process remains poorly understood in mammalian oocytes. Intriguingly, meiotic spindle assembly differs from mitosis and is regulated, at least in part, by unique microtubule organizing centers (MTOCs). Assessment of MTOC-associated proteins can provide valuable insight into the regulatory mechanisms that govern meiotic spindle formation and organization. Here, we describe methods to isolate mouse oocytes and deplete MTOC-associated proteins using a siRNA-mediated approach to test function. In addition, we describe oocyte fixation and immunofluorescence analysis conditions to evaluate meiotic spindle formation and organization.
Введение
Мейоз является уникальным процессом деления, что происходит в гамет (яйцеклеток и сперматозоидов) и включает в себя два последовательных деления, не вмешиваясь синтез ДНК, чтобы отделить гомологичные хромосомы и сестринские хроматиды во время мейоза-I и мейоз-II, соответственно 1. Ошибки в сегрегации хромосом во время деления мейоза ооцитов может привести к анеуплоидии, которые наследуется эмбриона во время оплодотворения. Примечательно, что заболеваемость анеуплоидии в развивающихся эмбрионов увеличивается с продвижения материнского возраста и является основной причиной врожденных врожденных дефектов, а также потери беременности у женщин 1,2, таким образом, подчеркивает важную необходимость, чтобы понять молекулярную основу анеуплоидии во деления мейоза ,
Во время деления клетки, расхождение хромосом в решающей степени зависит от комплектации аппарата микротрубочек веретена и установления стабильных хромосомных из микротрубочек взаимодействий для правильного крепления к противоположной шпинделяполюса. Важно отметить, что формирование мейоза шпинделя в ооцитах млекопитающих отличается от митоза в соматических клетках, и регулируется уникальных микротрубочек организации центров (MTOCs), которые не имеют центриолей 3,4. Основные белки, необходимые для нуклеации микротрубочек и организации локализуются в ооцитов MTOCs, в том числе гамма-тубулина, который катализирует сборку микротрубочек. Кроме того, pericentrin функций, как одного из важнейших строительных лесов белка, который связывает и анкеров гамма-тубулина, а также других факторов на MTOCs 5. Примечательно, наши исследования показывают, что истощение основных ЦОМТ связанных белков нарушает мейоза организации шпинделя и приводит к ошибкам хромосом в ооцитах, которые не в полной мере решены путем сборки веретена контрольно-пропускном пункте (SAC) 6,7. Таким образом, дефекты в шпинделя стабильности, которые не вызывают задержку мейоза, представляют собой значительный риск в содействии анеуплоидии. Несмотря на их существенную роль в сборке и шпинделя организации, ооцитов MTOC протЭйн состав и функции еще недостаточно изучена.
Тестирование функции специфических белков-мишеней в ооцитах млекопитающих является сложной задачей, так как клетки становятся транскрипционно покоя незадолго до возобновления мейоза 8,9. Следовательно, предовуляторного ооциты полагаться на материнской магазинах мРНК возобновить мейоз и поддерживать деления мейоза, а также первых делений дробления после оплодотворения 10,11. Эффективность РНК-интерференции (RNAi), опосредованной деградации мРНК транскриптов в ооцитах млекопитающих хорошо известна и материнской РНК завербованные для перевода во время мейоза созревания особенно поддаются миРНК ориентации 12-14. Таким образом, микроинъекции коротких интерферирующих РНК (миРНК) в ооциты предоставляет ценную подход к истощению целевых мРНК для функционального тестирования.
Здесь мы опишем методы для выделения ооцитов мыши и миРНК опосредованного истощения конкретных transcriPTS, чтобы проверить функцию важного ЦОМТ связанного белка, pericentrin. Кроме того, описаны условия анализа иммунофлуоресцентных оценить мейоза образование шпинделя в ооциты.
протокол
Этот протокол был одобрен уходу и использованию комитета Институциональные животных (IACUC) в университете Грузии.
1. Подготовка
- Для ооцитов культуры, приобретение или только приготовить минимальной необходимой среде (MEM), и дополнить 3 мг / мл бычьего сывороточного альбумина (БСА), как показано в таблице 1. Поместите бутылку из полистирола на балансировку загрузки (тары к нулю). Добавить все реагенты, кроме BSA, в порядке и воспитывать конечного объема с MQ-воде по весу в общей сложности 250 г. Затем добавить BSA, позволяют растворить и стерилизовать фильтр.
Примечание: Описанный МЕМ среды требует для уравновешивания и инкубации клеток с медицинской газовой смеси 5% CO 2, 5% O 2 и 90% N 2. Тем не менее, другие средства массовой информации (например, CZB) могут быть использованы, которые позволяют для инкубации клеток в 5% CO 2 в атмосферных условиях. - Для ооцитов микроинъекции, купить или приготовить M2 среду.
- Подготовьте рпреобладающий кобылье сыворотки гонадотропин (PMSG) в концентрации 5 МЕ / 100 мкл.
- Покупка и восстановить запасы миРНК в рабочей концентрации 1 мкМ.
2. Мышь ооцитов Коллекция
- ДЕНЬ 1: стимулировать развитие фолликула и увеличить число предовуляторного фолликулов, управлять 5 МЕ ГСЖК внутрибрюшинно самкам мышей 48 ч до сбора яйцеклеток.
- ДЕНЬ 3: Для сбора и культуры ооцитов, настроить 35 мм культуры блюда с 3 мл MEM / BSA с добавлением 1 мкг / мл милринон. Это ингибитор фосфодиэстеразы поддерживает ооцитов в профазе-я арестую и предотвращает срыв зародышевого пузырька (GVBD). Равновесие культуру блюда в медицинской газовой смеси, по крайней мере 15 мин.
Примечание: Милринон дополнить СМИ, на всем протяжении ооцитов коллекции, а также ооцитов микроинъекции и 24 ч культура удержания период поста миРНК. - Получить яичники из самок мышей, используя установленную лабораторию практикует 15 и передать на новое блюдо культуры с предварительно нагретой и уравновешивают MEM / BSA / милринон.
- Место культуры блюдо на стадии стереомикроскопом для сбора ооцитов. Релиз кучевые-ооцитов-комплексы (КОК в) вручную пробивани антральных фолликулов с 27 г хвои. Исправление один яичник на дно чашки для культивирования, с 27 г иглы, прикрепленной к 1 мл шприца, и использовать вторую иглу, чтобы проколоть все крупных фолликулов. Повторите для каждого яичника.
- Используя стандартные процедуры рот пипетки или другие средства ооцитов стремление, собрать все ооциты, окруженные 2 или более слоев компактных кучевые клеток. Перевести КОК, чтобы новое блюдо и инкубировать при 37 ° С в течение 1 ч.
- Осторожно снимите окружающие клетки от кучевые повторного осторожно пипеткой с 1 мл пипетки, установленной на объем аспирации 750 мкл. Повторите шаг пипетки около 12 рази позволяют ооциты, чтобы восстановить в течение 5 мин. Продолжайте в том же порядке, пока все или большинство из кучевых клеток были удалены. Передача оголенных ооцитов в другую чашку для культивирования и позволяют прийти в равновесие при 37 ° С в течение 15 мин.
- Выделяют оголенных ооцитов на три экспериментальные группы, которые будут использоваться для: (I) микроинъекции конкретных миРНК против мишени интерес, (II) микроинъекции неспецифических (контроль) киРНК, и (III) не-вводили контрольной группе, чтобы учесть Условия культивирования.
3. Яйцеклетка Микроинъекция
- Настройка культуральные чашки с 3 мл М2 среде с Milrinone (1 мкг / мл) в течение ооцитов микроинъекции. Подготовка культуры блюд, содержащих MEM / BSA / милринон для мытья и последующего культуры вводили ооцитов.
Примечание: М2 среда содержит буфер HEPES и требует предварительного нагрева при температуре 37 ° С в течение 15 мин при атмосферных условиях. MEM требует предварительной потепление и уравновешивание с помощью медицинской газа, как описаноD выше. - Подготовка системы микроинъекции. Загрузка инъекционную иглу 5 мкл 1 мкМ раствора киРНК конкретного. Обеспечения проведения пипетки и иглу для микроманипуляторами системы микроинъекции и настроить узел впрыска с калиброванного объема и давления.
- Поместите 200 мкл микро-капли М2 СМИ на внутренней стороне крышки 3 см культуры блюдо и добавить яйцеклетки для установки и выравнивания системы микроинъекции.
- Использование яйцеклетки в качестве руководства, отрегулировать положение холдинговых и инъекционных игл. Применение отрицательного давления к удерживающей пипеткой осторожно закрепить ооциты и отрегулировать положение инъекционной иглы к наибольшему диаметру клетки. Настройте параметры, чтобы микроинъекции примерно 10 мкл на миРНК решения в любом месте в цитоплазме ооцита.
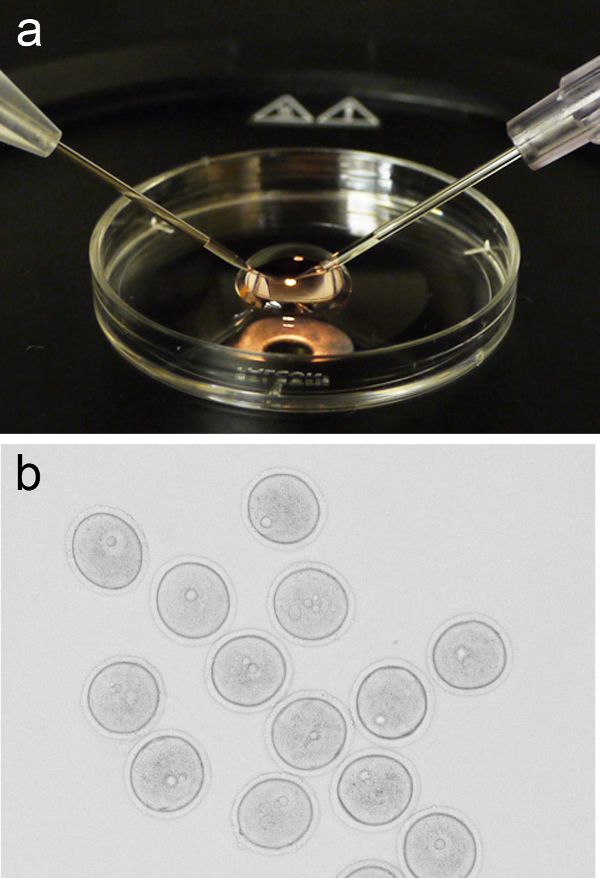
Рисунок 1. Яйцеклетка микроинъекции настроить. ( А) представитель образ 200 мкл микро-капли М2 СМИ размещены на крышке от 3 см блюдо культуры, с проведением пипетки и инъекционной иглой, расположенной на левой и правой, соответственно. (Б) Группа профаза-я арестован ооцитов (GV-этап) до микроинъекции. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры. - Верните крышку на сцену стереомикроскопа и добавить 200 мкл микро-капли свежего М2 СМИ. Добавить группу ооцитов (~ 10) в микро-капли в рот пипеткой, или альтернативных методов, а затем вернуться крышку с микро-капли на сцену микроинъекции.
- Приступить к microinject отдельные ооциты. Безопасный одну яйцеклетку с холдингом пипетки, медленно вставьте кончик инъекционной иглой в цитоплазму и изгнать объем впрыска раствора миРНК. Тщательно убрать иглу для инъекций и МОве вводят яйцеклетки в положение в нижней части микро-капли. Перемещение безуспешно инъекционные ооцитов в положение, в верхней части микро-капли.
- Повторите процедуру микроинъекции с каждым яйцеклетки. Для поддержания оптимального жизнеспособности яйцеклетки, microinject лишь небольшое число яйцеклеток одновременно. Убедитесь, что этот процесс не займет более нескольких минут, чтобы предотвратить температуры и рН изменения в микро-капли.
- Аспирируйте успешно вводят ооцитов или тщательно перемещать крышку с микро-капли вводили ооцитов к стереомикроскопа. Передача инъекционные жизнеспособных яйцеклеток в рот пипеткой или альтернативных методов, чтобы MEM / BSA / Milrinone среду для мытья и равновесия при 37 ° С.
- Используя другую группу ооцитов, повторить процесс микроинъекции с новой инъекционной иглой с грузом неспецифических миРНК для контрольной группы. Вымойте ооцитов в MEM / BSA / милринон и передачи в отдельную чашку для культивирования.
- Культура все группыооцитов в течение 24 ч в MEM / BSA / милринон при 37 ° С в атмосфере медицинской газа.
Примечание: 'милринон блок "период культура необходима для истощения мРНК / белка эффективность целевой.
4. яйцеклеток Культура для мейотических созревания
- ДЕНЬ 4: Для каждой экспериментальной группы ооцитов настройки 4 культуры блюда (35 мм) с 3 мл MEM / BSA. Дополнение один СМИ блюдо на группу с 10% (высокое качество) эмбриональной телячьей сыворотки (FBS), чтобы использовать для созревания ооцитов. Разрешить все культуральные чашки для уравновешивания при 37 ° С в медицинской газовой смеси.
- Чтобы освободить ооцитов от "Milrinone блока", последовательно мыть ооцитов три раза в блюдах, содержащих MEM / BSA, а затем передать ооцитов к созреванию блюдо с СМИ с 10% FBS. Культура все группы ооцитов в течение 17 ч при 37 ° С, для того, чтобы возобновить и прогрессирование мейоза.
- День 5: Подготовка решения для ооцитов FIXaции, в том числе: (I) 4% параформальдегида (PFA) в PEM буфера (100 мМ ТРУБЫ [рН 6,9], 1 мМ MgCl 2, 1 мМ EGTA) с 0,5% Тритон-X 100, и (II) ФБР с добавкой 5 % FBS, которые будут использоваться для мытья и блокировать ооцитов.
Примечание: Эти решения требуют предварительного нагрева до 37 ° С до ооцитов фиксации. - Для ооцитов фиксации (после 17 ч культуры), быстро передавать каждой экспериментальной группы ооцитов в рот пипеткой или альтернативных методов в отдельных скважинах (в блюдо 4-а), содержащего 750 мкл предварительно нагревают 4% раствор PFA и инкубировать при 37 ° C в течение 1 часа. Впоследствии мыть каждую группу ооцитов 3 раза (15 мин каждый) в 750 мкл подогретого PBS, содержащего 5% FBS.
- Блок ооциты в 200 мкл PBS / FBS 5% O / N при 4 ° С для минимизации неспецифического связывания антитела.
5. Анализ Иммунофлуоресценции
- ДЕНЬ 6:
Примечание: иммунное окрашивание делается в нескольких луночного планшета и OOCytes серийно передается последовательных скважин, содержащий соответствующие антитела и мыть решения. Либо 48 или 96-луночные планшеты могут быть использованы, просто отрегулировать громкость решение на основе хорошо размера. Для 96-луночных планшетах использовать 200 мкл на лунку. Яйцеклетки передаются различных решений в следующем порядке: решения первичных антител - 3 мыть скважин - раствор вторичного антитела - 3 мыть скважин. Чтобы ограничить освещенность пластина может быть покрыта пленкой.
Приготовьте свежий PBS / FBS в 5% и использовать это решение для приготовления антител разведений (например, кролика против pericentrin (1/1000), мышиного анти-тубулина (1/1000)). - Передача фиксированных ооцитах каждой экспериментальной группы на отдельные лунки, содержащие 200 мкл (или 100 мкл, если меньше объема желательна) раствора первичных антител и покрывают скважины парафином. Инкубируйте в соответствии с оптимальными условиями антител специфических (например, 37 ° С в течение 1 ч, или 4 ° CO / N).
Примечание: Первичный dilutio антителп, а также определенное время инкубации и температуры требуется тестирование, чтобы определить оптимальные условия для различных антител, используемых. - После инкубации с первичными антителами, мыть ооцитов три раза в PBS / FBS 5% (10-15 мин каждый).
- Передача ооцитов в раствор, содержащий флуоресцентно-конъюгированные вторичные антитела (например, 1/1 000 разбавление анти-кролик и анти-мышь антитела, конъюгированного с флюорохромами различных длин волн). Инкубируют в течение 1 ч при 37 ° С.
- Вымойте ооцитов три раза в PBS / 5% FBS (10 - 15 минут каждый).
- После окончательного стадии промывки, передавать ооциты на чистую предметное стекло и осторожно аспирации излишки промывочного раствора. Это иммобилизации ооцитов на поверхности стекла. Добавить 8 мкл монтажа СМИ (содержащий DAPI) и тщательно накладывать монтажную СМИ с 22 мм х 22 мм покровным. Опустите покровное медленно, чтобы избежать образования пузырьков и / или повреждения ооцитов.
Примечание: В качестве альтернативы, для поддержания 3-мерного свойства ооцита для конфокальной микроскопии анализа, добавить небольшой объем 100 мкм стеклянных бусин (в смеси с вазелином) к углам покровного стекла перед монтажом на слайде. - Хранить слайды при 4 ° С, или перейти к оценке мейоза прогрессии, а также анализа уровней экспрессии и локализации белка субклеточном использованием флуоресцентного микроскопа оснащен необходимыми фильтрами, чтобы соответствовать вторичных антител использовали.
Результаты
Микроинъекция миРНК обеспечивает эффективный подход к деградации мРНК и последующего истощения белка в ооцитах, что позволяет эффективно и высоко специфический функциональное тестирование различных целевых факторов в пробирке. Впоследствии, иммунофлюоресценции используется ?...
Обсуждение
В то время как существует несколько методов экзогенной передачи нуклеиновой кислоты в соматических клетках, таких как электропорация и трансфекции, микроинъекции является оптимальным способом доставки молекул РНК в транскрипционно молчащих ооцитов мыши. Текущий протокол обеспечив?...
Раскрытие информации
The authors have nothing to disclose
Благодарности
This research was supported in part by the University of Georgia, and a grant (HD071330) from the National Institutes of Health to MMV.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Pregnant Mare's Serum Gonadotropin (PMSG) | EMD Biosciences | 367222 | |
| Minimal Essential Medium (MEM) | *Recipe outlined in Table 1 | ||
| Earle's Balanced Salt Solution (10x) | Sigma | E-7510 | |
| Sodium Bicarbonate | Sigma | S-5761 | |
| Pyruvic Acid, sodium salt | Sigma | P-5280 | |
| Penicillin G, potassium salt | Sigma | P-7794 | |
| Streptomycin Sulfate | Sigma | S-9137 | |
| L-Glutamine | Sigma | G-8540 | |
| EDTA, disodium salt dihydrate | Sigma | E-4884 | |
| Essential Amino Acids (50x) | Gibco | 11130-051 | |
| MEM Vitamin Mixture (100x) | Sigma | M-6895 | |
| Phenol Red solution | Sigma | P-0290 | |
| Bovine Serum Albumin (BSA) | Sigma | A1470 | |
| Milrinone | Sigma | M4659 | |
| Fetal Bovine Serum (FBS) | Hyclone | SH30070.01 | |
| EmbryoMax M2 Media with Hepes | EMD Millipore | MR-015-D | |
| siRNAs targeting Pericentrin | Qiagen | GS18541 | |
| Negative control siRNAs | Qiagen | SI03650318 | |
| Paraformaldehyde (16% solution) | Electron Microscopy Sciences | 15710 | |
| Triton-X | Sigma | T-8787 | |
| Phosphate Buffered Saline (PBS) | Hyclone | SH30028.02 | |
| Anti-Pericentrin (rabbit) | Covance | PRB-432C | |
| Anti-acetylated a-tubulin (mouse) | Sigma | T-6793 | |
| Goat anti-rabbbit Alexa Fluor 488 | Invitrogen | A-21430 | |
| Goat anti -mouse Alexa Fluor 555 | Invitrogen | A-11017 | |
| Major Equipment | |||
| Stereomicroscope (SMZ 800) | Nikon | ||
| Upright Fluorescent Microscope | Leica Microsystems | ||
| Inverted Microscope | Nikon | ||
| Femtojet Micro-injections System | Eppenforf | ||
| Micro manipulators | Eppendorf | ||
| Micro-injection needles (femtotips) | Eppendorf | 930000035 | |
| Holding pipettes (VacuTip) | Eppendorf | 930001015 | |
| Plasticware | |||
| 35 mm culture dishes | Corning Life Sciences | 351008 | |
| 4-well plates | Thermo Scientific | 176740 | |
| 96 well plates | Corning Life Sciences | 3367 | |
| 0.45 mm CA Filter System | Corning Life Sciences | 430768 |
Ссылки
- Nagaoka, S. I., Hassold, T. J., Hunt, P. A. Human aneuploidy: mechanisms and new insights into an age-old problem. Nat Rev Genet. 13 (7), 493-504 (2012).
- Hassold, T. J., Hunt, P. A. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2 (4), 280-291 (2001).
- Szollosi, D., Calarco, P., Donahue, R. P. Absence of Centrioles in the First and Second Meiotic Spindles of Mouse Oocytes. J Cell Sci. 11 (2), 521-541 (1972).
- Manandhar, G., Schatten, H., Sutovsky, P. Centrosome Reduction During Gametogenesis and Its Significance. Biol Reprod. 72 (1), 2-13 (2005).
- Zimmerman, W. C., Sillibourne, J., Rosa, J., Doxsey, S. J. Mitosis-specific anchoring of gamma tubulin complexes by pericentrin controls spindle organization and mitotic entry. Mol Biol Cell. 15 (8), 3642-3647 (2004).
- Ma, W., Baumann, C., Viveiros, M. M. NEDD1 is crucial for meiotic spindle stabilty and accurate chromosome segregation in mammalian oocytes. Dev Biol. 339 (439-450), (2010).
- Ma, W., Viveiros, M. M. Depletion of pericentrin in mouse oocytes disrupts microtubule organizing center function and meiotic spindle organization. Mol Reprod Dev. 81 (11), 1019-1029 (2014).
- Bouniol-Baly, C., et al. Differential Transcriptional Activity Associated with Chromatin Configuration in Fully Grown Mouse Germinal Vesicle Oocytes. Biol Reprod. 60 (3), 580-587 (1999).
- De La Fuente, R., Eppig, J. J. Transcriptional Activity of the Mouse Oocyte Genome: Companion Granulosa Cells Modulate Transcription and Chromatin Remodeling. Dev Biol. 229 (1), 224-236 (2001).
- Hodgman, R., Tay, J., Mendez, R., Richter, J. D. CPEB phosphorylation and cytoplasmic polyadenylation are catalyzed by the kinase IAK1/Eg2 in maturing mouse oocytes. Development. 128 (14), 2815-2822 (2001).
- De La Fuente, R. Chromatin modifications in the germinal vesicle (GV) of mammalian oocytes. Dev Biol. 292 (1), 1-12 (2006).
- Wianny, F., Zernicka-Goetz, M. Specific interference with gene function by double-stranded RNA in early mouse development. Nat Cell Biol. , 270-275 (2000).
- Svoboda, P., Stein, P., Hayashi, H., Schultz, R. M. Selective reduction of dormant maternal mRNAs in mouse oocytes by RNA interference. Development. 127 (19), 4147-4156 (2000).
- Svoboda, P. Renaissance of mammalian endogenous RNAi. FEBS Letters. 588 (15), 2550-2556 (1016).
- Behringer, R., Gertsenstein, M., Nagy, K., Nagy, A. . Manipulating the Mouse Embryo: A Laboratory Manual. , (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены