Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Los métodos para aguda y subaguda murino de isquemia del miembro posterior
En este artículo
Resumen
Surgical induction of hindlimb ischemia in the mouse is useful to examine angiogenesis, however this is compromised in certain inbred mouse strains that display marked ischemia-induced tissue necrosis. Methods are described to induce subacute limb ischemia using ameroid constrictors to circumvent this problem through the induction of gradual arterial occlusion.
Resumen
La enfermedad arterial periférica (PAD) es una causa importante de morbilidad y mortalidad cardiovascular en los países desarrollados, y modelos animales que se reproducen de forma fiable la enfermedad humana son necesarias para desarrollar nuevas terapias para esta enfermedad. El modelo de extremidad posterior del ratón isquemia ha sido ampliamente utilizado para este propósito, pero la práctica estándar de la inducción de isquemia del miembro aguda por la ligadura de la arteria femoral puede dar lugar a necrosis tisular sustancial, comprometer la capacidad de investigadores para estudiar las respuestas vasculares y el tejido muscular esquelético a isquemia . Un enfoque alternativo a la ligadura de la arteria femoral es la inducción de la oclusión de la arteria femoral gradual mediante el uso de constrictor ameroide. Cuando se coloca alrededor de la arteria femoral en la misma o diferentes ubicaciones como los sitios de ligación de la arteria femoral, estos dispositivos ocluyen la arteria por encima de 1 - 3 días, lo que resulta en más gradual, isquemia subaguda. Esto da como resultado la necrosis del tejido del músculo esquelético menos sustancial, which puede imitar más de cerca las respuestas observadas en la AP humano. Debido a las influencias genéticas fondo resultados tanto en los modelos de isquemia aguda y subaguda, la consideración de la cepa de ratón en estudio es importante en la elección del mejor modelo. Este artículo describe el procedimiento adecuado y la colocación anatómica de ligaduras o constrictoras AMEROID en la arteria femoral de ratón para inducir isquemia subaguda o aguda de las extremidades posteriores en el ratón.
Introducción
La enfermedad arterial periférica (PAD) es una de las principales causas de morbilidad y mortalidad cardiovascular en los países desarrollados 1. PAD resultados de la obstrucción aterosclerótica de las arterias periféricas que conduce a la isquemia de las extremidades con dolor de esfuerzo o de reposo resultante y, ocasionalmente, las úlceras y gangrena que requieren amputación de miembros que no cicatrizan. Las terapias dirigidas PAD se dirigen principalmente hacia endovascular 2 o 3 revascularización quirúrgica, ya que en esencia no existen terapias médicas eficaces 4.
Por desgracia, la revascularización es a menudo un beneficio limitado, ya que los injertos de derivación tienen altas tasas de fracaso (hasta un 50% en 5 años) 5 que son peores en algunas poblaciones (por ejemplo, fumadores, mujeres, injertos de vena safena) no 6,7. enfoques endovasculares, tales como angioplastia y colocación de stent, también se ven comprometidos por las altas tasas de reestenosis (en exceso de 50% dentro de 1 año), particularmente in femoropoplíteo enfermedad 8, aunque el uso de globos y stents liberadores de fármacos ha mejorado los resultados un tanto 9-11. Con el fin de desarrollar nuevos tratamientos para la PAD es esencial para desarrollar modelos animales que reproduzcan de forma fiable la enfermedad humana.
Hasta la fecha, el modelo más común de la EAP es el modelo de extremidad posterior isquemia (HLI), que se realiza con mayor frecuencia en los ratones 12,13. En su manifestación más común, el modelo implica la ligadura quirúrgica de la arteria femoral proximal y distal y sus intermedios ramas laterales seguido por escisión de la embarcación, dando como resultado la oclusión del flujo sanguíneo y la inducción de la isquemia de las extremidades aguda. HLI se ha utilizado principalmente para estudiar las respuestas angiogénicas y arteriogénicos en el tejido muscular del miembro periférica y los efectos de varias terapias (por ejemplo, las drogas, la entrega de genes, células madre) en estas respuestas. Más recientemente, nuestro grupo ha utilizado este modelo para examinar el papel de las células del músculo esquelético in la respuesta a la isquemia de las extremidades y de los efectos de las diferencias genéticas en los resultados 14.
El modelo de HLI ha facilitado nuestra actual comprensión de que las respuestas vasculares y musculares a la isquemia dependen de la genética (es decir, la cepa consanguínea) 15, de 16 años, y la presencia o ausencia de otras enfermedades o condiciones relacionadas con la aterosclerosis, como la diabetes mellitus 17 y hipercolesterolemia 18. Sin embargo, una debilidad importante del modelo tradicional HLI es que es un modelo de isquemia de las extremidades aguda 12,13, mientras que PAD humana provoca isquemia crónica como resultado del desarrollo gradual de las lesiones ateroscleróticas oclusivos en las arterias periféricas.
En un intento de eludir esta debilidad, Tang y sus colegas desarrollaron inicialmente un modelo de rata de la oclusión de la arteria femoral gradual usando constrictores AMEROID 19, y el mismo Grupo que más tarde developed un modelo similar del ratón 20. Constrictor ameroide se describieron inicialmente en la década de 1950 en un modelo canino de isquemia miocárdica crónica 21,22. Estos dispositivos tienen un manguito de metal exterior que encierra una capa interior de un material higroscópico, por lo general caseína, y cuando se coloca alrededor de una arteria que inducen la oclusión del vaso gradual a medida que absorben la humedad de los tejidos circundantes. En su modificación del modelo, Yang et al. Coloca constrictores tanto en los extremos proximal y distal de la arteria femoral en sitios análogos a los sitios de la ligadura quirúrgica, y se ligó las ramas laterales de la arteria femoral, como en el modelo tradicional. En comparación con HLI aguda, aneroide la isquemia inducida por constrictor resultó en una menor expresión de genes inflamatorios y de estrés de cizalla-dependiente, la recuperación del flujo sanguíneo inferior 4 - 5 semanas después de la cirugía, y menos necrosis muscular 20. Basándose en estas observaciones, se consideró que la oclusión arterial gradual podría proporcionar un modelo de PAD más relevante para la enfermedad humana.
En particular, en el informe original, efectos de la isquemia inducida por constrictor aneroide se examinaron sólo en ratones C57BL / 6 19, que son relativamente resistentes a la necrosis muscular inducida por isquemia 15. Recientemente hemos modificado el modelo de isquemia progresiva más allá y exploramos sus efectos en el más susceptible a la isquemia BALB / c cepa de ratón 23. En la primera manifestación de la modelo, colocamos constrictoras en ambos extremos proximal y distal de la arteria femoral, pero nos fuimos todos los ramas laterales intactas. En una segunda modificación, más suave, colocamos un solo constrictor sólo en la arteria femoral proximal y otra vez fuimos todos los secundarios manojos de la arteria intacta. En ambas modificaciones de este modelo, se encontró que los ratones BALB / c, pero no C57BL / 6 ratones, mostró necrosis muscular significativa a pesar de tener el flujo de sangre y densidad similares vascular. Al igual que en nuestro estudio anterior 14, estos resultados demuestran que el músculo del miembrolesión no está únicamente influenciado por el flujo de sangre, pero depende en parte en el fondo genético. Por otra parte, se encontró que el flujo sanguíneo hacia las extremidades cayó a su punto más bajo dentro de los 3 días, por lo que el modelo parece ser más una de 'subaguda' en lugar de isquemia de las extremidades gradual.
Con base en estos estudios previos, parece claro que un solo método para inducir isquemia del miembro posterior puede no ser adecuado en todos los casos. Debido a una variedad de condiciones (por ejemplo, las diferencias genéticas y la presencia o ausencia de condiciones comórbidas) influyen tanto en el vascular y las respuestas específicas del músculo esquelético, los investigadores puede verse en la necesidad de modificar la cronicidad y / o la severidad de la isquemia de las extremidades posteriores al mejor satisfacer sus propósitos. Por otra parte, las descripciones anteriores del modelo por lo general carecían de referencias anatómicas adecuadas para facilitar fiable reproducibilidad inter-investigador de la técnica. En este trabajo, los métodos para inducir isquemia de las extremidades posteriores, ya sea aguda o subaguda en el ratónse describen y se proporcionan puntos de referencia anatómicos precisos.
Protocolo
Todos los experimentos con animales se realizaron de acuerdo con el protocolo aprobado por el Comité de Cuidado y Uso de Animales institucional de Duke. Los ratones machos se utilizaron en este estudio, aunque se puede utilizar cualquier sexo, como se indica con el fin científico del estudio.
1. Depilación
- Antes de la inducción de la anestesia, establecer un área de preparación de pre-quirúrgico que consiste en una resistencia de calentamiento cubierto fijado en 37 ° C y un puerto de ojiva conectado a flujo continuo de isoflurano.
- Coloque el ratón en la cámara de inducción de la anestesia. Ajuste el medidor de flujo de O 2 a 1 L / min e isoflurano al 1-3%.
NOTA: La anestesia se induce típicamente en un 25 g de ratón con isoflurano al 2%. - Comprobar la respuesta de estímulo del ratón moviendo suavemente la cámara y la observación de la falta de un reflejo de enderezamiento.
- Enjuague la cámara con O 2 para borrar el isoflurano antes de la apertura. Mueve rápidamente el ratón para el calentamiento panuncio y conectarlo con isoflurano a través de la ojiva.
- Ajuste el isoflurano al 1,5%. Marque la respuesta de estímulo por el pedal del reflejo (pizca dedo del pie).
- Aplicar lubricante oftálmica generosamente en ambos ojos para evitar que se seque durante la cirugía.
- Afeitar el vello de las dos extremidades traseras mediante un pequeño condensador de ajuste eléctrico. Manteniendo la piel tirante mientras se afeita para evitar lacerar la piel.
- Aplicar crema de depilación pre-calentado y dejar reposar durante 1 minuto. Limpie suavemente usando una gasa humedecida.
- Para el procedimiento quirúrgico en un momento posterior, apague el isoflurano y mueva el ratón a una jaula de recuperación toalla forrado de papel vacío para asegurar el ratón no aspirar la ropa de cama de la jaula. Supervisar el animal hasta que es capaz de mantener decúbito esternal. De lo contrario, mueva el ratón a la mesa de operaciones.
NOTA: El proceso de eliminación del vello puede irritar la piel y afectar a las mediciones de perfusión. Se recomienda esperar 1 - 2 días después de eliminar el pelo del animal antes de performing una gammagrafía de perfusión previa a la cirugía o la realización de la cirugía.
2. Preparación prequirúrgica
- Utilizar las siguientes herramientas durante este procedimiento; pequeñas tijeras quirúrgicas rectas, 2 pinzas de ángulo de punta fina, pequeñas pinzas, fórceps Graefe portaagujas 3, retractores, pequeñas tijeras de primavera, y bastoncillos de algodón de punta fina.
- Esterilizar todas las herramientas utilizando un autoclave antes de la iniciación de la cirugía. Utilizar un esterilizador-grano caliente antes y entre cada procedimiento quirúrgico, para un máximo de 5 animales. Esterilizar los paquetes de herramientas quirúrgicas adicionales para intervenciones quirúrgicas en grupos de más de 5.
- Preparar un campo quirúrgico estéril que consiste en una almohadilla de calefacción cubierta y un puerto de isoflurano. Realizar todo el trabajo bajo un microscopio de disección 10 estéreo.
- Anestesiar y preparar el ratón como se describe en los puntos 1.1 a 1.5.
- Compruebe que el ratón está completamente sedado y coloque en una posición de decúbito supino sobre la mesa de operaciones. Fije las dos piernas con cinta quirúrgica.
- Si se utiliza una resistencia de calentamiento de temperatura controlada, conecte la sonda de temperatura y fijarlo a la base de la plataforma quirúrgica utilizando cinta quirúrgica para asegurarse de que no se desconecta accidentalmente durante el procedimiento.
- Limpiar el sitio de la incisión utilizando 3 alternantes de povidona yodada y alcohol toallitas. Cubrir el animal con un paño quirúrgico estéril y cortar un agujero para exponer el sitio de la incisión.
3. La inducción de isquemia de extremidades
- Utilice un bisturí para realizar una incisión inicial a lo largo del centro del muslo medial, que va desde la rodilla hacia el abdomen, y alargar la incisión para aproximadamente 1 cm con unas tijeras finas (Figura 1A).
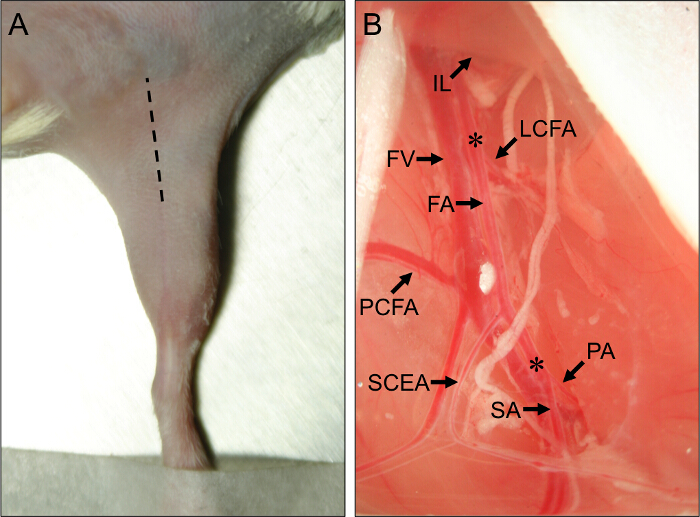
Figura 1. Sitio Quirúrgico y vasculares anatómicas Puntos de referencia para la cirugía de ratón del miembro posterior isquemia. (A) Vista externa della extremidad posterior de un ratón en la posición supina. La línea discontinua indica el lugar de la incisión para realizar correctamente los procedimientos de las extremidades posteriores de isquemia. (B) Vista de la vasculatura proximal del miembro posterior del ratón. El extremo proximal de la arteria femoral (FA) surge de debajo del ligamento inguinal (IL). El extremo distal de la FA está situada en su bifurcación en la arteria poplítea (PA) y la arteria safena (SA). Las principales arterias colaterales fuera de la FA son la arteria circunfleja femoral lateral (LCFA), la arteria femoral caudal proximal (PCFA), y la arteria epigástrica caudal superficial (SCEA). La vena femoral (VF) se extiende adyacente a la FA, y las ramas venosas se puede ver en paralelo a las principales ramas arteriales. Los asteriscos (*) indican los sitios proximal y distal para la colocación de constrictor ameroide o ligaduras, dependiendo de si se inducirán subaguda o isquemia aguda. Por favor click aquí para ver una versión más grande de esta figura.
- Con unas pinzas, abrir la incisión y exponer la membrana que cubre el tejido de grasa inguinal (IFT).
- Usando forceps-cerradas, perfore a través de la membrana en la separación entre el IFT y el abdomen. liberar suavemente la presión en las pinzas para separar el IFT de los músculos abdominales, exponiendo el haz neurovascular debajo. Observar los extremos proximal y ramas caudales superficiales como importantes puntos de referencia (Figura 1B).
- Insertar un retractor y tirar del tejido abdominal proximal para exponer el constrictor aneroide o ligadura proximal sitio, justo proximal a la arteria circunfleja femoral lateral (Figura 1B). La arteria circunfleja lateral se encuentra a unos 5 mm proximal a la proximal y las arterias caudales superficiales.
- Inserte dos retractores más en la parte distal de la incisión, uno medial y lateral, para tirar de la IFT distalmente lejos de lasitio quirúrgico para ampliar el campo quirúrgico.
- Use dos pinzas finas para retirar la membrana exterior que cubre el haz neurovascular. Introduzca suavemente la mitad de la punta de pinza fina entre la vena y la arteria, deslizando la punta fórceps debajo de la membrana que los une. Cerrar la pinza y suavemente rasgar la membrana.
- Inserte la punta de una pinza cerrada entre la vena y la arteria y crear una brecha entre ellos por la liberación de la presión en las pinzas. Repetir esta técnica para crear un hueco entre la arteria y el nervio.
- Para subaguda isquemia de las extremidades, colocar un constrictor aneroide en la arteria femoral proximal (Figura 2).
- Para instalar el constrictor aneroide proximal, deslice la punta de una pinza debajo de la arteria femoral para aislarlo del haz neurovascular. Use un segundo conjunto de pinzas angled- para agarrar el borde del constrictor y guiar en los términos de la arteria femoral.
- Coloque la arteria femoral en los smucho en el constrictor. Repita para el constrictor distal, posicionándola inmediatamente proximal a la bifurcación de la arteria femoral a la arteria poplítea y la arteria safena (Figura 2).
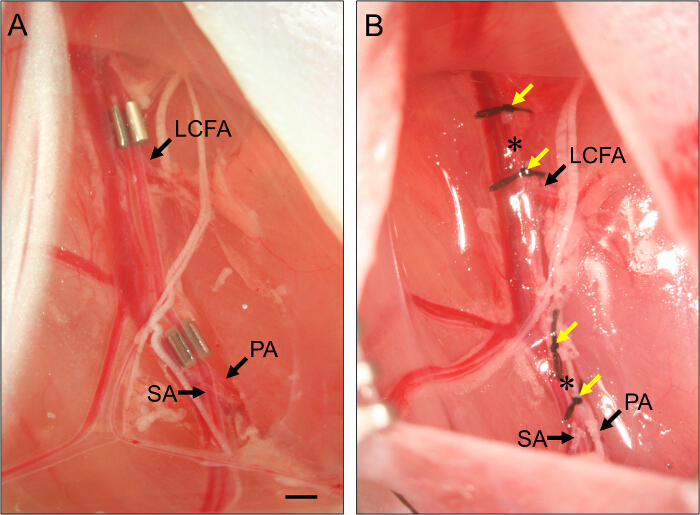
Figura 2. Colocación de AMEROID constrictores y ligaduras. (A) Ejemplo de dos constrictores AMEROID colocados en la arteria femoral para inducir isquemia subaguda miembro posterior. El constrictor proximal se coloca justo proximal a la arteria circunfleja femoral lateral (LCFA). El constrictor distal se coloca justo proximal a la bifurcación de la poplítea (PA) y las arterias safena (SA). Constrictoras se instalan con la ranura hacia arriba para asegurar la arteria está bien ajustado dentro del constrictor. (B) Ejemplo de ligaduras de la arteria femoral para inducir isquemia de las extremidades posteriores aguda. ligaturES (flechas amarillas) se colocan de tal manera que flanquean la posición de los constrictores en el panel (B), y la arteria femoral se secciona entre cada conjunto de dos ligaduras (asteriscos). Bar, 1 mm. Haga clic aquí para ver una versión más grande de esta figura.
- Para isquemia de las extremidades aguda, ligar y seccionar la arteria femoral proximal.
- Para seccionar la arteria femoral, hilo 7 - O sutura debajo de la arteria proximal a la posición de la constrictor proximal (véase el paso 3.7) y se liga. Ate una segunda ligadura alrededor de 1 mm distal a la primera.
- Use tijeras de primavera para seccionar la arteria entre las dos ligaduras. Para la transección arterial distal, repetir estos pasos, la colocación de dos ligaduras alrededor de 1 mm entre sí, justo proximal a la bifurcación de la arteria femoral a la arteria poplítea y la arteria safena pero asegurando que son distal a la caud superficialAl arteria epigástrica (ver Figura 1)
- Cerrar la incisión utilizando interrumpido 5 - suturas de vicryl S.
4. Imagen de perfusión
- Mover el ratón para una almohadilla térmica 37 ° C, ubicado bajo el generador de imágenes de perfusión por láser doppler (LDPI) y conectarse a través de un cono de nariz a la fuente de isoflurano. Si no hay un monitor de temperatura está disponible, permita 5 minutos para el ratón se caliente hasta 37 ° C.
- Encienda el generador de imágenes e inicie el software de captura de imágenes.
- Haga clic en el icono "Nueva Imagen sencilla 'para abrir la ventana" Configuración del escáner ". Ajuste el 'tamaño de escaneado "en" Grande "y la" velocidad de escaneo "a" 4 ms / píxel. Ajuste el área de escaneado, cambiando los valores de x e y en el marco del "área de escaneado (unidades) 'panel.
- Haga clic en la pestaña 'vídeo y Distancia "para ver las imágenes de vídeo, y organizar el ratón para encajar en el área de exploración indicado por un contorno rojo. Haga clic en "Auto Distancia 'para calibrarla distancia desde el láser al sujeto. Haga clic en "Siguiente" para abrir la ventana '' Asunto detalles.
- Introduzca la información del asunto y cualquier comentario relevante. Haga clic en el botón 'Siguiente' para pasar a la ventana de exploración.
- Haga clic en el botón 'Inicio de medida' para abrir el 'Confirmar o Invalidar Scan Distancia' de diálogo. Haga clic en 'OK' para confirmar la distancia de exploración. Observar el proceso de escaneado comienza y una duración de 4 - 8 minutos, dependiendo del tamaño del área de escaneo.
- Después de la exploración es completa, observe la ventana "Guardar como". Nombre del archivo y guardarlo.
- Cierre el isoflurano y mueva el ratón a una jaula de recuperación vacía y monitorear hasta que el animal es capaz de mantener decúbito esternal. Nunca coloque un ratón se recupera de la anestesia en una jaula con otros ratones.
- Abra el software de análisis de imágenes. Haga clic en el icono "Abrir" y busque y abra el archivo de imagen para su análisis. En la ventana de archivos, observar el flujo,fotos, imágenes en color y del ratón.
- Con motivo de la región de interés (ROI) en la imagen de flujo, haga clic en el icono "Mostrar regiones de interés. A continuación, haga clic en el botón 'Añadir Polígono' y arrastra el cursor alrededor de la extremidad no quirúrgico para extraer el retorno de la inversión. Haga clic para cerrar la forma. Seleccione 'Añadir Polígono' de nuevo y dibujar un retorno de la inversión a juego alrededor del miembro quirúrgico.
- Haga clic en el icono 'Estadísticas' para abrir la 'Imagen ROI estadística Resultados (PU) "ventana. Observe la diferencia porcentual en proceso de cambio en la columna 'Flux%'.
NOTA: La primera ROI dibujado servirá de referencia.
NOTA: Antes de cada perfusión posterior sigue los pasos descritos en la Sección 1 para anestesiar el ratón y en los pasos 4.1 a 4.11 de la imagen del animal.
Resultados
La correcta identificación de los vasos de las extremidades posteriores del ratón es fundamental para asegurar la reproducibilidad de las técnicas para inducir tanto la isquemia subaguda y aguda de las extremidades posteriores, tal como se describe aquí. Además de la variación inherente en estudios con animales, otros factores pueden introducir variabilidad en láser de perfusión Doppler (LDPI), incluyendo el tipo de anestesia, la posición del animal (vs. supina boca aba...
Discusión
Quizás el paso más difícil en este procedimiento es la separación de la arteria femoral de la vena femoral. El diámetro más grande y paredes más delgadas de la vena femoral en comparación con los de la arteria aumentan su susceptibilidad a la perforación y al desgarro durante la manipulación quirúrgica. La probabilidad de que la interrupción de la vena puede reducirse manteniendo húmeda la herida usando un hisopo estéril humedecido con PBS. También es importante asegurarse de que todos los fórceps se afi...
Divulgaciones
The authors have no conflicts of interest to disclose.
Agradecimientos
This study was supported by NIH grants R21HL118661, R56HL124444, and R01HL124444 to CDK, and by NIH grants R00HL103797 and R01HL125695 to JMM.
Materiales
| Name | Company | Catalog Number | Comments |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | Dumoxel |
| Dumont Style 5 Mini Forceps | Fine Science Tools | 11200-14 | Inox |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| 7 - 0 Silk Suture | Sharpoint | DA-2527N | |
| 5 - 0 Coated Vicryl Suture | Ethicon | J463G | |
| Graefe Forceps | Fine Science Tools | 11053-10 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-03 | |
| Artifical Tears Ointment | Rugby Laboratories | 0536-6550-91 | |
| Surgical Tape | 3M | 1530-0 | |
| Fine Cotton Swabs | Contec | SC-4 | |
| Temperature Controller | Physitemp | TCAT-2DF | |
| Ameroid Constrictors | Research Instruments SW | MMC-0.25 x 1.00-SS | |
| Hot Bead Sterilizer | |||
| Deltaphase Isothermal Pad | Braintree Scientific | 39DP | |
| Needle Driver | Fine Science Tools | ||
| Phosphate Buffered Saline | Gibco | 10010-023 | |
| Moor LDPI | Moor Instruments | moorLDI2 | |
| moorLDI Measurement software | Moor Instruments | v. 6.0 | |
| Hair Removal Cream | Nair |
Referencias
- Criqui, M. H., Aboyans, V. Epidemiology of peripheral artery disease. Circ. Res. 116, 1509-1526 (2015).
- Thukkani, A. K., Kinlay, S. Endovascular intervention for peripheral artery disease. Circ. Res. 116, 1599-1613 (2015).
- Vartanian, S. M., Conte, M. S. Surgical intervention for peripheral arterial disease. Circ. Res. 116, 1614-1628 (2015).
- Bonaca, M. P., Creager, M. A. Pharmacological treatment and current management of peripheral artery disease. Circ. Res. 116, 1579-1598 (2015).
- Conte, M. S., et al. Design and rationale of the PREVENT III clinical trial: edifoligide for the prevention of infrainguinal vein graft failure. Vasc Endovascular Surg. 39, 15-23 (2005).
- Pomposelli, F. B., et al. A decade of experience with dorsalis pedis artery bypass: analysis of outcome in more than 1000 cases. J. Vasc. Surg. 37, 307-315 (2003).
- Willigendael, E. M., et al. Smoking and the patency of lower extremity bypass grafts: a meta-analysis. J. Vasc. Surg. 42, 67-74 (2005).
- Schillinger, M., et al. Balloon angioplasty versus implantation of nitinol stents in the superficial femoral artery. N. Engl. J. Med. 354, 1879-1888 (2006).
- Marmagkiolis, K., et al. 12-month primary patency rates of contemporary endovascular device therapy for femoro-popliteal occlusive disease in 6,024 patients: beyond balloon angioplasty. Catheter. Cardiovasc. Interv. 84, 555-564 (2014).
- Rosenfield, K., et al. Trial of a Paclitaxel-Coated Balloon for Femoropopliteal Artery Disease. N. Engl. J. Med. 373, 145-153 (2015).
- Tepe, G., et al. Drug-coated balloon versus standard percutaneous transluminal angioplasty for the treatment of superficial femoral and popliteal peripheral artery disease: 12-month results from the IN.PACT SFA randomized trial. Circulation. 131, 495-502 (2015).
- Couffinhal, T., et al. Mouse model of angiogenesis. Am. J. Pathol. 152, 1667-1679 (1998).
- Niiyama, H., Huang, N. F., Rollins, M. D., Cooke, J. P. Murine model of hindlimb ischemia. J Vis Exp. , (2009).
- McClung, J. M., et al. Skeletal muscle-specific genetic determinants contribute to the differential strain-dependent effects of hindlimb ischemia in mice. Am. J. Pathol. 180, 2156-2169 (2012).
- Dokun, A. O., et al. A quantitative trait locus (LSq-1) on mouse chromosome 7 is linked to the absence of tissue loss after surgical hindlimb ischemia. Circulation. 117, 1207-1215 (2008).
- Rivard, A., et al. Age-dependent impairment of angiogenesis. Circulation. 99, 111-120 (1999).
- Hazarika, S., et al. Impaired angiogenesis after hindlimb ischemia in type 2 diabetes mellitus: differential regulation of vascular endothelial growth factor receptor 1 and soluble vascular endothelial growth factor receptor 1. Circ. Res. 101, 948-956 (2007).
- Couffinhal, T., et al. Impaired collateral vessel development associated with reduced expression of vascular endothelial growth factor in ApoE-/- mice. Circulation. 99, 3188-3198 (1999).
- Tang, G. L., Chang, D. S., Sarkar, R., Wang, R., Messina, L. M. The effect of gradual or acute arterial occlusion on skeletal muscle blood flow, arteriogenesis, and inflammation in rat hindlimb ischemia. J. Vasc. Surg. 41, 312-320 (2005).
- Yang, Y., et al. Cellular and molecular mechanism regulating blood flow recovery in acute versus gradual femoral artery occlusion are distinct in the mouse. J. Vasc. Surg. 48, 1546-1558 (2008).
- Litvak, J., Siderides, L. E., Vineberg, A. M. The experimental production of coronary artery insufficiency and occlusion. Am. Heart J. 53, 505-518 (1957).
- Bredee, J. J. An improved ameroid constrictor. Preliminary communication. J. Surg. Res. 9, 107-112 (1969).
- McClung, J. M., et al. Subacute limb ischemia induces skeletal muscle injury in genetically susceptible mice independent of vascular density. J. Vasc. Surg. , (2015).
- Hellingman, A. A., et al. Variations in surgical procedures for hind limb ischaemia mouse models result in differences in collateral formation. Eur. J. Vasc. Endovasc. Surg. 40, 796-803 (2010).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PloS one. 8, e84047 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados