このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
急性および亜急性ネズミ後肢虚血のための方法
要約
Surgical induction of hindlimb ischemia in the mouse is useful to examine angiogenesis, however this is compromised in certain inbred mouse strains that display marked ischemia-induced tissue necrosis. Methods are described to induce subacute limb ischemia using ameroid constrictors to circumvent this problem through the induction of gradual arterial occlusion.
要約
末梢動脈疾患(PAD)先進国における心臓血管の罹患率および死亡率の主要な原因であり、確実にヒトの疾患を再現する動物モデルは、この疾患の新規治療法を開発するために必要です。マウス後肢虚血モデルは、この目的のために広く使用されてきたが、大腿動脈の結紮によって急性四肢虚血を誘導する標準的な方法は、実質的な組織壊死を生じることができ、虚血に対する血管および骨格筋組織の応答を研究する研究者の能力を損ないます。大腿動脈結紮する別のアプローチは、アメロイドconstrictorsの使用を介して緩やかな大腿動脈閉塞の誘導です。より緩やかな、亜急性虚血を生じ、3日 - 大腿動脈結紮部位と同一又は異なる場所に大腿動脈の周囲に配置されたときに、これらのデバイスは1上の動脈を閉塞します。これは、wは、以下の実質的な骨格筋組織の壊死をもたらしますHICHより密接に人間のPADで見られる応答を模倣し得ます。急性および亜急性虚血モデルの両方における遺伝的背景の影響成果ため、研究されているマウス株の対価は最適なモデルを選択する際に重要です。本稿では、マウスに亜急性または急性後肢虚血を誘導するための適切な手順とマウスの大腿動脈上の合字またはアメロイドconstrictorsの解剖学的配置を説明しています。
概要
末梢動脈疾患(PAD)は、先進国1における心臓血管の罹患率および死亡率の主な原因です。得られた労作または安静時疼痛、時折手足の切断を必要と潰瘍や壊疽を非治癒と下肢虚血につながる末梢動脈のアテローム性動脈硬化症の障害物からのPAD結果。本質的に効果的な薬物療法が4存在しないようにPADを標的にする治療は、主に血管内2または外科的血行再建3に向けられます。
バイパス移植片は、いくつかの集団( 例えば 、喫煙者、女性、非伏在静脈グラフト)6,7で悪化している5(5年以内に50%まで)、高い故障率を持っているように残念なことに、血行再建術は、多くの場合、限られた利益のです。例えば、血管形成術およびステント術などの血管内アプローチは、また(1年以内50%を超える)高い再狭窄率によって損なわれている、私particulary薬剤溶出バルーンやステントの使用は、成果やや9-11を改善したものの、大腿膝窩動脈疾患8を n個。 PADのための新しい治療法を開発するためには、確実にヒトの疾患を再現する動物モデルを開発することが不可欠です。
現在までに、PADの最も一般的なモデルは、最も頻繁に、マウス12,13で実行される後肢虚血モデル(HLI)、です。その最も一般的な症状では、モデルは、近位および遠位の大腿動脈の外科的結紮を必要とし、その介在側枝は、血流および急性四肢虚血の誘導の閉塞を生じる、血管の切除が続きます。 HLIは四肢末梢の筋肉組織における血管新生と動脈形成応答し、これらの応答に対する様々な療法( 例えば 、薬物は、遺伝子送達は、幹細胞)の効果を研究するために主に使用されています。さらに最近では、我々のグループは、骨格筋細胞の役割を調べるために、このモデルを使用したI下肢虚血やアウトカム14上の遺伝子の違いの影響に対する応答をn個。
HLIモデルは、虚血に対する血管や筋肉の応答は遺伝学に依存していることを私たちの現在の理解( すなわち 、近交系)15、年齢16、及び糖尿病17を含むアテローム性動脈硬化症に関連する他の疾患または症状の有無を容易にしたと高コレステロール血症18。しかし、伝統的なHLIモデルの重要な弱点は人間のPADが末梢 動脈の閉塞性動脈硬化病変の段階的な開発の結果として慢性虚血を引き起こすのに対し、それは、急性下肢虚血12,13のモデルであることです。
この弱点を回避する試みでは、唐らは当初アメロイドconstrictors 19、および同じグループ続 いてDを使用して、段階的な大腿動脈閉塞のラットモデルを開発しました同様のマウスモデル20を eveloped。アメロイドconstrictorsは慢性心筋虚血21,22のイヌのモデルで1950年代に最初に記載されています。これらのデバイスは、通常、カゼイン、吸湿性材料の内側層を包む外側の金属スリーブを有し、動脈の周りに置かれたときに、それらが周囲の組織からの水分を吸収するように、それらは段階的な血管閉塞を引き起こします。モデルのその変形例では、Yangら外科的ライゲーション部位に類似したサイトで近位および遠位大腿動脈の両方にconstrictorsを置いた、と彼らは伝統的なモデルのように、大腿動脈の側枝を連結しました。術後5週、およびより少ない筋壊死20 -急性HLIと比較すると、アメロイドコンストリクター誘発性虚血は、炎症性およびせん断応力依存性遺伝子のより低い発現、下血流回復4が得られました。これらの観察に基づいて、段階的な動脈閉塞がPのモデルを提供するかもしれないと感じましたヒトの疾患へのより関連性の高い広告。
注目すべきは、元のレポートでは、アメロイドコンストリクター誘発性虚血の効果は、虚血誘発性筋壊死15に対して比較的耐性があるC57BL / 6マウス19、で調べました。我々は最近、さらに緩やかな虚血モデルを修正し、より虚血感受性のBALB / cマウス株23でその効果を検討しました。モデルの最初の症状では、近位および遠位大腿動脈の両方にconstrictorsを置いたが、無傷のすべての側枝を残しました。第二の、より穏やかな変形例では、我々は唯一の近位大腿動脈上の単一のコンストリクターを入れて、再び無傷の動脈のすべての側面brachesを残しました。このモデルの両方の変形では、BALB / cマウスことを発見ではなく、C57BL / 6マウスを、同様の血流および血管密度を有するにもかかわらず、かなりの筋壊死を示しました。私たちの以前の研究14と同様に、これらの知見は、その手足の筋肉を実証しました損傷はもっぱら血流の影響を受けますが、一部には遺伝的背景に依存していません。さらに、我々は、手足の血流が3日以内にその天底に落ち、したがってモデルは「亜急性」の1よりもむしろ漸進的な下肢虚血もっとあるように思われることがわかりました。
これらの以前の研究に基づいて、後肢虚血を誘導するための単一の方法は、すべての場合に適していないことが明確に表示されます。様々な条件( 例えば 、遺伝的差異および存在または合併症の条件が存在しない)影響血管および骨格筋特異的応答の両方ので、研究者らは、それが必要な最良に慢性および/ または後肢虚血の重症度を変更するかもしれませんその目的に合います。さらに、モデルの事前の説明は、一般的な技術の信頼性の間調査官の再現性を容易にするために、適切な解剖学的目印を欠いていました。本論文では、マウスに急性または亜急性のいずれか後肢虚血を誘導するための方法記載されており、正確な解剖学的目印が設けられています。
プロトコル
全ての動物実験は、デューク制度動物実験委員会によって承認されたプロトコルに従って実施しました。いずれかの性別を用いることができるが、研究の科学的目的のために示されているように雄マウスを、この研究に使用しました。
1.脱毛
- 麻酔導入に先立って、37℃に設定した屋根付きの加熱パッドおよびイソフルランの連続的な流れに接続されたノーズコーンポートからなる手術前の準備領域を設定します。
- 麻酔導入チャンバー内にマウスを置きます。 3% - 1から1リットル/分およびイソフルランにO 2流量計を設定します。
注:麻酔は、典型的には2%のイソフルランで25gのマウスにおいて誘導されます。 - 優しく室をロッキングし、立ち直り反射の欠如を観察することにより、マウスの刺激応答を確認してください。
- 開口部の前にイソフルランをクリアするには、O 2とチャンバーをフラッシュします。素早く加熱pにマウスを移動広告とノーズコーンを介してイソフルランに接続します。
- 1.5パーセントにイソフルランを調整します。ペダル反射(つま先ピンチ)によって刺激応答を確認してください。
- 手術中の乾燥を避けるために、両眼に自由に眼科潤滑剤を塗布します。
- 小型電気トリマーを使用して、両方の後肢から毛を剃ります。皮膚を深く傷つける避けるためにシェービングしながら、ピンと張った皮膚を持ちます。
- 予熱した脱毛クリームを適用し、1分間放置します。静かに湿らせたガーゼパッドを使用して拭き取ってください。
- 後の時点で、外科的処置のために、イソフルランをオフにして、ケージの寝具を吸引しないマウスを確保するために、空のペーパータオルでライニング回復ケージにマウスを移動します。胸骨横臥位を維持できるようになるまで動物を監視します。それ以外の場合は、手術台にマウスを移動します。
注:脱毛処理は、皮膚を刺激し、血流の測定に影響を与えることができます。 P前に、動物の毛を除去した後、2日 - 1を待つことをお勧めします手術前血流スキャンをerformingまたは手術を行います。
2.手術前の準備
- この手順の実行中に以下のツールを使用します。小さなストレート手術用はさみ、2先の細い斜めの鉗子、小さなグレーフェ鉗子、針ドライバ鉗子、3開創、小さな春のはさみと、先の細い綿棒。
- 手術の開始に先立って、オートクレーブを使用してすべてのツールを滅菌します。最大5匹の動物のために、それぞれの外科的処置の前との間にホットビーズ滅菌器を使用してください。 5より大きいグループの手術のための追加手術道具パケットを滅菌します。
- 覆われた加熱パッドおよびイソフルランポートからなる無菌の手術領域を準備します。 10ステレオ解剖顕微鏡下ですべての作業を実行します。
- 麻酔およびステップ1.5から1.1に記載されているように、マウスを準備します。
- マウスが完全に鎮静剤を投与されていることを確認し、手術台に仰臥位に配置します。サージカルテープを使用して両足を固定します。
- 温度制御加熱パッドを使用している場合は、温度プローブを取り付け、それが誤って処置中に引き抜かれないことを確実にするために、外科用テープを使用して、手術用プラットフォームのベースに固定します。
- 3交互ポビドンヨードとアルコールワイプを使用して切開部位をきれいにしてください。滅菌外科用ドレープで動物を覆い、切開部位を露出させる穴をカット。
下肢虚血の3誘導
- 腹部に向かって膝から実行して、大腿内側の中心に沿って最初の切開を行い、微細なハサミ( 図1A)で約1cmに切開部を長くするメスを使用してください。
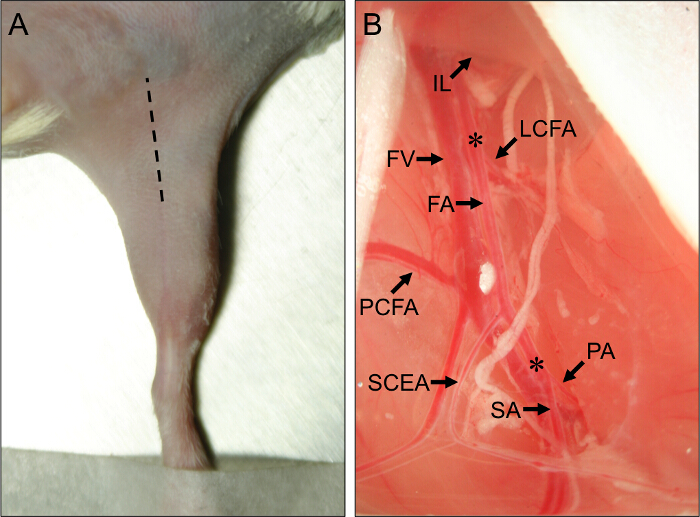
図1.手術部位とマウス後肢虚血の外科血管解剖のランドマーク。(A)の外観仰臥位でのマウスの後肢。斜線が正しく後肢虚血の手順を実行するために切開部位を示している。近位マウスの後肢血管系の(B)を見ます。大腿動脈(FA)の近位端は、鼠径靱帯(IL)の下から生じます。 FAの遠位端は、膝窩動脈(PA)及び伏在動脈(SA)への分岐部に配置されています。 FAのオフ主要な担保の動脈は横方向の回旋大腿動脈(LCFA)、近位尾大腿動脈(PCFA)、および浅尾上腹部動脈(SCEA)です。大腿静脈(FV)がFAに隣接して実行され、静脈枝は主要な動脈枝に平行に見ることができます。アスタリスク(*)。亜急性又は急性虚血が誘導されるかどうかに応じて、アメロイドconstrictorsまたは結紮を配置するための近位および遠位の部位を意味するCLIくださいこの図の拡大版を表示するには、こちらのCK。
- 鉗子を使用して、切開を開き、鼠径部脂肪組織(IFT)を覆う膜を露出させます。
- ピアスIFTと腹部の間の分離に膜を介して、閉じた鉗子を使用して。そっと下に神経血管束を露出させ、腹部の筋肉からIFTを分離するために鉗子に圧力を解放します。重要な解剖学的ランドマーク( 図1B)などの近位および浅尾側枝を観察します。
- 開創器を挿入して、横方向の回旋大腿動脈( 図1B)のすぐ近位、近位アメロイドのコンストリクターまたは連結部位を露出するように近位に腹部組織を引っ張ります。横方向の回旋動脈は、近位および浅尾動脈から約5ミリメートルの近位に位置しています。
- 切開部の先端部に2以上のリトラクターを挿入し、1内側と外側1、離れて遠位からIFTを引っ張って手術野を広げる手術部位。
- 神経血管束をカバーする最も外側の膜を除去するために2つの細かい鉗子を使用してください。静かにそれらを一緒に結合し、膜の下に鉗子先端をスライド、静脈と動脈との間に微細な鉗子の先端の半分を挿入します。鉗子を閉じて、そっと膜を離れて引き裂きます。
- 静脈と動脈の間、閉じた鉗子の先端を挿入し、鉗子に圧力を解放することによって、それらの間のギャップを作成します。動脈と神経の間のギャップを作成するには、この手法を繰り返します。
- 亜急性下肢虚血のために、近位大腿動脈( 図2)にアメロイドコンストリクターを置きます。
- 近位アメロイドのコンストリクターをインストールするには、神経血管束からそれを分離するために大腿動脈の下に鉗子の先端をスライドさせます。コンストリクターのエッジグリップにangled-鉗子の第2のセットを使用し、大腿動脈の下でそれを導きます。
- sの中に大腿動脈を築きますコンストリクターでたくさん。膝窩動脈および伏在動脈( 図2)に大腿動脈の分岐部に近位すぐにそれを配置する、遠位コンストリクターのために繰り返します。
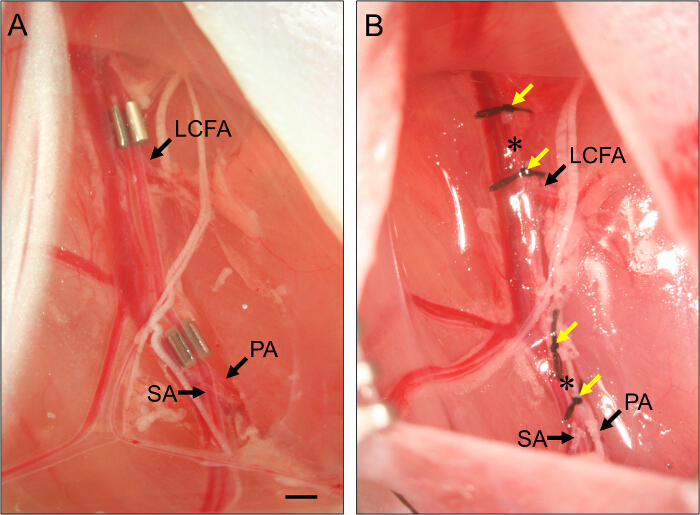
アメロイドConstrictorsと合字の図2.配置。亜急性後肢虚血を誘導するために大腿動脈に配置された2つのアメロイドconstrictorsの(A)の例。近位のコンストリクターは、横方向の大腿回旋動脈(LCFA)のすぐ近位に配置されています。遠位コンストリクターは、膝窩(PA)の分岐及び伏在動脈(SA)のすぐ近位に配置されています。 Constrictorsは、動脈を確実にするために、上向きにスロットが適切にコンストリクター内に設定されるとともにインストールされている。急性後肢虚血を誘導する大腿動脈の結紮糸の(B)の例。 LigaturESは、(黄色の矢印)は、パネル(B)におけるconstrictorsの位置に隣接するように配置され、そして大腿動脈は、二つの結紮(アスタリスク)の各セット間に切開されます。バー、1ミリメートル。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 急性下肢虚血のために、連結および近位大腿動脈を横断。
- 大腿動脈を横断するには、スレッド7 - 近位のコンストリクターの位置のすぐ近位動脈の下でO縫合糸はとライゲート(ステップ3.7を参照します)。最初に遠位の1ミリメートル程度秒リガチャーを接続します。
- 2合字間の動脈を横断するために春のはさみを使用してください。遠位の動脈切断のために、ちょうど膝窩動脈および伏在動脈への大腿動脈の分岐部に近接するが、彼らは表面的caudに対して遠位であることを確実に離れて1ミリメートル、約2合字を配置し、これらの手順を繰り返しアル上腹部動脈( 図1を参照)
- 使用して切開部を閉じて5中断 - Oのビクリル縫合糸を。
4.灌流イメージング
- レーザードップラー血流画像化装置(LDPI)の下に設定し、37℃の加熱パッドにマウスを移動し、イソフルランソースにノーズコーンを介して接続します。何の温度モニタが利用できない場合は、マウス5分間、37℃まで昇温することができます。
- イメージャの電源を入れて、画像キャプチャソフトウェアを起動します。
- 「スキャナの設定」ウィンドウを開くには、「新シングルイメージ」アイコンをクリックします。 「4ミリ秒/ピクセル」に「大」と「スキャン速度」に「読込サイズ」を設定します。 「スキャン領域(単位)」ペインの下に、xとyの値を変更することで、スキャン範囲を設定します。
- ビデオフィードを確認するには、「ビデオとの距離」タブをクリックし、赤い枠で示さスキャン領域に収まるように、マウスを手配。校正するために「自動距離」をクリックしてください被写体までのレーザーからの距離。 「件名の詳細]ウィンドウを開くには、[次へ]をクリックします。
- 被験者情報および関連するコメントを入力します。スキャンウィンドウに移動するために[次へ]ボタンをクリックします。
- ダイアログ「スキャンの距離を確認したりオーバーライド」を開くには、「測定開始」ボタンをクリックします。スキャン距離を確認するために「OK」をクリックします。スキャン領域のサイズに応じて8分 - スキャン処理を開始し、4のために実行確認します。
- スキャンが完了したら、[名前を付けて保存]ウィンドウを観察します。ファイルに名前を付けて保存します。
- イソフルランを遮断し、空の回復ケージにマウスを移動し、動物が胸骨横臥位を維持できるようになるまで監視します。他のマウスを用いたケージに麻酔から回復するマウスを置かないでください。
- 画像解析ソフトウェアを開きます。 「開く」アイコンをクリックし、を参照し、分析用の画像ファイルを開きます。ファイルウィンドウで、フラックスを観察し、マウスの写真、カラー画像。
- フラックス画像上に関心領域(ROI)をマークするには、「表示のROI」アイコンをクリックします。次に「追加ポリゴン」ボタンをクリックし、ROIを描画する非外科的な肢の周りにカーソルをドラッグします。シェイプを閉じるには、右クリックします。選択し、再び「ポリゴンの追加」および外科四肢の周りのマッチングROIを描きます。
- 「画像のROI統計結果(PU)」ウィンドウを開くには、[統計情報]アイコンをクリックします。 「フラックス% '列内の磁束のパーセント差を観察します。
注:描かれた最初のROIが参考となります。
注:後続の各血流スキャンの前に、マウスを麻酔するために第1節で説明した手順に従い、ステップ画像に4.11から4.1動物インチ
結果
ここで説明するように、マウスの後肢血管系の適切な識別は、亜急性および急性後肢虚血の両方を誘導するための技術の再現性を確保するために重要です。動物試験における固有の変動に加えて、他の要因は、麻酔の種類、動物の位置(仰臥位対傾向)、体温( 図3参照 )を含む、レーザードップラー灌流画像(LDPI)の変動を導入することができ?...
ディスカッション
おそらく、この手順の中で最も挑戦的なステップは、大腿静脈から大腿動脈の分離です。より大きい直径の動脈に比べ大腿静脈の薄い壁が穿刺に対する感受性を増加させ、外科的処置の間に裂けます。静脈を破壊する可能性をPBSで湿らせた無菌の綿棒を使用して湿った傷を維持することによって低減することができます。血管の正確な操作および周囲組織を可能にするために、すべての鉗子?...
開示事項
The authors have no conflicts of interest to disclose.
謝辞
This study was supported by NIH grants R21HL118661, R56HL124444, and R01HL124444 to CDK, and by NIH grants R00HL103797 and R01HL125695 to JMM.
資料
| Name | Company | Catalog Number | Comments |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | Dumoxel |
| Dumont Style 5 Mini Forceps | Fine Science Tools | 11200-14 | Inox |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| 7 - 0 Silk Suture | Sharpoint | DA-2527N | |
| 5 - 0 Coated Vicryl Suture | Ethicon | J463G | |
| Graefe Forceps | Fine Science Tools | 11053-10 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-03 | |
| Artifical Tears Ointment | Rugby Laboratories | 0536-6550-91 | |
| Surgical Tape | 3M | 1530-0 | |
| Fine Cotton Swabs | Contec | SC-4 | |
| Temperature Controller | Physitemp | TCAT-2DF | |
| Ameroid Constrictors | Research Instruments SW | MMC-0.25 x 1.00-SS | |
| Hot Bead Sterilizer | |||
| Deltaphase Isothermal Pad | Braintree Scientific | 39DP | |
| Needle Driver | Fine Science Tools | ||
| Phosphate Buffered Saline | Gibco | 10010-023 | |
| Moor LDPI | Moor Instruments | moorLDI2 | |
| moorLDI Measurement software | Moor Instruments | v. 6.0 | |
| Hair Removal Cream | Nair |
参考文献
- Criqui, M. H., Aboyans, V. Epidemiology of peripheral artery disease. Circ. Res. 116, 1509-1526 (2015).
- Thukkani, A. K., Kinlay, S. Endovascular intervention for peripheral artery disease. Circ. Res. 116, 1599-1613 (2015).
- Vartanian, S. M., Conte, M. S. Surgical intervention for peripheral arterial disease. Circ. Res. 116, 1614-1628 (2015).
- Bonaca, M. P., Creager, M. A. Pharmacological treatment and current management of peripheral artery disease. Circ. Res. 116, 1579-1598 (2015).
- Conte, M. S., et al. Design and rationale of the PREVENT III clinical trial: edifoligide for the prevention of infrainguinal vein graft failure. Vasc Endovascular Surg. 39, 15-23 (2005).
- Pomposelli, F. B., et al. A decade of experience with dorsalis pedis artery bypass: analysis of outcome in more than 1000 cases. J. Vasc. Surg. 37, 307-315 (2003).
- Willigendael, E. M., et al. Smoking and the patency of lower extremity bypass grafts: a meta-analysis. J. Vasc. Surg. 42, 67-74 (2005).
- Schillinger, M., et al. Balloon angioplasty versus implantation of nitinol stents in the superficial femoral artery. N. Engl. J. Med. 354, 1879-1888 (2006).
- Marmagkiolis, K., et al. 12-month primary patency rates of contemporary endovascular device therapy for femoro-popliteal occlusive disease in 6,024 patients: beyond balloon angioplasty. Catheter. Cardiovasc. Interv. 84, 555-564 (2014).
- Rosenfield, K., et al. Trial of a Paclitaxel-Coated Balloon for Femoropopliteal Artery Disease. N. Engl. J. Med. 373, 145-153 (2015).
- Tepe, G., et al. Drug-coated balloon versus standard percutaneous transluminal angioplasty for the treatment of superficial femoral and popliteal peripheral artery disease: 12-month results from the IN.PACT SFA randomized trial. Circulation. 131, 495-502 (2015).
- Couffinhal, T., et al. Mouse model of angiogenesis. Am. J. Pathol. 152, 1667-1679 (1998).
- Niiyama, H., Huang, N. F., Rollins, M. D., Cooke, J. P. Murine model of hindlimb ischemia. J Vis Exp. , (2009).
- McClung, J. M., et al. Skeletal muscle-specific genetic determinants contribute to the differential strain-dependent effects of hindlimb ischemia in mice. Am. J. Pathol. 180, 2156-2169 (2012).
- Dokun, A. O., et al. A quantitative trait locus (LSq-1) on mouse chromosome 7 is linked to the absence of tissue loss after surgical hindlimb ischemia. Circulation. 117, 1207-1215 (2008).
- Rivard, A., et al. Age-dependent impairment of angiogenesis. Circulation. 99, 111-120 (1999).
- Hazarika, S., et al. Impaired angiogenesis after hindlimb ischemia in type 2 diabetes mellitus: differential regulation of vascular endothelial growth factor receptor 1 and soluble vascular endothelial growth factor receptor 1. Circ. Res. 101, 948-956 (2007).
- Couffinhal, T., et al. Impaired collateral vessel development associated with reduced expression of vascular endothelial growth factor in ApoE-/- mice. Circulation. 99, 3188-3198 (1999).
- Tang, G. L., Chang, D. S., Sarkar, R., Wang, R., Messina, L. M. The effect of gradual or acute arterial occlusion on skeletal muscle blood flow, arteriogenesis, and inflammation in rat hindlimb ischemia. J. Vasc. Surg. 41, 312-320 (2005).
- Yang, Y., et al. Cellular and molecular mechanism regulating blood flow recovery in acute versus gradual femoral artery occlusion are distinct in the mouse. J. Vasc. Surg. 48, 1546-1558 (2008).
- Litvak, J., Siderides, L. E., Vineberg, A. M. The experimental production of coronary artery insufficiency and occlusion. Am. Heart J. 53, 505-518 (1957).
- Bredee, J. J. An improved ameroid constrictor. Preliminary communication. J. Surg. Res. 9, 107-112 (1969).
- McClung, J. M., et al. Subacute limb ischemia induces skeletal muscle injury in genetically susceptible mice independent of vascular density. J. Vasc. Surg. , (2015).
- Hellingman, A. A., et al. Variations in surgical procedures for hind limb ischaemia mouse models result in differences in collateral formation. Eur. J. Vasc. Endovasc. Surg. 40, 796-803 (2010).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PloS one. 8, e84047 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved