Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Methoden für die akute und subakute Murine hindlimb Ischemia
In diesem Artikel
Zusammenfassung
Surgical induction of hindlimb ischemia in the mouse is useful to examine angiogenesis, however this is compromised in certain inbred mouse strains that display marked ischemia-induced tissue necrosis. Methods are described to induce subacute limb ischemia using ameroid constrictors to circumvent this problem through the induction of gradual arterial occlusion.
Zusammenfassung
Periphere arterielle Verschlusskrankheit (pAVK) ist eine führende Ursache für kardiovaskuläre Morbidität und Mortalität in den entwickelten Ländern und Tiermodellen, die zuverlässig die menschliche Krankheit zu reproduzieren sind notwendig, um neue Therapien für diese Krankheit zu entwickeln. Die Maus hindlimb Ischämie-Modell wurde für diesen Zweck, aber die gängige Praxis zu induzieren akute Ischämie der Extremitäten durch Ligatur der Arteria femoralis kann führen zu erheblichen Gewebsnekrosen, gefährden Ermittler die Fähigkeit zur Untersuchung der Gefäß und Skelettmuskelgewebe Reaktionen auf Ischämie weit verbreitet . Ein alternativer Ansatz zur Femoralarterie Ligierung ist die Induktion der graduellen Femoralarterie Okklusion durch die Verwendung von Ameroid constrictors. Wenn sie um die Oberschenkelarterie in der gleichen oder verschiedenen Stellen wie die Stellen der Femoralarterie Ligatur gelegt, okkludieren diese Vorrichtungen die Arterie über 1 - 3 Tage, was zu allmählicher, subakute Ischämie. Dies führt zu weniger beträchtliche Nekrose Skelettmuskelgewebe, which mehr nachahmen kann genau die Reaktionen im menschlichen PAD gesehen. Da der genetische Hintergrund Einflüsse Ergebnisse in den beiden akuten und subakuten Ischämie-Modellen Berücksichtigung der Mausstamm beobachtet, die bei der Auswahl der besten Modell wichtig ist. Dieses Papier beschreibt die richtige Verfahren und anatomische Platzierung der Ligatur oder Ameroid constrictor auf der Maus Femoralarterie subakuten oder akuten hinteren Gliedmaßen Ischämie in der Maus zu induzieren.
Einleitung
Periphere arterielle Verschlusskrankheit (pAVK) ist eine führende Ursache für kardiovaskuläre Morbidität und Mortalität in den entwickelten Ländern 1. PAD Ergebnisse von atherosklerotischen Obstruktion der peripheren Arterien, die mit den daraus resultierenden Belastungs oder Ruheschmerzen zu Extremitäten-Ischämie führt und gelegentlich nicht heilende Geschwüre und Gangrän, die Amputation von Gliedmaßen erforderlich machen. Therapien PAD Targeting sind darauf gerichtet , in erster Linie in Richtung endovaskuläre 2 oder chirurgische Revaskularisation 3, wie im wesentlichen keine wirksame medizinische Therapien 4 existieren.
Leider ist Revaskularisierung oft von begrenztem Nutzen, da Bypässen hohen Ausfallraten (bis zu 50% innerhalb von 5 Jahren) 5 , die in einigen Populationen schlimmer sind (zB Raucher, Frauen, nicht Vena saphena - Transplantate) 6,7. Endovaskuläre Ansätze, wie Angioplastie und Stent-Implantation, werden auch durch hohe Restenoseraten beeinträchtigt (mehr als 50% innerhalb von 1 Jahr), particulary in 8 femoropoplitealen Krankheit, obwohl die Verwendung von Medikamenten-freisetz Ballons und Stents Ergebnisse etwas 9-11 verbessert hat. Um neue Therapien für PAD zu entwickeln, ist es wichtig, Tiermodelle zu entwickeln, die zuverlässig die menschliche Krankheit zu reproduzieren.
Bis heute ist das häufigste Modell der PAD ist die hinteren Gliedmaßen Ischämie - Modell (HLI), die am häufigsten in Mäusen durchgeführt 12,13. In ihrer häufigsten Manifestation bringt das Modell chirurgische Ligation des proximalen und distalen Oberschenkelarterie und die dazwischenliegenden Seitenäste durch Exzision des Schiffes gefolgt, in Okklusion des Blutflusses und die Induktion von akuter Ischämie der Gliedmaßen zur Folge hat. HLI wurde in erster Linie zur Untersuchung der Angiogenese und Arteriogenese Reaktionen in peripheren Gliedmaßen Muskelgewebe und die Wirkungen von verschiedenen Therapien (zB Medikamente, Genabgabe, Stammzellen) auf diesen Reaktionen verwendet. In jüngerer Zeit hat sich unsere Gruppe dieses Modell die Rolle von Skelettmuskelzellen zu untersuchen, verwendeten in die Antwort 14 Ischämie und die Auswirkungen der genetischen Unterschiede auf die Ergebnisse zu Gliedmaßen.
Das HLI - Modell hat sich unser gegenwärtiges Verständnis erleichtert , dass die Gefäß- und Muskelreaktionen auf Ischämie auf Genetik abhängig sind (dh Inzuchtstamm) 15, 16 Jahre alt, und das Vorhandensein oder Fehlen von anderen Krankheiten oder Bedingungen , die für Atherosklerose, einschließlich Diabetes mellitus 17 und Hypercholesterinämie 18. Allerdings ist eine wichtige Schwäche des traditionellen HLI - Modell , dass es sich um ein Modell der akuten Extremitäten - Ischämie ist 12,13, während menschliche PAD chronische Ischämie als Folge der allmählichen Entwicklung der okklusiven atherosklerotischen Läsionen in den peripheren Arterien verursacht.
In einem Versuch , diese Schwäche zu umgehen, Tang und Kollegen zunächst ein Rattenmodell der allmählichen Oberschenkelarterienverschluss entwickelt mit Ameroid constrictors 19 und die gleiche Gruppe , die später developed ein ähnliches Mausmodell 20. Ameroid constrictors wurden in einem Hunde - Modell der chronischen Myokardischämie 21,22 ursprünglich in den 1950er Jahren beschrieben. Diese Vorrichtungen haben eine äußere Metallhülse umschließt eine innere Schicht aus einem hygroskopischen Material, üblicherweise Casein und wenn sie um eine Arterie platziert sie induzieren graduelle Gefäßverschluss, da sie Feuchtigkeit aus den umgebenden Geweben zu absorbieren. In ihrer Modifikation des Modells, Yang et al. Platziert constrictors sowohl auf der proximalen und distalen Oberschenkelarterie an Stellen analog zu den chirurgischen Ligationsstellen, und sie ligiert , die Seitenzweige der Femoralarterie, wie in dem herkömmlichen Modell. Im Vergleich zu akuten HLI führte Ameroid constrictor-induzierte Ischämie bei niedriger Expression von inflammatorischen und schubspannungsabhängigen Gene, senkt den Blutfluss Recovery 4 - 5 Wochen nach der Operation, und weniger Muskelnekrose 20. Auf der Grundlage dieser Beobachtungen wurde es, dass die schrittweise Arterienverschluss fühlte ein Modell P liefern könnteAD mehr relevant für die menschliche Krankheit.
Bemerkenswert ist , in dem ursprünglichen Bericht, Auswirkungen von Ameroid Konstriktor induzierte Ischämie wurden nur in C57BL / 6 - Mäusen 19, untersucht , die auf 15 - Nekrose ischämisch induzierter Muskel relativ resistent sind. Wir modifizierte kürzlich die allmähliche Ischämie - Modell weiter und erforscht ihre Auswirkungen in der mehr Ischämie-anfälligen BALB / c - Maus - Stamm 23. In der ersten Manifestation des Modells, legten wir constrictors sowohl auf der proximalen und distalen Oberschenkelarterie ließ aber alle Seitenzweige intakt. In einer zweiten, milder Modifikation, legten wir einen einzigen constrictor nur auf der proximalen Arteria femoralis und wieder links alle Seitenzweige der Arterie intakt. In beiden Modifikationen dieses Modells haben wir festgestellt, dass BALB / c-Mäusen, aber nicht C57BL / 6-Mäuse, zeigten eine signifikante Muskelnekrose trotz ähnlicher Blutfluss und Gefäßdichte. Ähnlich wie unsere früheren Studie 14 zeigten diese Ergebnisse , dass Gliedmaßen MuskelVerletzungen nicht allein durch den Blutfluss beeinflusst, sondern ist teilweise abhängig von genetischen Hintergrund. Darüber hinaus fanden wir, dass Gliedmaßen Blutfluss zu seinem Nadir innerhalb von 3 Tagen fiel, so dass das Modell scheint mehr ein von 'subakute' zu sein, anstatt schrittweise Extremitäten-Ischämie.
Auf der Grundlage dieser früheren Studien scheint es klar, dass ein einheitliches Verfahren zur hinteren Gliedmaßen Ischämie induziert nicht in allen Fällen geeignet sein können. Da eine Vielzahl von Bedingungen (zB genetische Unterschiede und das Vorhandensein oder Fehlen von Komorbiditäten) beeinflussen sowohl die vaskuläre und Skelettmuskel-spezifischen Antworten, Ermittler finden es notwendig , die Chronifizierung und / oder die Schwere der hinteren Gliedmaßen Ischämie am besten zu ändern passen ihre Zwecke. Des Weiteren vor Beschreibungen des Modells typischerweise geeignete anatomische Orientierungspunkte fehlten zuverlässige inter Ermittler Reproduzierbarkeit der Technik zu erleichtern. In diesem Dokument werden Verfahren zur entweder akute oder subakute hindlimb Ischämie in der Maus zu induzierenwerden beschrieben und präzise sind anatomische Orientierungspunkte zur Verfügung gestellt.
Protokoll
Alle Tierversuche wurden gemäß dem Protokoll vom Herzog Institutional Animal Care und Use Committee genehmigt durchgeführt. Männliche Mäuse wurden in dieser Studie verwendet, obwohl beiderlei Geschlechts verwendet werden, wie für den wissenschaftlichen Zweck der Studie angegeben.
1. Haarentfernung
- Vor der Einleitung der Narkose, eine präoperative Vorbereitungsbereich, bestehend aus einem abgedeckten Heizkissen gesetzt bei 37 ° C und einer nosecone Port angeschlossen kontinuierlichen Fluss von Isofluran eingerichtet.
- Platzieren Sie die Maus in der Anästhesie Induktionskammer. Stellen Sie den O 2 Durchflussmesser auf 1 l / min und Isofluran auf 1 - 3%.
HINWEIS: Anesthesia wird typischerweise in einer 25 g Maus mit 2% Isofluran induziert. - Überprüfen Sie die Reizantwort der Maus, indem Sie vorsichtig die Kammer Schaukeln und einen Mangel an einem aufrichtenden Reflex zu beobachten.
- Spülen Sie die Kammer mit O 2 zu deaktivieren Sie die Isofluran vor dem Öffnen. bewegen Sie schnell die Maus an die Heizung pAnzeige und schließen Sie es über den nosecone zu Isofluran.
- Stellen Sie die Isofluran auf 1,5%. Überprüfen Sie die Reizantwort durch Pedal Reflex (toe Prise).
- Bewerben ophthalmische Schmiermittel großzügig auf beiden Augen Trocknen während der Operation zu vermeiden.
- Rasieren Sie die Haare von beiden Hinterbeine einen kleinen elektrischen Trimmer. Halten Sie die straffe Haut während der Rasur zerreißt die Haut zu vermeiden.
- Bewerben vorgewärmten Enthaarungscreme und lassen für 1 Minute sitzen. mit einem angefeuchteten Gazeauflage vorsichtig abwischen.
- Für chirurgische Verfahren zu einem späteren Zeitpunkt, drehen Sie die Isofluran und bewegen Sie die Maus auf einen leeren Papiertuch gesäumten Erholungskäfig aus die Maus, um sicherzustellen, ist der Käfig Bettwäsche nicht ansaugen. Überwachen Sie das Tier, bis es in der Lage ist Brustlage zu halten. Andernfalls die Maus an den OP-Tisch zu bewegen.
HINWEIS: Die Haarentfernung Prozess kann die Haut reizen und Perfusions - Messungen beeinflussen. Es wird empfohlen, 1 bis warten - 2 Tage nach den Tierhaaren vor p Entfernenerforming eine präoperative Perfusion Scan oder eine Operation durchgeführt wird.
2. Pre-OP-Vorbereitung
- Verwenden Sie die folgenden Werkzeuge während dieses Verfahrens; kleine gerade chirurgische Scheren, zwei fein kippte abgewinkelte Pinzette, kleine Graefe Pinzetten, Nadeltreiber Zange, 3 Retraktoren, kleine Feder Schere und fein kippte Wattestäbchen.
- Sterilisieren alle Werkzeuge, einen Autoklaven vor dem Beginn der Operation verwendet wird. Verwenden eines Heiß bead Sterilisator vor und zwischen jedem chirurgischen Verfahren, für bis zu 5 Tieren. Sterilisieren zusätzliche chirurgische Werkzeug-Pakete für Operationen von Gruppen mit mehr als 5.
- Bereiten Sie einen sterilen OP-Bereich, bestehend aus einer überdachten Heizkissen und einer Isofluran-Port. Alle Arbeiten im Rahmen eines 10-Stereo-Präpariermikroskop.
- Anesthetize und die Maus herzustellen, wie in den Schritten 1.1 bis 1.5 beschrieben.
- Überprüfen Sie, ob die Maus vollständig sediert und in einen Rückenlage auf dem OP-Tisch. Sichern Sie beide Beine chirurgische Klebeband.
- Wenn ein temperaturgesteuertes Heizkissen verwendet, den Temperaturfühler befestigen und an der Basis der chirurgischen Plattform befestigen chirurgisches Band verwendet, um sicherzustellen, dass es nicht versehentlich während des Verfahrens herausgezogen werden.
- Reinigen Sie die Inzisionsstelle mit 3 Wechsel Povidon-Iod und Alkoholtupfer. Decken Sie das Tier mit einem sterilen Operationstuch und schneiden Sie ein Loch, um die Einschnittstelle zu belichten.
3. Induktion von Limb Ischemia
- Verwenden Sie ein Skalpell einen anfänglichen Schnitt entlang der Mitte des medialen Oberschenkel zu machen, vom Knie in Richtung Bauch läuft, und verlängern den Schnitt auf etwa 1 cm mit einer feinen Schere (Abbildung 1A).
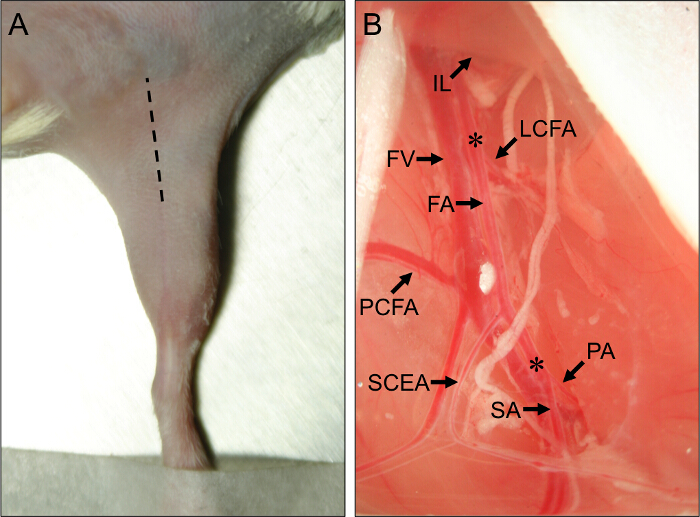
Abbildung 1. Operationsstelle und Gefäß Anatomische Leitstrukturen für Maus hindlimb Ischemia Chirurgie. (A) Außenansichtdie hinteren Gliedmaßen einer Maus in der Rückenlage. Die gestrichelte Linie zeigt die Einschnittstelle , um richtig die hinteren Gliedmaßen Ischämie Verfahren durchführen. (B) Ansicht des proximalen Maus hindlimb Gefäße. Das proximale Ende der Femoralarterie (FA) entsteht, von unterhalb des Leistenbandes (IL). Das distale Ende des FA ist an seinem Gabelung in die A. poplitea (PA) und die Saphena-Arterie (SA) angeordnet ist. Die Haupt Kollateralarterien aus der FA sind die seitlichen circumflex Femoralarterie (LCFA), der proximal caudal Femoralarterie (pCFA) und die oberflächliche caudal epigastric Arterie (SCEA). Die Oberschenkelvene (FV) läuft zum FA benachbarten und venösen Zweige können zu den großen Arterienäste parallel zu sehen. Sternchen (*) bezeichnen die proximalen und distalen Stellen für die Platzierung von Ameroid constrictors oder Ligaturen, je nachdem , ob subakute oder akute Ischämie wird induziert werden. Bitte click hier eine größere Version dieser Figur zu sehen.
- Mit einer Pinzette, öffnen Sie den Schnitt und setzen die Membran für den Leisten Fettgewebe (IFT).
- Mit geschlossener Zange, durchdringen die Membran in die Trennung zwischen dem IFT und den Bauch. Lösen Sie vorsichtig Druck auf die Zange die IFT aus den Bauchmuskeln zu trennen, darunter das Gefäßnervenbündel ausgesetzt wird. Beachten Sie die proximalen und oberflächlichen Schwanz Zweige als wichtige anatomische Orientierungspunkte (Abbildung 1B).
- Legen Sie eine Aufroller und ziehen proximal an den Bauchgewebe des proximalen Ameroid constrictor oder Ligierungsstelle auszusetzen, nur proximal der A. circumflexa femoris lateralis (1B). Die seitliche Kranzarterie liegt etwa 5 mm proximal zu dem proximalen und oberflächlichen Schwanzarterien.
- Legen Sie zwei weitere Retraktoren in den distalen Teil des Einschnitts, einer medialen und einer lateralen, die IFT distal weg von der zu ziehenOperationsstelle das Operationsfeld zu erweitern.
- Verwenden Sie zwei feinen Pinzette die äußerste Membran Abdeckung der Gefäßnervenbündel zu entfernen. Setzen Sie vorsichtig eine Hälfte der feinen Pinzette Spitze zwischen der Vene und Arterie, die Zangenspitze unter der Membran Gleiten, die sie zusammenhält. Schließen Sie die Zange und sanft reißen die Membran entfernt.
- Legen Sie die Spitze eines geschlossenen Zange zwischen der Vene und Arterie und erstellen auf der Zange eine Lücke zwischen ihnen durch Druck freigibt. Wiederholen Sie diese Technik, um eine Lücke zwischen der Arterie und Nerven zu erzeugen.
- Für subakute Extremitäten - Ischämie, legen Sie eine Ameroid constrictor auf der proximalen Arteria femoralis (Abbildung 2).
- Um den proximalen Ameroid constrictor installieren, schieben Sie die Spitze einer Zange unter der Femoralarterie es aus dem Gefäßnervenbündel zu isolieren. Verwenden Sie einen zweiten Satz von Winkel- Zange zu greifen den Rand des constrictor und führen ihn unter der Femoralarterie.
- Legen Sie die Femoralarterie in die sviel in der constrictor. Wiederholen Sie dies für das distale constrictor, positionieren sie unmittelbar proximal zu der Gabelung der Arteria femoralis in die Arteria poplitea und Vena Arterie (Abbildung 2).
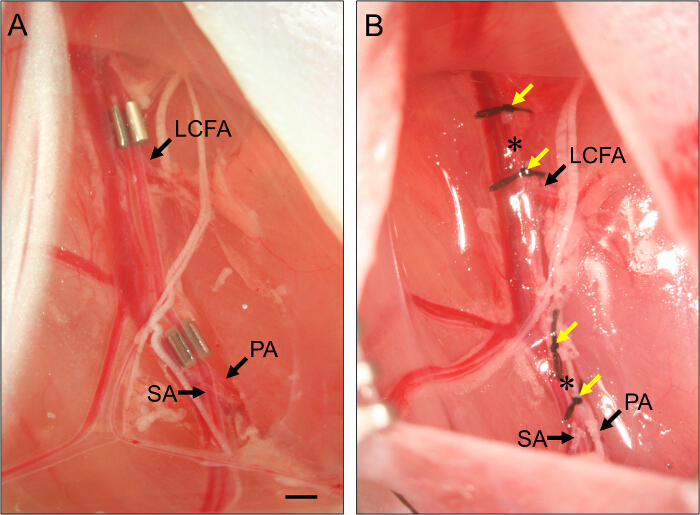
Abbildung 2. Platzierung von Ameroid constrictor und Ligatures. (A) Beispiel für zwei Ameroid constrictor auf die Femoralarterie platziert subakute hindlimb Ischämie induzieren. Der proximale constrictor ist gerade proximal der A. circumflexa femoris lateralis (LCFA) gestellt. Das distale constrictor ist gerade proximal der Bifurkation der poplitea (PA) und Vena Arterien (SA) platziert. Constrictor sind mit der Schlitz richtig im constrictor. (B) Beispiel für Ligatur der A. femoralis zu induzieren akute hindlimb Ischämie festgelegt wird , um die Arterie , um sicherzustellen , nach oben eingelegt. LigaturES (gelbe Pfeile) sind so angeordnet, dass sie die Position der constrictors in Tafel (B) flankieren, und die Arteria femoralis ist zwischen jedem Satz von zwei Ligaturen (Sternchen) durchtrennt. Bar, 1 mm. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
- Für die akute Ischämie der Extremitäten, abzubinden und die proximalen Arteria femoralis transect.
- Um die Femoralarterie transect, Gewinde 7 - O Naht unter der Arterie proximal zu der Position des proximalen constrictor (siehe Schritt 3.7) und Ligat. Binden Sie eine zweite Ligatur etwa 1 mm distal der ersten.
- Verwenden Sie Feder Schere, um die Arterie zwischen den beiden Ligaturen transect. Für die distale arterielle Durchtrennung, wiederholen Sie diese Schritte, wenn man zwei Ligaturen etwa 1 mm auseinander, gerade proximal zu der Gabelung der Arteria femoralis in die Arteria poplitea und Vena Arterie aber sicherzustellen, dass sie auf die oberflächliche caud distalal A. epigastrica (siehe Abbildung 1)
- Schließen Sie den Schnitt mit unterbrochen 5 - O Vicryl Nähten.
4. Perfusionsbildgebung
- Bewegen Sie die Maus auf eine 37 ° C Heizkissen unter dem Laser Doppler Perfusion Imager eingestellt (LDPI) und über eine nosecone an die Isofluran-Quelle verbinden. Wenn kein Temperaturmonitor verfügbar ist, erhalten Sie 5 min für die Maus auf 37 ° C zu erwärmen.
- Schalten Sie den Scanner und starten Sie die Bild-Capture-Software.
- Klicken Sie auf die "Neue Single-Bild 'Symbol zum Öffnen des" Scanner-Setup' Fenster. Stellen Sie die "Scanformat" auf "Large" und die "Scan-Geschwindigkeit" auf "4 ms / Pixel". Stellen Sie den Scanbereich durch die x- und y-Werte unter der "Scanbereich (Einheiten)" Scheibe ändern.
- Klicken Sie auf die 'Video und Entfernung "die Registerkarte Video-Feed anzuzeigen, und ordnen Sie die Maus in den Scanbereich durch eine rote Umrandung angezeigt zu passen. Klicken Sie auf "Auto Distance 'zu kalibrierenDie Entfernung von dem Laser zu dem Thema. "Weiter" klicken, um das "Betreff Details 'Fenster zu öffnen.
- Geben Sie den Betreff und alle relevanten Kommentare ein. Klicken Sie auf die Schaltfläche "Weiter", um Scanfenster zu bewegen.
- Klicken Sie auf die Schaltfläche "Messung starten" zu öffnen Sie die "Bestätigen oder außer Kraft setzen Scan Distance 'Dialog. Klicken Sie auf 'OK' Scan-Abstand zu bestätigen. Beachten Sie die Scan-Prozess beginnen und führen für 4 - 8 min von der Größe des Scanbereichs abhängig.
- Nach Abschluss der Prüfung abgeschlossen ist, beachten Sie die "Speichern unter" Fenster. Benennen Sie die Datei und speichern Sie es.
- Fahren Sie die Isofluran und bewegen Sie die Maus auf einen leeren Erholungskäfig ab und zu überwachen, bis das Tier in der Lage ist Brustlage zu halten. Stellen Sie niemals eine Maus aus der Narkose in einen Käfig mit anderen Mäusen erholt.
- Öffnen Sie die Bildanalyse-Software. Klicken Sie auf die "Öffnen" Symbol und navigieren Sie zu und öffnen Sie die Bilddatei für die Analyse. Auf dem Dateifenster beobachten den Fluss,Foto und Farbbilder der Maus.
- Um die Region of Interest (ROI) auf dem Fluss Bild zu markieren, klicken Sie auf die 'Show ROIs' Symbol. Als nächstes klicken Sie auf die Schaltfläche "Hinzufügen Polygon" und ziehen Glied den Cursor auf dem nicht-chirurgische den ROI zu ziehen. Rechtsklick auf die Form zu schließen. Wählen Sie 'Add Polygon' wieder und zeichnen Sie einen passenden ROI um den OP-Glied.
- Klicken Sie auf das Symbol "Statistik", das "Image ROIs Statistik Ergebnisse (PU) 'zu öffnen Fenster. Beachten Sie die prozentuale Differenz im Fluss in der "Flux%" Spalte.
HINWEIS: Der erste ROI gezogen wird als Referenz dienen.
HINWEIS: Vor jedem Scan nachfolgende Perfusion befolgen Sie die Anweisungen in Abschnitt 1 der Maus und in Schritten von 4,1 bis 4,11 zu Bild zu betäuben das Tier.
Ergebnisse
Richtige Identifizierung der Maus hindlimb Vaskulatur ist kritisch Reproduzierbarkeit der Techniken zur Gewährleistung sowohl subakute und akute Ischämie der hinteren Gliedmaßen Induzieren wie hier beschrieben. Zusätzlich zu der inhärenten Variation in Tierstudien können andere Faktoren Variabilität in Laser Doppler Perfusion Imaging (LDPI) einzuführen, einschließlich der Art der Anästhesie, die Position des Tieres (supine vs. anfällig) und Körpertemperatur (siehe
Diskussion
Vielleicht ist der schwierigste Schritt bei diesem Verfahren ist die Trennung von der Femoralarterie von der Femoralvene. Der größere Durchmesser und dünnere Wände der Femoralvene, die denen der Arterie im Vergleich zu erhöhen seine Anfälligkeit während der chirurgischen Manipulation zu durchstechen und zu zerreißen. Die Wahrscheinlichkeit, dass die Vene stören können, indem sie die Wunde feucht mit einem sterilen Tupfer angefeuchtet mit PBS reduziert werden. Es ist auch wichtig, um sicherzustellen, dass alle ...
Offenlegungen
The authors have no conflicts of interest to disclose.
Danksagungen
This study was supported by NIH grants R21HL118661, R56HL124444, and R01HL124444 to CDK, and by NIH grants R00HL103797 and R01HL125695 to JMM.
Materialien
| Name | Company | Catalog Number | Comments |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | Dumoxel |
| Dumont Style 5 Mini Forceps | Fine Science Tools | 11200-14 | Inox |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| 7 - 0 Silk Suture | Sharpoint | DA-2527N | |
| 5 - 0 Coated Vicryl Suture | Ethicon | J463G | |
| Graefe Forceps | Fine Science Tools | 11053-10 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-03 | |
| Artifical Tears Ointment | Rugby Laboratories | 0536-6550-91 | |
| Surgical Tape | 3M | 1530-0 | |
| Fine Cotton Swabs | Contec | SC-4 | |
| Temperature Controller | Physitemp | TCAT-2DF | |
| Ameroid Constrictors | Research Instruments SW | MMC-0.25 x 1.00-SS | |
| Hot Bead Sterilizer | |||
| Deltaphase Isothermal Pad | Braintree Scientific | 39DP | |
| Needle Driver | Fine Science Tools | ||
| Phosphate Buffered Saline | Gibco | 10010-023 | |
| Moor LDPI | Moor Instruments | moorLDI2 | |
| moorLDI Measurement software | Moor Instruments | v. 6.0 | |
| Hair Removal Cream | Nair |
Referenzen
- Criqui, M. H., Aboyans, V. Epidemiology of peripheral artery disease. Circ. Res. 116, 1509-1526 (2015).
- Thukkani, A. K., Kinlay, S. Endovascular intervention for peripheral artery disease. Circ. Res. 116, 1599-1613 (2015).
- Vartanian, S. M., Conte, M. S. Surgical intervention for peripheral arterial disease. Circ. Res. 116, 1614-1628 (2015).
- Bonaca, M. P., Creager, M. A. Pharmacological treatment and current management of peripheral artery disease. Circ. Res. 116, 1579-1598 (2015).
- Conte, M. S., et al. Design and rationale of the PREVENT III clinical trial: edifoligide for the prevention of infrainguinal vein graft failure. Vasc Endovascular Surg. 39, 15-23 (2005).
- Pomposelli, F. B., et al. A decade of experience with dorsalis pedis artery bypass: analysis of outcome in more than 1000 cases. J. Vasc. Surg. 37, 307-315 (2003).
- Willigendael, E. M., et al. Smoking and the patency of lower extremity bypass grafts: a meta-analysis. J. Vasc. Surg. 42, 67-74 (2005).
- Schillinger, M., et al. Balloon angioplasty versus implantation of nitinol stents in the superficial femoral artery. N. Engl. J. Med. 354, 1879-1888 (2006).
- Marmagkiolis, K., et al. 12-month primary patency rates of contemporary endovascular device therapy for femoro-popliteal occlusive disease in 6,024 patients: beyond balloon angioplasty. Catheter. Cardiovasc. Interv. 84, 555-564 (2014).
- Rosenfield, K., et al. Trial of a Paclitaxel-Coated Balloon for Femoropopliteal Artery Disease. N. Engl. J. Med. 373, 145-153 (2015).
- Tepe, G., et al. Drug-coated balloon versus standard percutaneous transluminal angioplasty for the treatment of superficial femoral and popliteal peripheral artery disease: 12-month results from the IN.PACT SFA randomized trial. Circulation. 131, 495-502 (2015).
- Couffinhal, T., et al. Mouse model of angiogenesis. Am. J. Pathol. 152, 1667-1679 (1998).
- Niiyama, H., Huang, N. F., Rollins, M. D., Cooke, J. P. Murine model of hindlimb ischemia. J Vis Exp. , (2009).
- McClung, J. M., et al. Skeletal muscle-specific genetic determinants contribute to the differential strain-dependent effects of hindlimb ischemia in mice. Am. J. Pathol. 180, 2156-2169 (2012).
- Dokun, A. O., et al. A quantitative trait locus (LSq-1) on mouse chromosome 7 is linked to the absence of tissue loss after surgical hindlimb ischemia. Circulation. 117, 1207-1215 (2008).
- Rivard, A., et al. Age-dependent impairment of angiogenesis. Circulation. 99, 111-120 (1999).
- Hazarika, S., et al. Impaired angiogenesis after hindlimb ischemia in type 2 diabetes mellitus: differential regulation of vascular endothelial growth factor receptor 1 and soluble vascular endothelial growth factor receptor 1. Circ. Res. 101, 948-956 (2007).
- Couffinhal, T., et al. Impaired collateral vessel development associated with reduced expression of vascular endothelial growth factor in ApoE-/- mice. Circulation. 99, 3188-3198 (1999).
- Tang, G. L., Chang, D. S., Sarkar, R., Wang, R., Messina, L. M. The effect of gradual or acute arterial occlusion on skeletal muscle blood flow, arteriogenesis, and inflammation in rat hindlimb ischemia. J. Vasc. Surg. 41, 312-320 (2005).
- Yang, Y., et al. Cellular and molecular mechanism regulating blood flow recovery in acute versus gradual femoral artery occlusion are distinct in the mouse. J. Vasc. Surg. 48, 1546-1558 (2008).
- Litvak, J., Siderides, L. E., Vineberg, A. M. The experimental production of coronary artery insufficiency and occlusion. Am. Heart J. 53, 505-518 (1957).
- Bredee, J. J. An improved ameroid constrictor. Preliminary communication. J. Surg. Res. 9, 107-112 (1969).
- McClung, J. M., et al. Subacute limb ischemia induces skeletal muscle injury in genetically susceptible mice independent of vascular density. J. Vasc. Surg. , (2015).
- Hellingman, A. A., et al. Variations in surgical procedures for hind limb ischaemia mouse models result in differences in collateral formation. Eur. J. Vasc. Endovasc. Surg. 40, 796-803 (2010).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PloS one. 8, e84047 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten