Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Méthodes de aiguë et subaiguë murin Ischémie membres postérieurs
Dans cet article
Résumé
Surgical induction of hindlimb ischemia in the mouse is useful to examine angiogenesis, however this is compromised in certain inbred mouse strains that display marked ischemia-induced tissue necrosis. Methods are described to induce subacute limb ischemia using ameroid constrictors to circumvent this problem through the induction of gradual arterial occlusion.
Résumé
La maladie artérielle périphérique (MAP) est une cause majeure de morbidité cardiovasculaire et de mortalité dans les pays développés, et les modèles animaux qui reproduisent de manière fiable la maladie humaine sont nécessaires pour développer de nouvelles thérapies pour cette maladie. Le modèle hindlimb de la souris d'ischémie a été largement utilisé à cette fin, mais la pratique courante d'induire une ischémie des membres aiguë par ligature de l'artère fémorale peut entraîner une nécrose tissulaire importante, ce qui compromet la capacité des chercheurs à étudier les vasculaires et les tissus des muscles squelettiques des réponses à l'ischémie . Une approche alternative à la ligature de l'artère fémorale est l'induction d'une occlusion progressive de l'artère fémorale à l'aide d'améroïde constricteurs. Lorsqu'il est placé autour de l'artère fémorale, identiques ou différents emplacements que les sites de ligature de l'artère fémorale, ces dispositifs occlure l'artère au-dessus de 1 - 3 jours, soit plus progressive, la panencéphalite ischémie. Cela se traduit par une nécrose osseuse moins importante du tissu musculaire, wUEL peut imiter de plus près les réponses observées chez PAD humaine. Parce génétiques influences de fond les résultats dans les deux modèles d'ischémie aiguë et subaiguë, l'examen de la souche de souris à l'étude est important dans le choix du meilleur modèle. Cet article décrit la procédure appropriée et le placement anatomique des ligatures ou constricteurs améroïde sur l'artère fémorale de la souris pour induire subaiguë ou hindlimb ischémie aiguë chez la souris.
Introduction
La maladie artérielle périphérique (MAP) est une cause majeure de morbidité et de mortalité cardiovasculaire dans les pays développés 1. Résultats de la PAD de obstruction athéroscléreuse des artères périphériques qui conduit à une ischémie des membres avec la douleur exertional ou de repos résultante et parfois des ulcères et des gangrènes qui nécessitent l'amputation des membres non-guérison. Les thérapies ciblant PAD sont dirigés principalement vers endovasculaire 2 ou revascularisation chirurgicale 3, comme essentiellement aucun traitement médical efficaces existent 4.
Malheureusement, la revascularisation est souvent d' un intérêt limité, comme les greffes de dérivation ont des taux d'échec élevés (jusqu'à 50% dans les 5 ans) 5 qui sont pires dans certaines populations (par exemple, les fumeurs, les femmes, les greffes de veine non-saphènes) 6,7. des approches endovasculaires, telles que l'angioplastie et la pose de stents, sont également compromis par les taux de resténose élevés (supérieurs à 50% à moins de 1 an), i particularyn fémoropoplité maladie 8, bien que l'utilisation de ballons et stents à élution médicamenteuse est quelque peu améliorée 9-11 résultats. Afin de développer de nouveaux traitements pour PAD, il est essentiel de développer des modèles animaux qui reproduisent de manière fiable la maladie humaine.
À ce jour, le modèle le plus commun de PAD est le modèle d'ischémie des membres postérieurs (HLI), qui est le plus souvent réalisée chez des souris 12,13. Dans sa manifestation la plus fréquente, le modèle implique la ligature chirurgicale de l'artère fémorale proximale et distale, et ses branches latérales intermédiaires suivie de l'excision du récipient, ce qui entraîne une occlusion de la circulation sanguine et l'induction d'une ischémie aiguë. HLI a été utilisé principalement pour étudier les réponses angiogéniques et artériogénique dans le tissu musculaire des membres périphériques et les effets de divers traitements (par exemple, les médicaments, la délivrance de gènes, les cellules souches) sur ces réponses. Plus récemment, notre groupe a utilisé ce modèle pour examiner le rôle des cellules musculaires squelettiques in la réponse à une ischémie des membres et les effets des différences génétiques sur les résultats 14.
Le modèle de HLI a facilité notre compréhension actuelle que les vasculaires et musculaires réponses à l' ischémie dépendent de la génétique ( par exemple, la souche consanguine) 15, 16 ans, et la présence ou l' absence d'autres maladies ou conditions pertinentes à l' athérosclérose, y compris le diabète sucré 17 et hypercholesterolemia 18. Cependant, une faiblesse importante du modèle traditionnel HLI est qu'il est un modèle d'ischémie des membres aiguë 12,13, alors que PAD humaine provoque une ischémie chronique à la suite de la mise en place progressive des lésions athérosclérotiques occlusifs dans les artères périphériques.
Dans une tentative de contourner cette faiblesse, Tang et ses collègues d' abord mis au point un modèle de rat de progressive occlusion artérielle fémorale en utilisant constricteurs améroïde 19, et le même groupe a ensuite developed un modèle de souris similaire 20. Constricteurs améroïde ont été décrits initialement dans les années 1950 dans un modèle canin d'ischémie chronique du myocarde 21,22. Ces dispositifs présentent un manchon métallique extérieur recouvrant une couche interne d'un matériau hygroscopique, le plus souvent la caséine, et lorsqu'il est placé autour de l'artère, ils induisent une occlusion progressive des vaisseaux car ils absorbent l'humidité à partir des tissus environnants. Dans leur modification du modèle, Yang et al. , Placé constricteurs à la fois l' extrémité proximale et l' artère fémorale distale au niveau de sites analogues aux sites de ligature chirurgicale, et on ligature les branches latérales de l'artère fémorale, comme dans le modèle traditionnel. Par rapport à HLI aiguë, améroïde ischémie constrictor-conduit à une plus faible expression des gènes de stress dépendant inflammatoires et de cisaillement, inférieure récupération de flux sanguin 4 - 5 semaines après l'opération, et moins nécrose musculaire 20. Sur la base de ces observations, il a été estimé que l'occlusion artérielle progressive pourrait fournir un modèle de PAD plus pertinent pour la maladie humaine.
Notamment, dans le rapport initial, les effets de améroïde ischémie constrictor été examinés uniquement dans C57BL / 6 19, qui sont relativement résistants à l' ischémie induite par nécrose musculaire 15. Nous avons récemment modifié le modèle d'ischémie progressive plus loin et exploré ses effets dans l'ischémie-sensibles BALB / c souche plus de la souris 23. Dans la première manifestation du modèle, nous avons placé constricteurs à la fois proximale et distale artère fémorale, mais toutes les branches latérales laissées intactes. Dans une seconde, modification plus doux, nous avons placé un seul constrictor seulement sur l'artère fémorale proximale et encore tous les secondaires Braches de l'artère laissé intact. Dans les deux modifications de ce modèle, nous avons constaté que souris BALB / c, mais pas C57BL / 6 souris, affiche significative nécrose musculaire malgré le flux sanguin similaire et la densité vasculaire. Semblable à notre étude précédente 14, ces résultats ont démontré que le membre musculaireblessure est non seulement influencée par le flux sanguin, mais elle est en partie dépendante de fond génétique. De plus, nous avons constaté que la circulation sanguine des membres est tombé à son nadir dans les 3 jours, donc le modèle semble être plus une «subaiguë» plutôt que progressive ischémie des membres.
Sur la base de ces études antérieures, il semble clair qu'une seule méthode pour induire une ischémie hindlimb peut ne pas convenir dans tous les cas. Parce que une variété de conditions (par exemple, les différences génétiques et de la présence ou l' absence de conditions de co-morbidité) influencent à la fois vasculaire et des réponses spécifiques du muscle squelettique, les enquêteurs peut juger nécessaire de modifier la chronicité et / ou la gravité de hindlimb ischémie au mieux répondre à leurs besoins. En outre, les descriptions antérieures du modèle généralement manquaient de repères anatomiques appropriés pour faciliter la reproductibilité fiable inter-investigateur de la technique. Dans cet article, les méthodes pour induire soit aiguë ou subaiguë hindlimb ischémie chez la sourissont décrits, et des repères anatomiques précis sont fournis.
Protocole
Toutes les expériences animales ont été effectuées selon le protocole approuvé par le Comité des soins et l'utilisation des animaux institutionnels Duke. Des souris mâles ont été utilisées dans cette étude, bien que ce soit le sexe peut être utilisé comme il est indiqué dans le but scientifique de l'étude.
1. Épilation
- Avant l'induction de l'anesthésie, mettre en place une zone de préparation pré-chirurgicale constituée d'un coussin chauffant couvert réglé à 37 ° C et un port nosecone connecté à flux continu de l'isoflurane.
- Placer la souris dans la chambre d'induction d'anesthésie. Réglez le débitmètre O 2 à 1 L / min et isoflurane 1 - 3%.
REMARQUE: L' anesthésie est induite en général dans un 25 g de souris avec 2% d' isoflurane. - Vérifiez la réponse du stimulus de la souris en secouant délicatement la chambre et en observant l'absence d'un réflexe de redressement.
- Purger la chambre avec O 2 pour effacer l'isoflurane avant l'ouverture. Déplacez rapidement la souris pour le chauffage pannonce et le connecter à isoflurane via le nosecone.
- Réglez le isoflurane à 1,5%. Vérifiez la réponse du stimulus par la pédale réflexe (pincement de l'orteil).
- Appliquer du lubrifiant ophtalmique généreusement sur les deux yeux pour éviter le séchage pendant la chirurgie.
- Raser les cheveux des deux membres postérieurs en utilisant une petite tondeuse électrique. Tenir la peau tendue pendant le rasage pour éviter lacérer la peau.
- Appliquer préchauffée crème d'épilation et laisser reposer pendant 1 min. Essuyez délicatement en utilisant un tampon de gaze humidifiée.
- Pour intervention chirurgicale à un moment plus tard, éteignez l'isoflurane et déplacez la souris à un vide papier essuie-tout rétablissement cage pour assurer la souris ne pas aspirer la litière de la cage. Surveiller l'animal jusqu'à ce qu'il soit en mesure de maintenir décubitus sternale. Sinon, déplacez la souris à la table chirurgicale.
NOTE: Le processus d'épilation peut irriter la peau et affecter les mesures de perfusion. Il est recommandé d'attendre 1 - 2 jours après avoir enlevé les cheveux de l'animal avant performing une scintigraphie de perfusion pré-chirurgicale ou d'effectuer une intervention chirurgicale.
Préparation 2. Pré-chirurgical
- Utilisez les outils suivants au cours de cette procédure; petits ciseaux chirurgicaux droites, 2 pinces inclinées à pointe fine, petites pinces Graefe, pinces de pilote d'aiguilles, 3 écarteurs, petits ciseaux à ressort, et tampons de coton à pointe fine.
- Stériliser tous les outils en utilisant un autoclave avant le début de la chirurgie. Utilisez un stérilisateur à chaud perles avant et entre chaque intervention chirurgicale, pour un maximum de 5 animaux. Stériliser paquets supplémentaires d'outils chirurgicaux pour les chirurgies de groupes de plus de 5.
- Préparer un champ opératoire stérile constitué d'un coussin chauffant et un orifice recouvert isoflurane. Effectuer tous les travaux sous un microscope de dissection 10 stéréo.
- Anesthetize et préparer la souris comme décrit dans les étapes 1.1 à 1.5.
- Vérifiez que la souris est complètement sous sédation et placer dans une position couchée sur la table chirurgicale. Fixer les deux jambes à l'aide de ruban adhésif chirurgical.
- Si vous utilisez un coussin chauffant à température contrôlée, fixez la sonde de température et de le fixer à la base de la plate-forme chirurgicale en utilisant du ruban chirurgical pour assurer qu'il ne sera pas accidentellement tiré pendant la procédure.
- Nettoyer le site d'incision en utilisant 3 alternance povidone-iode et d'alcool lingettes. Couvrir l'animal avec un drap chirurgical stérile et découper un trou pour exposer le site d'incision.
3. Induction de Limb Ischémie
- Utiliser un scalpel pour faire une incision le long du centre initial de la cuisse médiale, courant à partir du genou vers l'abdomen, et d' allonger l'incision jusqu'à environ 1 cm avec des ciseaux fins (figure 1A).
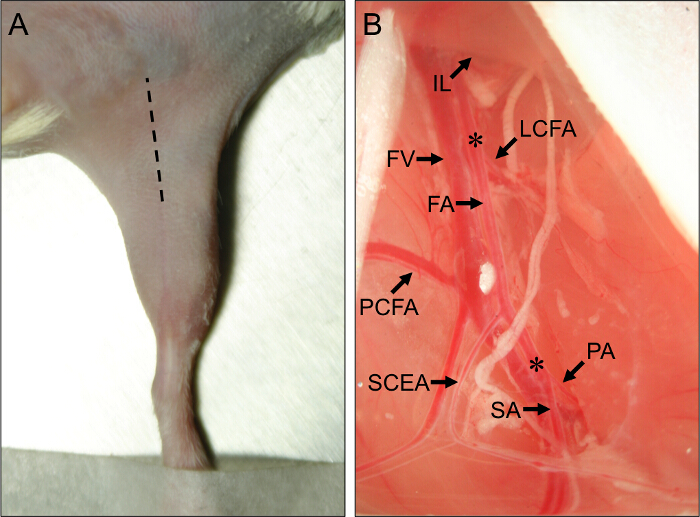
Figure 1. Site chirurgical et vasculaires anatomiques Repères pour la chirurgie de la souris Ischémie membres postérieurs. (A) Vue extérieure dela patte arrière d'une souris dans la position couchée sur le dos. La ligne hachurée indique le site d'incision pour effectuer correctement les procédures hindlimb d'ischémie. (B) Vue de l' extrémité proximale de la souris hindlimb vascularisation. L'extrémité proximale de l'artère fémorale (FA) provient de dessous du ligament inguinal (IL). L'extrémité distale de la FA se trouve dans sa bifurcation de l'artère poplitée (PA) et l'artère saphène (SA). Les principales artères collatérales hors de la FA sont l'artère fémorale latérale circonflexe (LCFA), l'artère fémorale caudale proximale (PCFA), et l'artère épigastrique caudale superficielle (SCEA). La veine fémorale (FV) fonctionne à côté de la FA, et les branches veineuses peut être vu parallèlement aux grandes branches artérielles. Les astérisques (*) désignent les sites proximale et distale pour le placement des constricteurs ou ligatures améroïde, selon que subaiguë ou une ischémie aiguë seront induites. S'il vous plaît click ici pour voir une version plus grande de cette figure.
- En utilisant des pinces, ouvrir l'incision et exposer la membrane recouvrant le tissu adipeux inguinal (IFT).
- Utilisation de forceps fermées, percer à travers la membrane dans la séparation entre l'IFT et l'abdomen. relâcher doucement la pression sur la pince pour séparer le IFT des muscles abdominaux, ce qui expose le faisceau neuro-vasculaire au-dessous. Observer proximale et branches caudales superficielles comme repères anatomiques importants (figure 1B).
- Insérez un écarteur et tirer le tissu abdominal proximalement pour exposer le constrictor améroïde ou ligature place proximale, juste en amont de l'artère fémorale circonflexe latérale (figure 1B). L'artère circonflexe latérale se trouve à environ 5 mm proximale à l'extrémité proximale et des artères caudales superficielles.
- Insérez deux écarteurs dans la partie distale de l'incision, une médiane et un latéral, pour tirer le IFT distalement loin de lasite chirurgical pour élargir le champ opératoire.
- Utilisez deux pinces fines pour enlever la membrane la plus extérieure couvrant le faisceau neurovasculaire. Insérez délicatement la moitié de la pointe des pinces fines entre la veine et l'artère, en glissant la pointe de la pince sous la membrane qui les lie. Fermez la pince et déchirer doucement la membrane.
- Insérez l'extrémité d'une pince fermée entre la veine et l'artère et de créer un espace entre eux en relâchant la pression sur la pince. Répétez cette technique pour créer un écart entre l'artère et le nerf.
- Pour subaiguë ischémie des membres, placez un constrictor améroïde sur l'artère fémorale proximale (Figure 2).
- Pour installer le améroïde constrictor proximal, faites glisser la pointe d'une pince dans l'artère fémorale pour l'isoler du faisceau neurovasculaire. Utilisez un deuxième jeu de pinces cornière- pour saisir le bord de la constrictor et le guider dans l'artère fémorale.
- Couchez l'artère fémorale dans les sbeaucoup dans le constrictor. Répéter pour constricteur distale, positionnant immédiatement proximale par rapport à la bifurcation de l'artère fémorale à l'artère poplitée et l' artère saphène (figure 2).
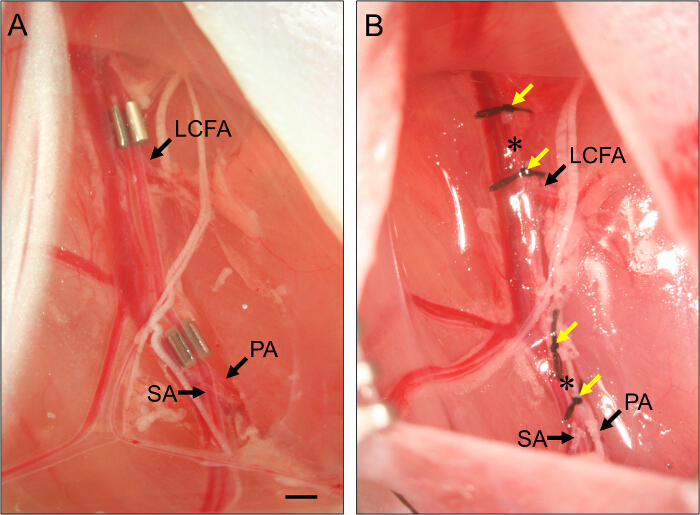
Figure 2. Placement de AMEROID constricteurs et ligatures. (A) Exemple de deux constricteurs améroïde placés sur l'artère fémorale pour induire subaiguë hindlimb ischémie. La constrictor proximale est placée juste en amont de l'artère fémorale circonflexe latérale (LCFA). Le constrictor distal est placé juste en amont de la bifurcation de la poplitée (PA) et les artères saphènes (SA). Constricteurs sont installés avec la fente orientée vers le haut pour assurer l'artère est correctement définie dans le constrictor. (B) Exemple de ligatures de l'artère fémorale pour induire une ischémie aiguë des membres postérieurs. Ligatures (flèches jaunes) sont placés de telle sorte qu'ils flanquent la position des constricteurs dans le panneau (B), et l'artère fémorale est sectionnés entre chaque série de deux ligatures (astérisques). Bar, 1 mm. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Pour le membre ischémie aiguë, ligaturer et sectionner l'artère fémorale proximale.
- Pour sectionner l'artère fémorale, le fil 7 - O suture sous l'artère juste en amont de la position de la constrictor proximale (voir étape 3.7) et ligaturer. Attacher une deuxième ligature environ 1 mm distal par rapport à la première.
- Utilisez des ciseaux à ressort pour sectionner l'artère entre les deux ligatures. Pour la transsection artérielle distale, répéter ces étapes, en plaçant deux ligatures d'environ 1 mm, juste en amont de la bifurcation de l'artère fémorale à l'artère poplitée et l'artère saphène, mais d'assurer qu'ils sont distale par rapport à la Caud superficielleal artère épigastrique (voir Figure 1)
- Fermer l'incision à l'aide interrompue 5 - sutures vicryl O.
4. Perfusion Imaging
- Déplacez la souris à un 37 ° C pad chauffant réglé sous l'imageur laser doppler de perfusion (LDPI) et se connecter via un nosecone à la source isoflurane. Si aucun contrôle de la température est disponible, laisser 5 min pour la souris se réchauffer à 37 ° C.
- Allumez l'imageur et de lancer le logiciel de capture d'image.
- Cliquez sur l'icône 'Nouveau single de l'image' pour ouvrir la fenêtre «Configuration du scanner». Réglez le "Format de numérisation» à «Grand» et «Vitesse de numérisation» à «4 ms / pixel. Réglez la zone de balayage en changeant les valeurs de x et y sous la 'zone de numérisation (unités)' volet.
- Cliquez sur l'onglet 'Vidéo et à distance »pour afficher le flux vidéo, et d'organiser la souris pour entrer dans la zone de numérisation indiquée par un contour rouge. Cliquez sur "Auto Distance" pour calibrerla distance du laser à la matière. Cliquez sur 'Suivant' pour ouvrir la fenêtre 'Sujet Détails de.
- Entrez les informations sujet et des commentaires pertinents. Cliquez sur le bouton «Suivant» pour passer à la fenêtre de numérisation.
- Cliquez sur le bouton «Démarrer la mesure 'pour ouvrir le' Confirmer ou Numériser Distance Override 'dialogue. Cliquez sur 'OK' pour confirmer la distance de balayage. Observer le processus de numérisation commence et fonctionner pendant 4-8 min en fonction de la taille de la zone de numérisation.
- Après la numérisation est terminée, observez la fenêtre "Enregistrer sous. Nommez le fichier et enregistrez-le.
- Coupez l'isoflurane et déplacer la souris pour une reprise cage vide et surveiller jusqu'à ce que l'animal est capable de maintenir décubitus sternale. Ne placez jamais une souris récupération de l'anesthésie dans une cage avec les autres souris.
- Ouvrez le logiciel d'analyse d'image. Cliquez sur l'icône 'Ouvrir' et rechercher et ouvrir le fichier d'image pour l'analyse. Dans la fenêtre de fichier, observer le flux,photo, images en couleur et de la souris.
- Pour marquer la région d'intérêt (ROI) sur l'image de flux, cliquez sur l'icône «Afficher ROIs». Ensuite, cliquez sur le bouton «Ajouter Polygon» et faites glisser le curseur autour du membre non-chirurgicale pour dessiner le retour sur investissement. Faites un clic droit pour fermer la forme. Sélectionnez 'Ajouter Polygon' à nouveau et tirer un retour sur investissement correspondant autour du membre chirurgical.
- Cliquez sur l'icône 'Statistiques pour ouvrir le' image Résultats ROIs statistique (PU) 'fenêtre. Observez la différence pour cent de flux dans la colonne «Flux de% '.
NOTE: La première ROI tirée servira de référence.
NOTE: Avant chaque scintigraphie de perfusion ultérieure suivre les étapes décrites dans la section 1 pour anesthésier la souris et dans les étapes 4.1 à 4.11 à l' image de l'animal.
Résultats
Une bonne identification de la vascularisation des membres postérieurs de la souris est essentielle pour assurer la reproductibilité des techniques pour induire la fois subaiguë et hindlimb ischémie aiguë, comme décrit ici. En plus de la variation inhérente dans les études animales, d' autres facteurs peuvent introduire la variabilité laser Doppler imagerie de perfusion (LDPI), y compris le type d'anesthésie, la position de l'animal (contre supination sujet...
Discussion
Peut-être l'étape la plus difficile dans ce procédé est la séparation de l'artère fémorale dans la veine fémorale. Le plus grand diamètre et des parois minces de la veine fémorale par rapport à celles de l'artère augmente sa sensibilité à la perforation et à la déchirure lors d'une manipulation chirurgicale. La probabilité d'une perturbation de la veine peut être réduit en gardant la plaie humide à l'aide d'un écouvillon stérile humidifié avec du PBS. Il est également ...
Déclarations de divulgation
The authors have no conflicts of interest to disclose.
Remerciements
This study was supported by NIH grants R21HL118661, R56HL124444, and R01HL124444 to CDK, and by NIH grants R00HL103797 and R01HL125695 to JMM.
matériels
| Name | Company | Catalog Number | Comments |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | Dumoxel |
| Dumont Style 5 Mini Forceps | Fine Science Tools | 11200-14 | Inox |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| 7 - 0 Silk Suture | Sharpoint | DA-2527N | |
| 5 - 0 Coated Vicryl Suture | Ethicon | J463G | |
| Graefe Forceps | Fine Science Tools | 11053-10 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-03 | |
| Artifical Tears Ointment | Rugby Laboratories | 0536-6550-91 | |
| Surgical Tape | 3M | 1530-0 | |
| Fine Cotton Swabs | Contec | SC-4 | |
| Temperature Controller | Physitemp | TCAT-2DF | |
| Ameroid Constrictors | Research Instruments SW | MMC-0.25 x 1.00-SS | |
| Hot Bead Sterilizer | |||
| Deltaphase Isothermal Pad | Braintree Scientific | 39DP | |
| Needle Driver | Fine Science Tools | ||
| Phosphate Buffered Saline | Gibco | 10010-023 | |
| Moor LDPI | Moor Instruments | moorLDI2 | |
| moorLDI Measurement software | Moor Instruments | v. 6.0 | |
| Hair Removal Cream | Nair |
Références
- Criqui, M. H., Aboyans, V. Epidemiology of peripheral artery disease. Circ. Res. 116, 1509-1526 (2015).
- Thukkani, A. K., Kinlay, S. Endovascular intervention for peripheral artery disease. Circ. Res. 116, 1599-1613 (2015).
- Vartanian, S. M., Conte, M. S. Surgical intervention for peripheral arterial disease. Circ. Res. 116, 1614-1628 (2015).
- Bonaca, M. P., Creager, M. A. Pharmacological treatment and current management of peripheral artery disease. Circ. Res. 116, 1579-1598 (2015).
- Conte, M. S., et al. Design and rationale of the PREVENT III clinical trial: edifoligide for the prevention of infrainguinal vein graft failure. Vasc Endovascular Surg. 39, 15-23 (2005).
- Pomposelli, F. B., et al. A decade of experience with dorsalis pedis artery bypass: analysis of outcome in more than 1000 cases. J. Vasc. Surg. 37, 307-315 (2003).
- Willigendael, E. M., et al. Smoking and the patency of lower extremity bypass grafts: a meta-analysis. J. Vasc. Surg. 42, 67-74 (2005).
- Schillinger, M., et al. Balloon angioplasty versus implantation of nitinol stents in the superficial femoral artery. N. Engl. J. Med. 354, 1879-1888 (2006).
- Marmagkiolis, K., et al. 12-month primary patency rates of contemporary endovascular device therapy for femoro-popliteal occlusive disease in 6,024 patients: beyond balloon angioplasty. Catheter. Cardiovasc. Interv. 84, 555-564 (2014).
- Rosenfield, K., et al. Trial of a Paclitaxel-Coated Balloon for Femoropopliteal Artery Disease. N. Engl. J. Med. 373, 145-153 (2015).
- Tepe, G., et al. Drug-coated balloon versus standard percutaneous transluminal angioplasty for the treatment of superficial femoral and popliteal peripheral artery disease: 12-month results from the IN.PACT SFA randomized trial. Circulation. 131, 495-502 (2015).
- Couffinhal, T., et al. Mouse model of angiogenesis. Am. J. Pathol. 152, 1667-1679 (1998).
- Niiyama, H., Huang, N. F., Rollins, M. D., Cooke, J. P. Murine model of hindlimb ischemia. J Vis Exp. , (2009).
- McClung, J. M., et al. Skeletal muscle-specific genetic determinants contribute to the differential strain-dependent effects of hindlimb ischemia in mice. Am. J. Pathol. 180, 2156-2169 (2012).
- Dokun, A. O., et al. A quantitative trait locus (LSq-1) on mouse chromosome 7 is linked to the absence of tissue loss after surgical hindlimb ischemia. Circulation. 117, 1207-1215 (2008).
- Rivard, A., et al. Age-dependent impairment of angiogenesis. Circulation. 99, 111-120 (1999).
- Hazarika, S., et al. Impaired angiogenesis after hindlimb ischemia in type 2 diabetes mellitus: differential regulation of vascular endothelial growth factor receptor 1 and soluble vascular endothelial growth factor receptor 1. Circ. Res. 101, 948-956 (2007).
- Couffinhal, T., et al. Impaired collateral vessel development associated with reduced expression of vascular endothelial growth factor in ApoE-/- mice. Circulation. 99, 3188-3198 (1999).
- Tang, G. L., Chang, D. S., Sarkar, R., Wang, R., Messina, L. M. The effect of gradual or acute arterial occlusion on skeletal muscle blood flow, arteriogenesis, and inflammation in rat hindlimb ischemia. J. Vasc. Surg. 41, 312-320 (2005).
- Yang, Y., et al. Cellular and molecular mechanism regulating blood flow recovery in acute versus gradual femoral artery occlusion are distinct in the mouse. J. Vasc. Surg. 48, 1546-1558 (2008).
- Litvak, J., Siderides, L. E., Vineberg, A. M. The experimental production of coronary artery insufficiency and occlusion. Am. Heart J. 53, 505-518 (1957).
- Bredee, J. J. An improved ameroid constrictor. Preliminary communication. J. Surg. Res. 9, 107-112 (1969).
- McClung, J. M., et al. Subacute limb ischemia induces skeletal muscle injury in genetically susceptible mice independent of vascular density. J. Vasc. Surg. , (2015).
- Hellingman, A. A., et al. Variations in surgical procedures for hind limb ischaemia mouse models result in differences in collateral formation. Eur. J. Vasc. Endovasc. Surg. 40, 796-803 (2010).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PloS one. 8, e84047 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon