A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שיטות חריפה subacute Murine Hindlimb איסכמיה
In This Article
Summary
Surgical induction of hindlimb ischemia in the mouse is useful to examine angiogenesis, however this is compromised in certain inbred mouse strains that display marked ischemia-induced tissue necrosis. Methods are described to induce subacute limb ischemia using ameroid constrictors to circumvent this problem through the induction of gradual arterial occlusion.
Abstract
מחלת עורקים היקפיים (PAD) הוא גורם מוביל לתחלואה ותמותה קרדיווסקולארית במדינות מפותחות, במודלים של בעלי החיים כי באופן מהימן לשחזר את המחלה האנושית נחוצים כדי לפתח טיפולים חדשים למחלה זו. המודל איסכמיה העכבר hindlimb כבר בשימוש נרחב למטרה זו, אך בפועל רמת גרימת איסכמיה איבר חריפה על ידי קשירת עורק הירך יכול לגרום נמק רקמות משמעותית, להתפשר על היכולת של החוקרים ללמוד את התגובות של כלי הדם ואת רקמת שריר השלד לאיסכמיה . גישה חלופית כדי קשירת עורק הירך היא אינדוקציה של חסימה בעורק הירך הדרגתית באמצעות נחשי ameroid. כאשר הניח סביב עורק הירך במיקומים זהים או שונים כמו באתרי של קשירת עורק הירך, התקנים אלה לחסום את העורק מעל 1 - 3 ימים, וכתוצאה מכך איסכמיה הדרגתית יותר, subacute. התוצאה היא נמק רקמות משמעותית פחות שריר השלד, which יכול לחקות באופן הדוק יותר את התגובות לראות PAD האדם. בגלל השפעות רקע גנטיות ותוצאות בשני הדגמים איסכמיה החריפים subacute, השיקול של זן העכבר נלמד חשוב בבחירת המודל הטוב ביותר. מאמר זה מתאר את ההליך הנכון ומיקום האנטומי של קשירות או נחשי ameroid על עורק עכבר הירך לגרום subacute או איסכמיה hindlimb החריפה בתוך העכבר.
Introduction
מחלת עורקים היקפיים (PAD) הוא גורם מוביל לתחלואה ותמותה קרדיו-וסקולרית במדינות מפותחות 1. תוצאות PAD מחסימה טרשתית של העורקים ההיקפיים שמוביל איסכמיה איבר עם כאב exertional או שאר כתוצאה וכיבים שאינו נרפא מדי פעם נמק המחייבים מכריתת גפיים. טיפולי מיקוד PAD מכוונים בעיקר כלפי endovascular 2 או רה-ווסקולריזציה כירורגית 3, שהוא במהותו לא לטיפולים רפואיים יעילים קיימים 4.
למרבה הצער, revascularization הוא לעתים קרובות של תועלת מוגבלת, כמו שתלי מעקף יש שיעור כישלון גבוה (עד 50% תוך 5 שנים) 5, גרועים באוכלוסיות מסוימות (למשל, מעשנים, נשים, שתל וריד הלא saphenous) 6,7. גישות Endovascular, כגון אנגיופלסטיקה ו סטנט, נפגמו גם על ידי תעריפים restenosis גבוהה (מעל 50% בתוך שנה 1), particulary in femoropopliteal מחלה 8, אם כי שימוש בלונים סטנטים סמי משחררים השתפר תוצאות במקצת 9-11. על מנת לפתח טיפולים חדשים עבור PAD זה הכרחי כדי לפתח מודלים של בעלי חיים כי לשחזר את המחלה האנושית באופן מהימן.
נכון להיום, המודל הנפוץ ביותר של PAD הוא המודל איסכמיה hindlimb (HLI), אשר רוב מבוצע לעתים קרובות בעכברים 12,13. בדמותו הנפוצה ביותר שלה, המודל כרוך קשירת כירורגית של עורק הירך הפרוקסימלית ומ דיסטלי ו-הענפים בצד התערבותה ואחריו כריתה של כלי השיט, וכתוצאה מכך חסימה של זרימת הדם ואת אינדוקציה של איסכמיה איבר חריפה. HLI נעשה ברוב המקרים ללמוד תגובות angiogenic ו arteriogenic ברקמת שריר איבר פריפריה ואת ההשפעות של טיפולים שונים (למשל, תרופות, למסירת הגן, תאי גזע) על התגובות הללו. לאחרונה, הקבוצה שלנו השתמשה במודל זה כדי לבחון את התפקיד של תאי שריר שלד in התגובה אחר ענף איסכמיה ואת ההשפעות של הבדלים גנטיים על תוצאות 14.
מודל HLI יש להקל ההבנה הנוכחית שלנו שהתגובות וסקולרית ושרירים לאיסכמיה תלויות בגנטיקה (כלומר, זן מולד) 15, גיל 16, ואת קיומו או אי קיומו של מחלות אחרות או בתנאים המתייחסים טרשת עורקת, כוללים סוכרת 17 היפרכולסטרולמיה 18. עם זאת, על חולשה מהותית של מודל HLI המסורתי היא שזה מודל של איבר איסכמיה חריפה 12,13, בעוד PAD האנושי גורם איסכמיה כרונית כתוצאה של ההתפתחות ההדרגתית של טרשת עורקי occlusive בעורקים ההיקפיים.
בניסיון לעקוף את החולשה הזאת, טאנג והעמיתים בתחילה פתחו מודל עכברוש של חסימת עורקית ירך הדרגתית באמצעות נחשי ameroid 19, ואת אותה הקבוצה ובהמשך ד20 eveloped במודל של עכברים דומה. נחשי Ameroid תוארו בתחילה בשנת 1950 במודל כלבים של איסכמיה לבבית כרונית 21,22. להתקנים אלה יש שרוול מתכת חיצוני העוטף שכבה פנימית של חומר היגרוסקופי, בדרך כלל קזאין, וכאשר להציב סביב עורק הוא לגרום לחסימת כלי הדרגתית כפי שהוא לספוג לחות מכל הרקמות הסובבות. ב השינוי שלהם של המודל, ואח יאנג. להציב נחשים הוא הפרוקסימלית ומ עורק ירך הדיסטלי באתרים מקבילים באתרי הקשירה כירורגית, והם ligated ענפים בצד של עורק הירך, כמו במודל המסורתי. לעומת HLI החריף, איסכמיה הכווץ הנגרמת ameroid מביע תחתון של גני מתח תלוי דלקתיים גזירה, שחזור זרימת דם נמוך 4 - 5 שבועות לאחר ניתוח, ופחות שרירים נימק 20. בהתבסס על תצפיות אלה, זה הורגש כי חסימת עורקית הדרגתית עשויה לספק מודל של PAD יותר רלוונטי המחלה האנושית.
יש לציין, כי הדו"ח המקורי, ההשפעות של איסכמיה ameroid הנגרמת הכווץ נבדקו רק C57BL / 6 עכברים 19, אשר עמידים יחסית נמק שריר-induced איסכמיה 15. אנחנו לאחרונה שונים מודל איסכמיה ההדרגתי נוספים ובחנו השפעותיו זן עכבר BALB / ג איסכמיה-רגישה יותר 23. בשנת הביטוי הראשון של המודל, מיקמנו נחשי הן הפרוקסימלית ומ עורק הירך הדיסטלי אבל עזבו את כל-הענפים בצד פגע. בשנת מודיפיקציה שנייה, מתונה יותר, מקמנו הכווץ אחת בלבד על עורק הפרוקסימלי ירך ושוב השארתי את כל תופעות braches של העורק ללא פגע. בשני השינויים של מודל זה, מצאנו כי עכברי BALB / c, אבל לא C57BL / 6 עכברים, מוצג נימק שריר רב, למרות שיש זרימת דם דומה וצפיפות כלי דם. בדומה למחקר הקודם שלנו 14, ממצאים אלו הוכיחו כי שריר איברפציעה אינה מושפעת אך ורק על ידי זרימת דם, אבל היא בחלקה תלויה רקע גנטי. יתר על כן, מצאנו כי זרימת הדם באיבר נפל לשפל תוך 3 ימים, ובכך המודל שנראה יותר אחד 'subacute' ולא איסכמיה איבר הדרגתית.
בהתבסס על מחקרים קודמים אלה, נראה ברור כי שיטה אחת גרימת איסכמיה hindlimb ואינו מתאים בכל המקרים. בגלל מגוון רחב של מצבים (למשל, הבדלים גנטיים קיומו או אי קיומו של תנאי שיתוף חולני) שפעה הוא כלי הדם ותגובות שרירים ספציפיים שלד, שחוקרים מוצאים לנכון לשנות את הכרוניות ו / או חומרת איסכמיה hindlimb הטובה ביותר לצרכיהם. יתר על כן, תיאורים מראש של המודל בדרך כלל חסרים ציונים דרך אנטומיים מתאימים כדי להקל שחזור הבין-חוקר אמין של הטכניקה. במאמר זה, שיטות גרימה או איסכמיה hindlimb חריפה או subacute בתוך העכברמתוארים, והם סיפקו לו ציוני דרך אנטומיים מדויקים.
Protocol
כל הניסויים בבעלי החיים בוצעו על פי פרוטוקול שאושר על ידי ועדת הטיפול בבעלי החיים המוסדית הדיוק והשימוש. עכברי זכרים שמשו במחקר זה, למרות שכל אחד מהמינים יכולים לשמש כמצוין לצורך המדעי של המחקר.
הסרת שיער 1.
- לפני אינדוקציה של הרדמה, להקים אזור הכנת טרום ניתוחית המורכב כרית חימום מכוסה נקבע על 37 מעלות צלזיוס, יציאת nosecone מחובר זרימה רציפה של isoflurane.
- מניחים את העכבר בתא אינדוקציה הרדמה. הגדר את מד זרימת O 2 עד 1 ליטר / דקה ו isoflurane ל 3 - 1%.
הערה: הרדמה בדרך כלל מושרת עכבר 25 גרם עם 2% isoflurane. - בדוק את גירוי התגובה של העכבר על ידי נדנדת התא בעדינות ולשמור על היעדר רפלקס ליישר.
- לשטוף את החדר עם O 2 כדי לנקות את isoflurane לפני הפתיחה. במהירות להזיז את העכבר אל p חימוםהמודעה ולחבר אותו isoflurane דרך nosecone.
- התאם את isoflurane ל -1.5%. בדוק את הגירוי תגובה על ידי רפלקס דוושת (קמצוץ הבוהן).
- החל סיכה עיניים בנדיבות על שתי העיניים כדי למנוע התייבשות במהלך הניתוח.
- לגלח את השיער משני הגפיים האחוריים באמצעות גוזם חשמלי קטן. מתח את העור בזמן הגילוח, כדי למנוע קרע את העור.
- החל קרם להסרת שיער מחומם מראש ולתת לשבת במשך דקות 1. נגב בעדינות משם באמצעות פד גזה לחה.
- עבור הליך כירורגי במועד מאוחר יותר, לכבות את isoflurane להזיז את העכבר כדי כלוב התאוששות ריק נייר מצופה מגבת כדי להבטיח את העכבר לא לשאוב מצעים בכלוב. צג את החיה עד שהוא מסוגל לשמור על שכיבה sternal. אחרת, להזיז את העכבר אל שולחן הניתוחים.
הערה: תהליך הסרת השיער יכול לגרות את העור על מדידות זלוף. מומלץ לחכות 1 - 2 ימים לאחר הסרת השיער של בעלי החיים לפני performing סריקה זלוף טרום ניתוחית או ביצוע ניתוחים.
2. הכנה טרום כירורגי
- השתמש בכלים הבאים במהלך הליך זה; מספרי כירורגיות ישרים קטנים, 2 קנס שקצו מלקחי זווית, מלקחיים גרפו קטנים, מלקחי נהג מחט, 3 כתיבה, מספריים באביב קטנים, צמר גפן קנס שקצו.
- לעקר את כל הכלים באמצעות חיטוי לפני תחילת הניתוח. השתמש מעקר חם חרוז לפני ובין כל הליך כירורגי, עד 5 חיות. לעקר מנות כלי כירורגיות לניתוחים של קבוצות גדולות מ -5.
- כן שדה כירורגי סטרילי מורכב כרית חימום מכוסית יציאת isoflurane. בצע את כל העבודה תחת מיקרוסקופ לנתיחה 10 סטריאו.
- להרדים ולהכין את העכבר כמתואר בשלבים 1.1 1.5.
- בדוק כי העכבר הוא מסומם לגמרי ומניחים לתנוחת שכיבה על שולחן הניתוחים. Secure שתי הרגליים באמצעות פלסטר.
- אם באמצעות כרית חימום מבוקר טמפרטורה, לצרף את בדיקת הטמפרטורה ומאובטח אותו לבסיס של הפלטפורמה כירורגית באמצעות פלסטר כדי לוודא שהוא לא יהיה שלף בטעות במהלך ההליך.
- נקה את אתר החתך באמצעות מגבוני povidone- יוד ואלכוהול חילופין 3. כסה את בעל החיים עם וילון ניתוח סטרילי וחותכים חור לחשוף את האתר החתך.
3. אינדוקציה של לימב איסכמיה
- השתמש אזמל לעשות חתך ראשוני לאורך במרכז הירך המדיאלי, ריצה מהברך כלפי הבטן, וכן להאריך את החתך כ 1 סנטימטר עם מספריים בסדר (איור 1 א).
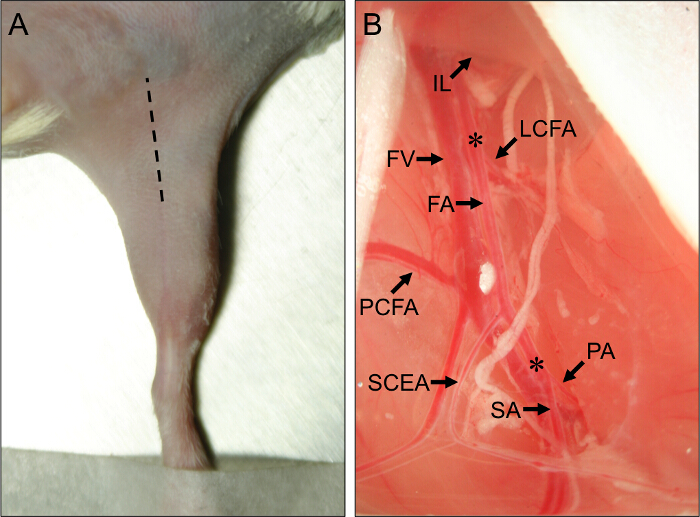
איור 1. אתר כירורגי ציוני דרך אנטומיים דם עבור עכבר Hindlimb איסכמיה כירורגיה. (א) מראה חיצוני שלhindlimb של עכבר במצב שכיבה. השורה בקע מציינת את אתר החתך כדי לבצע את הליכי איסכמיה hindlimb כראוי. (ב) צפייה של כלי דם hindlimb העכבר הפרוקסימלי. סוף הפרוקסימלי של עורק הירך (FA) נובע מתחת הרצועה מפשעתי (IL). בקצה הדיסטלי של FA ממוקם ההסתעפות שלה לתוך עורק popliteal (PA) עורק saphenous (SA). העורקים בטחונות הגדולים הנחה של FA הם עורקים ירך גג לרוחב (LCFA), עורק ירך הזנב הפרוקסימלית (PCFA), ואת העורק ברום בטן הזנב השטחי (SCEA). וריד הירך (ע"ע) פועל בצמוד FA, וענפי ורידים ניתן לראות במקביל לסניפי העורקים המרכזיים. כוכביות (*) יציין את אתרי הפרוקסימלית ומ דיסטלי עבור מיקום של נחשי ameroid או ליגטורות, תלוי אם subacute או איסכמיה חריפה יהיה מושרה. אנא CLICK כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- בעזרת מלקחיים, פתח את החתך ולחשוף את הקרום המכסה את רקמת השומן מפשעתי (IFT).
- שימוש-מלקחיים סגורים, פירס דרך הממברנה אל תוך ההפרדה בין IFT ואת הבטן. בעדינות לשחרר את הלחץ על מלקחיים כדי להפריד את IFT מן שרירי הבטן, לחשוף את צרור העצבים וכלי הדם מתחת. שים את הפרוקסימלי וענפי זנב שטחיים כציוני דרך אנטומיים חשובה (איור 1B).
- הכנס מפשק ולמשוך את רקמת בטן proximally לחשוף את האתר הכווץ או קשירת ameroid הפרוקסימלי, רק הפרוקסימלי עורק הירך גג לרוחב (איור 1 ב). עורק הגג לרוחב שקרים על 5 מ"מ הפרוקסימלי הפרוקסימלי ועורק זנב שטחי.
- הכניסו שתי כתיבה יותר לתוך החלק הדיסטלי של החתך, המדיאלי אחד לרוחב, כדי למשוך את IFT distally הרחקאתר כירורגית כדי להרחיב את שדה הניתוח.
- השתמש בשני במלקחיים בסדר להסיר את הקרום החיצוני המכסה את צרור העצבים וכלי הדם. הכנס בעדינות מחצית קצה מלקחיים בסדר בין הוורידים והעורקים, הזזה קצה מלקחיים תחת קרום שקושר אותם יחד. סגור את המלקחיים בעדינות לקרוע את הקרום.
- הכנס את קצה מלקחיים הסגור שבין הוורידים והעורקים וליצור פער ביניהם על ידי שחרור הלחץ על מלקחיים. חזור על הטכניקה הזו כדי ליצור פער בין העורק והעצב.
- עבור איסכמיה איבר subacute, למקם הכווץ ameroid על עורק הירך הפרוקסימלית (איור 2).
- כדי להתקין את הכווץ ameroid הפרוקסימלי, להחליק את קצה מלקחיים תחת עורק הירך לבודד אותה מהחבילה העצבים וכלי הדם. השתמש סט שני של מלקחי angled- לאחוז בשולי הכווץ ולהדריך אותו תחת עורק הירך.
- הנח את עורק הירך לתוך היםהרבה של הכווץ. חזור על הכווץ דיסטלי, מיקומה מיד הפרוקסימלי הסתעפות של עורק הירך לתוך העורק popliteal ועורקים saphenous (איור 2).
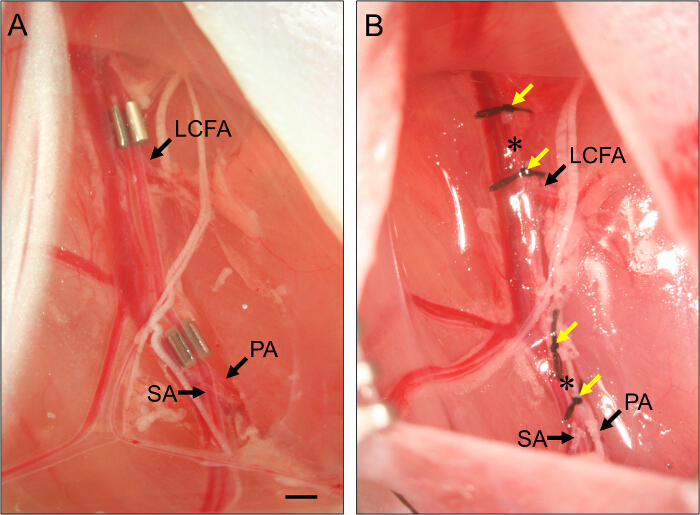
איור 2. מיקום של Ameroid נחשים ו ליגטורות. (א) דוגמא של שני נחשים ameroid דגש על עורק הירך לגרום איסכמיה hindlimb subacute. הכווץ הפרוקסימלי מושם רק הפרוקסימלי עורק הירך גג לרוחב (LCFA). הכווץ דיסטלי מושם רק הפרוקסימלי הסתעפות של popliteal (PA) ועורקים saphenous (SA). נחשים מותקנים עם החריץ פונה כלפי מעלה על מנת להבטיח את העורק מוגדר כראוי בתוך הכווץ. (ב) דוגמא של קשירות של עורק הירך לגרום איסכמיה hindlimb החריפה. Ligatures (חיצים צהובים) ממוקם כך שהם לאגף את עמדת הנחשים בלוח (B), ואת עורק הירך הוא transected בין כל סט של שנייה ליגטורה (כוכביות). בר, 1 מ"מ. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- עבור איסכמיה איבר חריפה, ולקשור ו transect עורק הירך הפרוקסימלי.
- כדי transect עורק הירך, חוט 7 - O תפר מתחת העורק רק הפרוקסימלי עמדת הכווץ הפרוקסימלית (ראה שלב 3.7) ולקשור. לקשור ליגטורה שני על דיסטלי 1 מ"מ עד הראשון.
- השתמש במספריים באביב כדי transect העורק בין שתי ליגטורות. עבור חיתוך רוחב עורקי דיסטלי, לחזור על שלבים אלה, נחת שתי ליגטורות על 1 מ"מ זה מזה, רק הפרוקסימלי ההסתעפות של עורק הירך לתוך עורק popliteal ועורק saphenous אלא בהבטחה שהם דיסטלי caud השטחיתאל העורק ברום הבטן (ראה איור 1)
- סגירת החתך באמצעות קטע 5 - O התפרים vicryl.
4. הדמיה זלוף
- להזיז את העכבר כדי כרית חימום 37 ° C להגדיר מתחת תרמי זלוף דופלר לייזר (LDPI) ולחבר באמצעות nosecone למקור isoflurane. אם אין לעקוב אחר הטמפרטורה זמין, לאפשר 5 דקות עבור בעכבר כדי להתחמם עד 37 מעלות צלזיוס.
- הפעל את תרמי ופתח את התוכנה לכידת תמונה.
- לחץ על הסמל 'רווקה תמונה חדשה' כדי לפתוח את החלון 'סורק ההגדרה'. הגדר את 'גודל סריקה' ל 'גדולים' ו 'מהירות סריקה' ל '4 ms / פיקסל'. הגדר את אזור הסריקה על ידי שינוי ערכי x ו- y תחת בחלונית 'שטח סריקה (יחידות) ".
- לחץ על הכרטיסייה 'וידאו המרחק' כדי להציג את הזנת וידאו, ולסדר את העכבר כדי להתאים לאזור הסריקה שמציין מתאר אדום. לחץ על 'מרחק אוטומטי' כדי לכיילהמרחק בין לייזר לנושא. לחץ על 'הבא' כדי לפתוח את החלון 'פרטי נושא'.
- הזן את המידע הנושא וכל הערות רלוונטיות. לחץ על כפתור "הבא" כדי להמשיך הלאה אל חלון הסריקה.
- לחצו על כפתור "התחל מדידה 'כדי לפתוח את' אישור או בטל סריקה מרחק 'הדו-שיח. לחץ על 'אישור' כדי לאשר מרחק סריקה. שים את תהליך הסריקה להתחיל ולרוץ 4 - 8 דקות, בהתאם לגודל של אזור הסריקה.
- לאחר שהסריקה הושלמה, להתבונן בחלון 'שמירה בשם'. תן שם לקובץ ושמור אותו.
- כבה את isoflurane להזיז את העכבר כדי כלוב התאוששות ריק ולפקח עד שהחיה היא מסוגלת לשמור על שכיבה sternal. אין למקם עכבר מתאושש מההרדמה לכלוב עם עכברים אחרים.
- פתח את תוכנת ניתוח תמונה. לחץ על הסמל 'Open' ולעיין כדי לפתוח את קובץ התמונה לניתוח. בחלון הקובץ, לקיים את השטף,תמונות צילום, והצבע של העכבר.
- כדי לסמן את האזור של עניין (ROI) על התמונה השטף, לחץ על הסמל 'הצג ROIs'. הבא לחץ על לחצן 'הוסף מצולע' וגרור את הסמן סביב הגפה לא ניתוחי לצייר את ההחזר על ההשקעה. לחץ לחיצה ימנית כדי לסגור את הצורה. בחר 'הוסף מצולע' שוב לצייר ROI התאמת סביב הגפה כירורגית.
- לחץ על הסמל 'הסטטיסטיקה' כדי לפתוח את 'תמונת תוצאות הסטטיסטיות ROIs (PU)' חלון. לראות את הבדל אחוזי השטף בעמודת 'שטף% ".
הערה: ROI הראשונים הערוכים ישמש כנקודת התייחסות.
הערה: לפני כל סריקת זלוף הבאה פעלה לפי השלבים המפורטים בסעיף 1 כדי להרדים את העכבר ב צעדי 4.1 ל 4.11 לתמונת החיה.
תוצאות
זיהוי נכון של כלי דם hindlimb העכבר הוא קריטי כדי להבטיח שחזור של הטכניקות להשרות את שני subacute ו איסכמיה hindlimb החריפה, כפי שמתואר כאן. בנוסף השוני הפנימי במחקרים בבעלי חיים, גורמים אחרים יכולים להציג השתנות הדמיה זלוף דופלר לייזר (LDPI), כולל סוג של הרדמה, עמד...
Discussion
אולי הצעד הכי מאתגר בהליך זה הוא ההפרדה של העורק הפמורלי מ וריד הירך. הקוטר הגדול קירות דקים של וריד הירך בהשוואה לאלו של העורק להגדיל את הרגישות שלו לנקב וקורע במהלך מניפולציה כירורגית. הסבירות של שיבוש וריד יכול להיות מופחת על ידי שמירה על הפצע לח באמצעות ספוגית סטר...
Disclosures
The authors have no conflicts of interest to disclose.
Acknowledgements
This study was supported by NIH grants R21HL118661, R56HL124444, and R01HL124444 to CDK, and by NIH grants R00HL103797 and R01HL125695 to JMM.
Materials
| Name | Company | Catalog Number | Comments |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | Dumoxel |
| Dumont Style 5 Mini Forceps | Fine Science Tools | 11200-14 | Inox |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| 7 - 0 Silk Suture | Sharpoint | DA-2527N | |
| 5 - 0 Coated Vicryl Suture | Ethicon | J463G | |
| Graefe Forceps | Fine Science Tools | 11053-10 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-03 | |
| Artifical Tears Ointment | Rugby Laboratories | 0536-6550-91 | |
| Surgical Tape | 3M | 1530-0 | |
| Fine Cotton Swabs | Contec | SC-4 | |
| Temperature Controller | Physitemp | TCAT-2DF | |
| Ameroid Constrictors | Research Instruments SW | MMC-0.25 x 1.00-SS | |
| Hot Bead Sterilizer | |||
| Deltaphase Isothermal Pad | Braintree Scientific | 39DP | |
| Needle Driver | Fine Science Tools | ||
| Phosphate Buffered Saline | Gibco | 10010-023 | |
| Moor LDPI | Moor Instruments | moorLDI2 | |
| moorLDI Measurement software | Moor Instruments | v. 6.0 | |
| Hair Removal Cream | Nair |
References
- Criqui, M. H., Aboyans, V. Epidemiology of peripheral artery disease. Circ. Res. 116, 1509-1526 (2015).
- Thukkani, A. K., Kinlay, S. Endovascular intervention for peripheral artery disease. Circ. Res. 116, 1599-1613 (2015).
- Vartanian, S. M., Conte, M. S. Surgical intervention for peripheral arterial disease. Circ. Res. 116, 1614-1628 (2015).
- Bonaca, M. P., Creager, M. A. Pharmacological treatment and current management of peripheral artery disease. Circ. Res. 116, 1579-1598 (2015).
- Conte, M. S., et al. Design and rationale of the PREVENT III clinical trial: edifoligide for the prevention of infrainguinal vein graft failure. Vasc Endovascular Surg. 39, 15-23 (2005).
- Pomposelli, F. B., et al. A decade of experience with dorsalis pedis artery bypass: analysis of outcome in more than 1000 cases. J. Vasc. Surg. 37, 307-315 (2003).
- Willigendael, E. M., et al. Smoking and the patency of lower extremity bypass grafts: a meta-analysis. J. Vasc. Surg. 42, 67-74 (2005).
- Schillinger, M., et al. Balloon angioplasty versus implantation of nitinol stents in the superficial femoral artery. N. Engl. J. Med. 354, 1879-1888 (2006).
- Marmagkiolis, K., et al. 12-month primary patency rates of contemporary endovascular device therapy for femoro-popliteal occlusive disease in 6,024 patients: beyond balloon angioplasty. Catheter. Cardiovasc. Interv. 84, 555-564 (2014).
- Rosenfield, K., et al. Trial of a Paclitaxel-Coated Balloon for Femoropopliteal Artery Disease. N. Engl. J. Med. 373, 145-153 (2015).
- Tepe, G., et al. Drug-coated balloon versus standard percutaneous transluminal angioplasty for the treatment of superficial femoral and popliteal peripheral artery disease: 12-month results from the IN.PACT SFA randomized trial. Circulation. 131, 495-502 (2015).
- Couffinhal, T., et al. Mouse model of angiogenesis. Am. J. Pathol. 152, 1667-1679 (1998).
- Niiyama, H., Huang, N. F., Rollins, M. D., Cooke, J. P. Murine model of hindlimb ischemia. J Vis Exp. , (2009).
- McClung, J. M., et al. Skeletal muscle-specific genetic determinants contribute to the differential strain-dependent effects of hindlimb ischemia in mice. Am. J. Pathol. 180, 2156-2169 (2012).
- Dokun, A. O., et al. A quantitative trait locus (LSq-1) on mouse chromosome 7 is linked to the absence of tissue loss after surgical hindlimb ischemia. Circulation. 117, 1207-1215 (2008).
- Rivard, A., et al. Age-dependent impairment of angiogenesis. Circulation. 99, 111-120 (1999).
- Hazarika, S., et al. Impaired angiogenesis after hindlimb ischemia in type 2 diabetes mellitus: differential regulation of vascular endothelial growth factor receptor 1 and soluble vascular endothelial growth factor receptor 1. Circ. Res. 101, 948-956 (2007).
- Couffinhal, T., et al. Impaired collateral vessel development associated with reduced expression of vascular endothelial growth factor in ApoE-/- mice. Circulation. 99, 3188-3198 (1999).
- Tang, G. L., Chang, D. S., Sarkar, R., Wang, R., Messina, L. M. The effect of gradual or acute arterial occlusion on skeletal muscle blood flow, arteriogenesis, and inflammation in rat hindlimb ischemia. J. Vasc. Surg. 41, 312-320 (2005).
- Yang, Y., et al. Cellular and molecular mechanism regulating blood flow recovery in acute versus gradual femoral artery occlusion are distinct in the mouse. J. Vasc. Surg. 48, 1546-1558 (2008).
- Litvak, J., Siderides, L. E., Vineberg, A. M. The experimental production of coronary artery insufficiency and occlusion. Am. Heart J. 53, 505-518 (1957).
- Bredee, J. J. An improved ameroid constrictor. Preliminary communication. J. Surg. Res. 9, 107-112 (1969).
- McClung, J. M., et al. Subacute limb ischemia induces skeletal muscle injury in genetically susceptible mice independent of vascular density. J. Vasc. Surg. , (2015).
- Hellingman, A. A., et al. Variations in surgical procedures for hind limb ischaemia mouse models result in differences in collateral formation. Eur. J. Vasc. Endovasc. Surg. 40, 796-803 (2010).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PloS one. 8, e84047 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved