Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Методы острой и подострой мышиной ишемии задней конечности
В этой статье
Резюме
Surgical induction of hindlimb ischemia in the mouse is useful to examine angiogenesis, however this is compromised in certain inbred mouse strains that display marked ischemia-induced tissue necrosis. Methods are described to induce subacute limb ischemia using ameroid constrictors to circumvent this problem through the induction of gradual arterial occlusion.
Аннотация
заболевания периферических артерий (PAD) является одной из основных причин сердечно-сосудистой заболеваемости и смертности в развитых странах, а также на животных моделях, которые надежно воспроизвести заболевание человека необходимо разработать новые методы лечения этого заболевания. Мышиную модель ишемии задней конечности широко используется для этой цели, но стандартная практика индукции острой ишемии нижних конечностей с помощью перевязки бедренной артерии может привести к значительному некрозу тканей, ставя под угрозу способность следственных органов для изучения сосудистой и скелетной мышечной ткани ответов на ишемии , Альтернативный подход к перевязке бедренной артерии является индукция постепенной окклюзии бедренной артерии за счет использования AMEROID констрикторов. При размещении вокруг бедренной артерии в одних и тех же или разных местах, как сайты перевязки бедренной артерии, эти устройства закупоривать артерии в течение 1 - 3 дней, что приводит к более постепенным, подострой ишемии. Это приводит к менее значительному скелетной некроза мышечной ткани, шHICH может более точно имитировать ответы, наблюдаемые в человеческом САП. Поскольку генетический фон влияет на исходы в обоих острых и подострых моделей ишемией, рассмотрение мышиного штамма изучается очень важно при выборе оптимальной модели. В данной статье описывается надлежащая процедура и анатомическое расположение лигатуры или AMEROID констрикторов на мыши бедренной артерии, чтобы вызвать подострую или острой ишемии задней конечности у мыши.
Введение
Заболевания периферических артерий (PAD) является одной из основных причин сердечно - сосудистой заболеваемости и смертности в развитых странах 1. Результаты PAD из атеросклеротической обструкции периферических артерий, что приводит к ишемии конечности с вытекающим или физической нагрузке покоя боли и иногда незаживающие язвы и гангрена, которые требуют ампутации конечностей. Методы лечения , направленные PAD направлены в первую очередь на эндоваскулярного 2 или хирургической реваскуляризации 3, как по существу , нет эффективных медицинских методов лечения не существует 4.
К сожалению, часто реваскуляризация ограниченную выгоду, поскольку шунтов имеют высокие показатели отказов (до 50% в течение 5 лет) 5, которые хуже , в некоторых группах населения (например, у курильщиков, женщин, без подкожных венозных шунтов) 6,7. Эндоваскулярные подходы, такие как ангиопластика и стентирование, также скомпрометирована высокими показателями рестеноза (более 50% в течение 1 года), I частичномN бедренно - подколенного болезнь 8, хотя применение с лекарственным покрытием воздушных шаров и стенты улучшила результаты несколько 9-11. Для разработки новых методов лечения для PAD необходимо разработать модели животных, которые достоверно воспроизводят человеческую болезнь.
На сегодняшний день наиболее распространенной моделью ЗПА является модель ишемии задней конечности (HLI), который чаще всего выполняется у мышей 12,13. В наиболее общем проявлении, модель влечет за собой хирургическое лигирование проксимальной и дистальной бедренной артерии и его промежуточные боковые ветви с последующим иссечением сосуда, что приводит к закупорке кровотока и индукцию острой ишемии конечности. HLI используется в основном для изучения кровеносных сосудов и артериогенной реакции в периферических тканях конечностей мышц и влияние различных методов лечения (например, наркотики, доставки гена, стволовые клетки) на этих ответов. Совсем недавно, наша группа использовала эту модель для изучения роли скелетных мышечных клеток яп ответ на конечности ишемии и последствий генетических различий по результатам 14.
Модель HLI облегчило наше нынешнее понимание того, что сосудистые и мышечные реакции на ишемию зависят от генетики (то есть, инбредных штамм) 15, 16 лет, а также наличие или отсутствие других заболеваний или состояний , связанных с атеросклерозом, в том числе сахарного диабета 17 и гиперхолестеринемия 18. Тем не менее, важным недостатком традиционной модели HLI является то , что она является моделью острой ишемии нижних конечностей 12,13, в то время как человек ПАД вызывает хроническое ишемию в результате постепенного развития окклюзионных атеросклеротических поражений в периферических артерий.
В попытке обойти эту слабость, Тан и его коллеги первоначально разработана крысиную модель постепенной бедренной артерии окклюзии с использованием AMEROID констрикторами 19 и ту же группу , впоследствии developed аналогичной модели мыши 20. AMEROID констриктор были описаны первоначально в 1950 - е годы в собачьей модели хронической ишемии миокарда 21,22. Эти устройства имеют наружный металлический рукав, герметизирующей внутренний слой из гигроскопичного материала, как правило, казеин, а также при размещении вокруг артерии они вызывают постепенное окклюзии сосуда, поскольку они поглощают влагу из окружающих тканей. В их модификации модели, Янг и др. Помещены констрикторами как на проксимальной и дистальной бедренной артерии в местах , аналогичных хирургических участков лигирования, и они лигированы боковые ветви бедренной артерии, как в традиционной модели. По сравнению с острым HLI, AMEROID сжимающая-индуцированной ишемией привела к снижению уровня экспрессии воспалительных и сдвиговых напряжений-зависимых генов, снижение артериального восстановления потока 4 - 5 недель после операции, и меньше мышечной некрозом 20. Основываясь на этих наблюдениях, было высказано мнение о том, что постепенное закупорки артерии может обеспечить модель PAD более непосредственное отношение к болезни человека.
Следует отметить, что в первоначальном докладе, эффекты AMEROID констриктора-индуцированной ишемии были рассмотрены только в C57BL / 6 мышей 19, которые относительно устойчивы к ишемией мышц некроза 15. Недавно мы изменили модель постепенной ишемию дальше и исследовали его эффекты в более ишемия подвержены BALB / с мыши штамма 23. В первом проявлении модели, мы поместили констрикторами как на проксимальной и дистальной бедренной артерии, но оставили все боковые ветви нетронутыми. Во втором, более умеренной модификации, мы поместили одного констриктора только на проксимальной бедренной артерии и снова оставили все побочные филиалы из артерии нетронутыми. В обеих модификациях этой модели, мы обнаружили, что BALB / с мышей, но не мышей C57BL / 6, обнаруживают значительное некроз мышц, несмотря на подобный приток крови и плотность сосудов. По аналогии с нашего предыдущего исследования 14, эти результаты показали , что мышцы конечностейтравма не только под влиянием кровотока, но отчасти зависит от генетического фона. Кроме того, мы обнаружили, что поток крови конечности упал до надира в течение 3-х дней, таким образом, эта модель, как представляется, еще один из "подострых", а не постепенной ишемии нижних конечностей.
На основании этих предыдущих исследований, представляется очевидным, что единственный способ для индукции ишемии задней конечности не могут быть пригодны во всех случаях. Поскольку ряд условий (например, генетических различий и наличия или отсутствия сопутствующих заболеваний) влияние как сосудистой и скелетные ответов специфических для мышц, исследователи могут счесть необходимым изменить хронизации и / или тяжесть ишемии задней конечности к лучшим удовлетворить свои цели. Кроме того, до описания модели, как правило, нет соответствующих анатомические ориентиры для облегчения надежного между исследователю воспроизводимости метода. В данной работе методы индукции либо острого или подострого ишемии задней конечности у мышиописаны и представлены точные анатомических ориентиров.
протокол
Все эксперименты на животных были проведены в соответствии с протоколом, утвержденным Institutional Animal Care и использование комитета Duke путем. У самцов мышей были использованы в этом исследовании, хотя обоего пола могут быть использованы, как указано для научных целей исследования.
1. Удаление волос
- До индукции анестезии, создать зону предоперационной препарат, состоящий из крытого грелку при 37 ° С, и головная часть порта, соединенного с непрерывным потоком изофлуран.
- Поместите мышь в анестезию индукции камеры. Установите расходомер O 2 до 1 л / мин и изофлюрана до 1 - 3%.
Примечание: Анестезия обычно возникает в 25 г мыши с 2% изофлуран. - Проверьте ответ раздражителя мыши осторожно покачайте камеру и наблюдая отсутствие рефлекса выпрямления.
- Промойте камеру с O 2 , чтобы очистить изофлуран до открытия. Быстро переместите мышь к отопительному робъявления и подключить его к изофлуран через головная часть.
- Отрегулируйте изофлуран до 1,5%. Проверить реакцию раздражителя педали рефлекса (носок щепотку).
- Нанесите смазку офтальмологических Обильно обоих глаз, чтобы избежать высыхания во время операции.
- Брить волосы с обеих задних конечностей с помощью небольшой электрический триммер. Держите кожу в натянутом состоянии во время бритья, чтобы избежать разрывая кожу.
- Применить подогретого крем для удаления волос и оставьте на 1 мин. Аккуратно вытрите с помощью увлажненной марлевый тампон.
- Для хирургической процедуры в более позднее время, выключите изофлуран и переместите мышь к пустым бумажным полотенцем подкладке восстановления клетки, чтобы обеспечить мышь не аспирата клетки постельные принадлежности. Монитор животное, пока он не в состоянии поддерживать грудины лежачее. В противном случае, переместите мышь к операционному столу.
Примечание: Процесс удаления волос может вызвать раздражение кожи и влияют на измерения перфузии. Рекомендуется подождать 1 - 2 дня после того, как удаление волос животного перед рerforming предварительно хирургическую перфузионное сканирование или при выполнении операции.
2. Предоперационная подготовка
- Используйте следующие инструменты во время этой процедуры; небольшие прямые хирургические ножницы, 2 остроконечный под углом пинцет, маленькие пинцетом Грефе, пинцеты водитель игла, 3 ретракторы, маленькие пружинные ножницы, и остроконечный ватные тампоны.
- Стерилизовать все инструменты с использованием автоклава до начала операции. Использование горячего шарика стерилизатор до и между каждой хирургической процедуры, до 5 животных. Стерилизовать дополнительные хирургические пакеты инструментов для операций групп более 5.
- Приготовьте стерильную хирургическую поле, состоящее из покрытого грелку и изофлурановым порт. Выполнить все работы под 10 стерео рассечения микроскопом.
- Обезболить и подготовить мышь, как описано в пунктах 1.1 до 1.5.
- Убедитесь, что мышь полностью успокоены и поместить в положении лежа на спине на операционном столе. Закрепите обе ноги с помощью хирургической ленты.
- При использовании с регулируемой температурой грелку, установите датчик температуры и закрепить ее на базе хирургической платформы с использованием хирургической ленты, чтобы убедиться, что он не будет случайно вырвали во время процедуры.
- Очистите место разреза, используя 3 чередующихся повидон-йода и спиртовые салфетки. Накройте животное стерильной хирургической простыне и вырезать отверстие, чтобы выставить сайт надреза.
3. Индукция Limb ишемией
- Используйте скальпель , чтобы сделать начальный разрез вдоль центра медиальной бедра, бег от колена к животу, и удлиняют разрез приблизительно 1 см с мелкими ножницами (Фигура 1А).
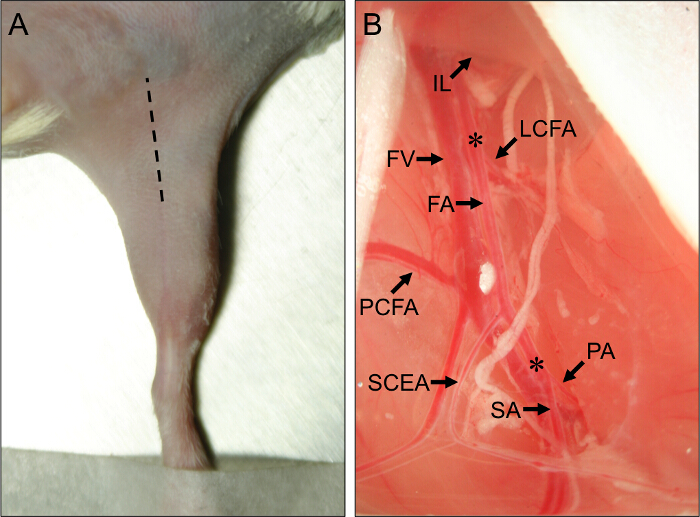
Рисунок 1. Хирургическая сайта и Сосудистые анатомическими ориентирами для мыши ишемии задней конечности хирургии. (A) Внешний видзадних конечностей мышки в положении лежа на спине. Заштрихованная линия указывает место разреза , чтобы правильно выполнять действия задних конечностей с ишемией. (B) Вид проксимального мыши задних конечностей сосудистую систему . Проксимальный конец бедренной артерии (FA) возникает из-под паховой связкой (IL). Дистальный конец FA находится на его ветвление в подколенной артерии (ПА) и подкожную артерию (SA). Основными коллатеральные артерии прочь FA являются латеральная огибающая бедренную кость артерии (LCFA), проксимальный каудально бедренной артерии (НКИД), и поверхностный каудально эпигастральный артерии (SCEA). Бедренную вену (FV) проходит рядом с FA, и венозные ветви можно увидеть параллельно главных артериальных ветвей. Звездочки (*) обозначают проксимальных и дистальных участков для размещения AMEROID констрикторов или лигатур, в зависимости от того, будет ли индуцированные подострое или острая ишемия. Пожалуйста , клиск здесь, чтобы посмотреть большую версию этой фигуры.
- Использование щипцов, откройте надрез и разоблачить мембрану, покрывающую паховой жировой ткани (IFT).
- С помощью закрытого типа пинцета, прокалывают через мембрану в разделении между IFT и брюшной полости. Стравить давление на щипцами, чтобы отделить IFT от мышц живота, обнажая сосудисто-нервный пучок внизу. Обратите внимание на проксимальный и поверхностные хвостовые ветви как важных анатомических ориентиров (рис 1В).
- Вставьте втягивающим и потянуть брюшной ткани проксимально подвергать проксимального AMEROID констриктор или перевязки сайт, просто проксимальнее латеральной огибающей бедренную артерию (рис 1B). Боковая огибающая артерия лежит около 5 мм проксимальнее проксимальных и поверхностных хвостовых артерий.
- Вставьте еще два втягивающих в дистальную части разреза, один медиально и один боковой, чтобы вытащить IFT дистально подальше отхирургический участок, чтобы расширить операционное поле.
- Используйте два тонких щипцов, чтобы удалить самую внешнюю оболочку, покрывающую сосудисто-нервный пучок. Аккуратно вставьте одну половину тонким пинцетом кончик между веной и артерией, сдвинув пинцетом кончик под мембраной, которая связывает их вместе. Закройте пинцетом и аккуратно оторвать мембрану.
- Вставьте кончик закрытым пинцетом между веной и артерией и создать зазор между ними, выпуская давление на щипцов. Повторите эту технику, чтобы создать зазор между артерией и нерва.
- Для подострой ишемии нижних конечностей, поместите AMEROID констриктор на проксимального отдела бедренной артерии (рис 2).
- Чтобы установить проксимального AMEROID констриктор, двигайте кончик пинцетом под бедренной артерии, чтобы изолировать его от сосудисто-нервного пучка. С помощью второго набора angled- щипцов для захвата края жома и направлять его под бедренную артерию.
- Положите бедренной артерии в секМного в констриктор. Повторите эти действия для дистального констриктор, позиционируя его сразу проксимальнее бифуркации бедренной артерии в подколенной артерии и подкожную артерии (рис 2).
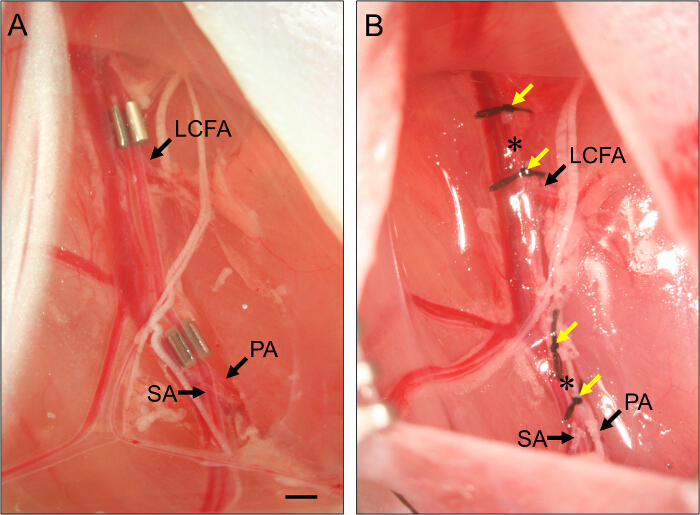
Рисунок 2. Размещение AMEROID констриктор и лигатур. (A) Пример двух AMEROID констрикторов размещенных на бедренной артерии , чтобы вызвать подострый ишемии задней конечности. Проксимальный констриктор помещается только проксимальнее латеральной огибающей бедренную артерию (LCFA). Дистальный констриктор помещают только проксимальнее бифуркации подколенной (ПА) и подкожных артерий (SA). Констриктор устанавливаются с слот лицевой стороной вверх , чтобы обеспечить артерии правильно установлен в пределах жома. (B) Пример лигатуры бедренной артерии , чтобы вызвать острый ишемии задней конечности. лигатурЕ. С. (желтые стрелки) расположены таким образом, что они примыкают к позиции констрикторов в панели (В), и бедренную артерию перерезают между каждым набором из двух лигатур (звездочки). Бар, 1 мм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- При острой ишемии конечности, перевязывать и секут проксимального бедренной артерии.
- Для секут бедренную артерию, резьба 7 - О шовный под артерии только проксимального к положению проксимального жома (шаг 3.7) и лигирование. Свяжите вторую лигатуру около 1 мм дистальнее к первому.
- Используйте пружинные ножницы секут артерию между двумя лигатурами. Для дистального артериального рассечения, повторите эти шаги, помещая две лигатуры около 1 мм друг от друга, только ближние к раздвоению бедренной артерии в подколенной артерии и артерии подкожную, но гарантируя, что они являются дистально по отношению к поверхностным caudаль эпигастрии артерии (см рисунок 1)
- Закрыть разрез с помощью прервала 5 - O викрил наложения швов.
4. Перфузия изображений
- Переместить мышь к C грелку 37 ° установлен ниже лазерной доплеровской перфузии томографа (LDPI) и подключить через головная часть с изофлуран источника. Если нет температуры монитора отсутствует, подождите 5 мин для мыши, чтобы нагреться до 37 ° С.
- Включите томографа и запустить программное обеспечение захвата изображения.
- Нажмите на значок "Новый сингл изображений", чтобы открыть окно "Установка сканера". Установите значение "Размер сканирования" в "Большой" и "Скорость сканирования" до "4 мс / пиксель". Установите область сканирования путем изменения х и у значения под 'Scan Area (единиц)' панели.
- Перейдите на вкладку "Видео и расстояние» для просмотра видео-канал, а также организовать мышь, чтобы вписаться в область сканирования, обозначенном красным контуром. Нажмите на кнопку "Auto" Расстояние для калибровкирасстояние от лазера до объекта. Нажмите "Next", чтобы открыть окно «субъект подробной информации.
- Введите тему информацию и любые соответствующие комментарии. Нажмите кнопку «Далее», чтобы перейти к окну сканирования.
- Нажмите кнопку "Пуск измерения", чтобы открыть "Подтвердить или Scan Distance Override 'диалог. Нажмите 'OK' для подтверждения расстояния сканирования. Наблюдать за процессом сканирования и начать работать в течение 4 - 8 мин в зависимости от размера области сканирования.
- После завершения сканирования, наблюдать окно "Сохранить как". Имя файла и сохраните его.
- Выключите изофлуран и переместите мышь в пустую клетку для восстановления и мониторинга, пока животное не в состоянии поддерживать грудины лежачее. Никогда не кладите мышь восстанавливается после анестезии в клетку с другими мышами.
- Откройте программное обеспечение для анализа изображений. Нажмите на значок "Открыть" и найдите и откройте файл изображения для анализа. В окне файла, наблюдать поток,фото и цветные изображения мыши.
- Чтобы отметить область интереса (ROI) на изображении потока, нажмите на значок 'Show трансформирования. Затем нажмите на ссылку "Полигон" кнопку и перетащите курсор по безоперационной конечности привлечь ROI. Щелкните правой кнопкой мыши, чтобы закрыть форму. Выберите 'Add Polygon' и нарисуйте соответствующий ROI вокруг хирургической конечности.
- Нажмите значок "Статистика", чтобы открыть 'Image Результаты трансформирования Статистика (PU)' окно. Обратите внимание на разницу процентов потока в колонке "Flux% '.
Примечание: Первый ROI обращается будет служить в качестве ссылки.
Примечание: Перед каждым последующим перфузионного сканирования выполните действия , описанные в разделе 1 обезболить мышь и с шагом 4.1 4.11 к изображению животных.
Результаты
Правильная идентификация мыши задних конечностей сосудистую сеть имеет решающее значение для обеспечения воспроизводимости методов индукции как подострой и острой ишемии задней конечности, как описано здесь. В дополнение к изменению , присущего в исследованиях на ?...
Обсуждение
Пожалуй, самым сложным шагом в этой процедуре является разделение бедренной артерии от бедренной вены. Чем больше диаметр и более тонкие стенки бедренной вены по сравнению с теми, артерии повысить ее восприимчивость к проколу и разрыву во время хирургических манипуляций. Вероятность ?...
Раскрытие информации
The authors have no conflicts of interest to disclose.
Благодарности
This study was supported by NIH grants R21HL118661, R56HL124444, and R01HL124444 to CDK, and by NIH grants R00HL103797 and R01HL125695 to JMM.
Материалы
| Name | Company | Catalog Number | Comments |
| Dumont #5/45 Forceps | Fine Science Tools | 11251-35 | Dumoxel |
| Dumont Style 5 Mini Forceps | Fine Science Tools | 11200-14 | Inox |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| 7 - 0 Silk Suture | Sharpoint | DA-2527N | |
| 5 - 0 Coated Vicryl Suture | Ethicon | J463G | |
| Graefe Forceps | Fine Science Tools | 11053-10 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-03 | |
| Artifical Tears Ointment | Rugby Laboratories | 0536-6550-91 | |
| Surgical Tape | 3M | 1530-0 | |
| Fine Cotton Swabs | Contec | SC-4 | |
| Temperature Controller | Physitemp | TCAT-2DF | |
| Ameroid Constrictors | Research Instruments SW | MMC-0.25 x 1.00-SS | |
| Hot Bead Sterilizer | |||
| Deltaphase Isothermal Pad | Braintree Scientific | 39DP | |
| Needle Driver | Fine Science Tools | ||
| Phosphate Buffered Saline | Gibco | 10010-023 | |
| Moor LDPI | Moor Instruments | moorLDI2 | |
| moorLDI Measurement software | Moor Instruments | v. 6.0 | |
| Hair Removal Cream | Nair |
Ссылки
- Criqui, M. H., Aboyans, V. Epidemiology of peripheral artery disease. Circ. Res. 116, 1509-1526 (2015).
- Thukkani, A. K., Kinlay, S. Endovascular intervention for peripheral artery disease. Circ. Res. 116, 1599-1613 (2015).
- Vartanian, S. M., Conte, M. S. Surgical intervention for peripheral arterial disease. Circ. Res. 116, 1614-1628 (2015).
- Bonaca, M. P., Creager, M. A. Pharmacological treatment and current management of peripheral artery disease. Circ. Res. 116, 1579-1598 (2015).
- Conte, M. S., et al. Design and rationale of the PREVENT III clinical trial: edifoligide for the prevention of infrainguinal vein graft failure. Vasc Endovascular Surg. 39, 15-23 (2005).
- Pomposelli, F. B., et al. A decade of experience with dorsalis pedis artery bypass: analysis of outcome in more than 1000 cases. J. Vasc. Surg. 37, 307-315 (2003).
- Willigendael, E. M., et al. Smoking and the patency of lower extremity bypass grafts: a meta-analysis. J. Vasc. Surg. 42, 67-74 (2005).
- Schillinger, M., et al. Balloon angioplasty versus implantation of nitinol stents in the superficial femoral artery. N. Engl. J. Med. 354, 1879-1888 (2006).
- Marmagkiolis, K., et al. 12-month primary patency rates of contemporary endovascular device therapy for femoro-popliteal occlusive disease in 6,024 patients: beyond balloon angioplasty. Catheter. Cardiovasc. Interv. 84, 555-564 (2014).
- Rosenfield, K., et al. Trial of a Paclitaxel-Coated Balloon for Femoropopliteal Artery Disease. N. Engl. J. Med. 373, 145-153 (2015).
- Tepe, G., et al. Drug-coated balloon versus standard percutaneous transluminal angioplasty for the treatment of superficial femoral and popliteal peripheral artery disease: 12-month results from the IN.PACT SFA randomized trial. Circulation. 131, 495-502 (2015).
- Couffinhal, T., et al. Mouse model of angiogenesis. Am. J. Pathol. 152, 1667-1679 (1998).
- Niiyama, H., Huang, N. F., Rollins, M. D., Cooke, J. P. Murine model of hindlimb ischemia. J Vis Exp. , (2009).
- McClung, J. M., et al. Skeletal muscle-specific genetic determinants contribute to the differential strain-dependent effects of hindlimb ischemia in mice. Am. J. Pathol. 180, 2156-2169 (2012).
- Dokun, A. O., et al. A quantitative trait locus (LSq-1) on mouse chromosome 7 is linked to the absence of tissue loss after surgical hindlimb ischemia. Circulation. 117, 1207-1215 (2008).
- Rivard, A., et al. Age-dependent impairment of angiogenesis. Circulation. 99, 111-120 (1999).
- Hazarika, S., et al. Impaired angiogenesis after hindlimb ischemia in type 2 diabetes mellitus: differential regulation of vascular endothelial growth factor receptor 1 and soluble vascular endothelial growth factor receptor 1. Circ. Res. 101, 948-956 (2007).
- Couffinhal, T., et al. Impaired collateral vessel development associated with reduced expression of vascular endothelial growth factor in ApoE-/- mice. Circulation. 99, 3188-3198 (1999).
- Tang, G. L., Chang, D. S., Sarkar, R., Wang, R., Messina, L. M. The effect of gradual or acute arterial occlusion on skeletal muscle blood flow, arteriogenesis, and inflammation in rat hindlimb ischemia. J. Vasc. Surg. 41, 312-320 (2005).
- Yang, Y., et al. Cellular and molecular mechanism regulating blood flow recovery in acute versus gradual femoral artery occlusion are distinct in the mouse. J. Vasc. Surg. 48, 1546-1558 (2008).
- Litvak, J., Siderides, L. E., Vineberg, A. M. The experimental production of coronary artery insufficiency and occlusion. Am. Heart J. 53, 505-518 (1957).
- Bredee, J. J. An improved ameroid constrictor. Preliminary communication. J. Surg. Res. 9, 107-112 (1969).
- McClung, J. M., et al. Subacute limb ischemia induces skeletal muscle injury in genetically susceptible mice independent of vascular density. J. Vasc. Surg. , (2015).
- Hellingman, A. A., et al. Variations in surgical procedures for hind limb ischaemia mouse models result in differences in collateral formation. Eur. J. Vasc. Endovasc. Surg. 40, 796-803 (2010).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PloS one. 8, e84047 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены