Method Article
Lavado broncoalveolar de los pulmones murinos para analizar infiltración de células inflamatorias
En este artículo
Resumen
El estado de salud de los pulmones se refleja por el tipo y número de células inmunitarias que están presentes en los bronquiolos del pulmón. Se describe una técnica de lavado broncoalveolar que permite el aislamiento y estudio de las células no adherentes y factores solubles en el tracto respiratorio inferior de los ratones.
Resumen
Lavage broncoalveolar (BAL) es un procedimiento experimental que se utiliza para examinar el contenido celular y acelular de la luz pulmonar ex vivo para obtener una visión de un estado de enfermedad en curso.
Aquí, se describe un método simple y eficiente para realizar BAL en los pulmones murinos sin la necesidad de herramientas o equipos especiales. El líquido BAL se aísla insertando un catéter en la tráquea de ratones terminalmente anestesiados, a través de los cuales se instila una solución salina en los bronquiolos. El líquido instilado se retrae suavemente para maximizar la recuperación del líquido BAL y para minimizar las fuerzas de corte. Esta técnica permite conservar la viabilidad, la función y la estructura de las células dentro de las vías respiratorias y del líquido BAL.
Numerosas técnicas se pueden aplicar para obtener una mayor comprensión de la enfermedad del estado del pulmón. Aquí, una técnica comúnmente utilizada para la identificación y enumeración de diferentes tipos de células inmunes es, En los que la citometría de flujo se combina con un panel selecto de marcadores fluorescentes marcados específicamente con la superficie celular. El procedimiento BAL presentado aquí también puede usarse para analizar agentes infecciosos, constituyentes de fluidos o partículas inhaladas en pulmones murinos.
Introducción
Las vías respiratorias se encuentran con numerosas insultos, que pueden conducir a la inflamación, invasión de patógenos, o la transformación maligna. Las células epiteliales que recubren el lumen de pulmón forman una de las principales barreras del cuerpo de los mamíferos. Junto con los macrófagos alveolares, impiden que las amenazas ambientales de ganar la entrada al sistema sistémico a través de las vías respiratorias. Ejemplos de tales amenazas incluyen productos químicos orgánicos e inorgánicos, bacterias, y virus. Del mismo modo, las vacunas específicas o intervenciones terapéuticas pueden ser diseñados para apuntar a los pulmones. En todos estos casos, un análisis detallado de la respuesta evocada es importante entender, intervenir, o prevenir los procesos biológicos que tienen lugar dentro del sistema respiratorio.
El lavado broncoalveolar (BAL) es un método muy valiosa para analizar tales respuestas, como las muestras resultantes contienen información importante acerca de las respuestas inflamatorias, mecanismos inmunes, y progresión de la enfermedad infecciosaque pueden ocurrir en las vías respiratorias pulmonares 1, 2. Mediante el uso de BAL, es posible estudiar las células infiltrantes. Esto contrasta con los pulmones digeridos, que dan una población de células "sucio", con muchas células muertas y pegajosas. BAL se lleva a cabo mediante la introducción de una solución salina en los bronquiolos terminales y, posteriormente, la recuperación de esta solución. La solución recuperada se puede utilizar para cuantificar y analizar fenotípicamente pulmón residente y células inflamatorias infiltrantes. se aplica con frecuencia este método para estudiar afluencia celular en modelos de enfermedades de las vías respiratorias, tales como asma, enfermedad pulmonar obstructiva crónica (EPOC), y modelos de enfermedades infecciosas. Aparte de la composición celular, la composición molecular de las vías respiratorias pulmonares también se refleja en el fluido BAL. Para analizar esto, inmunoabsorbente ligado a enzimas (ELISA), inmunotransferencia, y el análisis simultáneo de múltiples citoquinas por una matriz de citoquinas perla puedeRealizado para evaluar la presencia de citocinas y quimiocinas.
El BAL es un método bien establecido para estudiar la afluencia de células inflamatorias en modelos animales de enfermedades respiratorias inflamatorias. La observación de un influjo celular alterado ( por ejemplo, niveles aumentados de linfocitos, eosinófilos o neutrófilos) puede conducir a una mejor comprensión de la enfermedad y puede ser un parámetro objetivo para evaluar el desempeño de una intervención terapéutica.
La interpretación precisa y reproducible del análisis celular BAL requiere que el BAL se realice correctamente y que el fluido recogido sea manejado y procesado adecuadamente. El término "lavado bronquial" fue introducido hace más de ochenta años por Stitt 3 . En 1961, Myrvik obtuvo macrófagos alveolares del líquido de lavado de pulmones de conejo 3 . BAL es ahora un método comúnmente utilizado para analizar y monitorear los pulmones en el modelo de ratón,Todavía no hay un informe de un procedimiento BAL estandarizado en la literatura científica 4 , 5 . Además, hay probablemente tantas maneras de realizar BAL como hay laboratorios de investigación utilizando la técnica 3 , 6 , 7 , 8 , 9 , 10 , 11 . Es importante que los datos obtenidos del BAL representen todo el pulmón murino, y no sólo una parte del pulmón. Este tipo de variabilidad complica la interpretación y comparación de resultados entre diferentes ensayos.
Aquí, se describe un procedimiento BAL básico, barato y reproducible que permite la recogida de la fracción celular y soluble presente en el lumen de la vía aérea del ratón. En resumen, se coloca un catéter en la tráquea expuestaFa ratón terminalmente anestesiado. Una jeringa está conectada al catéter, y una solución salina tamponada que contiene ácido etilendiaminotetraacético (EDTA) se introduce en los pulmones. El lumen del pulmón se muestrea por lavado suave y repetido de la solución salina usando el émbolo. La presión negativa aplicada durante este paso es mínima para evitar el colapso de la vía aérea. Después de la recolección, el BAL obtenido debe procesarse adicionalmente para enumerar e identificar las células mediante citometría de flujo.
Protocolo
Todos los experimentos con animales descritos en este estudio se llevaron a cabo de acuerdo con el (Ley belga 14/08/1986 y 22/12/2003, Real Decreto belga 06/04/2010) nacional y la legislación europea (Directivas de la UE 2010/63 / UE y 86 / 609 / CEE). Todos los experimentos con ratones y todos los protocolos con animales fueron aprobados por el comité de ética de la Universidad de Gante (los números de permisos y LA1400091 EC2016-027).
1. Preparación
- el líquido de lavado
- Preparar una solución de sal equilibrada con 100 mM ácido etilendiaminotetraacético (EDTA).
NOTA: Para medir los niveles de proteína en el líquido de BAL, se recomienda añadir inhibidores de la proteasa para evitar la actividad de la proteasa en el fluido BAL.
- Preparar una solución de sal equilibrada con 100 mM ácido etilendiaminotetraacético (EDTA).
- Catéter
- Hacer un catéter mediante la inserción de una aguja de 23 G en polietileno transparente de plástico 21 G tubo (diámetro interno: 0,58 mm, diámetro exterior: 0.965 mm, y la longitud: 0,5 cm). catéteres confeccionados también se pueden utilizar.
- Anesthetics
- Preparar un anestésico terminal, preferiblemente uno que causa la parada respiratoria (por ejemplo, un barbitúrico como pentobarbital de sodio (> 100 mg / kg) de solución en solución salina tamponada con fosfato (PBS)).
NOTA: Se recomienda el uso de la anestesia inyectada en lugar de anestesia inhalada, como anestesia inhalada puede tener una influencia en el contenido líquido de BAL. CO 2, por ejemplo, tiene una influencia sobre el pH de la sangre y por lo tanto en la redistribución de diferentes compuestos 12.
- Preparar un anestésico terminal, preferiblemente uno que causa la parada respiratoria (por ejemplo, un barbitúrico como pentobarbital de sodio (> 100 mg / kg) de solución en solución salina tamponada con fosfato (PBS)).
- Amonio-cloruro-potasio (ACK) de tampón de lisis de glóbulos rojos
- Preparar un tampón de lisis ACK disolviendo 8,29 g de NH 4 Cl y 1 g de KHCO3 en 1 L de H 2 O con 100 mM EDTA; tampón de lisis celular rojo sangre también se pueden comprar de una fuente externa.
2. Realización de la lavado broncoalveolar (BAL)
- Introducir el catéter en la tráquea
- La eutanasia el ratón por inyección intraperitoneal de una dosis letal de anestesia de barbitúricos de acción corta usando una aguja de 26 G. Para confirmar la anestesia adecuada letal, pellizcar la pata trasera del ratón con una pinza para comprobar el reflejo del pie.
- Colocar el animal en su parte posterior en una placa quirúrgica y fijar el ratón por la fijación abajo las extremidades.
- Pulverizar 70% de etanol en el cuello para desinfectar. Hacer una incisión en la piel del cuello, cerca de la tráquea utilizando un bisturí.
- Abrir la piel para exponer las glándulas salivales. Separar las glándulas salivales mediante el uso de tenazas para exponer el músculo esternohioideo. Incisión en el músculo alrededor de la tráquea utilizando pinzas para exponer la tráquea.
- Colocar un hilo de algodón bajo la tráquea usando pinzas.
- perforar con cuidado el medio de la tráquea expuesta entre dos anillos de cartílago con una aguja 26 G. Tenga cuidado de no dañar la tráquea más allá.
- Insertar el catéter alrededor de 0,5 cm en la tráquea. Asegúrese de que el catheter no se inserta demasiado abajo en la tráquea, ya que esto puede conducir a un daño de la estructura pulmonar.
- Estabilizar el catéter mediante la vinculación de la tráquea alrededor del catéter usando el hilo de algodón se coloca en el paso 2.1.5. Si el catéter no está ligado lo suficiente, la solución de sal equilibrada inyectado puede fluir hacia la parte superior del tracto respiratorio en lugar de hacia abajo en los pulmones.
- Recoger el líquido de lavado
- Cargar una jeringa de 1 ml con 1 ml de solución salina equilibrada estéril con 100 mM EDTA.
- Conectar la jeringa 1 ml al catéter e inyectar suavemente la solución de sal / EDTA en el pulmón.
- Aspirar la solución suavemente mientras que el masaje el tórax del ratón. Si el fluido aspirado no es visible en la jeringa, insertar cuidadosamente el catéter un poco más abajo o hasta la tráquea.
- Retire la jeringa de la aguja y transferir el fluido de lavado recuperado en un tubo de 15 ml se colocó en hielo. Normalmente, el 700 - 900 y# 181; L de BAL se recupera de 1 ml de solución inyectada.
- Repita los pasos 2.2.1 - 2.2.4 dos veces más.
NOTA: Si el propósito es analizar el contenido no celular, se recomienda concentrar las muestras reunidas cuando hay problemas con la sensibilidad.
3. Recogida de los componentes celulares y no celulares del fluido BAL
- Centrifugar el líquido de lavado durante 7 minutos a 400 xg y 4 ° C.
- Recoger el sobrenadante e inmediatamente utilizarlo para un análisis adicional (por ejemplo, ELISA) o congelación a -80 ° C. Mantener el sedimento celular a analizar la afluencia celular en los pulmones.
- Resuspender el sedimento celular en 200 l de tampón de lisis ACK.
NOTA: Este paso asegura la lisis de los eritrocitos, manteniendo intactas las células blancas de la sangre. - Incubar durante 2 min a TA.
Nota: Para reducir la variación causada por la lisis de glóbulos rojos, este paso no debe realizarse durante más de 2 min. - Añadir 1 ml de PBS frío para diluir el tampón de lisis ACK.
- Centrifugar durante 7 min a 400 xg y 4 ° C. Descartar el sobrenadante y volver a suspender las células en un volumen adecuado de PBS para el análisis de aguas abajo (ver abajo).
NOTA: El volumen de la PBS depende del estudio de aguas abajo que se va a realizar.
4. Análisis de los diferentes tipos de células en el líquido BAL mediante citometría de flujo
NOTA: Una posibilidad es analizar la composición celular absoluta y relativa del fluido BAL mediante la realización de citometría de flujo. El objetivo de este trabajo es la elaboración de la técnica de BAL. La citometría de flujo es una técnica especializada por su cuenta. Se recomienda leer los papeles especializados en la técnica de citometría de flujo 13, 14, 15, 16, 17. Anticuerpos acoplados a un fluoróforo tReconocen los antígenos de superficie (véase la Tabla 1 ) específicos de un tipo o tipos de células particulares. Usando una estrategia de gating, es posible identificar células T, macrófagos, células dendríticas, células B, eosinófilos y neutrófilos en la fracción celular del BAL.
| Antígeno | Tipo de célula |
| Clúster de diferenciación 3 (CD3) | Expresado en células T |
| Clúster de diferenciación 11c (CD11c) | Alta expresión en la mayoría de las células dendríticas, pero también en monocitos, macrófagos, neutrófilos y algunas células B. |
| Clúster de diferenciación 11b (CD11b) | Expresado en la superficie de muchos leucocitos incluyendo monocitos, neutrófilos, células asesinas naturales, granulocitos y macrófagos. |
| SiglecF | UNmacrófagos y eosinófilos lveolar. |
| MHCII | Que normalmente se encuentran sólo en células presentadoras de antígeno tales como células dendríticas, los fagocitos mononucleares y las células B. |
| CD19 | antígeno de linfocitos B |
| Ly-6G | Un marcador de monocitos, granulocitos y neutrófilos |
Tabla 1: Selección de Inmunes Los antígenos de superficie celular. Esta tabla proporciona una lista de los epítopos de superficie utilizados para caracterizar los diferentes tipos de células. Se requerirán combinaciones de varios marcadores para definir de manera fiable un tipo de célula específico.
| Las muestras | ||||
| Tubo | Antígeno-fluoróforo que se añaden a las células | Concentración de stock de anticuerpos (mg / ml) | Dilución de anticuerpos | Volumen total (μl) |
| Colorante de viabilidad fijable | 0,2 | 1/1000 | 50 | |
| CD11c | 0,2 | 1/800 | 50 | |
| SiglecF | 0,2 | 1/100 | 50 | |
| Muestra X | MHCII | 0,2 | 1/200 | 50 |
| CD3 | 0,2 | 1/200 | 50 | |
| CD19 | 0,2 | 1/200 | 50 | |
| CD11b | 0,2 | 1/200 | 50 | |
| Ly6G | 0,2 | 1/200 | 50 | |
| Controles de tensión | ||||
| Tubo | Antígeno-fluoróforo que se añade a las células | Concentración de stock de anticuerpos (mg / ml) | Dilución de anticuerpos | Volumen total (μl) |
| Células no conservadas | / | / | / | 50 |
| Células teñidas individuales | Colorante de viabilidad fijable | 0,2 | 1/1000 | 50 |
| Células teñidas individuales | CD11c | 0,2 | 1/800 | 50 |
| Células teñidas individuales | SiglecF | 0,2 | 1/100 | 50 |
| Células teñidas individuales | MHCII | 0,2 | 1/200 | 50 |
| Células teñidas individuales | CD3 | 0.2 | 1/200 | 50 |
| Células teñidas individuales | CD19 | 0,2 | 1/200 | 50 |
| Células teñidas individuales | CD11b | 0,2 | 1/200 | 50 |
| Células teñidas individuales | Ly6G | 0,2 | 1/200 | 50 |
| Controles de compensación | ||||
| Tubo | Antígeno-fluoróforo a ser añadido a perlas | Concentración de stock de anticuerpos (mg / ml) | Dilución de anticuerpos | Volumen total (μl) |
| Granos no madurados | / | / | / | 200 |
| Cuentas manchadas individuales | CD11c | 0,2 | 1/2000 | 200 |
| perlas teñidas individuales | SiglecF | 0.2 | 1/2000 | 200 |
| perlas teñidas individuales | MHCII | 0.2 | 1/200 | 200 |
| perlas teñidas individuales | CD3 | 0.2 | 1/2000 | 200 |
| perlas teñidas individuales | CD19 | 0.2 | 1/2000 | 200 |
| perlas teñidas individuales | CD11b | 0.2 | 1/400 | 200 |
| perlas teñidas individuales | Ly6G | 0.2 | 1/200 | 200 |
Tabla 2. Lista de los controles que se deben incluir. Esta tabla muestra todos los controles necesarios para la correcta interpretación de los resultados obtenidos.
- tinción de la superficie celular
NOTA: Es impoPara incluir todos los controles críticos para el análisis de citometría de flujo. Se necesitan tres juegos de tubos (ver Tabla 2 ): (1) tubos que contienen las muestras; (2) tubos con células BAL para cada anticuerpo-fluoróforo para hacer manchas únicas; Esto permite la determinación de las tensiones para cada canal en el citómetro de flujo; Y (3) tubos con perlas para cada anticuerpo-fluoróforo para hacer manchas únicas; Esto es para determinar la matriz de compensación.- Hacer una mezcla de los anticuerpos y bloque Fc (anti-CD16 / CD32) en PBS a las diluciones apropiadas (ver Tabla 2 ). Es necesario determinar la dilución de trabajo óptima para cada anticuerpo antes del experimento.
- Resuspender las células en 50 μL de la mezcla de anticuerpos para la muestra y añadir 50 μl del anticuerpo diluido apropiadamente a los controles críticos.
NOTA: La tinción puede realizarse en una placa de 96 pocillos en forma de "U". Esto hace posible reducir fácilmente el volumen de mancha aY ejecutar cantidades significativas de muestras. - Incubar durante 30 minutos en la oscuridad a 4 ° C.
- Centrifugar durante 7 min a 400 xg y 4 ° C. Deseche el sobrenadante.
- Re-suspender las células en PBS a un volumen final de 200 μL.
NOTA: Este volumen final depende del volumen mínimo al que puede acceder el citómetro de flujo. Esto puede variar ligeramente entre las máquinas. Además, el volumen de lectura depende del número de células y / o del tiempo que tardará la muestra en ejecutarse en el citómetro de flujo. - Utilizar las muestras y los controles para el análisis de citometría de flujo.
NOTA: Para determinar el número de células absoluto de las diferentes poblaciones de células, se deben agregar cuentas. Añada el mismo número de cuentas (± 25.000 cuentas) a cada muestra justo antes de la medición. Mediante el uso de dispersión directa y lateral, las cuentas de recuento se pueden identificar por citometría de flujo (véase la figura 1 ). Posteriormente, el número absoluto de células en la muestra se puede calcular comparandoE de acontecimientos de la perla a los acontecimientos de la célula. Se puede utilizar la siguiente fórmula: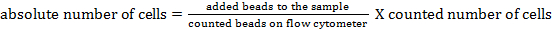
- Análisis de citometría de flujo
NOTA: El análisis de citometría de flujo debe realizarse inmediatamente después de completar el protocolo de tinción. Se debe utilizar un citómetro de flujo con láser y filtros adecuados para la detección de señales. La Tabla 3 da una visión general de los láseres y filtros necesarios para el estudio descrito en este manuscrito. Para obtener más información sobre el análisis de citometría de flujo, véase Adan et al. 18 .- Establezca las puertas primarias basadas en la dispersión delantera y lateral, excluyendo restos y dobletes (vea la Figura 1 ).
- Ajustar el voltaje y la compensación para la superposición espectral con la ayuda de las células de un solo color y cuentas.
NOTA: Estos ajustes son diferentes para cada citómetro de flujo y deben comprobarse antes de cada experimento. Fo análisis de flujo correcta, los voltajes prospectivas y de lado de dispersión son críticos. Una dispersión correcta hacia adelante y lateral puede ayudar en la identificación y la confirmación de la identidad de las células analizadas. Para determinar estas tensiones, una muestra sin teñir se debe ejecutar primero. - Configurar puertas de fluorescencia para el antígeno de superficie (véase la Figura 1) y analizar las muestras.
| tipo de láser | configuración del filtro | |
| 505 LP | 525/50 | |
| Azul (488 nm) | 550 LP | 575/26 |
| 100 mW | 670 LP | 685/35 |
| 750 LP | 780/60 | |
| violeta 405 nm | 450/50 | |
| 100 mW | ||
| rojo 633 nm | 660/20 | |
| 70 mW | 750 LP | 780/60 |
Tabla 3: Resumen de los láseres y filtros del citómetro de flujo utilizado en este estudio.
Resultados
Después de realizar BAL con 3x 1 ml de solución salina tamponada, un volumen de entre 2 y 3 ml debe ser recuperado. Este fluido BAL se puede analizar adicionalmente para caracterizar el contenido celular y no celular. Para investigar la presencia de citocinas y quimiocinas, ELISA 19, inmunotransferencia 20, y el análisis simultáneo de múltiples citoquinas por una matriz de citoquinas talón 21 se puede realizar. Además, el contenido de albúmina y de proteína total de este fluido se puede determinar 22.
Como un ejemplo, este manuscrito describe cómo analizar el contenido celular del fluido BAL por citometría de flujo. El fluido BAL analizado se recogió a partir de ratones Balb / cAnNCrl hembra (edad: 7 semanas) 24 h después de que fueron instilada por vía intratraqueal con lipopolisacárido. Los siguientes anticuerpos, acoplados a un fluoróforo, wSe usaron para identificar los diferentes tipos de células: CD11c, SiglecF, MHCII, CD3ε, CD19, Ly6g y CD11b (véase Tabla 1 y Tabla de Materiales ). También se usó el colorante de viabilidad fijable. Utilizando una estrategia de gating basada en la expresión diferencial de antígenos en las superficies de las diferentes poblaciones celulares ( Figura 1 ), fue posible identificar macrófagos, células dendríticas, células B, células T, neutrófilos y eosinófilos.
En primer lugar, los restos y los dobletes se cerraron basándose en los parámetros de dispersión hacia adelante y hacia el lado. Un colorante de viabilidad facilitó la activación de las células vivas. A continuación, se identificaron células CD11c altas y células CD11c bajas. En la población CD11c alta, se identificaron macrófagos y células dendríticas basándose en la expresión de MHCII y SiglecF, respectivamente. En la población CD11c baja, se identificaron células T y células B basándose en la expresión de CD3ε y CD19, respectivamente. Ene restantes población celular, neutrófilos y eosinófilos se identificaron en base a la expresión de los marcadores CD11b y Ly-6G, respectivamente.
Se añadieron perlas de recuento para determinar el número de células absolutos de las diferentes poblaciones celulares mediante la comparación de la proporción de acontecimientos de talón a los eventos celulares 23. Estas perlas de conteo se identificaron en base a su orientadas hacia y propiedades dispersión lateral (Figura 1). Tabla 4 proporciona una visión general de los números de células absolutos de las diferentes poblaciones de células en el fluido BAL de un ratón ingenuo y un ratón que fue estimulado durante 24 h con 5 g de lipopolisacárido.
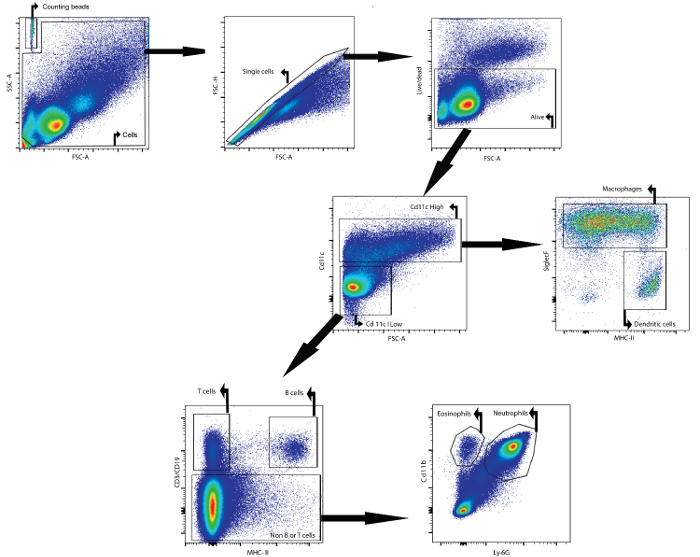
Figura 1: Estrategia de apertura de puerta para la citometría de flujo de detección de macrófagos, células dendríticas, células T, células B, neutrófilos y eosinófilos iFluid n BAL. Se aislaron células de BAL usando el protocolo descrito BAL. Las células fueron aisladas de los ratones 24 h después de la instilación intratraqueal de lipopolisacárido. contar bolas y las células se identificaron basándose en propiedades prospectivas y dispersión lateral. En la puerta de células, se identificaron células individuales utilizando dispersión frontal y lateral. En esta última población, se identificaron las células que estaban vivos. A continuación, se identificaron pilas de gran CD11c y las células de baja CD11c. En la alta población CD11c, se identificaron macrófagos y células dendríticas basado en la expresión MHCII y SiglecF, respectivamente. En el CD11c baja población, se identificaron las células T y células B basado en CD3e y la expresión CD19, respectivamente. En la población de células restante, se identificaron los neutrófilos y eosinófilos basado en CD11b y expresión Ly-6G, respectivamente. Haga clic aquí para ver unaVersión más grande de esta figura.
| Población celular | Número absoluto de células en ratones ingenuos | Número absoluto de células en ratones estimulados con LPS |
| Macrófagos | 79.612 | 25.439 |
| células dendríticas | 495 | 671 |
| Células T | 45.271 | 28.089 |
| Células B | 4.164 | 2.926 |
| Neutrófilos | 632 | 566.716 |
| Eosinófilos | 3.483 | 4.332 |
Cuadro 4: RepresenResultados tativos del Análisis de citometría de flujo sobre el fluido BAL de los ratones estimulados con LPS Naïve y.
Discusión
BAL es una técnica útil para obtener citológico e información bioquímica en respuesta a infecciones o drogas. Inicialmente, BAL se utiliza para gestionar la producción excesiva de moco en pacientes humanos que sufren de toxicidad fosgeno 3. Hoy en día, la técnica se utiliza en los seres humanos para investigar la patogénesis de pulmón, el diagnóstico y manejo terapéutico de enfermedades 3, 24. En animales de laboratorio, BAL se utiliza comúnmente para controlar las respuestas inflamatorias, mecanismos inmunes, y los procesos de enfermedades infecciosas que se producen en las vías respiratorias pulmonares 1, 2.
Para estudiar el patrón celular inflamatoria en modelos de enfermedades respiratorias, BAL debe ser seguido por el recuento de células absoluta y diferencial. Además del número de células absoluto, los números de células relativos son también de interés. Por ejemplo, los modelos de reparación y cáncer muestran vPequeño o ningún recuento de células BAL aumenta. En este modelo, la evaluación de la composición celular es útil. Mediante el uso de tinción celular combinado con microscopía óptica, se pueden identificar diferentes tipos de células, tales como eosinófilos, neutrófilos, macrófagos y linfocitos, basándose en la morfología 25 , 26 , 27 , 28 , 29 , 30 . Citometría de flujo se puede utilizar para las evaluaciones específicas, tales como identificar diferentes fenotipos de células T [ 7 , 31] . Además de la identificación de las diferentes poblaciones de células infiltrantes, la composición no celular del pulmón puede ser investigada usando BAL. Métodos tales como ELISA, inmunoblot, matriz de perlas de citocinas, inmunohistoquímica, y reacción en cadena de la polimerasa cuantitativa se realizan sobre el fluido BAL para determinar las citoquinas, el crecimientofactores, y otros componentes inflamatorios. Para determinar el daño pulmonar, el total de los niveles de proteína y lactato deshidrogenasa en el fluido BAL se pueden medir también 32, 33.
Con el desarrollo de nuevas herramientas de diagnóstico, la caracterización genómica y proteómica de los componentes BAL será posible en un futuro próximo. La combinación de expansión de las capacidades computacionales y tecnologías de expresión génica de alto rendimiento hará que sea posible definir los perfiles de expresión de genes específicos para diversos estados de enfermedad. La realización de estas técnicas en fluido BAL puede proporcionar patrones de expresión génica y proteica para identificar las moléculas importantes que intervienen en las diferentes fases de enfermedades pulmonares.
La principal limitación de los datos obtenidos a partir de fluido BAL es la falta de comparabilidad entre los diferentes ensayos de investigación 3, 9. Hay un alto grado deVariabilidad en la técnica de lavado y el posterior procesamiento de líquido BAL. Para poder comparar cada ensayo BAL, es necesario estandarizar el tipo de fluido de lavado que se inculca, el sitio de instilación, y la fracción que se va a analizar para la composición celular y no celular. Existen diferencias significativas en el número de fracciones de lavado entre diferentes ensayos, variando de uno a 14 veces 34 , 35 , 36 . Esta diferencia puede tener un impacto en el número total estimado de células en los pulmones. Es importante saber qué fracción de líquido BAL contiene la mayoría de las células. Song et al. Mostró que aproximadamente el 70% del número total de células fueron recuperados en la fracción uno a tres [ 22] . Sin embargo, otros informes sugieren que el segundo lavado contenía más células que la primera 37 , 38 . Podemos concluir de estos estudios que un lavado con una sola fracción no representa el pulmón completo, lo que conduce a la mala interpretación de los resultados.
La composición no celular del líquido BAL contiene información valiosa sobre el estado de salud del pulmón 33 , 39 , 40 . Las variaciones en la dilución del líquido BAL contribuyen a la diferencia en la cuantificación de la fracción soluble y, en consecuencia, a las diferencias en los resultados entre ensayos. Song et al. Compararon los niveles de proteína y lactato deshidrogenasa de cada fracción de lavado y concluyeron que la primera fracción de lavado contenía de dos a tres veces más que la segunda fracción.
Para obtener una muestra BAL representativa para su análisis, algunas consideraciones técnicas son cruciales. Uno de ellos es realizar anestesia adecuada. Es muy importante comprobar el pie reflex del ratón para asegurar la sedación terminal. Esto es importante no sólo por razones éticas, sino también porque es difícil de colocar y retener el catéter en la posición correcta si el ratón no está anestesiado adecuadamente.
Una segunda consideración técnica importante es la posición del catéter en la tráquea. Cuando se inserta demasiado profundo el catéter, puede dañar la estructura del pulmón. El extremo distal del catéter no debe llegar a los pulmones durante el procedimiento de BAL. El catéter también debe ser estabilizado y se ata con un hilo de algodón. Si el catéter no se estabiliza, la solución salina inyectado puede fluir hacia arriba en la cavidad nasal en lugar de hacia abajo en los pulmones. Durante la inyección y aspiración de la solución salina, es importante mantener el catéter constante.
Los datos obtenidos a partir del fluido BAL deben representar todo el pulmón murino. Por lo tanto, es importante para infundir un volumen adecuado de tampón de solución salina (es decir,3 ml, divididos en 3 partes alícuotas de 1 ml de cada uno). No hay una relación lineal entre el rendimiento celular y el rendimiento de fluido BAL. Es importante para recoger la solución suavemente mientras que el masaje el tórax del ratón. Si las fuerzas de cizallamiento son demasiado fuertes, la viabilidad, la función y estructura de las células dentro del fluido BAL vías respiratorias y pueden verse comprometidas. Si el fluido aspirado no es visible en la jeringa, cuidadosamente mover el catéter más profundo o más alto en la tráquea.
notificación debe prestar especial atención a aspectos específicos de procesamiento y análisis de BAL. Esto maximizará la información retenida a partir de muestras de BAL. Después de BAL, las células están en un medio salino pobres en nutrientes. Por lo tanto, es muy importante para procesar las muestras dentro de 1 h después del muestreo BAL. Si es necesario un almacenamiento prolongado, se requiere el uso de un medio nutriente suplementado.
Para preservar la viabilidad celular, evitar tubos que promueven la adherencia de las células a la superficie. Evitar ceNtrifugación de suspensiones celulares a velocidades que puedan comprometer la integridad celular o evitar la resuspensión uniforme de las células BAL recuperadas. Las células que contienen fluido BAL deben ser centrifugadas a 400 xg y 4 ° C durante 7 min. Es importante tener en cuenta que las suspensiones de células deben mantenerse a 4 ° C durante el procesamiento.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
HVI es un asistente de investigación en el Departamento de Biomédica Biología Molecular de la Universidad de Gante. ERJ es apoyado por UniVacFlu, subvención número 607690. KR es apoyada por la CE-7PM FLUNIVAC proyecto.
Materiales
| Name | Company | Catalog Number | Comments |
| Hanks' Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 14175-129 | |
| ethyleendiaminetetra acetic acid (EDTA) | Sigma-Aldrich | E6511 | irritating |
| 23 G x 1 1/4 needle | Henke Sass Wolf | 4710006030 | size: 0.60 x 30 mm |
| 26 G x 1/2 needle | Henke Sass Wolf | 4710004512 | size: 0.45 x 12 mm |
| plastic tubing | BD medical technology | 427411 | Polyethylene Tubing, I.D. 0.58 mm (0.023") O.D. 0.965 mm (0.38") 30.5 m (100') |
| sodium pentobarbital | Kela NV | 514 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | PBS without Ca2+ Mg2+ or phenol red; sterile filtered |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | nonpyrogenic and nontoxic |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Surgical scissors | Fine Science Tools GmbH | 91460-11 | |
| centrifuge tube 50 mL | TH.Geyer | 7696705 | Free from Rnase/Dnase/endotoxin |
| centrifuge tube 15 mL | TH.Geyer | 7696702 | Free from Rnase/Dnase/endotoxin |
| microcentrifuge tube 1.5 mL | Sigma-Aldrich | 0030 120.094 | polypropylene |
| Microcentrifuge | Sigma-Aldrich | 5415R | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| Ammonium-Chloride-Potassium (ACK) lysing buffer | Lonza | 10-548E | sterile-filtered |
| live/dead - efluor 506 | ebioscience | 65-0866-18 | fixable viability dye |
| CD11c-PE-cy7 | eBiosciences | 25-0114-81 | |
| SiglecF-PE | BD Pharmingen | 552126 | |
| MHCII-APCefluor780 | Biolegend | 107628 | |
| CD3-PE-cy5 | VWR | 55-0031-U100 | |
| CD19-PE-cy5 | eBiosciences | 15-0193-83 | |
| CD11b-V450 | BD Pharmingen | 560455 | |
| Ly6G-AF700 | Biolegend | 127621 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| anti-CD16/CD32 | BD Pharmingen | 553142 | |
| 96-well 340 µl storage plate plate | Falcon | 353263 | V-bottom, natural polypropylene |
| flow cytometer | BD Biosciences | ||
| catheter | BD Biosciences | 393202 |
Referencias
- Stankunas, K., et al. Conditional protein alleles using knockin mice and a chemical inducer of dimerization. Mol Cell. 12 (6), 1615-1624 (2003).
- Hunninghake, G. W., Gadek, J. E., Kawanami, O., Ferrans, V. J., Crystal, R. G. Inflammatory and immune processes in the human lung in health and disease: evaluation by bronchoalveolar lavage. Am J Pathol. 97 (1), 149-206 (1979).
- Gee, J. B., Fick, R. B. Bronchoalveolar lavage. Thorax. 35 (1), 1-8 (1980).
- Tornling, G., et al. Hyaluronic acid in bronchoalveolar lavage in rats exposed to quartz. Br J Ind Med. 44 (7), 443-445 (1987).
- Henderson, R. F. Use of bronchoalveolar lavage to detect respiratory tract toxicity of inhaled material. Exp Toxicol Pathol. 57, 155-159 (2005).
- Morris, A., et al. Longitudinal analysis of the lung microbiota of cynomolgous macaques during long-term SHIV infection. Microbiome. 4 (1), 38 (2016).
- Naessens, T., et al. GM-CSF treatment prevents respiratory syncytial virus-induced pulmonary exacerbation responses in postallergic mice by stimulating alveolar macrophage maturation. J Allergy Clin Immunol. 137 (3), 700-709 (2016).
- Chockalingam, A., Duraiswamy, R., Jagadeesan, M. Bronchoalveolar lavage cellular analyses in conjunction with high-resolution computed tomography imaging as a diagnostic intervention for patients with suspected interstitial lung disease. Lung India. 33 (3), 287-291 (2016).
- Crystal, R. G., Reynolds, H. Y., Kalica, A. R. Bronchoalveolar lavage. The report of an international conference. Chest. 90 (1), 122-131 (1986).
- Baughman, R. P. The uncertainties of bronchoalveolar lavage. Eur Respir J. 10 (9), 1940-1942 (1997).
- Singletary, M. L., et al. Modification of a common BAL technique to enhance sample diagnostic value. J Am Assoc Lab Anim Sci. 47 (5), 47-51 (2008).
- Angus, D. W., Baker, J. A., Mason, R., Martin, I. J. The potential influence of CO2, as an agent for euthanasia, on the pharmacokinetics of basic compounds in rodents. Drug Metab Dispos. 36 (2), 375-379 (2008).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. J Vis Exp. (97), (2015).
- Rubio-Navarro, A., et al. Phenotypic Characterization of Macrophages from Rat Kidney by Flow Cytometry. J Vis Exp. (116), (2016).
- Butcher, M. J., Herre, M., Ley, K., Galkina, E. Flow cytometry analysis of immune cells within murine aortas. J Vis Exp. (53), (2011).
- Noto, A., Ngauv, P., Trautmann, L. Cell-based flow cytometry assay to measure cytotoxic activity. J Vis Exp. (82), e51105 (2013).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Database, J. S. E. The ELISA method. J Vis Exp. , (2016).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Wunderlich, M. L., Dodge, M. E., Dhawan, R. K., Shek, W. R. Multiplexed fluorometric immunoassay testing methodology and troubleshooting. J Vis Exp. (58), (2011).
- Song, J. A., et al. Standardization of bronchoalveolar lavage method based on suction frequency number and lavage fraction number using rats. Toxicol Res. 26 (3), 203-208 (2010).
- Seliger, C., et al. A rapid high-precision flow cytometry based technique for total white blood cell counting in chickens. Vet Immunol Immunopathol. 145 (1-2), 86-99 (2012).
- Daniele, R. P., Elias, J. A., Epstein, P. E., Rossman, M. D. Bronchoalveolar lavage: role in the pathogenesis, diagnosis, and management of interstitial lung disease. Ann Intern Med. 102 (1), 93-108 (1985).
- Delayre-Orthez, C., Becker, J., de Blay, F., Frossard, N., Pons, F. Exposure to endotoxins during sensitization prevents further endotoxin-induced exacerbation of airway inflammation in a mouse model of allergic asthma. Int Arch Allergy Immunol. 138 (4), 298-304 (2005).
- Delayre-Orthez, C., et al. PPARalpha downregulates airway inflammation induced by lipopolysaccharide in the mouse. Respir Res. 6, 91 (2005).
- Delayre-Orthez, C., de Blay, F., Frossard, N., Pons, F. Dose-dependent effects of endotoxins on allergen sensitization and challenge in the mouse. Clin Exp Allergy. 34 (11), 1789-1795 (2004).
- Hachet-Haas, M., et al. Small neutralizing molecules to inhibit actions of the chemokine CXCL12. J Biol Chem. 283 (34), 23189-23199 (2008).
- Ble, F. X., et al. Activation of the lung S1P(1) receptor reduces allergen-induced plasma leakage in mice. Br J Pharmacol. 158 (5), 1295-1301 (2009).
- Ble, F. X., et al. Allergen-induced lung inflammation in actively sensitized mice assessed with MR imaging. Radiology. 248 (3), 834-843 (2008).
- Reber, L. L., et al. A dissociated glucocorticoid receptor modulator reduces airway hyperresponsiveness and inflammation in a mouse model of asthma. J Immunol. 188 (7), 3478-3487 (2012).
- Drent, M., Cobben, N. A., Henderson, R. F., Wouters, E. F., van Dieijen-Visser, M. Usefulness of lactate dehydrogenase and its isoenzymes as indicators of lung damage or inflammation. Eur Respir J. 9 (8), 1736-1742 (1996).
- Henderson, R. F. Use of bronchoalveolar lavage to detect lung damage. Environ Health Perspect. 56, 115-129 (1984).
- Forget, G., et al. An adherent cell perifusion technique to study the overall and sequential response of rat alveolar macrophages to toxic substances. Environ Health Perspect. 51, 131-140 (1983).
- Sung, J. H., et al. Recovery from welding-fume-exposure-induced lung fibrosis and pulmonary function changes in sprague dawley rats. Toxicol Sci. 82 (2), 608-613 (2004).
- Majetschak, M., Sorell, L. T., Patricelli, T., Seitz, D. H., Knoferl, M. W. Detection and possible role of proteasomes in the bronchoalveolar space of the injured lung. Physiol Res. 58 (3), 363-372 (2009).
- Rehn, B., Bruch, J., Zou, T., Hobusch, G. Recovery of rat alveolar macrophages by bronchoalveolar lavage under normal and activated conditions. Environ Health Perspect. 97, 11-16 (1992).
- Kelly, C. A., Ward, C., Stenton, S. C., Hendrick, D. J., Walters, E. H. Assessment of pulmonary macrophage and neutrophil function in sequential bronchoalveolar lavage aspirates in sarcoidosis. Thorax. 43 (10), 787-791 (1988).
- Eklund, A., Tornling, G., Blaschke, E., Curstedt, T. Extracellular matrix components in bronchoalveolar lavage fluid in quartz exposed rats. Br J Ind Med. 48 (11), 776-782 (1991).
- Olsen, G. N., Harris, J. O., Castle, J. R., Waldman, R. H., Karmgard, H. J. Alpha-1-antitrypsin content in the serum, alveolar macrophages, and alveolar lavage fluid of smoking and nonsmoking normal subjects. J Clin Invest. 55 (2), 427-430 (1975).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados