Method Article
Lavaggio broncoalveolare murini di polmoni per analizzare infiammatoria infiltrazione cellulare
In questo articolo
Riepilogo
Lo stato di salute del polmone si riflette il tipo e il numero di cellule immunitarie che sono presenti nei bronchioli dei polmoni. Descriviamo una tecnica di lavaggio broncoalveolare che consente di isolare e studio delle cellule non aderenti e fattori solubili dal tratto respiratorio inferiore dei topi.
Abstract
Lavaggio Broncoalveolare (BAL) è una procedura sperimentale che viene utilizzata per esaminare il contenuto cellulare e acellulare del lume polmonare ex vivo per ottenere una visione di uno stato di malattia in corso.
Qui viene descritto un metodo semplice ed efficiente per eseguire BAL sui polmoni murini senza la necessità di strumenti o attrezzature speciali. Il liquido BAL viene isolato mediante l'inserimento di un catetere nella trachea di topi terminalmente anestetizzati, attraverso i quali viene solcata una soluzione salina nei bronchioli. Il fluido instillato viene ritratto dolcemente per massimizzare il recupero del liquido BAL e per ridurre al minimo le forze di taglio. Questa tecnica consente di preservare la vitalità, la funzione e la struttura delle cellule all'interno delle vie aeree e del fluido BAL.
Numerose tecniche possono essere applicate per ottenere una maggiore comprensione dello stato di malattia del polmone. Qui, una tecnica comunemente utilizzata per l'identificazione e l'enumerazione di diversi tipi di cellule immunitarie èdescritto, dove la citometria a flusso è unito con un pannello di selezione di marcatori specifici superficiali cellulari fluorescente. La procedura BAL qui presentata può essere utilizzato anche per analizzare gli agenti infettivi, costituenti del fluido o di particelle inalate all'interno polmoni murini.
Introduzione
Le vie aeree incontrano numerosi insulti, che può portare a infiammazione, patogeno invasione o trasformazione maligna. Le cellule epiteliali che rivestono il lume polmonari costituiscono uno dei principali ostacoli del corpo dei mammiferi. Insieme a macrofagi alveolari, impediscono minacce ambientali da l'ammissione al sistema sistemica attraverso le vie respiratorie. Esempi di tali minacce includono prodotti chimici organici e inorganici, batteri e virus. Analogamente, vaccinazioni specifiche o interventi terapeutici possono essere progettati per indirizzare i polmoni. In tutti questi casi, l'analisi elaborata della risposta evocata è importante capire, intervenire o prevenire processi biologici che avvengono all'interno del sistema respiratorio.
lavaggio broncoalveolare (BAL) è un metodo prezioso per analizzare tali risposte, come i campioni risultanti contengono informazioni importanti sulle risposte infiammatorie, meccanismi immunitari, e la progressione della malattia infettivaChe può verificarsi nelle vie respiratorie polmonari 1 , 2 . Utilizzando BAL, è possibile studiare le cellule infiltranti. Questo contrasta con i polmoni digeriti, che danno una popolazione cellulare più "sporca", con molte cellule morte e appiccicose. BAL viene eseguito introducendo una soluzione salina nei bronchioli terminali e successivamente recuperando questa soluzione. La soluzione recuperata può quindi essere utilizzata per quantificare e analizzare fenotipicamente polmone residente e infiltrare le cellule infiammatorie. Questo metodo è spesso utilizzato per studiare l'afflusso cellulare nei modelli di malattia delle vie aeree, come l'asma, la malattia polmonare cronica ostruttiva (COPD) e modelli di malattie infettive. Oltre alla composizione cellulare, la composizione molecolare delle vie aeree polmonari si riflette anche nel fluido BAL. Per analizzare, si può analizzare l'associazione enzimatica dell'immunosorbente (ELISA), l'immunoblot e l'analisi simultanea di citochine multiple tramite un array di brani di citochineeseguito per valutare la presenza di citochine e chemochine.
BAL è un metodo ben consolidata per studiare l'afflusso di cellule infiammatorie in modelli animali di malattia respiratoria infiammatorie. L'osservazione di un afflusso cellulare alterato (ad esempio, livelli aumentati di linfociti, eosinofili, neutrofili o) può portare a migliori intuizioni malattia e può essere un parametro oggettivo per valutare le prestazioni di un intervento terapeutico.
L'interpretazione accurata e riproducibile di analisi cellulare BAL richiede che il BAL è eseguita correttamente e che il liquido raccolto viene gestita ed elaborata correttamente. Il termine "lavaggio bronchiale" è stato introdotto più di ottanta anni fa da Stitt 3. Nel 1961, Myrvik ottenuta macrofagi alveolari dal liquido di lavaggio dei polmoni coniglio 3. BAL è ormai un metodo comunemente usato per analizzare e monitorare i polmoni nel modello di topo, ma ilRe è ancora nessun rapporto di una procedura standardizzata BAL nella letteratura scientifica 4, 5. Inoltre, ci sono probabilmente come molti modi per eseguire BAL in quanto vi sono laboratori di ricerca che utilizzano la tecnica del 3, 6, 7, 8, 9, 10, 11. E 'importante che i dati ottenuti dal BAL rappresentano l'intero polmone murino, e non solo una parte del polmone. Questo tipo di variabilità complica l'interpretazione e il confronto dei risultati tra diverse prove.
Qui, un procedimento semplice, economico, e riproducibile BAL è descritto che permette la raccolta della frazione cellulare solubile presente nel lume delle vie aeree del mouse. In breve, un catetere viene inserito nella trachea esposto oFa mouse terminalmente anestetizzato. Una siringa è collegata al catetere e viene introdotta nei polmoni una soluzione salina tamponata contenente acido etilendiammina-tetraacetico (EDTA). I lumi del polmone sono campionati con una dolce ripetizione della soluzione salina utilizzando lo stantuffo. La pressione negativa applicata durante questa fase è minima per impedire il crollo delle vie aeree. Dopo la raccolta, il BAL ottenuto dovrebbe essere elaborato ulteriormente per enumerare e identificare le cellule mediante citometria a flusso.
Protocollo
Tutti gli esperimenti sugli animali descritti in questo studio sono stati condotti secondo la legislazione nazionale (legge belga 14/08/1986 e 22/12/2003, decreto belga 06/04/2010) e legislazione europea (Direttive UE 2010/63 / UE e 86 / 609 / CEE). Tutti gli esperimenti sui topi e su tutti i protocolli animali sono stati approvati dal comitato etico dell'Università di Ghent (numeri di autorizzazione LA1400091 e EC2016-027).
1. Preparazione
- Fluido lavaggio
- Preparare una soluzione salina equilibrata con 100 μM di acido etilendiammina-tetraecetico (EDTA).
NOTA: Per misurare i livelli di proteine nel fluido BAL, si raccomanda di aggiungere inibitori della proteasi per prevenire l'attività proteasi nel fluido BAL.
- Preparare una soluzione salina equilibrata con 100 μM di acido etilendiammina-tetraecetico (EDTA).
- Catetere
- Realizzare un catetere inserendo un ago da 23 G in tubo di plastica trasparente in polietilene 21 G (diametro interno: 0,58 mm, diametro esterno: 0,965 mm e lunghezza: 0,5 cm). Possono essere utilizzati anche cateteri Premade.
- AnesthETICS
- Preparare un anestetico terminale, preferibilmente uno che provoca arresto respiratorio (ad esempio, un barbiturico come sodio pentobarbital (> 100 mg / kg) in soluzione salina tamponata con fosfato (PBS)).
NOTA: Si raccomanda di utilizzare l'anestesia iniettati invece di anestesia inalatoria, come anestesia inalato può avere un'influenza sul contenuto BAL. CO 2, ad esempio, ha un'influenza sul pH del sangue e conseguentemente sulla ridistribuzione di diversi composti 12.
- Preparare un anestetico terminale, preferibilmente uno che provoca arresto respiratorio (ad esempio, un barbiturico come sodio pentobarbital (> 100 mg / kg) in soluzione salina tamponata con fosfato (PBS)).
- Ammonio-cloruro di potassio (ACK) tampone di lisi dei globuli rossi
- Preparare un tampone di lisi ACK sciogliendo 8.29 g di NH 4 Cl e 1 g di KHCO 3 in 1 L di H 2 O con 100 mM EDTA; tampone di lisi dei globuli rossi può anche essere acquistato da una fonte esterna.
2. Esecuzione del lavaggio broncoalveolare (BAL)
- Introducendo il catetere nella trachea
- Eutanizzare il mouse mediante iniezione intraperitoneale di una dose letale di un anestetico a barbiturato a breve durata utilizzando un ago da 26 G. Per confermare l'anestetizzazione letale appropriata, pizzicare la zampa posteriore del mouse con le pinze per controllare il riflesso del piede.
- Posizionare l'animale sulla schiena su una piastra chirurgica e fissare il mouse appiccando gli arti.
- Spruzzare il 70% di etanolo sul collo per disinfettare. Fai un'incisione nella pelle del collo vicino alla trachea usando un bisturi.
- Aprire la pelle per esporre le ghiandole salivari. Separare le ghiandole salivari usando le pinze per esporre il muscolo sternohyoid. Incise il muscolo intorno alla trachea utilizzando le pinze per esporre la trachea.
- Mettere un filo di cotone sotto la trachea utilizzando le pinze.
- Scollegare attentamente il centro della trachea esposta tra due anelli di cartilagine con un ago da 26 G. Fare attenzione a non danneggiare la trachea.
- Inserire il catetere di circa 0,5 cm nella trachea. Assicurarsi che la catheter non è inserito troppo in basso nella trachea, poiché ciò può portare a danni della struttura dei polmoni.
- Stabilizzare il catetere legando la trachea intorno al catetere utilizzando il filo di cotone collocato nel passaggio 2.1.5. Se il catetere non è legata a sufficienza, la soluzione salina bilanciata iniettata può scorrere verso la parte superiore del tratto respiratorio anziché verso il basso nei polmoni.
- Raccogliere il liquido di lavaggio
- Caricare una siringa da 1 ml con 1 mL di soluzione salina bilanciata sterile con 100 pM EDTA.
- Collegare la siringa da 1 ml al catetere e iniettare delicatamente la soluzione salina / EDTA nei polmoni.
- Aspirare la soluzione delicatamente mentre massaggia il torace del mouse. Se il liquido aspirato non è visibile nella siringa, inserire con cautela il catetere un po 'più in basso o verso l'alto la trachea.
- Rimuovere la siringa dall'ago e trasferire il liquido di lavaggio recuperato in una provetta da 15 ml posti su ghiaccio. Normalmente, 700-900 &# 181; L di BAL viene recuperato da 1 mL di soluzione iniettata.
- Ripetere i punti 2.2.1 - 2.2.4 altre due volte.
NOTA: Se lo scopo è quello di analizzare il contenuto non cellulare, si consiglia di concentrare le campioni aggregati quando ci sono problemi con la sensibilità.
3. Raccogliere le componenti cellulari e non cellulari del fluido BAL
- Centrifugare il liquido di lavaggio per 7 minuti a 400 xg e 4 ° C.
- Raccogliere il surnatante ed utilizzare immediatamente per ulteriore analisi (ad esempio, ELISA) o congelamento a -80 ° C. Tenere il pellet di cellule per analizzare l'afflusso cellulare nei polmoni.
- Risospendere il pellet cellulare in 200 microlitri di tampone di lisi ACK.
NOTA: Questo passaggio garantisce la lisi degli eritrociti, mantenendo intatte le cellule bianche del sangue. - Incubare per 2 minuti a temperatura ambiente.
NOTA: Per ridurre la variazione causata da lisi dei globuli rossi, questo passo non deve essere eseguita per più di 2 min. - Aggiungere 1 mL di PBS freddo per diluire il tampone di lysing ACK.
- Centrifugare per 7 minuti a 400 xg e 4 ° C. Scartare il supernatante e ri-sospendere le cellule in un adeguato volume di PBS per l'analisi a valle (vedi sotto).
NOTA: Il volume del PBS dipende dallo studio a valle che verrà eseguito.
4. Analisi dei diversi tipi di cellule nel liquido BAL mediante citometria di flusso
NOTA: Una possibilità è di analizzare la composizione cellulare assoluta e relativa del fluido BAL eseguendo la citometria a flusso. L'obiettivo di questo documento è elaborare la tecnica del BAL. La citometria a flusso è una tecnica specializzata da solo. Si raccomanda di leggere documenti specializzati sulla tecnica della citometria a flusso 13 , 14 , 15 , 16 , 17 . Anticorpi accoppiati ad un fluoroforo tCappello riconoscono antigeni superficiali (vedi tabella 1 ) specifici per un particolare tipo di cellule. Utilizzando una strategia di gating, è possibile identificare le cellule T, i macrofagi, le cellule dendritiche, le cellule B, gli eosinofili ei neutrofili nella frazione cellulare del BAL.
| Antigene | Tipo di cella |
| Cluster di differenziazione 3 (CD3) | Espresso sulle cellule T |
| Cluster di differenziazione 11c (CD11c) | Alta espressione sulla maggior parte delle cellule dendritiche, ma anche su monociti, macrofagi, neutrofili e alcune cellule B. |
| Cluster di differenziazione 11b (CD11b) | Espresso sulla superficie di molti leucociti compresi monociti, neutrofili, cellule killer naturali, granulociti e macrofagi. |
| SiglecF | UNmacrofagi lveolar ed eosinofili. |
| MHCII | Normalmente si trovano solo sulle cellule presentanti l'antigene come le cellule dendritiche, fagociti mononucleati e cellule B. |
| CD19 | B-linfociti antigene |
| Ly-6G | Un marcatore per monociti, granulociti neutrofili e |
Tabella 1: Selezione di immunitario antigeni delle cellule superficiali. Questa tabella fornisce un elenco di epitopi di superficie usati per caratterizzare i diversi tipi cellulari. Combinazioni di diversi marcatori dovranno definire affidabile un tipo di cellula specifico.
| Campioni | ||||
| Tubo | Antigen-fluoroforo da aggiungere alle cellule | Concentrazione delle concentrazioni degli anticorpi (mg / ml) | Diluizione dell'anticorpo | Volume totale (μL) |
| Tintura di vitalità riparabile | 0.2 | 1/1000 | 50 | |
| CD11c | 0.2 | 1/800 | 50 | |
| SiglecF | 0.2 | 1/100 | 50 | |
| Campione X | MHCII | 0.2 | 1/200 | 50 |
| CD3 | 0.2 | 1/200 | 50 | |
| CD19 | 0.2 | 1/200 | 50 | |
| CD11b | 0.2 | 1/200 | 50 | |
| Ly6G | 0.2 | 1/200 | 50 | |
| Controlli di tensione | ||||
| Tubo | Antigen-fluoroforo da aggiungere alle cellule | Concentrazione delle concentrazioni degli anticorpi (mg / ml) | Diluizione dell'anticorpo | Volume totale (μL) |
| Cellule non sottili | / | / | / | 50 |
| Singole cellule macchiate | Tintura di vitalità riparabile | 0.2 | 1/1000 | 50 |
| Singole cellule macchiate | CD11c | 0.2 | 1/800 | 50 |
| Singole cellule macchiate | SiglecF | 0.2 | 1/100 | 50 |
| Singole cellule macchiate | MHCII | 0.2 | 1/200 | 50 |
| Singole cellule macchiate | CD3 | 0.2 | 1/200 | 50 |
| Singole cellule macchiate | CD19 | 0.2 | 1/200 | 50 |
| Singole cellule macchiate | CD11b | 0.2 | 1/200 | 50 |
| Singole cellule macchiate | Ly6G | 0.2 | 1/200 | 50 |
| Controlli di compensazione | ||||
| Tubo | Antigene-fluoroforo da aggiungere alle perle | Concentrazione delle concentrazioni degli anticorpi (mg / ml) | Diluizione dell'anticorpo | Volume totale (μL) |
| Perline insoddisfatti | / | / | / | 200 |
| Perline singole macchiate | CD11c | 0.2 | 1/2000 | 200 |
| Perline singole macchiate | SiglecF | 0.2 | 1/2000 | 200 |
| Perline singole macchiate | MHCII | 0.2 | 1/200 | 200 |
| Perline singole macchiate | CD3 | 0.2 | 1/2000 | 200 |
| Perline singole macchiate | CD19 | 0.2 | 1/2000 | 200 |
| Perline singole macchiate | CD11b | 0.2 | 1/400 | 200 |
| Perline singole macchiate | Ly6G | 0.2 | 1/200 | 200 |
Tabella 2. Elenco dei controlli da includere. Questa tabella mostra tutti i controlli necessari per l'interpretazione precisa dei risultati ottenuti.
- Colorazione della superficie cellulare
NOTA: è important per includere tutti i controlli critici per la citometria a flusso di analisi. Sono necessarie tre serie di tubi (vedi Tabella 2): (1) provette contenenti i campioni; (2) tubi con cellule del BAL per ogni anticorpo-fluoroforo per rendere macchie singoli; questo consente la determinazione delle tensioni per ciascun canale del citometro di flusso; e (3) tubi con perline per ogni anticorpo-fluoroforo per rendere macchie singoli; questo è quello di determinare la matrice di compensazione.- Realizzare una miscela degli anticorpi e Fc-block (anti-CD16 / CD32) in PBS a diluizioni appropriate (vedere Tabella 2). È necessario determinare la diluizione di lavoro ottimale per ogni anticorpo prima dell'esperimento.
- Risospendere le cellule in 50 pl di miscela di anticorpi per il campione ed aggiungere 50 ml di anticorpo opportunamente diluito ai controlli critici.
NOTA: La colorazione può essere eseguita in un pozzo 96, a forma di piatto u. Ciò rende possibile ridurre facilmente il volume macchia unND eseguire notevoli quantità di campioni. - Incubare per 30 minuti al buio a 4 ° C.
- Centrifugare per 7 minuti a 400 xg e 4 ° C. Eliminare il surnatante.
- Risospendere le cellule in PBS ad un volume finale di 200 microlitri.
NOTA: Questo volume finale dipende dal volume minimo del citometro di flusso può accedere. Questo può differire leggermente tra macchine. Inoltre, il volume di lettura dipende dal numero di cellule e / o il tempo del campione prenderà a funzionare in citofluorimetro. - Utilizzare i campioni ei controlli per le analisi di citometria di flusso.
NOTA: Per determinare il numero di cella assoluto delle diverse popolazioni di cellule, dovrebbero essere aggiunti conteggio sfere. Aggiungere lo stesso numero di perline (± 25.000 perline) per ciascun campione appena prima della misura. Utilizzando avanti e scatter laterale, contando perline possono essere identificati mediante citometria di flusso (vedere Figura 1). Successivamente, il numero assoluto di cellule nel campione può essere calcolata confrontando the rapporto di eventi branello agli eventi cellulari. La seguente formula può essere utilizzato: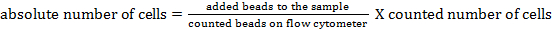
- analisi di citometria di flusso
NOTA: L'analisi di citometria di flusso deve essere effettuata immediatamente dopo il completamento del protocollo di colorazione. Un citofluorimetro con laser e filtri per il rilevamento del segnale appropriati deve essere utilizzato. La tabella 3 fornisce una panoramica dei laser e filtri necessari per lo studio descritto in questo manoscritto. Per ulteriori informazioni sulle analisi di citometria di flusso, vedi Adan et al. 18.- Impostare le porte principali basate sulla avanti e scatter laterale, escluse detriti e doppietti (vedi Figura 1).
- Regolare la tensione e la compensazione per la sovrapposizione spettrale con l'aiuto delle cellule singole macchiati e perline.
NOTA: Queste impostazioni sono diverse per ogni citofluorimetro e hanno bisogno di essere controllati prima di ogni esperimento. Fo l'analisi di flusso corretta, le tensioni forward e laterale scatter sono critici. Una corretta e con il lato scatter può aiutare nella identificazione e la conferma dell'identità delle cellule analizzate. Per determinare queste tensioni, un campione non colorato deve essere eseguito prima. - Impostare cancelli fluorescenza per l'antigene di superficie (vedi Figura 1) e analizzare i campioni.
| tipo di laser | l'installazione del filtro | |
| 505 LP | 525/50 | |
| Blu (488 nm) | 550 LP | 575/26 |
| 100 mW | 670 LP | 685/35 |
| 750 LP | 780/60 | |
| violetto 405 nm | 450/50 | |
| 100 mW | ||
| Rosso 633 nm | 660/20 | |
| 70 mW | 750 LP | 780/60 |
Tabella 3: Panoramica dei laser e dei filtri del citometro di flusso utilizzato in questo studio.
Risultati
Dopo l'esecuzione di BAL con 3x1 mL di soluzione salina tamponata, occorre recuperare un volume compreso tra 2 e 3 mL. Questo fluido BAL può essere analizzato ulteriormente per caratterizzare il contenuto cellulare e non cellulare. Per studiare la presenza di citochine e chemocine, può essere eseguita l'ELISA 19 , l'immunoblot 20 e l'analisi simultanea di citochine multiple mediante una matrice di raggi di citochine 21 . Inoltre, l'albumina e il contenuto proteico totale di questo fluido possono essere determinati 22 .
Ad esempio, questo manoscritto descrive come analizzare il contenuto cellulare del fluido BAL mediante citometria a flusso. Il fluido BAL analizzato è stato raccolto da topi femminili Balb / cAnNCrl (età: 7 settimane) 24 h dopo che sono stati intratrachealmente istruiti con lipopolisaccaride. I seguenti anticorpi, accoppiati ad un fluoroforo,Sono stati utilizzati per identificare i diversi tipi di cellule: CD11c, SiglecF, MHCII, CD3ε, CD19, Ly6g e CD11b (vedere tabella 1 e tabella dei materiali ). Viene inoltre utilizzato il colorante di vitabilità fisso. Utilizzando una strategia di gating basata sull'espressione differenziale di antigeni sulle superfici delle diverse popolazioni cellulari ( Figura 1 ), è stato possibile identificare macrofagi, cellule dendritiche, cellule B, cellule T, neutrofili e eosinofili.
Innanzitutto, i detriti ei doppi sono stati eliminati in base ai parametri avanti e laterali. Un colorante di vitabilità ha facilitato il gating sulle cellule vive. Successivamente, sono state identificate le cellule alte CD11c e le basse cellule CD11c. Nell'alta popolazione CD11c, i macrofagi e le cellule dendritiche sono stati identificati in base all'espressione MHCII e SiglecF. Nella popolazione bassa CD11c, le cellule T e le cellule B sono state identificate in base all'espressione CD3ε e CD19, rispettivamente. In thE la restante popolazione cellulare, i neutrofili e gli eosinofili sono stati identificati sulla base dell'espressione del marker CD11b e Ly-6G.
Le perline di conteggio sono state aggiunte per determinare i numeri di cellule assoluti delle diverse popolazioni di cellule confrontando il rapporto degli eventi di branco agli eventi di cellule 23 . Queste perline di conteggio sono state identificate in base alle loro proprietà di avanzamento e di dispersione laterale ( Figura 1 ). La tabella 4 fornisce una panoramica dei numeri di cellule assoluti delle diverse popolazioni di cellule nel fluido BAL di un topo naïve e di un topo stimolato per 24 h con 5 μg di liposolisaccaride.
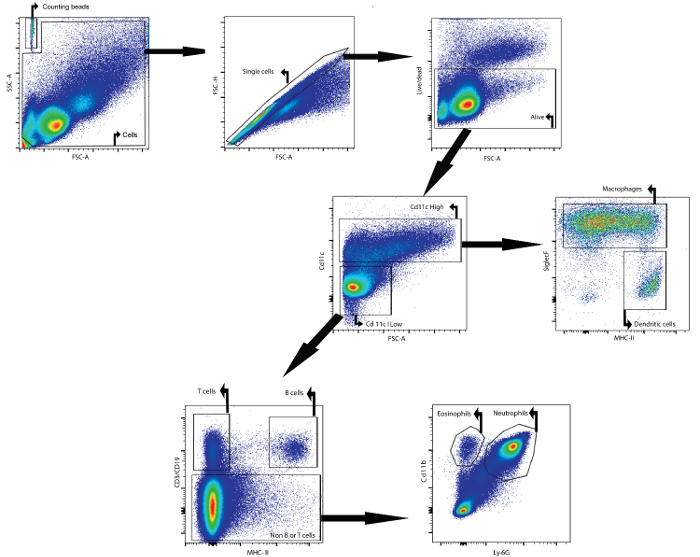
Figura 1: Strategia di Gating per la rilevazione citometrica dei flussi di macrofagi, cellule dendritiche, cellule T, cellule B, neutrofili e eosinofili iN Fluido BAL. Le cellule BAL sono state isolate utilizzando il protocollo BAL descritto. Le cellule sono state isolate dai topi 24 h dopo l'instillazione intracranica del lipopolisaccaride. Le perline e le celle di conteggio sono state identificate in base alle proprietà di spostamento avanti e laterale. Nel cancello cellulare sono state identificate singole cellule usando il dispersione avanti e laterale. In questa ultima popolazione, le cellule vive sono state identificate. Allo stesso modo sono state identificate le cellule alte CD11c e le basse cellule CD11c. Nell'alta popolazione CD11c, i macrofagi e le cellule dendritiche sono stati identificati in base all'espressione MHCII e SiglecF. Nella popolazione bassa CD11c, le cellule T e le cellule B sono state identificate in base all'espressione CD3ε e CD19, rispettivamente. Nella restante popolazione cellulare, i neutrofili e gli eosinofili sono stati identificati sulla base dell'espressione CD11b e Ly-6G, rispettivamente. Fare clic qui per visualizzare una paginaVersione più grande di questa figura.
| Popolazione cellulare | Numero assoluto di cellule in topi ingenuo | Numero assoluto di cellule in topi stimolati da LPS |
| macrofagi | 79.612 | 25.439 |
| Cellule dendritiche | 495 | 671 |
| Cellule T | 45.271 | 28.089 |
| B cellule | 4.164 | 2.926 |
| neutrofili | 632 | 566.716 |
| eosinofili | 3.483 | 4.332 |
Tabella 4: RappresentaI risultati tativi della Citometria a Flusso di analisi sul fluido BAL di topi ingenuo e LPS-stimolati.
Discussione
BAL è una tecnica utile per ottenere citologico e informazioni biochimiche in risposta alle infezioni o farmaci. Inizialmente, BAL è stato utilizzato per gestire l'eccessiva produzione di muco nei pazienti umani affetti da tossicità fosgene 3. Al giorno d'oggi, la tecnica è utilizzata negli esseri umani per studiare la patogenesi del polmone, la diagnosi e la gestione terapeutica delle malattie 3, 24. In animali da laboratorio, BAL è comunemente utilizzato per monitorare risposte infiammatorie, meccanismi immunitari e processi malattie infettive che si verificano nelle vie aeree polmonari 1, 2.
Per studiare il modello cellulare infiammatoria in modelli di malattia respiratoria, BAL dovrebbe essere seguito da conta cellulare assoluta e differenziale. Oltre al numero di cella assoluto, i numeri di cella relativi sono interessanti. Ad esempio, i modelli di riparazione e di cancro mostrano very piccolo a nessun BAL aumenta conta delle cellule. In questo modello, la valutazione della composizione cellulare è utile. Utilizzando colorazione della cellula combinata con microscopia ottica, diversi tipi di cellule, come eosinofili, neutrofili, macrofagi e linfociti, possono essere identificati sulla base di morfologia 25, 26, 27, 28, 29, 30. La citometria a flusso può essere utilizzato per valutazioni specifiche, ad esempio per identificare diversi fenotipi cellule T 7, 31. Oltre alla identificazione delle diverse popolazioni cellulari infiltrante, la composizione non cellulare del polmone può essere studiata utilizzando BAL. Metodi come ELISA, immunoblot, matrice citochine perlina, immunoistochimica, e la reazione a catena della polimerasi quantitativa vengono eseguite su BAL determinare citochine, crescitaFattori e altri componenti infiammatori. Per determinare i danni polmonari, i livelli totali di proteine e di lattato deidrogenasi nel fluido BAL possono anche essere misurati 32 , 33 .
Con lo sviluppo di nuovi strumenti diagnostici, la caratterizzazione genomica e proteomica dei componenti BAL sarà possibile nel prossimo futuro. La combinazione di funzionalità computazionali in espansione e tecnologie di espressione genica ad alta velocità consentirà di definire profili specifici di espressione genica per vari stati di malattia. L'esecuzione di queste tecniche sul fluido BAL può fornire modelli di espressione genica e proteica per identificare le molecole importanti coinvolte nelle diverse fasi delle malattie polmonari.
La limitazione principale dei dati ottenuti con il fluido BAL è la mancanza di comparabilità tra i vari studi di ricerca 3 , 9 . C'è un alto grado divariabilità nella tecnica di lavaggio e il successivo trattamento di BAL. Per poter confrontare ogni prova BAL, è necessario uniformare il tipo di liquido di lavaggio che viene instillata, il sito di instillazione, e la frazione che deve essere analizzato per composizione cellulare e non cellulare. Ci sono differenze significative nel numero di frazioni di lavaggio tra diverse prove, variabile da una a 14 volte 34, 35, 36. Questa differenza può avere un impatto sul numero di cellule totali stimate nei polmoni. E 'importante sapere quale frazione BAL contiene la maggior parte delle cellule. Canzone et al. ha mostrato che circa il 70% del numero totale di cellule sono state recuperate in frazione 2:59 22. Tuttavia, altri rapporti hanno suggerito che il secondo lavaggio conteneva più celle rispetto al primo 37, 38 . Possiamo concludere da questi studi che una lavanda con una sola frazione non rappresenta l'intero polmone, che porta alla errata interpretazione dei risultati.
La composizione noncellular del fluido BAL contiene informazioni preziose sullo stato di salute del polmone 33, 39, 40. Variazioni della diluizione del liquido BAL contribuisce alla differenza nella quantificazione della frazione solubile e, di conseguenza, le differenze nei risultati tra prove. Canzone et al. rispetto delle proteine e lattato deidrogenasi di ogni frazione lavanda e concluso che la prima frazione di lavaggio conteneva due a tre volte più della seconda frazione.
Per recuperare un campione rappresentativo BAL per l'analisi, alcune considerazioni tecniche sono cruciali. Uno di loro è di eseguire una corretta anestesia. E 'molto importante controllare l'arbitro piedelex del mouse per garantire sedazione terminale. Questo è importante non solo per motivi etici, ma anche perché è difficile da posizionare e mantenere il catetere nella posizione corretta se il mouse non è adeguatamente anestetizzato.
Una seconda importante considerazione tecnica è la posizione del catetere nella trachea. Quando il catetere viene inserito troppo in profondità, può danneggiare la struttura del polmone. L'estremità distale del catetere non dovrebbe raggiungere i polmoni durante la procedura di BAL. Il catetere deve essere stabilizzata e legato con un filo di cotone. Se il catetere non è stabilizzato, la soluzione salina iniettata può fluire verso l'alto nella cavità nasale anziché verso il basso nei polmoni. Durante l'iniezione e l'aspirazione della soluzione salina, è importante mantenere il catetere costante.
I dati ottenuti dal BAL devono rappresentare l'intero polmone murino. Pertanto, è importante infondere un adeguato volume di tampone salino (ie3 mL, suddivisi in 3 aliquote di 1 mL ciascuna). Non esiste una relazione lineare tra la resa cellulare e la resa del fluido BAL. È importante raccogliere la soluzione delicatamente mentre si massaggia il torace del topo. Se le forze di taglio sono troppo forti, la vitalità, la funzione e la struttura delle cellule all'interno delle vie aeree e del fluido BAL possono essere compromesse. Se il liquido aspirato non è visibile nella siringa, spostare con attenzione il catetere più o più in alto nella trachea.
Particolare attenzione deve essere rivolta a specifici aspetti dell'elaborazione e dell'analisi BAL. Questo massimizzerà le informazioni conservate dai campioni BAL. Dopo BAL, le cellule sono in un mezzo salino medio povero di nutrienti. È pertanto molto importante elaborare i campioni entro 1 ora dopo il campionamento BAL. Se è necessario uno stoccaggio prolungato, è necessario utilizzare un supporto nutrizionale.
Per preservare la vitalità cellulare, evitare tubi che promuovano l'adesione cellulare alla superficie. Evita centrifugation di sospensioni cellulari a velocità che possono compromettere l'integrità cellulare o per prevenire risospensione uniforme delle cellule BAL recuperati. cellule del liquido contenente BAL devono essere centrifugate a 400 xg e 4 ° C per 7 minuti. È importante tenere presente che sospensioni cellulari devono essere tenuti a 4 ° C durante la lavorazione.
Divulgazioni
Gli autori non hanno niente da rivelare.
Riconoscimenti
LVH è un assistente di ricerca presso il Dipartimento di Biologia Molecolare Biomedica dell'Università di Ghent. ERJ è supportato da UniVacFlu, codice di autorizzazione 607690. KR è supportato da EC-FP7 progetto FLUNIVAC.
Materiali
| Name | Company | Catalog Number | Comments |
| Hanks' Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 14175-129 | |
| ethyleendiaminetetra acetic acid (EDTA) | Sigma-Aldrich | E6511 | irritating |
| 23 G x 1 1/4 needle | Henke Sass Wolf | 4710006030 | size: 0.60 x 30 mm |
| 26 G x 1/2 needle | Henke Sass Wolf | 4710004512 | size: 0.45 x 12 mm |
| plastic tubing | BD medical technology | 427411 | Polyethylene Tubing, I.D. 0.58 mm (0.023") O.D. 0.965 mm (0.38") 30.5 m (100') |
| sodium pentobarbital | Kela NV | 514 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | PBS without Ca2+ Mg2+ or phenol red; sterile filtered |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | nonpyrogenic and nontoxic |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Surgical scissors | Fine Science Tools GmbH | 91460-11 | |
| centrifuge tube 50 mL | TH.Geyer | 7696705 | Free from Rnase/Dnase/endotoxin |
| centrifuge tube 15 mL | TH.Geyer | 7696702 | Free from Rnase/Dnase/endotoxin |
| microcentrifuge tube 1.5 mL | Sigma-Aldrich | 0030 120.094 | polypropylene |
| Microcentrifuge | Sigma-Aldrich | 5415R | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| Ammonium-Chloride-Potassium (ACK) lysing buffer | Lonza | 10-548E | sterile-filtered |
| live/dead - efluor 506 | ebioscience | 65-0866-18 | fixable viability dye |
| CD11c-PE-cy7 | eBiosciences | 25-0114-81 | |
| SiglecF-PE | BD Pharmingen | 552126 | |
| MHCII-APCefluor780 | Biolegend | 107628 | |
| CD3-PE-cy5 | VWR | 55-0031-U100 | |
| CD19-PE-cy5 | eBiosciences | 15-0193-83 | |
| CD11b-V450 | BD Pharmingen | 560455 | |
| Ly6G-AF700 | Biolegend | 127621 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| anti-CD16/CD32 | BD Pharmingen | 553142 | |
| 96-well 340 µl storage plate plate | Falcon | 353263 | V-bottom, natural polypropylene |
| flow cytometer | BD Biosciences | ||
| catheter | BD Biosciences | 393202 |
Riferimenti
- Stankunas, K., et al. Conditional protein alleles using knockin mice and a chemical inducer of dimerization. Mol Cell. 12 (6), 1615-1624 (2003).
- Hunninghake, G. W., Gadek, J. E., Kawanami, O., Ferrans, V. J., Crystal, R. G. Inflammatory and immune processes in the human lung in health and disease: evaluation by bronchoalveolar lavage. Am J Pathol. 97 (1), 149-206 (1979).
- Gee, J. B., Fick, R. B. Bronchoalveolar lavage. Thorax. 35 (1), 1-8 (1980).
- Tornling, G., et al. Hyaluronic acid in bronchoalveolar lavage in rats exposed to quartz. Br J Ind Med. 44 (7), 443-445 (1987).
- Henderson, R. F. Use of bronchoalveolar lavage to detect respiratory tract toxicity of inhaled material. Exp Toxicol Pathol. 57, 155-159 (2005).
- Morris, A., et al. Longitudinal analysis of the lung microbiota of cynomolgous macaques during long-term SHIV infection. Microbiome. 4 (1), 38 (2016).
- Naessens, T., et al. GM-CSF treatment prevents respiratory syncytial virus-induced pulmonary exacerbation responses in postallergic mice by stimulating alveolar macrophage maturation. J Allergy Clin Immunol. 137 (3), 700-709 (2016).
- Chockalingam, A., Duraiswamy, R., Jagadeesan, M. Bronchoalveolar lavage cellular analyses in conjunction with high-resolution computed tomography imaging as a diagnostic intervention for patients with suspected interstitial lung disease. Lung India. 33 (3), 287-291 (2016).
- Crystal, R. G., Reynolds, H. Y., Kalica, A. R. Bronchoalveolar lavage. The report of an international conference. Chest. 90 (1), 122-131 (1986).
- Baughman, R. P. The uncertainties of bronchoalveolar lavage. Eur Respir J. 10 (9), 1940-1942 (1997).
- Singletary, M. L., et al. Modification of a common BAL technique to enhance sample diagnostic value. J Am Assoc Lab Anim Sci. 47 (5), 47-51 (2008).
- Angus, D. W., Baker, J. A., Mason, R., Martin, I. J. The potential influence of CO2, as an agent for euthanasia, on the pharmacokinetics of basic compounds in rodents. Drug Metab Dispos. 36 (2), 375-379 (2008).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. J Vis Exp. (97), (2015).
- Rubio-Navarro, A., et al. Phenotypic Characterization of Macrophages from Rat Kidney by Flow Cytometry. J Vis Exp. (116), (2016).
- Butcher, M. J., Herre, M., Ley, K., Galkina, E. Flow cytometry analysis of immune cells within murine aortas. J Vis Exp. (53), (2011).
- Noto, A., Ngauv, P., Trautmann, L. Cell-based flow cytometry assay to measure cytotoxic activity. J Vis Exp. (82), e51105 (2013).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Database, J. S. E. The ELISA method. J Vis Exp. , (2016).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Wunderlich, M. L., Dodge, M. E., Dhawan, R. K., Shek, W. R. Multiplexed fluorometric immunoassay testing methodology and troubleshooting. J Vis Exp. (58), (2011).
- Song, J. A., et al. Standardization of bronchoalveolar lavage method based on suction frequency number and lavage fraction number using rats. Toxicol Res. 26 (3), 203-208 (2010).
- Seliger, C., et al. A rapid high-precision flow cytometry based technique for total white blood cell counting in chickens. Vet Immunol Immunopathol. 145 (1-2), 86-99 (2012).
- Daniele, R. P., Elias, J. A., Epstein, P. E., Rossman, M. D. Bronchoalveolar lavage: role in the pathogenesis, diagnosis, and management of interstitial lung disease. Ann Intern Med. 102 (1), 93-108 (1985).
- Delayre-Orthez, C., Becker, J., de Blay, F., Frossard, N., Pons, F. Exposure to endotoxins during sensitization prevents further endotoxin-induced exacerbation of airway inflammation in a mouse model of allergic asthma. Int Arch Allergy Immunol. 138 (4), 298-304 (2005).
- Delayre-Orthez, C., et al. PPARalpha downregulates airway inflammation induced by lipopolysaccharide in the mouse. Respir Res. 6, 91 (2005).
- Delayre-Orthez, C., de Blay, F., Frossard, N., Pons, F. Dose-dependent effects of endotoxins on allergen sensitization and challenge in the mouse. Clin Exp Allergy. 34 (11), 1789-1795 (2004).
- Hachet-Haas, M., et al. Small neutralizing molecules to inhibit actions of the chemokine CXCL12. J Biol Chem. 283 (34), 23189-23199 (2008).
- Ble, F. X., et al. Activation of the lung S1P(1) receptor reduces allergen-induced plasma leakage in mice. Br J Pharmacol. 158 (5), 1295-1301 (2009).
- Ble, F. X., et al. Allergen-induced lung inflammation in actively sensitized mice assessed with MR imaging. Radiology. 248 (3), 834-843 (2008).
- Reber, L. L., et al. A dissociated glucocorticoid receptor modulator reduces airway hyperresponsiveness and inflammation in a mouse model of asthma. J Immunol. 188 (7), 3478-3487 (2012).
- Drent, M., Cobben, N. A., Henderson, R. F., Wouters, E. F., van Dieijen-Visser, M. Usefulness of lactate dehydrogenase and its isoenzymes as indicators of lung damage or inflammation. Eur Respir J. 9 (8), 1736-1742 (1996).
- Henderson, R. F. Use of bronchoalveolar lavage to detect lung damage. Environ Health Perspect. 56, 115-129 (1984).
- Forget, G., et al. An adherent cell perifusion technique to study the overall and sequential response of rat alveolar macrophages to toxic substances. Environ Health Perspect. 51, 131-140 (1983).
- Sung, J. H., et al. Recovery from welding-fume-exposure-induced lung fibrosis and pulmonary function changes in sprague dawley rats. Toxicol Sci. 82 (2), 608-613 (2004).
- Majetschak, M., Sorell, L. T., Patricelli, T., Seitz, D. H., Knoferl, M. W. Detection and possible role of proteasomes in the bronchoalveolar space of the injured lung. Physiol Res. 58 (3), 363-372 (2009).
- Rehn, B., Bruch, J., Zou, T., Hobusch, G. Recovery of rat alveolar macrophages by bronchoalveolar lavage under normal and activated conditions. Environ Health Perspect. 97, 11-16 (1992).
- Kelly, C. A., Ward, C., Stenton, S. C., Hendrick, D. J., Walters, E. H. Assessment of pulmonary macrophage and neutrophil function in sequential bronchoalveolar lavage aspirates in sarcoidosis. Thorax. 43 (10), 787-791 (1988).
- Eklund, A., Tornling, G., Blaschke, E., Curstedt, T. Extracellular matrix components in bronchoalveolar lavage fluid in quartz exposed rats. Br J Ind Med. 48 (11), 776-782 (1991).
- Olsen, G. N., Harris, J. O., Castle, J. R., Waldman, R. H., Karmgard, H. J. Alpha-1-antitrypsin content in the serum, alveolar macrophages, and alveolar lavage fluid of smoking and nonsmoking normal subjects. J Clin Invest. 55 (2), 427-430 (1975).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon