Method Article
ברונכאלווולאר של ריאות Murine כדי לנתח דלקת תאים דלקתית
In This Article
Summary
מצב בריאותי של הריאה משתקף על ידי סוג ומספר של תאים חיסוניים הנמצאים bronchioles של הריאה. אנו מתארים טכניקת שטיפה ברונכואלוואלית המאפשרת בידוד ומחקר של תאים לא דליקים וגורמים מסיסים ממערכת הנשימה התחתונה של עכברים.
Abstract
שטיפת ברונכואלוואולרית (BAL) היא הליך ניסיוני המשמש לבדיקת תוכן הסלולר acellular של לומן הריאות לשעבר vivo כדי לקבל תובנה לגבי מצב מחלה מתמשך.
כאן, שיטה פשוטה ויעילה מתואר לבצע BAL על הריאות בעכברים ללא צורך בכלים מיוחדים או ציוד. נוזל BAL מבודד על ידי הכנסת קטטר בתוך קנה הנשימה של עכברים הרדימו סופנים, שדרכו פתרון מלוח החדיר לתוך bronchioles. הנוזל החדיר הוא חזר בו בעדינות כדי למקסם אחזור נוזל BAL ולמזער כוחות מניעים. טכניקה זו מאפשרת את יכולת הקיום, פונקציה, ומבנה של תאים בתוך דרכי הנשימה ואת נוזל BAL להישמר.
טכניקות רבות ניתן להחיל להשיג הבנה נוספת של מדינת המחלה של הריאות. הנה, טכניקה נפוצה לזיהוי הספירה של סוגים שונים של תאי מערכת חיסון היאתיאר, שבו cytometry זרימה משולב עם פאנל נבחר של סמנים על פני השטח fluorescently שכותרתו תאים ספציפיים. ההליך BAL המוצג כאן יכול לשמש גם כדי לנתח סוכני זיהומיות, המרכיבים נוזל, או חלקיקים בשאיפה בתוך ריאות Murine.
Introduction
דרכי הנשימה פוגשות עלבונות רבים, אשר יכולים להוביל לדלקת, פלישת פתוגן או שינוי ממאיר. תאי אפיתל כי קו הריאות לומן טופס אחד המחסומים העיקריים של הגוף היונקים. יחד עם מקרופאגים אלכוהולים, הם מונעים איומים סביבתיים להיכנס למערכת המערכתית דרך דרכי הנשימה. דוגמאות לאיומים כאלה כוללות כימיקלים אורגניים ואי-אורגניים, חיידקים ווירוסים. כמו כן, חיסונים ספציפיים או התערבויות טיפוליות יכול להיות מתוכנן לכוון את הריאות. בכל המקרים האלה, ניתוח מפורט של התגובה מעוררת חשוב להבין, להתערב, או למנוע תהליכים ביולוגיים המתרחשים בתוך מערכת הנשימה.
שטיפה ברונכואלוואלית (BAL) היא שיטה שלא יסולא בפז כדי לנתח תגובות כאלה, כמו דגימות וכתוצאה מכך מכילים מידע חשוב על תגובות דלקתיות, מנגנוני החיסון, התקדמות מחלה מדבקתשיכולות להתרחש בדרכי הנשימה ריאתי 1, 2. באמצעות BAL, אפשר ללמוד את תאי הסתננות. זאת בניגוד ריאות מעוכלות, שנותנות אוכלוסיית תא של "מלוכלכת", עם הרבה תאים מתים ודביקים. BAL מבוצע על ידי החדרת תמיסת מלח לתוך bronchioles מסוף ובהמשך מתאושש הפתרון הזה. הפתרון לאחזר לאחר מכן ניתן להשתמש כדי לכמת phenotypically לנתח ריאות תושב ותאים דלקתיים הסתננות. שיטה זו מיושמת לעיתים קרובות כדי ללמוד נהירה הסלולר דגמים מחלה של דרכי הנשימה, כגון אסטמה, מחלת ריאות חסימתית כרונית (COPD), ומודלים מחלה מדבקת. מלבד הרכב הסלולר, את ההרכב המולקולרי של דרכי הנשימה ריאתי משתקפת גם בנוזל BAL. כדי לנתח את זה, enzyme-linked immunosorbent Assay (ELISA), immunoblot, ואת ניתוח סימולטני של ציטוקינים מרובים על ידי מערך חרוז ציטוקינים יכול להיותביצע להעריך את הנוכחות של ציטוקינים chemokines.
BAL היא שיטה מבוססת היטב כדי ללמוד את הזרם של תאים דלקתיים במודלים של בעלי חי מחלה דלקתיים. תצפית של נהירה הסלולר שינו (למשל, רמות גבוהות של לימפוציטים, אאוזינופילים, או נויטרופילים) יכול להוביל לתובנות טובות יותר לתוך המחלה יכולה להיות פרמטר אובייקטיבי כדי להעריך את הביצועים של התערבות טיפולית.
הפרשנות המדויקת ודיר של ניתוח הסלולר BAL דורשת כי BAL מבוצע כהלכה וכי הנוזל שנאסף מטופל ועובד כראוי. המונח "שטיפת הסימפונות" הוצגה לפני יותר משימון שנה על ידי סטיט 3. בשנת 1961, Myrvik שהושג מקרופאגים המכתשית מן נוזל השטיפה של ריאות ארנב 3. BAL עכשיו שיטה נפוצה לנתח ולעקוב אחר הריאות במודל העכבר, אךעדיין אין דיווח על נוהל BAL מתוקנן בספרות המדעית 4 , 5 . יתר על כן, יש כנראה דרכים רבות לבצע BAL כמו ישנם מעבדות מחקר באמצעות טכניקה 3 , 6 , 7 , 8 , 9 , 10 , 11 . חשוב כי הנתונים המתקבלים BAL מייצגים את הריאה Murine כולו, ולא רק חלק של הריאה. סוג זה של השתנות מסבך את הפרשנות וההשוואה בין התוצאות בין ניסויים שונים.
הנה, הבסיסי, זול, ו לשחזור BAL הליך מתואר המאפשר איסוף של חלק הסלולר מסיס נוכח לומן של דרכי הנשימה של העכבר. בקיצור, קטטר ממוקם לתוך קנה הנשימה חשוף oעכבר הרדמה סופנית. מזרק מחובר catheter, וכן תמיסת מלח שנאגרו המכיל אתילנדיאמינטראקטיק חומצה (EDTA) הוא הציג לתוך הריאות. לומן הריאות הוא דגימה על ידי שטיפה חוזרת ונשנית עדין של תמיסת מלח באמצעות הבוכנה. הלחץ השלילי מיושם במהלך שלב זה הוא מינימלי כדי למנוע התמוטטות דרכי הנשימה. לאחר איסוף, BAL המתקבל צריך להיות מעובד נוספת כדי למנות ולזהות את התאים על ידי cytometry הזרימה.
Protocol
כל הניסויים בבעלי החיים המתוארים במחקר זה נערכו לפי חוק הביטוח הלאומי (החוק הבלגי 14/08/1986 ו 22/12/2003, הצו מלכותי בלגי 06/04/2010) וחקיקה אירופאית (EU הוראות 2010/63 / EU ו- 86 / 609 / EEC). כל הניסויים על עכברים וכל פרוטוקולים חיה אושרו על ידי ועדת האתיקה של גנט האוניברסיטה (LA1400091 מספרים היתר EC2016-027).
אופן ההכנה 1.
- נוזל שטיפה
- כן תמיסת מלח מאוזן עם 100 מיקרומטר חומצת ethylenediaminetetraacetic (EDTA).
הערה: כדי למדוד את רמות החלבון בנוזל BAL, מומלץ להוסיף מעכבי פרוטאז למנוע פעילות הפרוטאז בנוזל BAL.
- כן תמיסת מלח מאוזן עם 100 מיקרומטר חומצת ethylenediaminetetraacetic (EDTA).
- צנתר
- הפוך קטטר על ידי החדרת מחט 23 G לתוך פוליאתילן פלסטיק שקוף 21 צינורות G (קוטר פנימי: 0.58 מ"מ, קוטר חיצוני: 0.965 מ"מ, ואורך: 0.5 ס"מ). צנתרים Premade יכול לשמש גם.
- AnesthETICS
- הכן הרדמה הטרמינל, רצוי אחד שגורם דום נשימה (למשל, ברביטורטים כמו פנטוברביטול נתרן (> 100 מ"ג / ק"ג) פתרון פוספט שנאגרו מלוחים (PBS)).
הערה: מומלץ להשתמש הרדמה מוזרקת במקום הרדמה נשאפת, כמו הרדמה נשאפת עשויה להיות להם השפעה על התוכן הנוזל BAL. יש CO 2, למשל השפעה על pH של הדם וכתוצאה מכך על החלוקה מחדש של תרכובות שונות 12.
- הכן הרדמה הטרמינל, רצוי אחד שגורם דום נשימה (למשל, ברביטורטים כמו פנטוברביטול נתרן (> 100 מ"ג / ק"ג) פתרון פוספט שנאגרו מלוחים (PBS)).
- אמוניום כלוריד-אשלגן (ACK) חיץ התא ימס דם אדום
- הכן חיץ תמוגה ACK ידי המסת 8.29 גרם של NH 4 Cl ו- 1 גרם של KHCO 3 ב 1 ליטר של H 2 O עם 100 מיקרומטר EDTA; חיץ דם תא ימס אדום ניתן לרכוש גם ממקור חיצוני.
2. ביצוע השטיפה ברונכואלוואולרית (BAL)
- היכרות עם קטטר לתוך קנה הנשימה
- להרדים את העכבר באמצעות זריקת intraperitoneal של מנה קטלנית של חומר הרדמה ברביטורטים קצר טווח באמצעות מחט 26 G. כדי לאשר הרדמה ראויה קטלנית, לצבוט את הכף האחורית של העכבר עם מלקחיים כדי לבדוק את רפלקס ברגל.
- מניח את החיה על גבה על צלחת כירורגיים לתקן את העכבר על ידי הצמדה במורד הגפיים.
- ספריי 70% אתנול על הצוואר כדי לחטא. עושים חתך בעור הצוואר ליד קנה הנשימה באמצעות אזמל.
- פתח את העור כדי לחשוף את בלוטות הרוק. הפרד את בלוטות הרוק באמצעות מצבטי לחשוף את השריר sternohyoid. לחתוך את השריר סביב קנה הנשימה באמצעות מלקחיים כדי לחשוף את קנה הנשימה.
- מניחים חוט כותנה תחת קנה הנשימה באמצעות מלקחיים.
- בזהירות לנקב באמצע של קנה הנשימה חשוף בין שתי טבעות סחוס עם מחט 26 G. יש להיזהר שלא לפגוע קנה הנשימה הלאה.
- הכנס את קטטר על 0.5 ס"מ לתוך קנה הנשימה. ודא כי catheter אינו מוכנס רחוק מדי לתוך קנה הנשימה, כמו זה יכול לגרום לנזק של מבנה הריאות.
- לייצב את הקטטר ידי קשירת קנה הנשימה סביב הקטטר באמצעות חוט כותנה להציב צעד 2.1.5. אם הקטטר לא קשור מספיק, פתרון מלח המאוזן המוזרק עשוי לזרום לכיוון החלק העליון של דרך הנשימה במקום למטה לתוך הריאות.
- אסוף את נוזל השטיפה
- טען מזרק מ"ל 1 עם 1 מ"ל של תמיסת מלח מאוזנת סטרילי עם 100 מיקרומטר EDTA.
- חבר את מזרק מ"ל 1 ל הקטטר בעדינות להזריק את תמיסת מלח / EDTA לתוך הריאות.
- לשאוב את הפתרון בעדינות תוך עיסוי בית החזה של העכבר. אם הנוזל לשאוב אינו גלוי בתוך המזרק, בזהירות להכניס את הקטטר שקצת יותר למטה או את קנה הנשימה.
- הסר את המזרק מהמחט ולהעביר את נוזל שטיפה התאושש לתוך צינור 15 מ"ל ממוקם על הקרח. בדרך כלל, 700 - 900 &# 181; L של BAL הוא התאושש 1 מ"ל של פתרון מוזרק.
- חזור על שלבים 2.2.1 - 2.2.4 פעמיים נוספות.
הערה: אם המטרה היא לנתח את תוכן בלתי תאי, מומלץ לרכז את דגימות ונקווה כשקיימות בעיות עם רגישות.
3. איסוף המרכיבים התאיים ו Noncellular של נוזל BAL
- צנטריפוגה נוזל שטיפה עבור 7 דקות ב 400 XG ו 4 מעלות צלזיוס.
- איסוף supernatant ומיד להשתמש בו לצורך ניתוח נוסף (למשל, ELISA) או הקפאה ב -80 מעלות צלזיוס. שמור התא גלולה לנתח את זרם הסלולר בתוך הריאות.
- Resuspend התא גלולה ב 200 μL של חיץ lysing ACK.
הערה: שלב זה מבטיח את תמס של אריתרוציטים תוך שמירה על תאי דם לבנים ללא פגע. - דגירה של 2 דקות ב RT.
הערה: כדי להפחית את הווריאציה נגרמת ימס כדוריות דם אדום, צעד זה לא צריך להיות מבוצע יותר מ 2 דקות. - להוסיף 1 מ"ל של קר PBS כדי לדלל את חיץ lysing ACK.
- צנטריפוגה 7 דקות ב 400 XG ו 4 מעלות צלזיוס. בטל supernatant מחדש להשעות את תאי נפח נאות של PBS לניתוח במורד זרם (ראה להלן).
הערה: הנפח של PBS תלויה במחקר במורד הזרם כי יבוצע.
4. ניתוח של סוגי תאים שונים בנוזל BAL ידי cytometry זרימה
הערה: אפשרות אחת היא לנתח את רכב הסלולר המוחלט ויחסים של נוזל BAL ידי ביצוע זרימת cytometry. מטרת מאמר זה היא לפרט את הטכניקה של BAL. Cytometry זרימה היא טכניקה מיוחדת בפני עצמה. מומלץ לקרוא מאמרים מיוחדים על זרימת cytometry טכניקה 13, 14, 15, 16, 17. נוגדנים מצמידים את t fluorophoreכובע להכיר אנטיגנים שטח (ראה טבלה 1) ספציפית לסוג תא מסוים (ים) משמש. באמצעות אסטרטגיה gating, אפשר לזהות תאי T, מקרופאגים, תאים דנדריטיים, תאי B, אאוזינופילים, ו נויטרופילים בשבריר התא של BAL.
| אַנְטִיגֵן | סוג תא |
| אשכול של בידול 3 (CD3) | ביטוי על תאי T |
| אשכול של 11C בידול (CD11c) | התבטאות גבוהה על רוב התאים הדנדריטים, אלא גם על מונוציטים, מקרופאגים, נויטרופילים, וכמה תאי B. |
| אשכול של 11b בידול (CD11b) | ביטוי על פני השטח של לויקוציטים רבים כולל מונוציטים, נויטרופילים, תאי הרג טבעיים, גרנולוציטים ו מקרופאגים. |
| SiglecF | אמקרופאגים lveolar ו eosinophils. |
| MHCII | בדרך כלל נמצא רק על תאים המציגים אנטיגן כגון תאים דנדריטים, phagocytes mononuclear ותאי B. |
| CD19 | לימפוציטים מסוג B- לימפוציטים |
| לי-6G | סמן עבור מונוציטים, גרנולוציטים ונויטרופילים |
טבלה 1: בחירה של אנטיגן החיסון משטח החיסון. טבלה זו מספקת רשימה של epitopes פני השטח המשמשים לאפיין את סוגי תאים שונים. שילובים של כמה סמנים יידרשו להגדיר באופן מהימן סוג תא מסוים.
| דגימות | ||||
| צינור | אנטיגן fluorophore להתווסף לתאים | ריכוז המניות נוגדן (מ"ג / מ"ל) | דילול נוגדן | סה"כ נפח (μL) |
| צבע כדאיות ניתן לתקן | 0.2 | 1/1000 | 50 | |
| CD11c | 0.2 | 1/800 | 50 | |
| SiglecF | 0.2 | 1/100 | 50 | |
| מדגם X | MHCII | 0.2 | 1/200 | 50 |
| CD3 | 0.2 | 1/200 | 50 | |
| CD19 | 0.2 | 1/200 | 50 | |
| CD11b | 0.2 | 1/200 | 50 | |
| Ly6G | 0.2 | 1/200 | 50 | |
| פקדי מתח | ||||
| צינור | אנטיגן fluorophore להתווסף לתאים | ריכוז מלאי נוגדן (mg / mL) | נוגדנים דילול | נפח כולל (μL) |
| תאים ללא כתם | / | / | / | 50 |
| תאים מוכתמים בודדים | תיקון הכדאיות Fixable | 0.2 | 1/1000 | 50 |
| תאים מוכתמים בודדים | CD11c | 0.2 | 1/800 | 50 |
| תאים מוכתמים בודדים | סיגל | 0.2 | 1/100 | 50 |
| תאים מוכתמים בודדים | MHCII | 0.2 | 1/2002 | 50 |
| תאים מוכתמים בודדים | CD3 | 0.2 | 1/2002 | 50 |
| תאים מוכתמים בודדים | CD19 | 0.2 | 1/2002 | 50 |
| תאים מוכתמים בודדים | CD11b | 0.2 | 1/2002 | 50 |
| תאים מוכתמים בודדים | Ly6G | 0.2 | 1/2002 | 50 |
| בקרת פיצויים | ||||
| צינור | אנטיגן fluorophore כדי להוסיף חרוזים | ריכוז מלאי נוגדן (mg / mL) | נוגדנים דילול | נפח כולל (μL) |
| חרוזים ללא כתם | / | / | / | 200 |
| חרוזים מוכתמים | CD11c | 0.2 | 1/2000 | 200 |
| חרוזים מוכתמים | סיגל | 0.2 | 1/2000 | 200 |
| חרוזים מוכתמים | MHCII | 0.2 | 1/2002 | 200 |
| חרוזים מוכתמים | CD3 | 0.2 | 1/2000 | 200 |
| חרוזים מוכתמים | CD19 | 0.2 | 1/2000 | 200 |
| חרוזים מוכתמים | CD11b | 0.2 | 1/400 | 200 |
| חרוזים מוכתמים | Ly6G | 0.2 | 1/2002 | 200 |
טבלה 2. רשימת בקרות שיכללו. טבלה זו מציגה את כל הבקרות הדרושות לפרשנות המדויקת של התוצאות המתקבלות.
- כתמי משטח התא
הערה: זה impoRtant לכלול את כל הפקדים קריטיים עבור ניתוח cytometry הזרימה. נדרשות שלוש מערכות של צינורות (ראה טבלה 2 ): (1) צינורות המכילים את הדגימות; (2) צינורות עם תאים BAL עבור כל נוגדנים fluorophore לעשות כתמים בודדים; זה מאפשר לקבוע את המתח עבור כל ערוץ על cytometer זרימה; ו (3) צינורות עם חרוזים עבור כל נוגדנים fluorophore לעשות כתמים בודדים; זה לקבוע את המטריצה פיצוי.- הפוך תערובת של נוגדנים ו FC- בלוק (אנטי CD16 / CD32) ב PBS בדילולים המתאים (ראה טבלה 2 ). יש לקבוע את דילול העבודה האופטימלי עבור כל נוגדן לפני הניסוי.
- Resuspend התאים μL 50 של תערובת נוגדנים המדגם ולהוסיף 50 μL של נוגדנים בדילול נאותה את הפקדים קריטיים.
הערה: מכתים יכול להתבצע צלחת 96-well, בצורת u. זה מאפשר בקלות להפחית את נפח הכתם אNd להפעיל כמויות משמעותיות של דגימות. - דגירה של 30 דקות בחושך על 4 מעלות צלזיוס.
- צנטריפוגה במשך 7 דקות ב 400 xg ו 4 ° C. מחק את supernatant.
- Re- להשעות את התאים PBS כדי נפח סופי של 200 μL.
הערה: נפח סופי זה תלוי בנפח מינימלי cytometer זרימה יכול לגשת. זה יכול להשתנות מעט בין מכונות. בנוסף, נפח לקרוא תלוי במספר התאים ו / או הזמן המדגם ייקח לפעול cytometer זרימה. - השתמש דגימות ובקרות לניתוח cytometric זרימה.
הערה: כדי לקבוע את מספר התא המוחלט של אוכלוסיות תאים שונות, ספירת חרוזים יש להוסיף. הוסף את אותו מספר חרוזים (± 25,000 חרוזים) לכל מדגם בדיוק לפני המדידה. באמצעות קדימה ופיזור בצד, ספירת חרוזים ניתן לזהות על ידי cytometry זרימה (ראה איור 1 ). לאחר מכן, המספר המוחלט של תאים במדגם ניתן לחשב על ידי השוואת הE של אירועים חרוז לאירועים התא. ניתן להשתמש בנוסחה הבאה: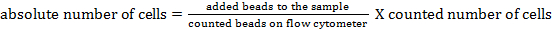
- ניתוח זרימת cytometric
הערה: ניתוח cytometric זרימה צריך להיעשות מיד לאחר השלמת פרוטוקול מכתים. סיטומטר זרימה עם לייזרים המתאימים מסננים לאיתור האות חייב לשמש. טבלה 3 מספקת סקירה של לייזרים ומסננים הדרושים למחקר המתואר בכתב יד זה. לקבלת מידע נוסף על זרימת cytometric זרימה, ראה Adan et al. 18 .- הגדר את השערים הראשוניים על פי התפזורת הקדמית והצדדית, למעט פסולת וגבישים (ראה איור 1 ).
- התאם את המתח ואת הפיצוי עבור חפיפה רפאים בעזרת תאים מוכתמים יחיד חרוזים.
הערה: הגדרות אלה שונות עבור כל cytometer זרימת צריך לבדוק לפני כל ניסוי. Fאו ניתוח תזרים נכון, את המתחים צופים ו-פיזור הצד הם קריטיים. פיזור נכון קדימה וצד יכול לעזור בזיהוי ואת האישור לזהות את התאים נתחו. כדי לקבוע מתחים אלה, מדגם בלא כתם צריך להתנהל ראשון. - הגדרת שערי קרינה עבור אנטיגן השטח (ראה איור 1) ולנתח הדגימות.
| סוג לייזר | התקנה מסננת | |
| 505 LP | 525/50 | |
| כחול (488 ננומטר) | 550 LP | 575/26 |
| 100 mW | 670 LP | 685/35 |
| 750 LP | 780/60 | |
| סגול 405 ננומטר | 450/50 | |
| 100 מגוואט | ||
| אדום 633 ננומטר | 660/20 | |
| 70 מגוואט | 750 LP | 780/60 |
טבלה 3: סקירה כללית של לייזרים ומסננים של ציטומטר זרימה המשמש במחקר זה.
תוצאות
לאחר ביצוע BAL עם 3x 1 מ"ל של תמיסת מלח שנאגרו, נפח בין 2 ו 3 מ"ל צריך להיות התאושש. נוזל BAL זה ניתן לנתח נוסף לאפיין את תוכן הסלולר noncellular. כדי לחקור את הנוכחות של ציטוקינים chemokines, 19 ELISA, immunoblot 20, ואת ניתוח סימולטני של ציטוקינים מרובים על ידי מערך חרוז ציטוקינים 21 יכול להתבצע. בנוסף, תוכן אלבומין וחלבון הכולל של נוזל זה יכול להיקבע 22.
כדוגמה, כתב היד הזה מתאר כיצד לנתח את התוכן הסלולרי של נוזל BAL ידי cytometry הזרימה. הנוזל נותחו BAL נאסף עכברות Balb / cAnNCrl (גיל: 7 שבועות) 24 שעות לאחר שהם החדירו intratracheally עם lipopolysaccharide. הנוגדנים הבאים, מצמידים את fluorophore, wEre השתמשו כדי לזהות את סוגי תאים שונים: CD11c, SiglecF, MHCII, CD3ε, CD19, Ly6g, ו CD11b (ראה טבלה 1 ואת טבלת החומרים ). לצבוע את הכדאיות fixable שימש גם. באמצעות אסטרטגיה gating מבוסס על הביטוי הדיפרנציאלי של אנטיגנים על המשטחים של אוכלוסיות תאים שונות ( איור 1 ), ניתן היה לזהות מקרופאגים, תאים דנדריטים, תאי B, תאי T, נויטרופילים, ו eosinophils.
ראשית, פסולת ו דבלטים היו נשלטים החוצה על בסיס פרמטרים קדימה ו-פיזור בצד. צבע הכדאיות הקל על gating על תאים חיים. לאחר מכן, CD11c תאים גבוהים ותאים נמוכים CD11c זוהו. באוכלוסייה גבוהה CD11c, מקרופאגים ותאים דנדריטים זוהה על בסיס ביטוי MHCII ו SiglecF, בהתאמה. באוכלוסייה נמוכה CD11c, תאי T ותאי B זוהו בהתבסס על ביטוי CD3ε ו- CD19, בהתאמה. בהאוכלוסייה דואר הנותרים התא, נויטרופילים אאוזינופילים זוהו מבוסס על ביטוי סמן CD11b ו Ly-6G, בהתאמה.
חרוזי ספירה נוספו לקבוע את מספרי התא המוחלטים של אוכלוסיות תאים השונות על ידי השוואת היחס של אירועים חרוזים לאירועי תא 23. ספירת חרוזי אלה זוהו על סמך צופה שלהם ומאפיינים בצד פיזור (איור 1). טבלה 4 הציג סקירה של המספרים סלולריים המוחלטים של אוכלוסיות תאים השונות בנוזל BAL של עכבר נאיבי עכבר כי היה מגורה עבור 24 שעות עם 5 מיקרוגרם של lipopolysaccharide.
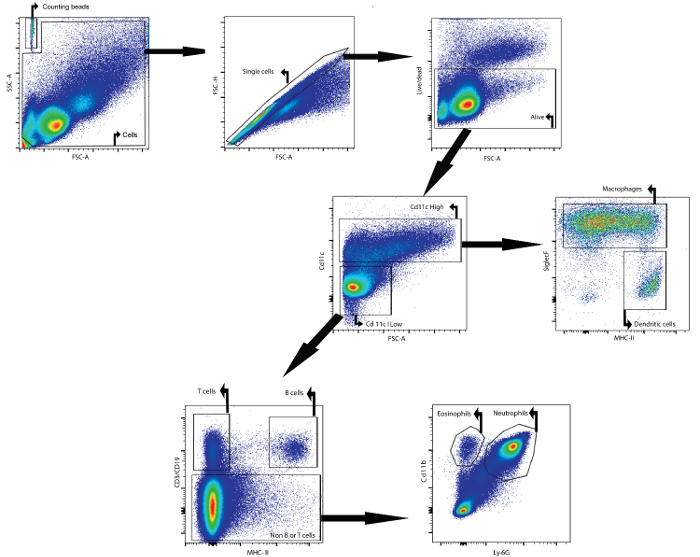
איור 1: אסטרטגית Gating עבור זרימת איתור Cytometric של מקרופאגים, תאים דנדריטים, תאי T, תאי B, נויטרופילים, אאוזינופילים ו iנוזל BAL. תאים BAL היו מבודדים באמצעות פרוטוקול BAL המתואר. תאים היו מבודדים עכברים 24 שעות לאחר החדרת intratracheal של lipopolysaccharide. ספירת חרוזים ותאים זוהו על בסיס תכונות פיזור קדמי וצד. בשער התא, תאים בודדים זוהו באמצעות פיזור קדימה וצד. באוכלוסייה האחרונה זוהו תאים חיים. תאים CD11c גבוהה תאים CD11c נמוך זוהו אז. באוכלוסייה גבוהה CD11c, מקרופאגים ותאים דנדריטים זוהה על בסיס ביטוי MHCII ו SiglecF, בהתאמה. באוכלוסייה נמוכה CD11c, תאי T ותאי B זוהו בהתבסס על ביטוי CD3ε ו- CD19, בהתאמה. באוכלוסיית תאים הנותרים, נויטרופילים ו eosinophils זוהו על בסיס CD11b ו -6G ביטוי לי, בהתאמה. אנא לחץ כאן כדי לראות אגרסה גדולה יותר של דמות זו.
| אוכלוסיית תאים | מספר מוחלט של תאים בעכברים נאיביים | מספר מוחלט של תאים בעכברים LPS מגורה |
| מקרופאגים | 79,612 | 25,439 |
| תאים דנדריטים | 495 | 671 |
| תאי T | 45,271 | 28,089 |
| תאי B | 4,164 | 2,926 |
| נויטרופילים | 632 | 566,716 |
| Eosinophils | 3,483 | 4,332 |
טבלה 4: Represenתוצאות tative של ניתוח cytometry זרימה על נוזל BAL של נאיביות עכברים LPS-מגורה.
Discussion
BAL היא טכניקה שימושית להשיג מידע ציטולוגי וביוכימי בתגובה לזיהומים או סמים. בתחילה, BAL שימש כדי לנהל את הייצור ריר מוגזם בחולים בני אדם הסובלים רעילות phosgene 3 . כיום, הטכניקה משמשת בבני אדם לחקור pathogenesis ריאות, אבחון, וניהול טיפולית של מחלות 3 , 24 . בחיות מעבדה, BAL משמש בדרך כלל כדי לעקוב אחר תגובות דלקתיות, מנגנוני החיסון, ותהליכי מחלה זיהומיות המתרחשים בדרכי הנשימה 1 , 2 .
כדי לחקור את התאים הסלולר דלקתיים במודלי מחלות נשימה, BAL צריך להיות ואחריו ספירת תאים מוחלטת ודיפרנציאלית. בנוסף למספר התא המוחלט, גם מספרי התאים היחסיים מעניינים. לדוגמה, מודלים של תיקון וסרטן מראים very קטן כדי לא מגביר את מספר הסלולרי BAL. במודל זה, ההערכה של רכב הסלולר שימושית. באמצעות תא מכתים בשילוב עם מיקרוסקופ אור, תאים מסוגים שונים, כגון אאוזינופילים, נויטרופילים, מקרופאגים, לימפוציטים, ניתן לזהות המבוססת על מורפולוגיה 25, 26, 27, 28, 29, 30. Cytometry זרימה ניתן להשתמש לצורך הערכות ספציפיות, כגון לזהות פנוטיפים T-תאים שונים 7, 31. בנוסף לזיהוי אוכלוסיות התאים להסתנן לתוכם השונות, בהרכב בלתי תא הריאה יכול להיחקר באמצעות BAL. שיטות כגון ELISA, immunoblot, מערך חרוז ציטוקינים, אימונוהיסטוכימיה, ואת תגובת שרשרת פולימראז כמותיים מבוצעות על נוזל BAL לקבוע ציטוקינים, צמיחהגורמים, ורכיבים דלקתיים אחרים. כדי לקבוע נזק ריאות, דהידרוגנז חלבון ו לקטט הכולל רמות בנוזל BAL ניתן גם למדוד 32, 33.
עם התפתחות כלי אבחון חדשים, אפיון גנומי proteomic של רכיבי BAL יהיה אפשרי בעתיד הקרוב. השילוב של הרחבת יכולות חישוביות וטכנולוגיות ביטוי גני תפוקה גבוהה יאפשר להגדיר פרופילי ביטוי גנים ספציפיים עבור מדינות מחלה שונות. ביצוע טכניקות אלה על נוזל BAL יכול לספק דפוסי גנים וחלבוני ביטוי לזהות המולקולות החשובות המעורבות בשלבים השונים של מחלות ריאה.
המגבלה העיקרית של נתונים המתקבלים נוזל BAL היא העדר השוואתי בין ניסויי מחקר השונים 3, 9. יש רמה גבוהה שלהשתנות טכניקת השטיפה והעיבוד הבא של נוזל BAL. כדי להיות מסוגל להשוות כל ניסיון BAL, יש צורך לתקנן את הסוג של נוזל שטיפה כי מוטמע, באתר של החדרה, והחלקיק כי היא שיש לנתח מבחינת רכב הסלולר בלתי תאי. ישנם הבדלים משמעותיים במספר שברי שטיפה בין ניסויים שונים, שנע בין שנת 14 פעמים 34, 35, 36. הבדל זה עשוי להשפיע על המספרים הסלולריים הכוללים המוערכים ב הריאות. חשוב לדעת אילו BAL שבריר נוזל המכיל את רוב התאים. מילות ואחות. הראה כי כ 70% מכלל התאים נאספו ב במקטע אחד כדי שלושה 22. עם זאת, דיווחים אחרים הציעו כי השטיפה השנייה הכילה יותר תאים מאשר הראשון 37, 38 . אנו יכולים להסיק ממחקרים אלה כי שטיפה עם רק שבריר אחד אינה מייצגת את הריאות כולו, מובילים לפרשנות שגויה של התוצאות.
רכב noncellular של נוזל BAL מכיל מידע רב ערך על מצב הבריאות של הריאה 33, 39, 40. וריאציות הדילול של נוזל BAL תורם הבדל הכימות של השבר המסיס, וכתוצאה מכך, הבדלים בתוצאות בין ניסויים. מילות ואחות. לעומת החלבון ואת הרמות לקטט דהידרוגנאז של כל שבריר שטיפה והגיע למסקנה כי שבר השטיפה הראשון הכיל פעמים עד שלוש פעמים יותר מאשר השבריר השני.
כדי לאחזר מדגם BAL נציג לצורך הניתוח, כמה שיקולים טכניים הם קריטיים. אחד מהם הוא לבצע הרדמה נאותה. חשוב מאוד לבדוק את נ"צ הרגללקס על העכבר כדי להבטיח סדציה סופנית. זה לא רק חשוב מסיבות אתיות, אלא גם משום שקשה להציב ולשמר את הקטטר במקום הנכון אם העכבר אינו מורדם כראוי.
שיקול טכני חשוב שני הוא המיקום של הקטטר בתוך קנה הנשימה. כאשר הקטטר מוחדר עמוק מדי, זה יכול לפגוע במבנה הריאה. בקצה הדיסטלי של הקטטר לא צריך להגיע לריאות במהלך ההליך BAL. קטטר צריך גם להיות מיוצב ומחוזק עם חוט כותנה. אם הקטטר לא התייצב, הפתרון המלוח המוזרק עשוי לזרום כלפי מעלה לתוך חלל האף במקום למטה לתוך הריאות. במהלך הזרקה ושאיפה של תמיסת המלח, חשוב להחזיק את הקטטר יציב.
הנתונים המתקבלים מן הנוזל BAL חייבים לייצג את הריאה בעכברים כולו. לכן, חשוב להטמיע נפח נאות של חיץ מלוח (כלומר3 מ"ל, מחולק 3 aliquots של 1 מ"ל כל אחד). אין קשר לינארי בין התשואה התא לבין התשואה נוזל BAL. חשוב לאסוף את הפתרון בעדינות תוך עיסת החזה של העכבר. אם כוחות הגז הם חזקים מדי, הכדאיות, הפונקציה והמבנה של התאים בתוך דרכי הנשימה ונוזל ה- BAL עלולים להיפגע. אם נוזל aspirated אינו גלוי מזרק, בזהירות להזיז את הקטטר עמוק יותר או גבוה יותר קנה הנשימה.
הודעה מיוחדת יש לתת היבטים ספציפיים של עיבוד BAL וניתוח. זה יהיה למקסם את המידע נשמר מדגימות BAL. לאחר BAL, התאים נמצאים בינוני מלח מזין עניים. לכן חשוב מאוד לעבד את דגימות תוך 1 שעות לאחר הדגימה BAL. אם יש צורך באחסון ממושך, נדרש שימוש במדיום המשלים חומרים מזינים.
כדי לשמור על הכדאיות התא, למנוע צינורות המקדמים התא דבקות על פני השטח. הימנע CENtrifugation של השעיות תא במהירויות העלולות לסכן את שלמות הסלולר או כדי למנוע resuspension אחיד של תאים BAL מאוחזר. נוזל BAL המכיל תאים צריך להיות centrifuged ב 400 xg ו 4 מעלות צלזיוס למשך 7 דקות. חשוב לזכור כי המתלים התא צריך להיות מוחזק על 4 מעלות צלזיוס במהלך העיבוד.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
LVH הוא עוזר מחקר במחלקה לביולוגיה מולקולרית ביו רפואית של אוניברסיטת גנט. ERJ נתמך על ידי UniVacFlu, מענק מספר 607690. KR נתמך על ידי פרויקט EC-FP7 FLUNIVAC.
Materials
| Name | Company | Catalog Number | Comments |
| Hanks' Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 14175-129 | |
| ethyleendiaminetetra acetic acid (EDTA) | Sigma-Aldrich | E6511 | irritating |
| 23 G x 1 1/4 needle | Henke Sass Wolf | 4710006030 | size: 0.60 x 30 mm |
| 26 G x 1/2 needle | Henke Sass Wolf | 4710004512 | size: 0.45 x 12 mm |
| plastic tubing | BD medical technology | 427411 | Polyethylene Tubing, I.D. 0.58 mm (0.023") O.D. 0.965 mm (0.38") 30.5 m (100') |
| sodium pentobarbital | Kela NV | 514 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | PBS without Ca2+ Mg2+ or phenol red; sterile filtered |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | nonpyrogenic and nontoxic |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Surgical scissors | Fine Science Tools GmbH | 91460-11 | |
| centrifuge tube 50 mL | TH.Geyer | 7696705 | Free from Rnase/Dnase/endotoxin |
| centrifuge tube 15 mL | TH.Geyer | 7696702 | Free from Rnase/Dnase/endotoxin |
| microcentrifuge tube 1.5 mL | Sigma-Aldrich | 0030 120.094 | polypropylene |
| Microcentrifuge | Sigma-Aldrich | 5415R | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| Ammonium-Chloride-Potassium (ACK) lysing buffer | Lonza | 10-548E | sterile-filtered |
| live/dead - efluor 506 | ebioscience | 65-0866-18 | fixable viability dye |
| CD11c-PE-cy7 | eBiosciences | 25-0114-81 | |
| SiglecF-PE | BD Pharmingen | 552126 | |
| MHCII-APCefluor780 | Biolegend | 107628 | |
| CD3-PE-cy5 | VWR | 55-0031-U100 | |
| CD19-PE-cy5 | eBiosciences | 15-0193-83 | |
| CD11b-V450 | BD Pharmingen | 560455 | |
| Ly6G-AF700 | Biolegend | 127621 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| anti-CD16/CD32 | BD Pharmingen | 553142 | |
| 96-well 340 µl storage plate plate | Falcon | 353263 | V-bottom, natural polypropylene |
| flow cytometer | BD Biosciences | ||
| catheter | BD Biosciences | 393202 |
References
- Stankunas, K., et al. Conditional protein alleles using knockin mice and a chemical inducer of dimerization. Mol Cell. 12 (6), 1615-1624 (2003).
- Hunninghake, G. W., Gadek, J. E., Kawanami, O., Ferrans, V. J., Crystal, R. G. Inflammatory and immune processes in the human lung in health and disease: evaluation by bronchoalveolar lavage. Am J Pathol. 97 (1), 149-206 (1979).
- Gee, J. B., Fick, R. B. Bronchoalveolar lavage. Thorax. 35 (1), 1-8 (1980).
- Tornling, G., et al. Hyaluronic acid in bronchoalveolar lavage in rats exposed to quartz. Br J Ind Med. 44 (7), 443-445 (1987).
- Henderson, R. F. Use of bronchoalveolar lavage to detect respiratory tract toxicity of inhaled material. Exp Toxicol Pathol. 57, 155-159 (2005).
- Morris, A., et al. Longitudinal analysis of the lung microbiota of cynomolgous macaques during long-term SHIV infection. Microbiome. 4 (1), 38 (2016).
- Naessens, T., et al. GM-CSF treatment prevents respiratory syncytial virus-induced pulmonary exacerbation responses in postallergic mice by stimulating alveolar macrophage maturation. J Allergy Clin Immunol. 137 (3), 700-709 (2016).
- Chockalingam, A., Duraiswamy, R., Jagadeesan, M. Bronchoalveolar lavage cellular analyses in conjunction with high-resolution computed tomography imaging as a diagnostic intervention for patients with suspected interstitial lung disease. Lung India. 33 (3), 287-291 (2016).
- Crystal, R. G., Reynolds, H. Y., Kalica, A. R. Bronchoalveolar lavage. The report of an international conference. Chest. 90 (1), 122-131 (1986).
- Baughman, R. P. The uncertainties of bronchoalveolar lavage. Eur Respir J. 10 (9), 1940-1942 (1997).
- Singletary, M. L., et al. Modification of a common BAL technique to enhance sample diagnostic value. J Am Assoc Lab Anim Sci. 47 (5), 47-51 (2008).
- Angus, D. W., Baker, J. A., Mason, R., Martin, I. J. The potential influence of CO2, as an agent for euthanasia, on the pharmacokinetics of basic compounds in rodents. Drug Metab Dispos. 36 (2), 375-379 (2008).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. J Vis Exp. (97), (2015).
- Rubio-Navarro, A., et al. Phenotypic Characterization of Macrophages from Rat Kidney by Flow Cytometry. J Vis Exp. (116), (2016).
- Butcher, M. J., Herre, M., Ley, K., Galkina, E. Flow cytometry analysis of immune cells within murine aortas. J Vis Exp. (53), (2011).
- Noto, A., Ngauv, P., Trautmann, L. Cell-based flow cytometry assay to measure cytotoxic activity. J Vis Exp. (82), e51105 (2013).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Database, J. S. E. The ELISA method. J Vis Exp. , (2016).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Wunderlich, M. L., Dodge, M. E., Dhawan, R. K., Shek, W. R. Multiplexed fluorometric immunoassay testing methodology and troubleshooting. J Vis Exp. (58), (2011).
- Song, J. A., et al. Standardization of bronchoalveolar lavage method based on suction frequency number and lavage fraction number using rats. Toxicol Res. 26 (3), 203-208 (2010).
- Seliger, C., et al. A rapid high-precision flow cytometry based technique for total white blood cell counting in chickens. Vet Immunol Immunopathol. 145 (1-2), 86-99 (2012).
- Daniele, R. P., Elias, J. A., Epstein, P. E., Rossman, M. D. Bronchoalveolar lavage: role in the pathogenesis, diagnosis, and management of interstitial lung disease. Ann Intern Med. 102 (1), 93-108 (1985).
- Delayre-Orthez, C., Becker, J., de Blay, F., Frossard, N., Pons, F. Exposure to endotoxins during sensitization prevents further endotoxin-induced exacerbation of airway inflammation in a mouse model of allergic asthma. Int Arch Allergy Immunol. 138 (4), 298-304 (2005).
- Delayre-Orthez, C., et al. PPARalpha downregulates airway inflammation induced by lipopolysaccharide in the mouse. Respir Res. 6, 91 (2005).
- Delayre-Orthez, C., de Blay, F., Frossard, N., Pons, F. Dose-dependent effects of endotoxins on allergen sensitization and challenge in the mouse. Clin Exp Allergy. 34 (11), 1789-1795 (2004).
- Hachet-Haas, M., et al. Small neutralizing molecules to inhibit actions of the chemokine CXCL12. J Biol Chem. 283 (34), 23189-23199 (2008).
- Ble, F. X., et al. Activation of the lung S1P(1) receptor reduces allergen-induced plasma leakage in mice. Br J Pharmacol. 158 (5), 1295-1301 (2009).
- Ble, F. X., et al. Allergen-induced lung inflammation in actively sensitized mice assessed with MR imaging. Radiology. 248 (3), 834-843 (2008).
- Reber, L. L., et al. A dissociated glucocorticoid receptor modulator reduces airway hyperresponsiveness and inflammation in a mouse model of asthma. J Immunol. 188 (7), 3478-3487 (2012).
- Drent, M., Cobben, N. A., Henderson, R. F., Wouters, E. F., van Dieijen-Visser, M. Usefulness of lactate dehydrogenase and its isoenzymes as indicators of lung damage or inflammation. Eur Respir J. 9 (8), 1736-1742 (1996).
- Henderson, R. F. Use of bronchoalveolar lavage to detect lung damage. Environ Health Perspect. 56, 115-129 (1984).
- Forget, G., et al. An adherent cell perifusion technique to study the overall and sequential response of rat alveolar macrophages to toxic substances. Environ Health Perspect. 51, 131-140 (1983).
- Sung, J. H., et al. Recovery from welding-fume-exposure-induced lung fibrosis and pulmonary function changes in sprague dawley rats. Toxicol Sci. 82 (2), 608-613 (2004).
- Majetschak, M., Sorell, L. T., Patricelli, T., Seitz, D. H., Knoferl, M. W. Detection and possible role of proteasomes in the bronchoalveolar space of the injured lung. Physiol Res. 58 (3), 363-372 (2009).
- Rehn, B., Bruch, J., Zou, T., Hobusch, G. Recovery of rat alveolar macrophages by bronchoalveolar lavage under normal and activated conditions. Environ Health Perspect. 97, 11-16 (1992).
- Kelly, C. A., Ward, C., Stenton, S. C., Hendrick, D. J., Walters, E. H. Assessment of pulmonary macrophage and neutrophil function in sequential bronchoalveolar lavage aspirates in sarcoidosis. Thorax. 43 (10), 787-791 (1988).
- Eklund, A., Tornling, G., Blaschke, E., Curstedt, T. Extracellular matrix components in bronchoalveolar lavage fluid in quartz exposed rats. Br J Ind Med. 48 (11), 776-782 (1991).
- Olsen, G. N., Harris, J. O., Castle, J. R., Waldman, R. H., Karmgard, H. J. Alpha-1-antitrypsin content in the serum, alveolar macrophages, and alveolar lavage fluid of smoking and nonsmoking normal subjects. J Clin Invest. 55 (2), 427-430 (1975).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved