Method Article
Lavage bronchoalvéaire des poumons murins pour analyser l'infiltration cellulaire inflammatoire
Dans cet article
Résumé
L'état de santé du poumon se reflète dans le type et le nombre de cellules immunitaires présentes dans les bronchioles du poumon. Nous décrivons une technique de lavage broncho-alvéolaire qui permet l'isolement et l'étude de cellules non adhérentes et des facteurs solubles des voies respiratoires inférieures des souris.
Résumé
Lavage broncho - alvéolaire (BAL) est une procédure expérimentale qui est utilisée pour examiner le contenu cellulaire et acellulaire de la lumière du poumon ex vivo afin de mieux comprendre l'état de la maladie en cours.
Ici, une méthode simple et efficace est décrit pour effectuer BAL sur les poumons de souris sans avoir besoin d'outils spéciaux ou de l'équipement. fluide BAL est isolé par insertion d'un cathéter dans la trachée des souris anesthésiées terminale, à travers lequel une solution saline est instillée dans les bronchioles. Le fluide est insufflé doucement rétracté pour maximiser la récupération du liquide BAL et de minimiser les forces de cisaillement. Cette technique permet la viabilité, la fonction et la structure des cellules dans les voies respiratoires et le fluide BAL à conserver.
De nombreuses techniques peuvent être appliquées afin de mieux comprendre l'état de la maladie du poumon. Ici, une technique couramment utilisée pour l'identification et l'énumération des différents types de cellules immunitaires estDécrit, où la cytométrie de flux est combinée avec un panel sélectionné de marqueurs spécifiques de surface cellulaire marquée par fluorescence. La procédure BAL présentée ici peut également être utilisée pour analyser des agents infectieux, des constituants fluides ou des particules inhalées dans les poumons murins.
Introduction
Les voies respiratoires rencontrent de nombreuses insultes, ce qui peut entraîner une inflammation, une invasion de pathogènes ou une transformation maligne. Les cellules épithéliales qui bordent la lumière pulmonaire constituent l'une des principales barrières du corps mammalien. Avec les macrophages alvéolaires, ils empêchent les menaces environnementales d'entrer dans le système systémique via les voies respiratoires. Des exemples de ces menaces incluent des produits chimiques organiques et inorganiques, des bactéries et des virus. De même, des immunisations spécifiques ou des interventions thérapeutiques peuvent être conçues pour cibler les poumons. Dans tous ces cas, une analyse élaborée de la réponse évoquée est importante pour comprendre, intervenir ou prévenir les processus biologiques qui se déroulent dans le système respiratoire.
Le lavage bronchoalvéolaire (BAL) est une méthode précieuse pour analyser ces réponses, car les échantillons résultants contiennent des informations importantes sur les réponses inflammatoires, les mécanismes immunitaires et la progression de la maladie infectieuseCela peut se produire dans les voies aériennes pulmonaires 1 , 2 . En utilisant BAL, il est possible d'étudier les cellules infiltrantes. Cela contraste avec les poumons digérés, qui donnent une population cellulaire "plus sale", avec de nombreuses cellules mortes et collantes. Le BAL est réalisé en introduisant une solution saline dans les bronchioles terminales et en récupérant ensuite cette solution. La solution récupérée peut ensuite être utilisée pour quantifier et analyser phénotypiquement les cellules inflammatoires pulmonaires et infiltrantes résidentes. Cette méthode est fréquemment appliquée pour étudier l'afflux cellulaire dans les modèles de maladies des voies respiratoires, tels que l'asthme, la maladie pulmonaire obstructive chronique (MPOC) et les modèles de maladies infectieuses. Outre la composition cellulaire, la composition moléculaire des voies aériennes pulmonaires se reflète également dans le fluide BAL. Pour analyser cela, le dosage immuno-absorbant enzymatique (ELISA), l'immuno-tache et l'analyse simultanée de cytokines multiples par un réseau de perles de cytokines peuvent êtreEffectué pour évaluer la présence de cytokines et de chimiokines.
BAL est une méthode bien établie pour étudier l'afflux de cellules inflammatoires dans les modèles animaux inflammatoires de la maladie respiratoire. L'observation d'un afflux cellulaire altéré ( p. Ex. Augmentation des taux de lymphocytes, éosinophiles ou neutrophiles) peut conduire à une meilleure compréhension de la maladie et peut être un paramètre objectif pour évaluer la performance d'une intervention thérapeutique.
L'interprétation précise et reproductible de l'analyse cellulaire BAL exige que le BAL soit correctement exécuté et que le liquide collecté soit manipulé et traité correctement. Le terme «lavage bronchique» a été introduit il y a plus de quatre-vingts ans par Stitt 3 . En 1961, Myrvik a obtenu des macrophages alvéolaires à partir du liquide de lavage des poumons de lapin 3 . BAL est maintenant une méthode couramment utilisée pour analyser et surveiller les poumons dans le modèle de la souris, mais laRe n'est toujours aucun rapport d'une procédure BAL standardisée dans la littérature scientifique 4 , 5 . En outre, il existe probablement autant de façons d'effectuer BAL car il existe des laboratoires de recherche utilisant la technique 3 , 6 , 7 , 8 , 9 , 10 , 11 . Il est important que les données obtenues à partir du BAL représentent le poumon murin entier et pas seulement une partie du poumon. Ce type de variabilité complique l'interprétation et la comparaison des résultats entre différents essais.
Ici, une procédure BAL basique, peu coûteuse et reproductible est décrite qui permet la collecte de la fraction cellulaire et soluble présente dans la lumière de la souris de la voie aérienne. Bref, un cathéter est placé dans la trachée exposée ofa souris terminale anesthésié. Une seringue est raccordée au cathéter, et une solution saline tamponnée contenant est introduit dans les poumons de l'acide éthylènediaminetétraacétique (EDTA). La lumière du poumon est échantillonné par un léger balayage répété de la solution saline en utilisant le piston. La pression négative appliquée au cours de cette étape est minime pour éviter l'effondrement des voies respiratoires. Après la collecte, la BAL obtenue doit être encore traité pour énumérer et identifier les cellules par cytométrie de flux.
Protocole
Toutes les expériences animales décrites dans cette étude ont été menées selon le national (loi belge 14/08/1986 et 22/12/2003, Décret royal belge 06/04/2010) et de la législation européenne (directives 2010 de l'UE / 63 / UE et 86 / 609 / CEE). Toutes les expériences sur les souris et tous les protocoles animaux ont été approuvés par le comité d'éthique de l'Université de Gand (nombre de permis de LA1400091 et EC2016-027).
1. Préparation
- le liquide de lavage
- Préparer une solution de sel équilibrée avec 100 uM d'acide éthylènediaminetétraacétique (EDTA).
REMARQUE: Pour mesurer les niveaux de protéines dans le liquide BAL, il est recommandé d'ajouter des inhibiteurs de protéase pour empêcher l'activité de la protéase dans le liquide BAL.
- Préparer une solution de sel équilibrée avec 100 uM d'acide éthylènediaminetétraacétique (EDTA).
- Cathéter
- Faire un cathéter par l'insertion d'une aiguille 23 G en polyéthylène de matière plastique transparente 21 du tube G (diamètre interne: 0,58 mm, diamètre externe: 0,965 mm, et longueur: 0,5 cm). Les cathéters Premade peuvent également être utilisés.
- anesthEtiques
- Préparer un anesthésique terminal, de préférence celui qui provoque un arrêt respiratoire ( p. Ex., Un barbiturate comme solution de pentobarbital de sodium (> 100 mg / kg) dans une solution salée tamponnée au phosphate (PBS)).
REMARQUE: Il est recommandé d'utiliser une anesthésie injectée au lieu d'une anesthésie inhalée, car l'anesthésie inhalée peut avoir une influence sur la teneur en fluide BAL. Le CO 2 , par exemple, influe sur le pH du sang et par conséquent sur la redistribution des différents composés 12 .
- Préparer un anesthésique terminal, de préférence celui qui provoque un arrêt respiratoire ( p. Ex., Un barbiturate comme solution de pentobarbital de sodium (> 100 mg / kg) dans une solution salée tamponnée au phosphate (PBS)).
- Le tampon de lyse des globules rouges à base d'ammonium-chlorure-potassium (ACK)
- Préparer un tampon de lyse ACK en dissolvant 8,29 g de NH 4 Cl et 1 g de KHCO 3 dans 1 L d'H 2 O avec 100 uM d'EDTA; Le tampon de lyse des globules rouges peut également être acheté à partir d'une source externe.
2. Effectuer la Lavage Bronchoalveolaire (BAL)
- Présentation du cathéter dans la trachée
- Euthanasier la souris par injection intraperitoneale d'une dose létale d'anesthésique barbiturique courte durée d'action en utilisant une aiguille 26 G. Pour confirmer anesthetization mortelle appropriée, pincer la patte arrière de la souris avec une pince pour vérifier le réflexe du pied.
- Placez l'animal sur son dos sur une plaque chirurgicale et fixer la souris par mettre le doigt sur les membres.
- Vaporiser 70% d'éthanol sur le cou pour désinfecter. Faire une incision dans la peau du cou près de la trachée à l'aide d'un scalpel.
- Ouvrez la peau pour exposer les glandes salivaires. Séparer les glandes salivaires en utilisant des tenailles pour exposer le muscle sterno. Inciser le muscle autour de la trachée en utilisant des tenailles pour exposer la trachée.
- Placez un fil de coton dans la trachée en utilisant des tenailles.
- percer soigneusement le milieu de la trachée exposée entre deux anneaux de cartilage avec une aiguille 26 G. Prenez soin de ne pas endommager la trachée plus loin.
- Insérer le cathéter d'environ 0,5 cm dans la trachée. Assurez-vous que le catheter n'est pas inséré trop loin dans la trachée, car cela peut entraîner des dommages de la structure du poumon.
- Stabiliser le cathéter en attachant la trachée autour du cathéter à l'aide du fil de coton placé à l'étape 2.1.5. Si le cathéter est pas lié suffisamment, la solution saline équilibrée injectée peut circuler vers la partie supérieure des voies respiratoires au lieu de descendre dans les poumons.
- Recueillir le liquide de lavage
- Charger une seringue de 1 ml avec 1 ml de solution saline équilibrée stérile avec 100 pM d'EDTA.
- Raccorder la seringue de 1 ml au cathéter et injecter doucement la solution de sel / EDTA dans le poumon.
- Aspirer la solution tout en massant le thorax de la souris. Si le fluide est aspirez pas visible dans la seringue, insérez soigneusement le cathéter un peu plus bas ou la trachée.
- Retirer la seringue de l'aiguille et transférer le fluide de lavage récupéré dans un tube de 15 ml placé sur de la glace. Normalement, 700-900 &# 181; L de BAL est récupéré à partir de 1 mL de solution injectée.
- Répétez les étapes 2.2.1 - 2.2.4 deux fois plus.
REMARQUE: si l'on veut analyser le contenu non cellulaire, il est recommandé de concentrer les échantillons mis en commun lorsqu'il y a des problèmes de sensibilité.
3. Collecte des composants cellulaires et non cellulaires du fluide BAL
- Centrifuger le liquide de lavage pendant 7 min à 400 xg et 4 ° C.
- Recueillir le surnageant et l'utiliser immédiatement pour une analyse plus approfondie ( par exemple, ELISA) ou congeler à -80 ° C. Gardez la pastille cellulaire pour analyser l'afflux cellulaire dans les poumons.
- Remettre en suspension le culot cellulaire dans 200 μL de tampon de lysage ACK.
REMARQUE: Cette étape assure la lyse des érythrocytes tout en conservant les globules blancs intacts. - Incuber pendant 2 min à la RT.
REMARQUE: Pour réduire la variation causée par la lyse des globules rouges, cette étape ne doit pas être effectuée pendant plus de 2 min. - Ajouter 1 ml de PBS froid pour diluer le tampon de lysage ACK.
- Centrifugez pendant 7 min à 400 xg et 4 ° C. Jeter le surnageant et ré-suspendre les cellules dans un volume adéquat de PBS pour l'analyse en aval (voir ci-dessous).
REMARQUE: Le volume du PBS dépend de l'étude en aval qui sera effectuée.
4. Analyse des différents types de cellules dans le fluide BAL par cytométrie de flux
NOTE: Une possibilité est d'analyser la composition cellulaire absolue et relative du fluide BAL en effectuant une cytométrie en flux. Le but de cet article est d'élaborer la technique de BAL. La cytométrie de flux est une technique spécialisée seule. Il est recommandé de lire des articles spécialisés sur la technique de cytométrie en flux 13 , 14 , 15 , 16 , 17 . Les anticorps couplés à un fluorophore tchapeau reconnaissent les antigènes de surface (voir tableau 1) spécifiques à un type cellulaire particulier (s) sont utilisés. En utilisant une stratégie de déclenchement, il est possible d'identifier les cellules T, les macrophages, les cellules dendritiques, les cellules B, les eosinophiles et les neutrophiles dans la fraction cellulaire de la BAL.
| Antigène | Type de cellule |
| Grappe de différenciation 3 (CD3) | Exprimé sur les cellules T |
| Grappe de différenciation 11c (CD11c) | Une expression élevée sur la plupart des cellules dendritiques, mais aussi sur les monocytes, les macrophages, les neutrophiles et des cellules B. |
| Grappe de 11b de différenciation (CD11b) | Exprimé à la surface de nombreux leucocytes comprenant les monocytes, les neutrophiles, les cellules tueuses naturelles, les granulocytes et des macrophages. |
| SiglecF | UNELes macrophages lveolaires et les éosinophiles. |
| MHCII | Normalement trouvé uniquement sur les cellules présentatrices d'antigène telles que les cellules dendritiques, les phagocytes mononucléaires et les cellules B. |
| CD19 | Antigène lymphocytaire B |
| Ly-6G | Un marqueur pour les monocytes, les granulocytes et les neutrophiles |
Tableau 1: Sélection des antigènes de surface cellulaire immunitaire. Ce tableau fournit une liste des épitopes de surface utilisés pour caractériser les différents types de cellules. Des combinaisons de plusieurs marqueurs seront nécessaires pour définir de manière fiable un type de cellule spécifique.
| Échantillons | ||||
| Tube | Antigen-fluorophore à ajouter aux cellules | Concentration stock d' anticorps (mg / ml) | dilution d' anticorps | Le volume total (pi) |
| colorant de viabilité fixable | 0,2 | 1/1000 | 50 | |
| CD11c | 0,2 | 1/800 | 50 | |
| SiglecF | 0,2 | 1/100 | 50 | |
| échantillon X | MHCII | 0,2 | 1/200 | 50 |
| CD3 | 0,2 | 1/200 | 50 | |
| CD19 | 0,2 | 1/200 | 50 | |
| CD11b | 0,2 | 1/200 | 50 | |
| Ly6G | 0,2 | 1/200 | 50 | |
| Commandes de tension | ||||
| Tube | Antigène-fluorophore à ajouter aux cellules | Concentration stock d' anticorps (mg / ml) | dilution d' anticorps | Le volume total (pi) |
| cellules non colorées | / | / | / | 50 |
| Les cellules individuelles colorées | colorant de viabilité fixable | 0,2 | 1/1000 | 50 |
| Les cellules individuelles colorées | CD11c | 0,2 | 1/800 | 50 |
| Les cellules individuelles colorées | SiglecF | 0,2 | 1/100 | 50 |
| Les cellules individuelles colorées | MHCII | 0,2 | 1/200 | 50 |
| Les cellules individuelles colorées | CD3 | 0.2 | 1/200 | 50 |
| Cellules colorées simples | CD19 | 0,2 | 1/200 | 50 |
| Cellules colorées simples | CD11b | 0,2 | 1/200 | 50 |
| Cellules colorées simples | Ly6G | 0,2 | 1/200 | 50 |
| Contrôles de rémunération | ||||
| Tube | Antigen-fluorophore à ajouter aux perles | Concentration de stock d'anticorps (mg / ml) | Dilution des anticorps | Volume total (μL) |
| Perles non tachées | / | / | / | 200 |
| Perles teintes simples | CD11c | 0,2 | 1/2000 | 200 |
| Perles teintes simples | SiglecF | 0,2 | 1/2000 | 200 |
| Perles teintes simples | MHCII | 0,2 | 1/200 | 200 |
| Perles teintes simples | CD3 | 0,2 | 1/2000 | 200 |
| Perles teintes simples | CD19 | 0,2 | 1/2000 | 200 |
| Perles teintes simples | CD11b | 0,2 | 1/400 | 200 |
| Perles teintes simples | Ly6G | 0,2 | 1/200 | 200 |
Tableau 2. Liste des contrôles à inclure. Ce tableau présente tous les contrôles nécessaires pour une interprétation précise des résultats obtenus.
- Coloration de la surface cellulaire
NOTE: C'est impoIl faut inclure tous les contrôles critiques pour l'analyse de cytométrie en flux. Trois ensembles de tubes sont nécessaires (voir tableau 2 ): (1) les tubes contenant les échantillons; (2) tubes avec des cellules BAL pour chaque anticorps-fluorophore pour fabriquer des taches simples; Cela permet de déterminer les tensions pour chaque canal sur le cytomètre de flux; Et (3) des tubes avec des perles pour chaque anticorps-fluorophore pour fabriquer des taches simples; Il s'agit de déterminer la matrice de compensation.- Faire un mélange des anticorps et Fc-block (anti-CD16 / CD32) dans le PBS aux dilutions appropriées (voir tableau 2 ). Il est nécessaire de déterminer la dilution de travail optimale pour chaque anticorps avant l'expérience.
- Remettre en suspension les cellules dans 50 μL du mélange d'anticorps pour l'échantillon et ajouter 50 μL de l'anticorps dilué de manière appropriée aux contrôles critiques.
REMARQUE: la coloration peut être effectuée dans une plaque en forme de 96 puits. Cela permet de réduire facilement le volume de taches aNd exécuter des quantités importantes d'échantillons. - Incuber pendant 30 min dans l'obscurité à 4 ° C.
- Centrifugez pendant 7 min à 400 xg et 4 ° C. Jeter le surnageant.
- Ré-suspendre les cellules dans PBS à un volume final de 200 μL.
REMARQUE: Ce volume final dépend du volume minimal auquel le cytomètre de flux peut accéder. Cela peut différer légèrement entre les machines. En outre, le volume de lecture dépend du nombre de cellules et / ou du temps que l'échantillon prendra pour fonctionner dans le cytomètre de flux. - Utilisez les échantillons et les contrôles pour l'analyse cytométrique en flux.
REMARQUE: Pour déterminer le nombre absolu de cellules des différentes populations de cellules, il faut ajouter des billes de comptage. Ajoutez le même nombre de perles (± 25 000 perles) à chaque échantillon juste avant la mesure. En utilisant la diffusion directe et latérale, les cordons de comptage peuvent être identifiés par cytométrie de flux (voir la figure 1 ). Par la suite, le nombre absolu de cellules dans l'échantillon peut être calculé en comparantE rapport des événements de talons aux événements cellulaires. La formule suivante peut être utilisée: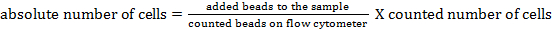
- Analyse cytométrique de flux
NOTE: L'analyse par cytométrie de flux doit être effectuée immédiatement après la fin du protocole de coloration. Un cytomètre de flux avec des lasers et des filtres appropriés pour la détection du signal doit être utilisé. Le tableau 3 donne un aperçu des lasers et des filtres nécessaires à l'étude décrite dans ce manuscrit. Pour plus d'informations sur l'analyse cytométrique en flux, voir Adan et al. 18 .- Configurez les portes principales en fonction de la dispersion vers l'avant et vers le côté, à l'exclusion des débris et des doublets (voir la figure 1 ).
- Réglez la tension et la compensation pour le chevauchement spectral à l'aide des cellules et des perles unis et colorés.
REMARQUE: ces paramètres sont différents pour chaque cytomètre de flux et doivent être vérifiés avant chaque expérience. FOu une analyse de débit correcte, les tensions de diffusion directe et latérale sont critiques. Une diffusion directe et latérale correcte peut aider à identifier et à confirmer l'identité des cellules analysées. Pour déterminer ces tensions, un échantillon non coloré doit être exécuté en premier. - Mettre en place des portes de fluorescence pour l'antigène de surface (voir la figure 1 ) et analyser les échantillons.
| Type de laser | Configuration du filtre | |
| 505 LP | 525/50 | |
| Bleu (488 nm) | 550 LP | 575/26 |
| 100 mW | 670 LP | 685/35 |
| 750 LP | 780/60 | |
| Violet 405 nm | 450/50 | |
| 100 mW | ||
| Rouge 633 nm | 660/20 | |
| 70 mW | 750 LP | 780/60 |
Tableau 3: Vue d'ensemble des lasers et des filtres du cytomètre de flux utilisés dans cette étude.
Résultats
Après avoir effectué BAL avec 3x 1 mL de solution de sel tamponnée, un volume compris entre 2 et 3 mL doit être récupéré. Ce fluide BAL peut être analysé plus en détail pour caractériser le contenu cellulaire et non cellulaire. Pour étudier la présence de cytokines et de chimiokines, ELISA 19 , immunoblot 20 et l'analyse simultanée de cytokines multiples par un réseau de perles de cytokines 21 peuvent être réalisées. En outre, la teneur en albumine et en protéines totales de ce fluide peut être déterminée 22 .
À titre d'exemple, ce manuscrit décrit comment analyser le contenu cellulaire du fluide BAL par cytométrie de flux. Le liquide BAL analysé a été recueilli à partir de souris femelles Balb / cAnNCrl (âge: 7 semaines) 24 h après leur injection intratrachéale avec du lipopolysaccharide. Les anticorps suivants, couplés à un fluorophore, wavant utilisé pour identifier les différents types de cellules: CD11c, SiglecF, CMHII, CD3e, CD19, Ly6g, et CD11b (voir le tableau 1 et le tableau des matériaux). Le colorant de viabilité fixable a également été utilisé. En utilisant une stratégie de gating sur la base de l'expression différentielle des antigènes sur les surfaces des différentes populations cellulaires (figure 1), il était possible d'identifier les macrophages, les cellules dendritiques, les lymphocytes B, les lymphocytes T, les neutrophiles et les eosinophiles.
Tout d'abord, les débris et les doublets ont été bloqués sur la base de paramètres vers l'avant et dispersion latérale. Un colorant de viabilité a facilité fenêtrage les cellules vivantes. Ensuite, les cellules et les cellules CD11c élevées à faible CD11c ont été identifiées. Dans la population CD11c élevée, les macrophages et les cellules dendritiques ont été identifiés sur la base de l'expression MHCII et SiglecF, respectivement. Dans la CD11c faible densité de population, les lymphocytes T et les cellules B ont été identifiés sur la base CD3e et l'expression de CD19, respectivement. dans ee reste de la population cellulaire, les neutrophiles et les éosinophiles ont été identifiés sur la base de l'expression du marqueur CD11b et Ly-6G, respectivement.
Des billes de comptage ont été ajoutés afin de déterminer le nombre de cellules absolues des différentes populations de cellules en comparant le rapport des événements de perles à des événements cellulaires 23. Ces perles de comptage ont été identifiées en fonction de leurs propriétés et vers l' avenir dispersion latérale (Figure 1). Le tableau 4 donne un aperçu des nombres de cellules absolues des différentes populations de cellules dans le fluide BAL de souris naïves et une souris qui a été stimulées pendant 24 heures avec 5 pg de lipopolysaccharide.
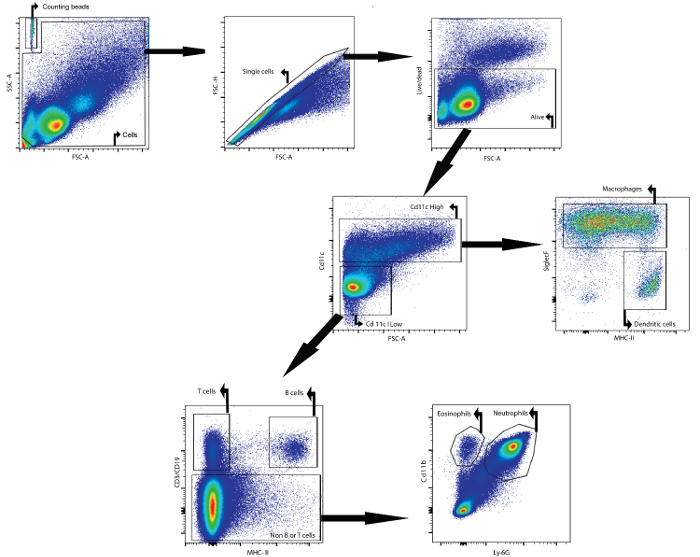
Figure 1: Stratégie gating pour la détection de cytométrie de flux macrophages, cellules dendritiques, les lymphocytes T, les lymphocytes B, les neutrophiles et éosinophiles iN Fluide BAL. Les cellules BAL ont été isolées en utilisant le protocole BAL décrit. Les cellules ont été isolées à partir de souris 24 h après l'instillation intratrachéale du lipopolysaccharide. Le comptage des perles et des cellules a été identifié en fonction des propriétés de diffusion directe et latérale. Dans la porte de la cellule, des cellules individuelles ont été identifiées en utilisant la diffusion directe et latérale. Dans cette dernière population, les cellules vivantes ont été identifiées. Des cellules CD11c élevées et des cellules CD11c faibles ont ensuite été identifiées. Dans la population élevée de CD11c, les macrophages et les cellules dendritiques ont été identifiés en fonction de l'expression MHCII et SiglecF, respectivement. Dans la population faible de CD11c, les lymphocytes T et les cellules B ont été identifiés en fonction de l'expression CD3ε et CD19, respectivement. Dans la population cellulaire restante, les neutrophiles et les éosinophiles ont été identifiés en fonction de l'expression CD11b et Ly-6G, respectivement. Cliquez ici pour voir unPlus grande de cette figure.
| Population cellulaire | Nombre absolu de cellules chez les souris naïves | Nombre absolu de cellules dans des souris stimulées par LPS |
| Les macrophages | 79 612 | 25 439 |
| Cellules dendritiques | 495 | 671 |
| Cellules T | 45,271 | 28 089 |
| Cellules B | 4,164 | 2.926 |
| Neutrophiles | 632 | 566 716 |
| Éosinophiles | 3 488 | 4,332 |
Tableau 4: ReprésenterRésultats de l'analyse de cytométrie de flux sur le fluide BAL de souris stimulées par Naïve et LPS.
Discussion
BAL est une technique utile pour obtenir des informations cytologique et biochimiques en réponse à des infections ou des médicaments. Dans un premier temps , BAL a été utilisé pour gérer la production excessive de mucus chez les patients humains souffrant de la toxicité du phosgène 3. De nos jours, la technique est utilisée chez l' homme pour enquêter sur la pathogenèse du poumon, le diagnostic et prise en charge thérapeutique des maladies 3, 24. Chez les animaux de laboratoire, BAL est couramment utilisé pour surveiller les réponses inflammatoires, des mécanismes immunitaires, et des processus de maladies infectieuses qui se produisent dans les voies aériennes pulmonaires 1, 2.
Pour étudier le modèle cellulaire inflammatoire dans les modèles de maladies respiratoires, BAL devrait être suivie par comptage cellulaire absolue et différentielle. En plus du numéro de cellule absolue, le nombre de cellules par rapport sont également intéressantes. Par exemple, les modèles de réparation et cancer montrent vLe nombre de cellules BAL augmente. Dans ce modèle, l'évaluation de la composition cellulaire est utile. En utilisant une coloration cellulaire combinée à un microscope optique, différents types de cellules, tels que les éosinophiles, les neutrophiles, les macrophages et les lymphocytes, peuvent être identifiés en fonction de la morphologie 25 , 26 , 27 , 28 , 29 , 30 . La cytométrie de flux peut être utilisée pour des évaluations spécifiques, telles que l'identification de différents phénotypes de lymphocytes T 7 , 31 . En plus de l'identification des différentes populations de cellules infiltrantes, la composition non cellulaire du poumon peut être étudiée en utilisant BAL. Des méthodes telles que l'ELISA, l'immuno-tache, la matrice de cytokines, l'immunohistochimie et la réaction en chaîne par polymérase quantitative sont effectuées sur le fluide BAL pour déterminer les cytokines, la croissanceDes facteurs et d'autres composants inflammatoires. Pour déterminer les dommages aux poumons, les concentrations totales de protéines et de lactate déshydrogénase dans le liquide BAL peuvent également être mesurées 32 , 33 .
Avec le développement de nouveaux outils de diagnostic, la caractérisation génomique et protéomique des composants BAL sera possible dans un proche avenir. La combinaison d'une capacité de calcul en expansion et de technologies d'expression de gènes à haut débit permettra de définir des profils spécifiques d'expression génique pour divers états pathologiques. L'exécution de ces techniques sur le fluide BAL peut fournir des modèles d'expression des gènes et des protéines pour identifier les molécules importantes impliquées dans les différentes phases des maladies pulmonaires.
La principale limitation des données obtenues à partir du liquide BAL est le manque de comparabilité entre les différents essais de recherche 3 , 9 . Il existe un degré élevé devariabilité de la technique de lavage et le traitement ultérieur de fluide BAL. Pour être en mesure de comparer chaque essai BAL, il est nécessaire de normaliser le type de liquide de lavage qui est inculqué, le site de l'instillation, et la fraction qui doit être analysée pour la composition cellulaire et non cellulaire. Il existe des différences significatives dans le nombre de fractions de lavage entre les différents essais, en faisant varier d'une à 14 fois 34, 35, 36. Cette différence peut avoir un impact sur le nombre total de cellules estimées dans les poumons. Il est important de savoir quelle fraction fluide BAL contient la majorité des cellules. Song et al. a montré qu'environ 70% du nombre total de cellules ont été récupérés dans la fraction de une à trois 22. Cependant, d' autres rapports ont suggéré que le deuxième lavage contenait plus de cellules que le premier 37, 38 . On peut conclure de ces études qu'un lavage avec une seule fraction ne représente pas l'ensemble du poumon, entraînant une interprétation erronée des résultats.
La composition non cellulaire du fluide BAL contient des informations précieuses sur l'état de santé du poumon 33 , 39 , 40 . Les variations de la dilution du fluide BAL contribuent à la différence de quantification de la fraction soluble et, par conséquent, aux différences dans les résultats entre essais. Song et al. A comparé les niveaux de protéines et de lactate déshydrogénase de chaque fraction de lavage et a conclu que la première fraction de lavage contenait deux à trois fois plus que la seconde fraction.
Pour récupérer un échantillon BAL représentatif pour analyse, certaines considérations techniques sont cruciales. L'un d'eux consiste à effectuer une anesthésie appropriée. Il est très important de vérifier le pied refLex de la souris pour assurer la sédation terminale. Ce n'est pas seulement important pour des raisons éthiques, mais aussi parce qu'il est difficile de placer et de retenir le cathéter dans la position correcte si la souris n'est pas anesthésiée correctement.
Une deuxième considération technique importante est la position du cathéter dans la trachée. Lorsque le cathéter est inséré trop profond, il peut endommager la structure du poumon. L'extrémité distale du cathéter ne doit pas atteindre les poumons pendant la procédure BAL. Le cathéter doit également être stabilisé et attaché avec un fil de coton. Si le cathéter n'est pas stabilisé, la solution saline injectée peut s'écouler vers le haut dans la cavité nasale au lieu de descendre dans les poumons. Pendant l'injection et l'aspiration de la solution saline, il est important de maintenir le cathéter stable.
Les données obtenues à partir du fluide BAL doivent représenter le poumon murin entier. Par conséquent, il est important d'instiller un volume adéquat de tampon salin ( c.-à-d.3 ml, divisé en 3 portions aliquotes de 1 ml chacune). Il n'y a pas de relation linéaire entre le rendement cellulaire et le rendement en fluide BAL. Il est important de collecter la solution doucement tout en massant le thorax de la souris. Si les forces de cisaillement sont trop fortes, la viabilité, la fonction et la structure des cellules dans les voies aériennes et le fluide BAL peuvent être compromises. Si le fluide aspiré n'est pas visible dans la seringue, déplacer soigneusement le cathéter plus profond ou plus haut dans la trachée.
Un avis spécial devrait être donné à des aspects spécifiques du traitement et de l'analyse BAL. Cela permettra de maximiser l'information retenue à partir des échantillons BAL. Après BAL, les cellules sont dans un milieu salin pauvre en éléments nutritifs. Il est donc très important de traiter les échantillons dans les 1 h après l'échantillonnage BAL. Si un stockage prolongé est nécessaire, l'utilisation d'un milieu supplémenté en éléments nutritifs est nécessaire.
Pour préserver la viabilité cellulaire, évitez les tubes qui favorisent l'adhérence cellulaire à la surface. Évitez ceLa ntrifugation des suspensions de cellules à des vitesses susceptibles de compromettre l'intégrité cellulaire ou d'empêcher une resuspension uniforme des cellules BAL récupérées. Les cellules contenant du liquide BAL doivent être centrifugées à 400 xg et 4 ° C pendant 7 min. Il est important de garder à l'esprit que les suspensions de cellules devraient être maintenues à 4 ° C pendant le traitement.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
LVH est un assistant de recherche au Département de biologie moléculaire biomédicale de l'Université de Gand. ERJ est soutenu par UniVacFlu, numéro de subvention 607690. KR est soutenu par le projet EC-FP7 FLUNIVAC.
matériels
| Name | Company | Catalog Number | Comments |
| Hanks' Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 14175-129 | |
| ethyleendiaminetetra acetic acid (EDTA) | Sigma-Aldrich | E6511 | irritating |
| 23 G x 1 1/4 needle | Henke Sass Wolf | 4710006030 | size: 0.60 x 30 mm |
| 26 G x 1/2 needle | Henke Sass Wolf | 4710004512 | size: 0.45 x 12 mm |
| plastic tubing | BD medical technology | 427411 | Polyethylene Tubing, I.D. 0.58 mm (0.023") O.D. 0.965 mm (0.38") 30.5 m (100') |
| sodium pentobarbital | Kela NV | 514 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | PBS without Ca2+ Mg2+ or phenol red; sterile filtered |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | nonpyrogenic and nontoxic |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Surgical scissors | Fine Science Tools GmbH | 91460-11 | |
| centrifuge tube 50 mL | TH.Geyer | 7696705 | Free from Rnase/Dnase/endotoxin |
| centrifuge tube 15 mL | TH.Geyer | 7696702 | Free from Rnase/Dnase/endotoxin |
| microcentrifuge tube 1.5 mL | Sigma-Aldrich | 0030 120.094 | polypropylene |
| Microcentrifuge | Sigma-Aldrich | 5415R | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| Ammonium-Chloride-Potassium (ACK) lysing buffer | Lonza | 10-548E | sterile-filtered |
| live/dead - efluor 506 | ebioscience | 65-0866-18 | fixable viability dye |
| CD11c-PE-cy7 | eBiosciences | 25-0114-81 | |
| SiglecF-PE | BD Pharmingen | 552126 | |
| MHCII-APCefluor780 | Biolegend | 107628 | |
| CD3-PE-cy5 | VWR | 55-0031-U100 | |
| CD19-PE-cy5 | eBiosciences | 15-0193-83 | |
| CD11b-V450 | BD Pharmingen | 560455 | |
| Ly6G-AF700 | Biolegend | 127621 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| anti-CD16/CD32 | BD Pharmingen | 553142 | |
| 96-well 340 µl storage plate plate | Falcon | 353263 | V-bottom, natural polypropylene |
| flow cytometer | BD Biosciences | ||
| catheter | BD Biosciences | 393202 |
Références
- Stankunas, K., et al. Conditional protein alleles using knockin mice and a chemical inducer of dimerization. Mol Cell. 12 (6), 1615-1624 (2003).
- Hunninghake, G. W., Gadek, J. E., Kawanami, O., Ferrans, V. J., Crystal, R. G. Inflammatory and immune processes in the human lung in health and disease: evaluation by bronchoalveolar lavage. Am J Pathol. 97 (1), 149-206 (1979).
- Gee, J. B., Fick, R. B. Bronchoalveolar lavage. Thorax. 35 (1), 1-8 (1980).
- Tornling, G., et al. Hyaluronic acid in bronchoalveolar lavage in rats exposed to quartz. Br J Ind Med. 44 (7), 443-445 (1987).
- Henderson, R. F. Use of bronchoalveolar lavage to detect respiratory tract toxicity of inhaled material. Exp Toxicol Pathol. 57, 155-159 (2005).
- Morris, A., et al. Longitudinal analysis of the lung microbiota of cynomolgous macaques during long-term SHIV infection. Microbiome. 4 (1), 38 (2016).
- Naessens, T., et al. GM-CSF treatment prevents respiratory syncytial virus-induced pulmonary exacerbation responses in postallergic mice by stimulating alveolar macrophage maturation. J Allergy Clin Immunol. 137 (3), 700-709 (2016).
- Chockalingam, A., Duraiswamy, R., Jagadeesan, M. Bronchoalveolar lavage cellular analyses in conjunction with high-resolution computed tomography imaging as a diagnostic intervention for patients with suspected interstitial lung disease. Lung India. 33 (3), 287-291 (2016).
- Crystal, R. G., Reynolds, H. Y., Kalica, A. R. Bronchoalveolar lavage. The report of an international conference. Chest. 90 (1), 122-131 (1986).
- Baughman, R. P. The uncertainties of bronchoalveolar lavage. Eur Respir J. 10 (9), 1940-1942 (1997).
- Singletary, M. L., et al. Modification of a common BAL technique to enhance sample diagnostic value. J Am Assoc Lab Anim Sci. 47 (5), 47-51 (2008).
- Angus, D. W., Baker, J. A., Mason, R., Martin, I. J. The potential influence of CO2, as an agent for euthanasia, on the pharmacokinetics of basic compounds in rodents. Drug Metab Dispos. 36 (2), 375-379 (2008).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. J Vis Exp. (97), (2015).
- Rubio-Navarro, A., et al. Phenotypic Characterization of Macrophages from Rat Kidney by Flow Cytometry. J Vis Exp. (116), (2016).
- Butcher, M. J., Herre, M., Ley, K., Galkina, E. Flow cytometry analysis of immune cells within murine aortas. J Vis Exp. (53), (2011).
- Noto, A., Ngauv, P., Trautmann, L. Cell-based flow cytometry assay to measure cytotoxic activity. J Vis Exp. (82), e51105 (2013).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Database, J. S. E. The ELISA method. J Vis Exp. , (2016).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Wunderlich, M. L., Dodge, M. E., Dhawan, R. K., Shek, W. R. Multiplexed fluorometric immunoassay testing methodology and troubleshooting. J Vis Exp. (58), (2011).
- Song, J. A., et al. Standardization of bronchoalveolar lavage method based on suction frequency number and lavage fraction number using rats. Toxicol Res. 26 (3), 203-208 (2010).
- Seliger, C., et al. A rapid high-precision flow cytometry based technique for total white blood cell counting in chickens. Vet Immunol Immunopathol. 145 (1-2), 86-99 (2012).
- Daniele, R. P., Elias, J. A., Epstein, P. E., Rossman, M. D. Bronchoalveolar lavage: role in the pathogenesis, diagnosis, and management of interstitial lung disease. Ann Intern Med. 102 (1), 93-108 (1985).
- Delayre-Orthez, C., Becker, J., de Blay, F., Frossard, N., Pons, F. Exposure to endotoxins during sensitization prevents further endotoxin-induced exacerbation of airway inflammation in a mouse model of allergic asthma. Int Arch Allergy Immunol. 138 (4), 298-304 (2005).
- Delayre-Orthez, C., et al. PPARalpha downregulates airway inflammation induced by lipopolysaccharide in the mouse. Respir Res. 6, 91 (2005).
- Delayre-Orthez, C., de Blay, F., Frossard, N., Pons, F. Dose-dependent effects of endotoxins on allergen sensitization and challenge in the mouse. Clin Exp Allergy. 34 (11), 1789-1795 (2004).
- Hachet-Haas, M., et al. Small neutralizing molecules to inhibit actions of the chemokine CXCL12. J Biol Chem. 283 (34), 23189-23199 (2008).
- Ble, F. X., et al. Activation of the lung S1P(1) receptor reduces allergen-induced plasma leakage in mice. Br J Pharmacol. 158 (5), 1295-1301 (2009).
- Ble, F. X., et al. Allergen-induced lung inflammation in actively sensitized mice assessed with MR imaging. Radiology. 248 (3), 834-843 (2008).
- Reber, L. L., et al. A dissociated glucocorticoid receptor modulator reduces airway hyperresponsiveness and inflammation in a mouse model of asthma. J Immunol. 188 (7), 3478-3487 (2012).
- Drent, M., Cobben, N. A., Henderson, R. F., Wouters, E. F., van Dieijen-Visser, M. Usefulness of lactate dehydrogenase and its isoenzymes as indicators of lung damage or inflammation. Eur Respir J. 9 (8), 1736-1742 (1996).
- Henderson, R. F. Use of bronchoalveolar lavage to detect lung damage. Environ Health Perspect. 56, 115-129 (1984).
- Forget, G., et al. An adherent cell perifusion technique to study the overall and sequential response of rat alveolar macrophages to toxic substances. Environ Health Perspect. 51, 131-140 (1983).
- Sung, J. H., et al. Recovery from welding-fume-exposure-induced lung fibrosis and pulmonary function changes in sprague dawley rats. Toxicol Sci. 82 (2), 608-613 (2004).
- Majetschak, M., Sorell, L. T., Patricelli, T., Seitz, D. H., Knoferl, M. W. Detection and possible role of proteasomes in the bronchoalveolar space of the injured lung. Physiol Res. 58 (3), 363-372 (2009).
- Rehn, B., Bruch, J., Zou, T., Hobusch, G. Recovery of rat alveolar macrophages by bronchoalveolar lavage under normal and activated conditions. Environ Health Perspect. 97, 11-16 (1992).
- Kelly, C. A., Ward, C., Stenton, S. C., Hendrick, D. J., Walters, E. H. Assessment of pulmonary macrophage and neutrophil function in sequential bronchoalveolar lavage aspirates in sarcoidosis. Thorax. 43 (10), 787-791 (1988).
- Eklund, A., Tornling, G., Blaschke, E., Curstedt, T. Extracellular matrix components in bronchoalveolar lavage fluid in quartz exposed rats. Br J Ind Med. 48 (11), 776-782 (1991).
- Olsen, G. N., Harris, J. O., Castle, J. R., Waldman, R. H., Karmgard, H. J. Alpha-1-antitrypsin content in the serum, alveolar macrophages, and alveolar lavage fluid of smoking and nonsmoking normal subjects. J Clin Invest. 55 (2), 427-430 (1975).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon