Method Article
Bronchoalveoläre Lavage von murinen Lungen zur Analyse der entzündlichen Zellinfiltration
In diesem Artikel
Zusammenfassung
Der Gesundheitszustand der Lunge spiegelt sich in der Art und Anzahl der Immunzellen, die in den Bronchiolen der Lunge vorhanden sind. Wir beschreiben eine bronchoalveoläre Lavagetechnik, die die Isolierung und Untersuchung von nichtadhärenten Zellen und löslichen Faktoren aus dem unteren Atemtrakt der Mäuse ermöglicht.
Zusammenfassung
Bronchoalveoläre Lavage (BAL) ist ein experimentelles Verfahren, das verwendet wird, um den zellulären und azellulären Gehalt des Lungenlumens ex vivo zu untersuchen, um Einblick in einen laufenden Krankheitszustand zu erhalten.
Hier wird eine einfache und effiziente Methode beschrieben, um BAL auf murine Lungen ohne die Notwendigkeit von speziellen Werkzeugen oder Ausrüstung durchzuführen. BAL-Flüssigkeit wird durch Einsetzen eines Katheters in die Trachea von endlich anästhesierten Mäusen isoliert, durch die eine Salzlösung in die Bronchiolen eingeflößt wird. Die eingefleckte Flüssigkeit wird vorsichtig zurückgezogen, um die BAL-Flüssigkeitsabfrage zu maximieren und die Scherkräfte zu minimieren. Diese Technik ermöglicht die Lebensfähigkeit, Funktion und Struktur der Zellen innerhalb der Atemwege und BAL-Flüssigkeit zu bewahren.
Es können zahlreiche Techniken angewendet werden, um ein weiteres Verständnis des Krankheitszustands der Lunge zu erhalten. Hier ist eine häufig verwendete Technik zur Identifizierung und Aufzählung verschiedener Immunzellenartenbeschrieben, wobei Cytometry mit einer ausgewählten Gruppe von fluoreszierend markierten Zelloberflächenspezifische Marker kombiniert wird fließen. Die BAL hier vorgestellte Verfahren können auch infektiöse Agenzien, flüssigen Bestandteile oder inhalierter Partikel in murine Lungen zu analysieren.
Einleitung
Die Atemwege begegnen zahlreichen Beleidigungen, die zu Entzündungen, Pathogeninvasionen oder bösartigen Transformation führen können. Die Epithelzellen, die das Lungenlumen bilden, bilden eine der Hauptbarrieren des Säugetierkörpers. Zusammen mit alveolaren Makrophagen verhindern sie, dass Umweltbedrohungen über die Atemwege Zugang zum Systemsystem haben. Beispiele für solche Bedrohungen sind organische und anorganische Chemikalien, Bakterien und Viren. Ebenso können spezifische Immunisierungen oder therapeutische Interventionen auf die Lungen ausgelegt werden. In all diesen Fällen ist eine aufwändige Analyse der evozierten Reaktion wichtig, um biologische Prozesse zu verstehen, zu intervenieren oder zu verhindern, die innerhalb des Atmungssystems stattfinden.
Bronchoalveoläre Lavage (BAL) ist eine unschätzbare Methode, um solche Reaktionen zu analysieren, da die resultierenden Proben wichtige Informationen über die entzündlichen Reaktionen, Immunmechanismen und Infektionskrankheitsprogression enthaltenDas kann in den pulmonalen Atemwegen 1 , 2 auftreten. Durch die Verwendung von BAL ist es möglich, die infiltrierenden Zellen zu untersuchen. Das kontrastiert mit verdauten Lungen, die eine "schmutzigere" Zellpopulation mit vielen toten und klebrigen Zellen geben. BAL wird durch Einführen einer Kochsalzlösung in die terminalen Bronchiolen und anschließende Gewinnung dieser Lösung durchgeführt. Die abgerufene Lösung kann dann verwendet werden, um residenten Lungen zu quantifizieren und phänotypisch zu analysieren und infundierende entzündliche Zellen zu infiltrieren. Diese Methode wird häufig angewendet, um zellulären Zustrom in Krankheitsmodellen der Atemwege, wie Asthma, chronisch obstruktive pulmonary Disease (COPD) und Infektionskrankheiten Modelle zu untersuchen. Neben der zellulären Zusammensetzung spiegelt sich auch die molekulare Zusammensetzung der pulmonalen Atemwege in der BAL-Flüssigkeit. Um dies zu analysieren, können Enzym-verbundener Immunosorbent-Assay (ELISA), Immunoblot und die simultane Analyse von mehreren Zytokinen durch ein Cytokin-Perlen-Array seingeführt, um die Anwesenheit von Zytokinen und Chemokinen zu beurteilen.
BAL ist ein gut etabliertes Verfahren den Einstrom von Entzündungszellen bei entzündlichen Atemwegserkrankungen Tiermodellen zu untersuchen. Die Beobachtung eines veränderten zellulären Einstrom (zB erhöhte Konzentrationen von Lymphozyten, Eosinophilen, Neutrophilen oder) kann zu einem besseren Einblick in die Krankheit führen und kann ein objektiver Parameter sein , die Leistung einer therapeutischen Intervention zu bestimmen.
Die genaue und reproduzierbare Interpretation der BAL zellulären Analyse erfordert, dass die BAL korrekt durchgeführt wird, und dass die aufgefangene Flüssigkeit wird richtig gehandhabt und verarbeitet. Der Begriff „Bronchiallavage“ wurde 3 von Stitt vor mehr als achtzig Jahren eingeführt. Im Jahr 1961 erhielt Myrvik Alveolarmakrophagen aus der Lavage von Kaninchenlungen 3. BAL ist jetzt ein häufig verwendetes Verfahren der Lungen im Mausmodell zu analysieren und zu überwachen, noch diere ist noch kein Bericht eines standardisierten BAL Verfahren in der wissenschaftlichen Literatur 4, 5. Darüber hinaus gibt es wahrscheinlich so viele Möglichkeiten , um BAL durchführen , wie es Forschungslabors sind mit der Technik 3, 6, 7, 8, 9, 10, 11. Es ist wichtig, dass die Daten aus der BAL repräsentieren die ganze Mäuselunge erhalten, und nicht nur einen Teil der Lunge. Diese Art der Variabilität erschwert die Interpretation und Vergleich der Ergebnisse der verschiedenen Studien.
Hier wird ein einfaches, kostengünstiges und reproduzierbares BAL Verfahren wird beschrieben, dass die Sammlung der zellulären und löslichen Fraktion, die in dem Atemweg Lumens der Maus ermöglicht. Kurz gesagt, wird ein Katheter in die Trachea freigelegt o platziertFa anästhesierte Maus. Eine Spritze ist mit dem Katheter verbunden, und eine gepufferte Kochsalzlösung, die Ethylendiamintetraessigsäure (EDTA) enthält, wird in die Lungen eingeführt. Das Lungenlumen wird durch sanftes wiederholtes Spülen der Kochsalzlösung unter Verwendung des Kolbens entnommen. Der Unterdruck, der während dieses Schrittes angewendet wird, ist minimal, um den Zusammenbruch der Atemwege zu verhindern. Nach der Sammlung sollte die erhaltene BAL weiter verarbeitet werden, um die Zellen durch Durchflusszytometrie aufzuzählen und zu identifizieren.
Protokoll
Alle Tierversuche, die in dieser Studie beschrieben wurden, wurden nach dem nationalen (belgischen Gesetz 14/08/1986 und 22/12/2003, belgischen Königlichen Dekret vom 06/04/2010) und der europäischen Gesetzgebung (EU-Richtlinien 2010/63 / EU und 86 / 609 / EWG). Alle Experimente an Mäusen und allen Tierprotokollen wurden vom Ethikkomitee der Universität Gent (Genehmigungsnummern LA1400091 und EC2016-027) genehmigt.
1. Vorbereitung
- Spülflüssigkeit
- Eine ausgewogene Salzlösung mit 100 μM Ethylendiamintetraessigsäure (EDTA) zubereiten.
HINWEIS: Um Proteinspiegel in der BAL-Flüssigkeit zu messen, empfiehlt es sich, Protease-Inhibitoren zuzusetzen, um die Protease-Aktivität in der BAL-Flüssigkeit zu verhindern.
- Eine ausgewogene Salzlösung mit 100 μM Ethylendiamintetraessigsäure (EDTA) zubereiten.
- Katheter
- Machen Sie einen Katheter, indem Sie eine 23 G Nadel in transparente Plastik Polyethylen 21 G Schlauch (Innendurchmesser: 0,58 mm, Außendurchmesser: 0,965 mm und Länge: 0,5 cm). Premade Katheter können auch verwendet werden.
- AnesthWDVS
- Bereiten einer terminalen Anästhetikum, vorzugsweise eine , die Atemstillstand verursacht (beispielsweise ein Barbiturat wie Natriumpentobarbital (> 100 mg / kg) Lösung in Phosphat-gepufferter Salzlösung (PBS)).
HINWEIS: Es wird empfohlen injiziert Anästhesie zu verwenden anstelle von inhalativen Anästhesie, wie inhalierte Anästhesie einen Einfluss auf die BAL-Gehalt aufweisen. CO 2, zum Beispiel hat einen Einfluss auf den pH - Wert des Blutes und damit auf die Umverteilung der verschiedenen Verbindungen 12.
- Bereiten einer terminalen Anästhetikum, vorzugsweise eine , die Atemstillstand verursacht (beispielsweise ein Barbiturat wie Natriumpentobarbital (> 100 mg / kg) Lösung in Phosphat-gepufferter Salzlösung (PBS)).
- Ammonium-Chlorid-Kalium (ACK) rote Blutpuffer Zelllyse
- Bereiten einen ACK - Lysepuffer 8,29 g NH 4 Cl und 1 g KHCO 3 in 1 l H 2 O mit 100 uM EDTA durch Auflösen; die roten Blutkörperchen Lysepuffer können auch von einer externen Quelle bezogen werden.
2. Durchführung der Bronchiallavage (BAL)
- Einführen des Katheters in die Trachea
- Euthanize der Maus durch intraperitoneale Injektion einer letalen Dosis eines kurzwirkenden Barbiturat Anästhetikum eine 26 G-Nadel. Um eine ordnungsgemäße tödliche anesthetization zu bestätigen, kneifen die hintere Pfote der Maus mit einer Pinzette die Fußreflexzonen zu überprüfen.
- Legen Sie das Tier auf dem Rücken auf einer chirurgischen Platte und befestigen Sie die Maus durch Pinning die Glieder nach unten.
- Spray 70% Ethanol auf dem Hals zu desinfizieren. Einen Einschnitt in der Haut am Hals in der Nähe der Luftröhre mit einem Skalpell.
- Öffnen Sie die Haut die Speicheldrüsen zu belichten. Trennen Sie die Speicheldrüsen durch Zangen mit dem M. sternohyoideus zu belichten. Einzuschneiden den Muskel um die Trachea Zange mit der Luftröhre zu belichten.
- Legen Sie einen Baumwollfaden unter der Trachea mit Zangen.
- Sorgfältig durchsticht die Mitte des freiliegenden Trachea zwischen zwei Knorpelringen mit einer 26 G-Nadel. Achten Sie darauf, nicht die Luftröhre weiter zu beschädigen.
- Setzen Sie den Katheter etwa 0,5 cm in die Luftröhre. Stellen Sie sicher, dass die catheter ist nicht zu weit nach unten in die Trachea eingeführt, da dies zu einer Schädigung der Lungenstruktur führen kann.
- Stabilisierung des Katheters durch die Luftröhre um den Katheter binden den Baumwollfaden in Schritt 2.1.5 platziert werden. Wenn der Katheter nicht ausreichend gebunden ist, kann die injizierte balancierter Salzlösung in Richtung des oberen Teils des Atmungstraktes fließt statt nach unten in die Lunge.
- Sammeln Sie die Spülflüssigkeit
- Laden eine 1 ml-Spritze mit 1 ml steriler ausgewogener Salzlösung mit 100 & mgr; M EDTA.
- Verbinden Sie die 1-ml-Spritze mit dem Katheter und sanft das Salz / EDTA-Lösung in die Lunge injizieren.
- Aspirieren Sie die Lösung behutsam, während der Thorax der Maus zu massieren. Wenn die Flüssigkeit absaugen nicht sichtbar in der Spritze ist, legt den Katheter vorsichtig ein wenig weiter nach unten oder oben der Trachea.
- Entfernen die Spritze von der Nadel übertragen, und die wiedergewonnene Spülflüssigkeit in ein 15 ml-Röhrchen auf Eis gestellt. Normalerweise 700-900 &# 181, L von BAL wird aus 1 ml injizierter Lösung gewonnen.
- Wiederholen Sie die Schritte 2.2.1 - 2.2.4 zweimal mehr.
HINWEIS: Wenn es darum geht, den nicht zellulären Inhalt zu analysieren, empfiehlt es sich, die gepoolten Proben zu konzentrieren, wenn es Probleme mit der Empfindlichkeit gibt.
3. Sammeln der zellulären und nichtzellulären Bestandteile der BAL-Flüssigkeit
- Die Spülflüssigkeit für 7 min bei 400 xg und 4 ° C zentrifugieren.
- Sammeln Sie den Überstand und verwenden Sie ihn sofort zur weiteren Analyse ( zB ELISA) oder bei -80 ° C einfrieren. Halten Sie das Zellpellet, um den zellulären Zustrom in den Lungen zu analysieren.
- Das Zellpellet wird in 200 μl ACK-lysierenden Puffer resuspendiert.
ANMERKUNG: Dieser Schritt stellt die Lyse der Erythrozyten sicher, während die weißen Blutzellen intakt gehalten werden. - Inkubieren für 2 min bei RT.
HINWEIS: Um die durch die Rotzelllyse verursachte Variation zu reduzieren, sollte dieser Schritt nicht länger als 2 min durchgeführt werden. - 1 ml kalter PBS, die ACK-Lysepuffer zu verdünnen.
- Zentrifuge für 7 min bei 400 xg und 4 ° C. Überstand verwerfen und resuspendiere die Zellen in einem ausreichenden Volumen von PBS für Downstream-Analyse (siehe unten).
HINWEIS: Das Volumen des PBS hängt von der Downstream-Studie, die durchgeführt werden soll.
4. Die Analyse der verschiedenen Zelltypen in der BAL-Flüssigkeit durch Durchflusszytometrie
HINWEIS: Eine Möglichkeit ist es, die absolute und relative Zellzusammensetzung der BAL-Flüssigkeit zu analysieren, mittels Durchflusszytometrie durchgeführt wird. Das Ziel dieser Arbeit ist die Technik des BAL zu erarbeiten. Die Durchflusszytometrie ist eine spezielle Technik für sich allein. Es wird empfohlen , auf dem Durchflusszytometrie Technik spezialisierte Papiere zu lesen , 13, 14, 15, 16, 17. Antikörper, gekoppelt an ein Fluorophor tHut erkennen Oberflächen-Antigene (siehe Tabelle 1 ), die für einen bestimmten Zelltyp (e) spezifisch sind. Durch die Verwendung einer Gating-Strategie ist es möglich, T-Zellen, Makrophagen, dendritische Zellen, B-Zellen, Eosinophile und Neutrophile in der Zellfraktion des BAL zu identifizieren.
| Antigen | Zelltyp |
| Cluster der Differenzierung 3 (CD3) | Ausgesprochen auf T-Zellen |
| Cluster der Differenzierung 11c (CD11c) | Hohe Expression auf den meisten dendritischen Zellen, aber auch auf Monozyten, Makrophagen, Neutrophilen und einigen B-Zellen. |
| Cluster der Differenzierung 11b (CD11b) | Ausgedrückt auf der Oberfläche von vielen Leukozyten, einschließlich Monozyten, Neutrophilen, natürlichen Killerzellen, Granulozyten und Makrophagen. |
| SiglecF | EINLveolaren Makrophagen und Eosinophilen. |
| MHCII | Normalerweise nur auf Antigen-präsentierenden Zellen wie dendritischen Zellen, mononuklearen Phagozyten und B-Zellen gefunden. |
| CD19 | B-Lymphozyten-Antigen |
| Ly-6G | Ein Marker für Monozyten, Granulozyten und Neutrophilen |
Tabelle 1: Auswahl von Immunzellen-Oberflächenantigenen. Diese Tabelle enthält eine Liste von Oberflächen-Epitopen, die zur Charakterisierung der verschiedenen Zelltypen verwendet werden. Es werden Kombinationen von mehreren Markern benötigt, um einen bestimmten Zelltyp zuverlässig zu definieren.
| Proben | ||||
| Tube | Antigen-Fluorophor wird den Zellen zugesetzt | Antikörper - Stammkonzentration (mg / ml) | Antikörper Verdünnung | Gesamtvolumen (ul) |
| Lebensfähigkeitsfarbstoff fixierbar | 0,2 | 1/1000 | 50 | |
| CD11c | 0,2 | 1/800 | 50 | |
| SiglecF | 0,2 | 1/100 | 50 | |
| Probe X | MHCII | 0,2 | 1/200 | 50 |
| CD3 | 0,2 | 1/200 | 50 | |
| CD19 | 0,2 | 1/200 | 50 | |
| CD11b | 0,2 | 1/200 | 50 | |
| Ly6G | 0,2 | 1/200 | 50 | |
| Spannungskontrollen | ||||
| Tube | Antigen-Fluorophor wird den Zellen zugesetzt | Antikörper-Stammkonzentration (mg / ml) | Antikörperverdünnung | Gesamtvolumen (μL) |
| Ungefärbte Zellen | / | / | / | 50 |
| Einzelgefärbte Zellen | Fixierbarer Lebensfähigkeitsfarbstoff | 0,2 | 1/1000 | 50 |
| Einzelgefärbte Zellen | CD11c | 0,2 | 1/800 | 50 |
| Einzelgefärbte Zellen | SiglecF | 0,2 | 1/100 | 50 |
| Einzelgefärbte Zellen | MHCII | 0,2 | 1/200 | 50 |
| Einzelgefärbte Zellen | CD3 | 00,2 | 1/200 | 50 |
| Einzelne gefärbten Zellen | CD19 | 0,2 | 1/200 | 50 |
| Einzelne gefärbten Zellen | CD11b | 0,2 | 1/200 | 50 |
| Einzelne gefärbten Zellen | Ly6G | 0,2 | 1/200 | 50 |
| Kompensationssteuerungen | ||||
| Tube | Antigen-Fluorophor Perlen hinzugefügt werden | Antikörper - Stammkonzentration (mg / ml) | Antikörper Verdünnung | Gesamtvolumen (ul) |
| ungefärbten Perlen | / | / | / | 200 |
| Einzel gefärbte Perlen | CD11c | 0,2 | 1/2000 | 200 |
| Einzel gefärbte Perlen | SiglecF | 0,2 | 1/2000 | 200 |
| Einzel gefärbte Perlen | MHCII | 0,2 | 1/200 | 200 |
| Einzel gefärbte Perlen | CD3 | 0,2 | 1/2000 | 200 |
| Einzel gefärbte Perlen | CD19 | 0,2 | 1/2000 | 200 |
| Einzel gefärbte Perlen | CD11b | 0,2 | 1/400 | 200 |
| Einzel gefärbte Perlen | Ly6G | 0,2 | 1/200 | 200 |
Tabelle 2. Liste der Kontrollen einbezogen werden. Diese Tabelle zeigt alle notwendigen Kontrollen für die genaue Interpretation der erzielten Ergebnisse.
- Zelloberflächenfärbung
HINWEIS: Es ist impoUm alle kritischen Kontrollen für die Durchflusszytometrieanalyse einzubeziehen. Es werden drei Sätze von Rohren benötigt (siehe Tabelle 2 ): (1) Röhrchen, die die Proben enthalten; (2) Röhrchen mit BAL-Zellen für jeden Antikörper-Fluorophor, um einzelne Flecken herzustellen; Dies ermöglicht die Bestimmung der Spannungen für jeden Kanal auf dem Durchflusszytometer; Und (3) Röhrchen mit Perlen für jeden Antikörper-Fluorophor, um einzelne Flecken herzustellen; Dies ist die Bestimmung der Kompensationsmatrix.- Mischen Sie die Antikörper und den Fc-Block (anti-CD16 / CD32) in PBS bei den entsprechenden Verdünnungen (siehe Tabelle 2 ). Es ist notwendig, die optimale Arbeitsverdünnung für jeden Antikörper vor dem Experiment zu bestimmen.
- Die Zellen in 50 μl der Antikörpermischung für die Probe resuspendieren und 50 μl des entsprechend verdünnten Antikörpers den kritischen Kontrollen zugeben.
ANMERKUNG: Die Färbung kann in einer 96-well, u-förmigen Platte durchgeführt werden. Dadurch ist es möglich, das Fleckvolumen leicht zu reduzierenNd führen erhebliche Mengen an Proben. - Inkubieren für 30 min im Dunkeln bei 4 ° C.
- 5 min bei 400 xg und 4 ° C zentrifugieren. Den Überstand verwerfen.
- Die Zellen in PBS auf ein Endvolumen von 200 μl erneut suspendieren.
HINWEIS: Dieses Endvolumen hängt von der minimalen Lautstärke ab, auf die das Durchflusszytometer zugreifen kann. Das kann sich zwischen den Maschinen leicht unterscheiden. Darüber hinaus hängt das Lesevolumen von der Anzahl der Zellen und / oder der Zeit ab, die die Probe ausführen wird, um im Durchflusszytometer zu laufen. - Verwenden Sie die Proben und Kontrollen für die Durchflusszytometrische Analyse.
HINWEIS: Um die absolute Zellzahl der verschiedenen Zellpopulationen zu bestimmen, sollten Zählperlen hinzugefügt werden. Füge die gleiche Anzahl von Perlen (± 25.000 Perlen) zu jeder Probe kurz vor der Messung hinzu. Durch die Verwendung von Vorwärts- und Seitenstreuung können Zählperlen durch Durchflusszytometrie identifiziert werden (siehe Abbildung 1 ). Anschließend kann die absolute Anzahl von Zellen in der Probe durch Vergleich von th berechnet werdenE-Verhältnis von Perlenereignissen zu Zellereignissen. Folgende Formel kann verwendet werden: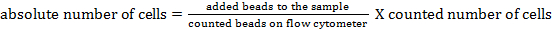
- Durchflusszytometrische Analyse
HINWEIS: Die Durchflusszytometrie sollte sofort nach Beendigung des Färbeprotokolls durchgeführt werden. Es muss ein Durchflusszytometer mit entsprechenden Lasern und Filtern zur Signalerkennung verwendet werden. Tabelle 3 gibt einen Überblick über die Laser und Filter, die für die in diesem Manuskript beschriebene Studie benötigt werden. Für weitere Informationen zur Durchflusszytometrieanalyse siehe Adan et al. 18- Richten Sie die Primärtore auf der Vorwärts- und Seitenstreuung ein, ohne Schutt und Dubletts (siehe Abbildung 1 ).
- Stellen Sie die Spannung und die Kompensation für die spektrale Überlappung mit Hilfe der einzelligen Zellen und Perlen ein.
HINWEIS: Diese Einstellungen sind für jeden Durchflusszytometer unterschiedlich und müssen vor jedem Experiment überprüft werden. Foder korrekte Flussanalyse, die Vorwärts- und Seitenstreuspannungen sind kritisch. Eine korrekte Vorwärts- und Seitenstreuung kann bei der Identifikation und Bestätigung der Identität der untersuchten Zellen helfen. Um diese Spannungen eine ungefärbte Probe bestimmen sollte zuerst ausgeführt werden. - Aufgebaut Fluoreszenz Gatter für das Oberflächenantigen (siehe Abbildung 1) und analysieren , um die Proben.
| Lasertyp | Filteraufbau | |
| 505 LP | 525/50 | |
| Blau (488 nm) | 550 LP | 575/26 |
| 100 mW | 670 LP | 685/35 |
| 750 LP | 780/60 | |
| Violett 405 nm | 450/50 | |
| 100 mW | ||
| Rot 633 nm | 660/20 | |
| 70 mW | 750 LP | 780/60 |
Tabelle 3: Übersicht über den Laser und Filter des Durchflusszytometer in dieser Studie verwendet.
Ergebnisse
BAL mit 3 × 1 ml gepufferter Salzlösung, ein Volumen zwischen 2 und 3 ml Nach der Durchführung soll gestellt werden. Die BAL-Flüssigkeit kann weiter analysiert werden, die zelluläre und nichtzelluläre Gehalt zu charakterisieren. Um die Anwesenheit von Cytokinen und Chemokinen zu untersuchen, ELISA 19, Immunoblot 20, und die gleichzeitige Analyse von mehreren Cytokinen durch eine Zytokin bead Anordnung 21 durchgeführt werden. Darüber hinaus kann das Albumin und Gesamtproteingehalt dieses Fluids 22 bestimmt werden.
Als Beispiel beschreibt dieses Manuskript wie das zelluläre Gehalt der BAL-Flüssigkeit mittels Durchflusszytometrie analysiert. 24 Stunden nach der sie intratracheal mit Lipopolysaccharid eingeflößt wurden: Die analysierte BAL-Flüssigkeit wurde von den weiblichen Balb / cAnNCrl Mäusen (7 Wochen alt) gesammelt. Die folgenden Antikörper, gekoppelt an ein Fluorophor, were verwendet , um die verschiedenen Zelltypen zu identifizieren: CD11c, SiglecF, MHCII, CD3e, CD19, Ly6g und CD11b (siehe Tabelle 1 und die Tabelle der Materialien). Der fixierbar Lebensfähigkeit Farbstoff wurde ebenfalls verwendet. Durch die Verwendung einer Gating - Strategie auf der Grundlage der differenziellen Expression von Antigenen auf den Oberflächen der verschiedenen Zellpopulationen (Abbildung 1), war es möglich , Makrophagen, dendritische Zellen, B - Zellen, T - Zellen, Neutrophilen, Eosinophilen und zu identifizieren.
Erstens, Schutt und Dubletten wurden gated basierend auf Vorwärts- und Seitenstreuparameter. Eine Lebensfähigkeit Farbstoff Gating auf den lebenden Zellen erleichtert. Als nächstes wurden CD11c hoch Zellen und CD11c niedrig Zellen identifiziert. In den CD11c hohen Bevölkerungs wurden identifiziert Makrophagen und dendritischen Zellen basierten auf MHCII und SiglecF Ausdruck ist. In der CD11c niedrig Population, T-Zellen und B-Zellen wurden auf Basis von CD3 & egr; und CD19 Expression identifiziert ist. in the verbleibenden Zellpopulation wurden Neutrophile und Eosinophile, basierend auf der CD11b und Ly-6G Markerexpression identifiziert sind.
Zählen Perlen wurden hinzugefügt , um die absoluten Zellzahl der verschiedenen Zellpopulationen zu bestimmen , indem das Verhältnis von bead Ereignissen Ereignisse Zelle 23 verglichen wird . Diese Zählung Perlen wurden basierend auf ihrer Vorwärts- und Seitenstreueigenschaften (Abbildung 1) identifiziert. Tabelle 4 gibt einen Überblick über die absoluten Zellzahl der verschiedenen Zellpopulationen in der BAL - Flüssigkeit eines naiven Maus und eine Maus , die für 24 h mit 5 ug Lipopolysaccharid stimuliert wurde.
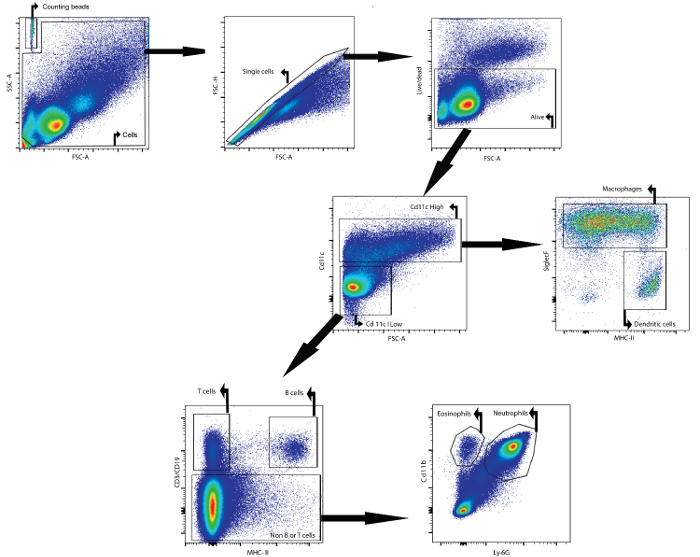
Abbildung 1: Gating - Strategie für den durchflusszytometrischen Nachweis von Makrophagen, dendritische Zellen, T - Zellen, B - Zellen, Neutrophile und Eosinophile iN BAL Flüssigkeit. BAL-Zellen wurden unter Verwendung des beschriebenen BAL-Protokolls isoliert. Die Zellen wurden von Mäusen 24 h nach intratrachealer Instillation von Lipopolysaccharid isoliert. Zählen von Perlen und Zellen wurden auf der Grundlage von Vorwärts- und Seitenstreuungseigenschaften identifiziert. Im Zelltor wurden einzelne Zellen mit Vorwärts- und Seitenstreuung identifiziert. In dieser letzten Population wurden Zellen, die lebendig waren, identifiziert. CD11c hohe Zellen und CD11c niedrige Zellen wurden dann identifiziert. In der CD11c-Hochpopulation wurden Makrophagen und dendritische Zellen auf der Basis von MHCII- bzw. SiglecF-Expression identifiziert. In der CD11c-niedrigen Population wurden T-Zellen und B-Zellen auf der Grundlage der CD3- bzw. CD19-Expression identifiziert. In der verbleibenden Zellpopulation wurden Neutrophile und Eosinophile auf der Basis von CD11b bzw. Ly-6G-Expression identifiziert. Bitte klicken Sie hier um eineGrößere Version dieser Figur.
| Zellpopulation | Absolute Anzahl von Zellen in naiven Mäusen | Absolute Anzahl von Zellen in LPS stimulierten Mäusen |
| Makrophagen | 79,612 | 25,439 |
| dendritische Zellen | 495 | 671 |
| T-Zellen | 45,271 | 28,089 |
| B-Zellen | 4,164 | 2,926 |
| Neutrophilen | 632 | 566,716 |
| Eosinophilen | 3,483 | 4,332 |
Tabelle 4: RepräsentationenTative Ergebnisse der Durchflusszytometrie-Analyse an der BAL-Flüssigkeit von Naiven und LPS-stimulierten Mäusen.
Diskussion
BAL ist eine nützliche Technik, um zytologische und biochemische Informationen als Reaktion auf Infektionen oder Medikamente zu erhalten. Zunächst wurde BAL verwendet, um die übermäßige Schleimproduktion bei Patienten mit Phosgen-Toxizität zu bewältigen 3 . Heutzutage wird die Technik bei Menschen verwendet, um die Lungenpathogenese, die Diagnose und die therapeutische Behandlung von Krankheiten zu untersuchen 3 , 24 . In Labortieren wird BAL häufig verwendet, um entzündliche Reaktionen, Immunmechanismen und Infektionskrankheiten, die in den pulmonalen Atemwegen 1 , 2 auftreten, zu überwachen.
Um das entzündliche Zellmuster bei Atemwegserkrankungsmodellen zu untersuchen, sollte dem BAL eine absolute und differenzielle Zellzählung folgen. Neben der absoluten Zellzahl sind auch die relativen Zellzahlen von Interesse. Zum Beispiel zeigen Reparatur- und Krebsmodelle vEry kleine bis gar keine BAL-Zellzahl erhöht. In diesem Modell ist die Beurteilung der zellulären Zusammensetzung nützlich. Durch die Verwendung von Zellfärbung mit Lichtmikroskopie kombiniert, verschiedene Zelltypen, wie Eosinophile, Neutrophile, Makrophagen und Lymphozyten, können basierend auf der Morphologie 25, 26, 27, 28, 29, 30 identifiziert werden. Durchflusszytometrie kann für spezifische Beurteilungen verwendet werden, wie beispielsweise verschiedene T-Zell - Phänotypen zu identifizieren , 7, 31. Neben der Identifizierung der verschiedenen infiltrierenden Zellpopulationen kann die nicht-zelluläre Zusammensetzung in der Lunge untersucht wird BAL verwendet. Verfahren, wie ELISA, Immunoblot, Zytokin-bead array, Immunhistochemie und quantitative Polymerase-Kettenreaktion werden auf BAL-Flüssigkeit durchgeführt, Cytokine, Wachstum um zu bestimmen,Faktoren und anderen entzündlichen Komponenten. Zur Bestimmung der Lungenschädigung können auch die Gesamtprotein- und Laktatdehydrogenase-Werte im BAL-Fluid gemessen werden 32 , 33 .
Mit der Entwicklung neuer Diagnosewerkzeuge wird die genomische und proteomische Charakterisierung von BAL-Komponenten in naher Zukunft möglich sein. Die Kombination von erweiterten Berechnungsfähigkeiten und Hochdurchsatz-Genexpressionstechnologien ermöglicht es, spezifische Genexpressionsprofile für verschiedene Krankheitszustände zu definieren. Die Durchführung dieser Techniken auf BAL-Flüssigkeit kann Gen- und Protein-Expressionsmuster liefern, um die wichtigen Moleküle zu identifizieren, die an den verschiedenen Phasen der Lungenerkrankungen beteiligt sind.
Die Hauptbeschränkung der Daten aus BAL-Flüssigkeit ist die mangelnde Vergleichbarkeit zwischen verschiedenen Forschungsversuchen 3 , 9 . Es gibt ein hohes Maß anVariabilität in der Lavagetechnik und die anschließende Verarbeitung von BAL-Flüssigkeit. Um jede BAL-Studie vergleichen zu können, ist es notwendig, die Art der eingesparten Spülflüssigkeit, die Instillationsstätte und die Fraktion, die für die zelluläre und nicht-zelluläre Zusammensetzung analysiert werden soll, zu standardisieren. Es gibt signifikante Unterschiede in der Anzahl der Spaltfraktionen zwischen verschiedenen Studien, die von einem bis 14 mal 34 , 35 , 36 variieren. Dieser Unterschied kann einen Einfluss auf die geschätzten Gesamtzellzahlen in den Lungen haben. Es ist wichtig zu wissen, welche BAL-Fluidfraktion die Mehrheit der Zellen enthält. Song et al. Zeigte, dass etwa 70% der Gesamtzahl der Zellen in Fraktion eins bis drei 22 abgerufen wurden. Jedoch schlugen andere Berichte vor, dass die zweite Lavage mehr Zellen enthielt als die erste 37 , 38 . Wir können aus diesen Studien kommen zum Schluss, dass eine Spülung mit nur einem Bruchteil nicht die ganze Lunge darstellen wird, was zu einer Fehlinterpretation der Ergebnisse.
Die nichtzelluläre Zusammensetzung der BAL - Flüssigkeit enthält wertvolle Informationen über den Gesundheitszustand der Lunge 33, 39, 40. Variationen in der Verdünnung der BAL-Flüssigkeit tragen zu der Differenz in der Quantifizierung der löslichen Fraktion und folglich auf den Unterschiede in den Ergebnissen zwischen den Versuchen. Song et al. verglichen, um das Protein und Lactatdehydrogenase Ebene jeder Fraktion Lavage und folgerte, dass die Fraktion erste lavage zwei- bis dreimal mehr als die zweite Fraktion enthielt.
Um eine repräsentative BAL Probe zur Analyse abgerufen werden, sind einige technische Überlegungen von entscheidender Bedeutung. Einer von ihnen ist die richtige anesthetization auszuführen. Es ist sehr wichtig, den Fuß ref zu überprüfenLex der Maus, um die endgültige Sedierung zu gewährleisten. Dies ist nicht nur aus ethischen Gründen wichtig, sondern auch, weil es schwierig ist, den Katheter in der richtigen Position zu platzieren und zu halten, wenn die Maus nicht richtig betäubt wird.
Eine zweite wichtige technische Betrachtung ist die Position des Katheters in der Trachea. Wenn der Katheter zu tief eingelegt ist, kann er die Lungenstruktur beschädigen. Das distale Ende des Katheters sollte während des BAL-Verfahrens nicht in die Lunge gelangen. Der Katheter sollte auch mit einem Baumwollfaden stabilisiert und abgebunden werden. Wenn der Katheter nicht stabilisiert ist, kann die eingespritzte Kochsalzlösung nach oben in die Nasenhöhle fließen, anstatt in die Lunge zu gelangen. Während der Injektion und Absaugung der Kochsalzlösung ist es wichtig, den Katheter stabil zu halten.
Die aus der BAL-Flüssigkeit gewonnenen Daten müssen die gesamte murine Lunge darstellen. Daher ist es wichtig, ein ausreichendes Volumen an Kochsalzlösung Puffer ( dh3 ml, aufgeteilt in 3 Aliquots von jeweils 1 ml). Es gibt keine lineare Beziehung zwischen der Zellausbeute und der BAL-Fluidausbeute. Es ist wichtig, die Lösung sanft zu sammeln, während man den Thorax der Maus massiert. Wenn Scherkräfte zu stark sind, können die Lebensfähigkeit, die Funktion und die Struktur der Zellen innerhalb der Atemwege und der BAL-Flüssigkeit beeinträchtigt werden. Wenn die angesaugte Flüssigkeit in der Spritze nicht sichtbar ist, bewegen Sie den Katheter vorsichtig oder tiefer in die Luftröhre.
Besondere Hinweise auf spezifische Aspekte der BAL-Verarbeitung und -Analyse. Dadurch werden die von BAL-Samples erhaltenen Informationen maximiert. Nach BAL sind die Zellen in einem nährstoffarmen salzhaltigen Medium. Es ist daher sehr wichtig, die Proben innerhalb von 1 h nach der BAL-Probenahme zu verarbeiten. Wenn eine verlängerte Lagerung erforderlich ist, ist die Verwendung eines Nährstoff-ergänzten Mediums erforderlich.
Um die Lebensfähigkeit der Zellen zu bewahren, vermeiden Sie Röhrchen, die die Zelladhäsion an der Oberfläche fördern. Vermeiden Sie centrifugation von Zellsuspensionen bei Geschwindigkeiten, die wahrscheinlich zelluläre Integrität gefährden oder einheitliche Aufwirbelung der abgerufenen BAL-Zellen zu verhindern. BAL-Flüssigkeit enthaltenden Zellen sollten bei 400 xg und 4 ° C für 7 min zentrifugiert werden. Es ist wichtig, im Auge zu behalten, dass die Zellsuspensionen sollen bei 4 ° C während der Verarbeitung gehalten werden.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
LVH ist wissenschaftlicher Mitarbeiter am Institut für Biomedizinische Molekularbiologie der Universität Gent. ERJ wird durch UniVacFlu unterstützt, Gewährungsnummer 607690. KR wird von EC-FP7-Projekt FLUNIVAC unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Hanks' Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 14175-129 | |
| ethyleendiaminetetra acetic acid (EDTA) | Sigma-Aldrich | E6511 | irritating |
| 23 G x 1 1/4 needle | Henke Sass Wolf | 4710006030 | size: 0.60 x 30 mm |
| 26 G x 1/2 needle | Henke Sass Wolf | 4710004512 | size: 0.45 x 12 mm |
| plastic tubing | BD medical technology | 427411 | Polyethylene Tubing, I.D. 0.58 mm (0.023") O.D. 0.965 mm (0.38") 30.5 m (100') |
| sodium pentobarbital | Kela NV | 514 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | PBS without Ca2+ Mg2+ or phenol red; sterile filtered |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | nonpyrogenic and nontoxic |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Surgical scissors | Fine Science Tools GmbH | 91460-11 | |
| centrifuge tube 50 mL | TH.Geyer | 7696705 | Free from Rnase/Dnase/endotoxin |
| centrifuge tube 15 mL | TH.Geyer | 7696702 | Free from Rnase/Dnase/endotoxin |
| microcentrifuge tube 1.5 mL | Sigma-Aldrich | 0030 120.094 | polypropylene |
| Microcentrifuge | Sigma-Aldrich | 5415R | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| Ammonium-Chloride-Potassium (ACK) lysing buffer | Lonza | 10-548E | sterile-filtered |
| live/dead - efluor 506 | ebioscience | 65-0866-18 | fixable viability dye |
| CD11c-PE-cy7 | eBiosciences | 25-0114-81 | |
| SiglecF-PE | BD Pharmingen | 552126 | |
| MHCII-APCefluor780 | Biolegend | 107628 | |
| CD3-PE-cy5 | VWR | 55-0031-U100 | |
| CD19-PE-cy5 | eBiosciences | 15-0193-83 | |
| CD11b-V450 | BD Pharmingen | 560455 | |
| Ly6G-AF700 | Biolegend | 127621 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| anti-CD16/CD32 | BD Pharmingen | 553142 | |
| 96-well 340 µl storage plate plate | Falcon | 353263 | V-bottom, natural polypropylene |
| flow cytometer | BD Biosciences | ||
| catheter | BD Biosciences | 393202 |
Referenzen
- Stankunas, K., et al. Conditional protein alleles using knockin mice and a chemical inducer of dimerization. Mol Cell. 12 (6), 1615-1624 (2003).
- Hunninghake, G. W., Gadek, J. E., Kawanami, O., Ferrans, V. J., Crystal, R. G. Inflammatory and immune processes in the human lung in health and disease: evaluation by bronchoalveolar lavage. Am J Pathol. 97 (1), 149-206 (1979).
- Gee, J. B., Fick, R. B. Bronchoalveolar lavage. Thorax. 35 (1), 1-8 (1980).
- Tornling, G., et al. Hyaluronic acid in bronchoalveolar lavage in rats exposed to quartz. Br J Ind Med. 44 (7), 443-445 (1987).
- Henderson, R. F. Use of bronchoalveolar lavage to detect respiratory tract toxicity of inhaled material. Exp Toxicol Pathol. 57, 155-159 (2005).
- Morris, A., et al. Longitudinal analysis of the lung microbiota of cynomolgous macaques during long-term SHIV infection. Microbiome. 4 (1), 38 (2016).
- Naessens, T., et al. GM-CSF treatment prevents respiratory syncytial virus-induced pulmonary exacerbation responses in postallergic mice by stimulating alveolar macrophage maturation. J Allergy Clin Immunol. 137 (3), 700-709 (2016).
- Chockalingam, A., Duraiswamy, R., Jagadeesan, M. Bronchoalveolar lavage cellular analyses in conjunction with high-resolution computed tomography imaging as a diagnostic intervention for patients with suspected interstitial lung disease. Lung India. 33 (3), 287-291 (2016).
- Crystal, R. G., Reynolds, H. Y., Kalica, A. R. Bronchoalveolar lavage. The report of an international conference. Chest. 90 (1), 122-131 (1986).
- Baughman, R. P. The uncertainties of bronchoalveolar lavage. Eur Respir J. 10 (9), 1940-1942 (1997).
- Singletary, M. L., et al. Modification of a common BAL technique to enhance sample diagnostic value. J Am Assoc Lab Anim Sci. 47 (5), 47-51 (2008).
- Angus, D. W., Baker, J. A., Mason, R., Martin, I. J. The potential influence of CO2, as an agent for euthanasia, on the pharmacokinetics of basic compounds in rodents. Drug Metab Dispos. 36 (2), 375-379 (2008).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. J Vis Exp. (97), (2015).
- Rubio-Navarro, A., et al. Phenotypic Characterization of Macrophages from Rat Kidney by Flow Cytometry. J Vis Exp. (116), (2016).
- Butcher, M. J., Herre, M., Ley, K., Galkina, E. Flow cytometry analysis of immune cells within murine aortas. J Vis Exp. (53), (2011).
- Noto, A., Ngauv, P., Trautmann, L. Cell-based flow cytometry assay to measure cytotoxic activity. J Vis Exp. (82), e51105 (2013).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Database, J. S. E. The ELISA method. J Vis Exp. , (2016).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Wunderlich, M. L., Dodge, M. E., Dhawan, R. K., Shek, W. R. Multiplexed fluorometric immunoassay testing methodology and troubleshooting. J Vis Exp. (58), (2011).
- Song, J. A., et al. Standardization of bronchoalveolar lavage method based on suction frequency number and lavage fraction number using rats. Toxicol Res. 26 (3), 203-208 (2010).
- Seliger, C., et al. A rapid high-precision flow cytometry based technique for total white blood cell counting in chickens. Vet Immunol Immunopathol. 145 (1-2), 86-99 (2012).
- Daniele, R. P., Elias, J. A., Epstein, P. E., Rossman, M. D. Bronchoalveolar lavage: role in the pathogenesis, diagnosis, and management of interstitial lung disease. Ann Intern Med. 102 (1), 93-108 (1985).
- Delayre-Orthez, C., Becker, J., de Blay, F., Frossard, N., Pons, F. Exposure to endotoxins during sensitization prevents further endotoxin-induced exacerbation of airway inflammation in a mouse model of allergic asthma. Int Arch Allergy Immunol. 138 (4), 298-304 (2005).
- Delayre-Orthez, C., et al. PPARalpha downregulates airway inflammation induced by lipopolysaccharide in the mouse. Respir Res. 6, 91 (2005).
- Delayre-Orthez, C., de Blay, F., Frossard, N., Pons, F. Dose-dependent effects of endotoxins on allergen sensitization and challenge in the mouse. Clin Exp Allergy. 34 (11), 1789-1795 (2004).
- Hachet-Haas, M., et al. Small neutralizing molecules to inhibit actions of the chemokine CXCL12. J Biol Chem. 283 (34), 23189-23199 (2008).
- Ble, F. X., et al. Activation of the lung S1P(1) receptor reduces allergen-induced plasma leakage in mice. Br J Pharmacol. 158 (5), 1295-1301 (2009).
- Ble, F. X., et al. Allergen-induced lung inflammation in actively sensitized mice assessed with MR imaging. Radiology. 248 (3), 834-843 (2008).
- Reber, L. L., et al. A dissociated glucocorticoid receptor modulator reduces airway hyperresponsiveness and inflammation in a mouse model of asthma. J Immunol. 188 (7), 3478-3487 (2012).
- Drent, M., Cobben, N. A., Henderson, R. F., Wouters, E. F., van Dieijen-Visser, M. Usefulness of lactate dehydrogenase and its isoenzymes as indicators of lung damage or inflammation. Eur Respir J. 9 (8), 1736-1742 (1996).
- Henderson, R. F. Use of bronchoalveolar lavage to detect lung damage. Environ Health Perspect. 56, 115-129 (1984).
- Forget, G., et al. An adherent cell perifusion technique to study the overall and sequential response of rat alveolar macrophages to toxic substances. Environ Health Perspect. 51, 131-140 (1983).
- Sung, J. H., et al. Recovery from welding-fume-exposure-induced lung fibrosis and pulmonary function changes in sprague dawley rats. Toxicol Sci. 82 (2), 608-613 (2004).
- Majetschak, M., Sorell, L. T., Patricelli, T., Seitz, D. H., Knoferl, M. W. Detection and possible role of proteasomes in the bronchoalveolar space of the injured lung. Physiol Res. 58 (3), 363-372 (2009).
- Rehn, B., Bruch, J., Zou, T., Hobusch, G. Recovery of rat alveolar macrophages by bronchoalveolar lavage under normal and activated conditions. Environ Health Perspect. 97, 11-16 (1992).
- Kelly, C. A., Ward, C., Stenton, S. C., Hendrick, D. J., Walters, E. H. Assessment of pulmonary macrophage and neutrophil function in sequential bronchoalveolar lavage aspirates in sarcoidosis. Thorax. 43 (10), 787-791 (1988).
- Eklund, A., Tornling, G., Blaschke, E., Curstedt, T. Extracellular matrix components in bronchoalveolar lavage fluid in quartz exposed rats. Br J Ind Med. 48 (11), 776-782 (1991).
- Olsen, G. N., Harris, J. O., Castle, J. R., Waldman, R. H., Karmgard, H. J. Alpha-1-antitrypsin content in the serum, alveolar macrophages, and alveolar lavage fluid of smoking and nonsmoking normal subjects. J Clin Invest. 55 (2), 427-430 (1975).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten