Method Article
Lavagem Broncoalveolar de Pulmões Murinos para Analisar a Infiltração de Células Inflamatórias
Neste Artigo
Resumo
O estado de saúde do pulmão é refletido pelo tipo e número de células imunes que estão presentes nos bronquíolos do pulmão. Descrevemos uma técnica de lavagem broncoalveolar que permite o isolamento e estudo de células não aderentes e fatores solúveis do trato respiratório inferior de camundongos.
Resumo
Lavagem Broncoalveolar (BAL) é um procedimento experimental que é usada para examinar o conteúdo celular e acelular do lúmen dos pulmões ex vivo para ter uma visão do estado de doença em curso.
Aqui, um método simples e eficiente é descrito para executar BAL em pulmões de murino sem a necessidade de ferramentas ou equipamentos especiais. fluido BAL é isolado por meio de inserção de um cateter na traqueia de ratos anestesiados terminalmente, por meio do qual uma solução salina é instilada nos bronquíolos. O fluido instilado é suavemente retraído para maximizar a recuperação de fluido BAL e para minimizar as forças de cisalhamento. Esta técnica permite a viabilidade, a função e estrutura de células dentro das vias aéreas e LBA a ser preservada.
Inúmeras técnicas podem ser aplicadas a ganhar mais compreensão do estado de doença do pulmão. Aqui, uma técnica vulgarmente utilizada para a identificação e contagem de diferentes tipos de células imunitárias éDescrito, em que a citometria de fluxo é combinada com um painel seleccionado de marcadores marcados fluorescentemente com uma superfície celular específica. O procedimento BAL aqui apresentado também pode ser utilizado para analisar agentes infecciosos, constituintes fluidos ou partículas inaladas dentro de pulmões murinos.
Introdução
As vias aéreas encontram inúmeros insultos, que podem levar a inflamação, invasão de patógenos ou transformação maligna. As células epiteliais que revestem o lúmen pulmonar formam uma das principais barreiras do corpo de mamíferos. Juntamente com os macrófagos alveolares, eles impedem que as ameaças ambientais ganhem entrada no sistema sistêmico através das vias aéreas. Exemplos de tais ameaças incluem produtos químicos orgânicos e inorgânicos, bactérias e vírus. Do mesmo modo, imunizações específicas ou intervenções terapêuticas podem ser concebidas para atingir os pulmões. Em todos estes casos, uma análise elaborada da resposta evocada é importante para compreender, intervir ou evitar processos biológicos que ocorrem dentro do sistema respiratório.
O lavado broncoalveolar (BAL) é um método inestimável para analisar tais respostas, pois as amostras resultantes contêm informações importantes sobre as respostas inflamatórias, mecanismos imunológicos e progressão da doença infecciosaque podem ocorrer nas vias aéreas pulmonares 1, 2. Usando BAL, é possível estudar as células infiltrantes. Isto contrasta com os pulmões digerida, que dão uma população de células "mais sujo", com muitas células mortas e pegajosas. BAL é realizada através da introdução de uma solução salina nos bronquíolos terminais e, posteriormente, recuperar esta solução. A solução obtida pode em seguida ser utilizada para quantificar e fenotipicamente analisar pulmão residentes e células inflamatórias infiltrantes. Este método é frequentemente aplicado para estudar influxo celular em modelos de doenças das vias respiratórias, tais como asma, doença pulmonar obstrutiva crónica (DPOC), e modelos de doenças infecciosas. Para além da composição celular, a composição molecular das vias aéreas pulmonares reflecte-se também no fluido BAL. Para analisar esta,-ensaio de imunoabsorção enzimática (ELISA), imunotransferência, e a análise simultânea de múltiplos citocinas por uma variedade de citoquinas pode ser grânuloRealizado para avaliar a presença de citocinas e quimiocinas.
O BAL é um método bem estabelecido para estudar o influxo de células inflamatórias em modelos animais de doenças respiratórias inflamatórias. A observação de um influxo celular alterado ( por exemplo, níveis aumentados de linfócitos, eosinófilos ou neutrófilos) pode levar a uma melhor compreensão da doença e pode ser um parâmetro objetivo para avaliar o desempenho de uma intervenção terapêutica.
A interpretação precisa e reprodutível da análise celular BAL requer que o BAL seja realizado correctamente e que o fluido recolhido seja manuseado e processado adequadamente. O termo "lavagem brônquica" foi introduzido há mais de oitenta anos por Stitt 3 . Em 1961, Myrvik obteve macrófagos alveolares do fluido de lavagem de pulmões de coelho 3 . BAL é agora um método comumente usado para analisar e monitorar os pulmões no modelo de rato,Ainda não há relato de um procedimento BAL padronizado na literatura científica 4 , 5 . Além disso, há provavelmente tantas maneiras de executar BAL quanto há laboratórios de pesquisa usando a técnica 3 , 6 , 7 , 8 , 9 , 10 , 11 . É importante que os dados obtidos a partir do BAL representem todo o pulmão murino e não apenas uma parte do pulmão. Este tipo de variabilidade complica a interpretação e comparação de resultados entre os diferentes ensaios.
Aqui, descreve-se um procedimento BAL básico, barato e reprodutível que permite a recolha da fracção celular e solúvel presente no lúmen das vias respiratórias do rato. Em resumo, um cateter é colocado na traquéia expostafa rato terminal anestesiado. Uma seringa é ligado ao cateter, e uma solução salina tamponada contendo ácido etilenodiaminotetracético (EDTA) é introduzido nos pulmões. O lúmen dos pulmões é amostrado por lavagem repetida suave da solução salina utilizando o êmbolo. A pressão negativa aplicada durante este passo é mínimo para impedir o colapso das vias aéreas. Após a colheita, a BAL obtido deve ser processado ainda mais para enumerar e identificar as células por citometria de fluxo.
Protocolo
Todos os experimentos com animais descritos neste estudo foram realizados de acordo com o (lei belga 14/08/1986 e 22/12/2003, belga Real Decreto 06/04/2010) nacional e legislação europeia (directivas da UE 2010/63 / UE e 86 / 609 / CEE). Todos os experimentos com camundongos e todos os protocolos animais foram aprovados pelo comitê de ética da Universidade de Ghent (números de licenças LA1400091 e EC2016-027).
1. Preparação
- lavado
- Prepara-se uma solução de sal equilibrada com 100 uM ácido etilenodiaminotetracético (EDTA).
NOTA: Para medir os neis de protea no fluido BAL, recomenda-se adicionar inibidores de protease para prevenir a actividade da protease no fluido BAL.
- Prepara-se uma solução de sal equilibrada com 100 uM ácido etilenodiaminotetracético (EDTA).
- Cateter
- Adicione um cateter através da inserção de uma agulha de 23 G em polietileno de plástico transparente 21 de tubagem L (diâmetro interno de 0,58 mm, diâmetro exterior: 0,965 milímetros, e comprimento: 0.5 cm). cateteres pré-fabricados também pode ser usado.
- AnesthEtics
- Preparar um anestésico terminal, preferencialmente um que cause parada respiratória ( por exemplo, um barbitúrico como solução de pentobarbital de sódio (> 100 mg / kg) em solução salina tamponada com fosfato (PBS)).
NOTA: Recomenda-se a utilização de anestesia injectada em vez de anestesia inalatória, uma vez que a anestesia inalatória pode ter uma influência no conteúdo de fluido BAL. CO 2 , por exemplo, tem uma influência sobre o pH do sangue e consequentemente sobre a redistribuição de diferentes compostos 12 .
- Preparar um anestésico terminal, preferencialmente um que cause parada respiratória ( por exemplo, um barbitúrico como solução de pentobarbital de sódio (> 100 mg / kg) em solução salina tamponada com fosfato (PBS)).
- Tampão de lise de glóbulos vermelhos de amónio-cloreto-potássio (ACK)
- Preparar um tampão de lise de ACK dissolvendo 8,29 g de NH4Cl e 1 g de KHCO3 em 1 L de H2O com 100 μM de EDTA; Tampão de lise de células vermelhas do sangue também pode ser adquirido a partir de uma fonte externa.
2. Realizando a Lavagem Broncoalveolar (BAL)
- Introdução do cateter na traquéia
- Eutanásia do rato através de injecção intraperitoneal de uma dose letal de anestésico um barbiturato de curta duração, utilizando uma agulha 26 G. Para confirmar anesthetization letal adequada, aperte a pata traseira do rato com uma pinça para verificar a pé reflexo.
- Colocar o animal em suas costas em uma placa cirúrgica e corrigir o mouse, fixando-se nos membros.
- Spray de etanol a 70% sobre o pescoço para desinfectar. Faça uma incisão na pele do pescoço, perto da traquéia usando um bisturi.
- Abra a pele para expor as glândulas salivares. Separaram-se as glândulas salivares usando pinças para expor o músculo esterno. Inciso o músculo ao redor da traquéia usando pinças para expor a traquéia.
- Coloque um fio de algodão sob a traquéia usando pinças.
- Cuidadosamente perfurar a meio da traqueia exposta entre dois anéis de cartilagem com uma agulha 26 G. Tome cuidado para não danificar a traqueia mais longe.
- Inserir o cateter de cerca de 0,5 cm para dentro da traqueia. Certifique-se de que o catheTer não é inserido demasiado longe para baixo para dentro da traqueia, tal como isto pode conduzir a danos da estrutura do pulmão.
- Estabilizar o cateter amarrando a traqueia ao redor do cateter através do fio de algodão colocados no passo 2.1.5. Se o cateter não está ligada suficientemente, a solução salina equilibrada injectado pode fluir para a parte superior do tracto respiratório em vez de para baixo para dentro dos pulmões.
- Recolhe-se o fluido de lavagem
- Carregar uma seringa de 1 mL com 1 mL de solução salina equilibrada estéril com 100 ^ M de EDTA.
- Conectar a seringa de 1 mL para o cateter e suavemente injectar a solução de sal / EDTA para o pulmão.
- Aspirar a solução suavemente enquanto massageia o tórax do mouse. Se o fluido aspirado não é visível na seringa, cuidadosamente inserir o cateter um pouco mais para baixo ou para cima da traqueia.
- Remover a seringa da agulha e transferir o fluido de lavagem recuperado para um tubo de 15 ml colocados em gelo. Normalmente, 700-900 &# 181; L de BAL é recuperado a partir de 1 mL de solução injectada.
- Repita os passos 2.2.1 - 2.2.4 duas vezes mais.
NOTA: Se o objetivo é analisar o conteúdo não-celular, recomenda-se concentrar as amostras agrupadas quando houver problemas com sensibilidade.
3. Coleta dos Componentes Celulares e Não-Celulares do Líquido BAL
- Centrifugar o fluido de lavagem durante 7 min a 400 xg e 4 ° C.
- Recolher o sobrenadante e utilizá-lo imediatamente para análises adicionais ( por exemplo, ELISA) ou congelar a -80 ° C. Mantenha o sedimento celular para analisar o influxo celular nos pulmões.
- Ressuspender o sedimento celular em 200 μL de tampão de lise de ACK.
NOTA: Esta etapa garante a lise dos eritrócitos, mantendo os glóbulos brancos intactos. - Incubar durante 2 min à RT.
NOTA: Para reduzir a variação causada pela lise dos eritrócitos, esta etapa não deve ser realizada por mais de 2 min. - Adicionar 1 ml de PBS frio para diluir o tampão de lise ACK.
- Centrifugar durante 7 min a 400 xg e 4 ° C. Descartar o sobrenadante e re-suspender as células num volume adequado de PBS para análise a jusante (ver abaixo).
NOTA: O volume de PBS depende do estudo a jusante que vai ser realizada.
4. Análise dos diferentes tipos de células no LBA por citometria de fluxo
NOTA: Uma possibilidade é o de analisar a composição celular absoluta e relativa do fluido BAL através da realização de citometria de fluxo. O objetivo deste trabalho é elaborar a técnica de BAL. A citometria de fluxo é uma técnica especializada por conta própria. Recomenda-se ler jornais especializados na citometria de fluxo técnica de 13, 14, 15, 16, 17. Anticorpos acoplados a um fluororo tReconhecem os antigénios de superfície (ver Tabela 1 ) específicos para um ou mais tipos de células particulares. Usando uma estratégia de gating, é possível identificar células T, macrófagos, células dendríticas, células B, eosinófilos e neutrófilos na fracção celular do BAL.
| Antígeno | Tipo de célula |
| Cluster de diferenciação 3 (CD3) | Expresso em células T |
| Cluster de diferenciação 11c (CD11c) | Alta expressão na maioria das células dendríticas, mas também em monócitos, macrófagos, neutrófilos e algumas células B. |
| Cluster de diferenciação 11b (CDllb) | Expresso na superfície de muitos leucócitos, incluindo monócitos, neutrófilos, células assassinas naturais, granulócitos e macrófagos. |
| SiglecF | UMAMacrófagos lveolares e eosinófilos. |
| MHCII | Normalmente encontrado apenas em células apresentadoras de antígenos, como células dendríticas, fagócitos mononucleares e células B. |
| CD19 | Antígeno de linfócito B |
| Ly-6G | Um marcador para monócitos, granulócitos e neutrófilos |
Tabela 1: Selec�o de antig�ios de superf�ie celular imune. Esta tabela fornece uma lista de epítopos de superfície usados para caracterizar os diferentes tipos de células. Serão necessárias combinações de vários marcadores para definir de forma fiável um tipo de célula específico.
| Amostras | ||||
| Tubo | Antígeno-fluoróforo a ser adicionado às células | Concentração de estoque de anticorpos (mg / mL) | Diluição de anticorpos | Volume total (μL) |
| Corante de viabilidade fixa | 0,2 | 1/1000 | 50 | |
| CD11c | 0,2 | 1/800 | 50 | |
| SiglecF | 0,2 | 1/100 | 50 | |
| Amostra X | MHCII | 0,2 | 1/200 | 50 |
| CD3 | 0,2 | 1/200 | 50 | |
| CD19 | 0,2 | 1/200 | 50 | |
| CD11b | 0,2 | 1/200 | 50 | |
| Ly6G | 0,2 | 1/200 | 50 | |
| Controles de tensão | ||||
| Tubo | Antígeno-fluoróforo a ser adicionado às células | Concentração de estoque de anticorpos (mg / mL) | Diluição de anticorpos | Volume total (μL) |
| Células não coradas | / | / | / | 50 |
| Células coloridas simples | Corante de viabilidade fixa | 0,2 | 1/1000 | 50 |
| Células coloridas simples | CD11c | 0,2 | 1/800 | 50 |
| Células coloridas simples | SiglecF | 0,2 | 1/100 | 50 |
| Células coloridas simples | MHCII | 0,2 | 1/200 | 50 |
| Células coloridas simples | CD3 | 0.2 | 1/200 | 50 |
| células coradas individuais | CD19 | 0,2 | 1/200 | 50 |
| células coradas individuais | CD11b | 0,2 | 1/200 | 50 |
| células coradas individuais | Ly6G | 0,2 | 1/200 | 50 |
| controles de compensação | ||||
| Tubo | Antigen-fluoróforo para ser adicionado a esferas | Concentração estoque de anticorpo (mg / ml) | diluição do anticorpo | O volume total (mL) |
| pérolas não coradas | / | / | / | 200 |
| pérolas manchadas individuais | CD11c | 0,2 | 1/2000 | 200 |
| Único, manchado, contas | SiglecF | 0,2 | 1/2000 | 200 |
| Único, manchado, contas | MHCII | 0,2 | 1/200 | 200 |
| Único, manchado, contas | CD3 | 0,2 | 1/2000 | 200 |
| Único, manchado, contas | CD19 | 0,2 | 1/2000 | 200 |
| Único, manchado, contas | CD11b | 0,2 | 1/400 | 200 |
| Único, manchado, contas | Ly6G | 0,2 | 1/200 | 200 |
Tabela 2. Lista de controles a serem incluídos. Esta tabela mostra todos os controles necessários para a interpretação correta dos resultados obtidos.
- Coloração da superfície celular
NOTA: É impoPara incluir todos os controles críticos para a análise de citometria de fluxo. São necessários três conjuntos de tubos (ver Tabela 2 ): (1) tubos contendo as amostras; (2) tubos com células BAL para cada anticorpo-fluoróforo para fazer manchas únicas; Isto permite a determinação das tensões para cada canal no citómetro de fluxo; E (3) tubos com pérolas para cada anticorpo-fluoróforo para fazer manchas únicas; Isto é para determinar a matriz de compensação.- Fazer uma mistura dos anticorpos e Fc-bloco (anti-CD16 / CD32) em PBS nas diluições apropriadas (ver Tabela 2 ). É necessário determinar a diluição de trabalho óptima para cada anticorpo antes da experiência.
- Ressuspender as células em 50 μL da mistura de anticorpos para a amostra e adicionar 50 μL do anticorpo apropriadamente diluído aos controlos críticos.
NOTA: A coloração pode ser realizada em uma placa de 96 poços em forma de "u". Isto torna possível reduzir facilmente o volume de mancha aE executar quantidades significativas de amostras. - Incubar durante 30 min no escuro a 4 ° C.
- Centrifugar durante 7 min a 400 xg e 4 ° C. Descartar o sobrenadante.
- Re-suspender as células em PBS para um volume final de 200 μL.
NOTA: Este volume final depende do volume mínimo ao qual o citómetro de fluxo pode acessar. Isso pode variar um pouco entre as máquinas. Além disso, o volume de leitura depende do número de células e / ou do tempo que a amostra demorará a correr no citómetro de fluxo. - Utilizar as amostras e os controlos para análise de citometria de fluxo.
NOTA: Para determinar o número absoluto de células das diferentes populações de células, devem ser adicionadas contas. Adicione o mesmo número de esferas (± 25.000 esferas) a cada amostra imediatamente antes da medição. Utilizando dispersão directa e lateral, as contas de contagem podem ser identificadas por citometria de fluxo (ver Figura 1 ). Subsequentemente, o número absoluto de células na amostra pode ser calculadoE de eventos de cordão para eventos de célula. A seguinte fórmula pode ser usada: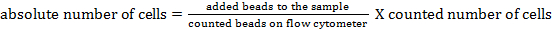
- Análise de citometria de fluxo
NOTA: A análise de citometria de fluxo deve ser feita imediatamente após a conclusão do protocolo de coloração. Deve ser utilizado um citómetro de fluxo com lasers e filtros adequados para detecção de sinal. A Tabela 3 dá uma visão geral dos lasers e filtros necessários para o estudo descrito neste manuscrito. Para obter mais informações sobre análise de citometria de fluxo, ver Adan et al. 18 .- Configure os portões primários com base na dispersão frontal e lateral, excluindo detritos e dupletos (consulte a Figura 1 ).
- Ajustar a tensão e a compensação para a sobreposição espectral com a ajuda das células e pérolas unicamente coradas.
NOTA: Estas configurações são diferentes para cada citómetro de fluxo e precisam ser verificadas antes de cada experimento. FOu análise de fluxo correto, as tensões de dispersão direta e lateral são críticas. Um correto encaminhamento lateral e lateral pode ajudar na identificação e confirmação da identidade das células analisadas. Para determinar essas tensões, uma amostra não corada deve ser executada primeiro. - Configurar portas de fluorescência para o antígeno de superfície (ver Figura 1 ) e analisar as amostras.
| Tipo de laser | Configuração do filtro | |
| 505 LP | 525/50 | |
| Azul (488 nm) | 550 LP | 575/26 |
| 100 mW | 670 LP | 685/35 |
| 750 LP | 780/60 | |
| Violeta 405 nm | 450/50 | |
| 100 mW | ||
| Vermelho 633 nm | 660/20 | |
| 70 mW | 750 LP | 780/60 |
Tabela 3: Resumo dos Láseres e Filtros do Citómetro de Fluxo utilizado neste Estudo.
Resultados
Após a realização de BAL com 3x 1 mL de solução salina tamponada, um volume entre 2 e 3 mL deve ser recuperado. Este fluido BAL pode ser analisado adicionalmente para caracterizar o conteúdo celular e não celular. Para investigar a presen� de citocinas e quimiocinas, ELISA 19 , imunotransfer�cia 20 , e a an�ise simult�ea de citoquinas m�tiplas por um conjunto de esferas de citoquinas 21 pode ser realizada. Além disso, a albumina eo conteúdo protéico total deste fluido podem ser determinados 22 .
Como exemplo, este manuscrito descreve como analisar o conteúdo celular do fluido BAL por citometria de fluxo. O fluido BAL analisado foi recolhido a partir de murganhos Balb / cAnNCrl fêmeas (idade: 7 semanas) 24 h depois de serem incutidos intratraquealmente com lipopolissacárido. Os anticorpos seguintes, acoplados a um fluoróforo, wForam utilizados para identificar os diferentes tipos de células: CD11c, SiglecF, MHCII, CD3ε, CD19, Ly6g e CDllb (ver Tabela 1 e Tabela de Materiais ). O corante de viabilidade fix�el foi tamb� utilizado. Utilizando uma estratégia de gating baseada na expressão diferencial de antigénios nas superfícies das diferentes populações celulares ( Figura 1 ), foi possível identificar macrófagos, células dendríticas, células B, células T, neutrófilos e eosinófilos.
Primeiro, os detritos e duetos foram fechados com base nos parâmetros de dispersão direta e lateral. Um corante de viabilidade facilitou o bloqueio das células vivas. Em seguida, foram identificadas células CD11c elevadas e células CD11c baixas. Na população elevada CD11c, os macrófagos e células dendríticas foram identificados com base na expressão de MHCII e SiglecF, respectivamente. Na população CD11c baixa, as células T e células B foram identificadas com base na expressão de CD3ε e CD19, respectivamente. EmA população celular restante, neutrófilos e eosinófilos foram identificados com base na expressão de marcador CD11b e Ly-6G, respectivamente.
As contas de contagem foram adicionadas para determinar o número de células absoluto das diferentes populações de células comparando a razão de eventos de cordão com os eventos de célula 23 . Estas contas de contagem foram identificadas com base nas suas propriedades de dispersão directa e lateral ( Figura 1 ). A Tabela 4 dá uma visão geral dos números de células absolutos das diferentes populações de células no fluido BAL de um rato naive e de um rato que foi estimulado durante 24 h com 5 μg de lipopolissacárido.
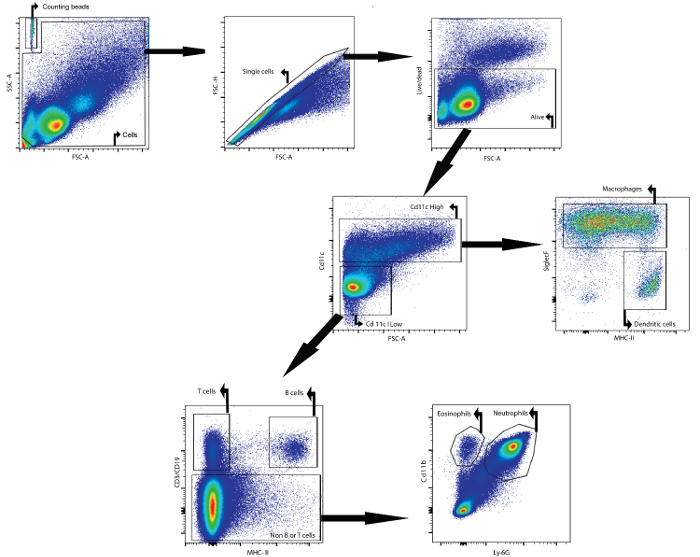
Figura 1: Estratégia de passagem para a detecção por citometria de fluxo de macrófagos, células dendríticas, células T, células B, neutrófilos e eosinófilos iFluido de BAL n. células de BAL foram isolados utilizando o protocolo descrito BAL. As células foram isoladas a partir de ratinhos 24 h após a instilação intratraqueal de lipopolissacarídeo. grânulos e contagem de células foram identificados com base em propriedades prospectivas e lado-dispersão. No portão de células, as células isoladas foram identificados utilizando dispersão frontal e lateral. Neste último população, as células que estavam vivos foram identificados. Células de alta CD11c e células de baixa CD11c foram então identificados. Na população elevada CD11c, macrófagos e células dendríticas foram identificados com base na expressão MHCII e SiglecF, respectivamente. Na população de baixa CD11c, as células T e as células B foram identificados com base na expressão CD3ε e CD19, respectivamente. Na população de células remanescente, neutrófilos e eosinófilos foram identificados com base na expressão de CD11b e Ly-6G, respectivamente. Por favor clique aqui para ver umaVersão maior desta figura.
| População celular | Número absoluto de células em ratos ingênuos | Número absoluto de células em ratos estimulados com LPS |
| Macrófagos | 79.612 | 25 439 |
| células dendríticas | 495 | 671 |
| Células T | 45.271 | 28.089 |
| Células B | 4.164 | 2.926 |
| Neutrófilos | 632 | 566.716 |
| Eosinófilos | 3.483 | 4.332 |
Tabela 4: RepresenResultados da Análise de Citometria de Fluxo sobre o Fluido BAL de Ratinhos Estimulados por Naïve e LPS.
Discussão
BAL é uma técnica útil para obter informações citológicas e bioquímicas em resposta a infecções ou drogas. Inicialmente, o BAL foi utilizado para gerenciar a produção excessiva de muco em pacientes humanos que sofrem de toxicidade por fosgênio 3 . Atualmente, a técnica é utilizada em humanos para investigar patogênese pulmonar, diagnóstico e manejo terapêutico de doenças 3 , 24 . Em animais de laboratório, o BAL é comumente usado para monitorar respostas inflamatórias, mecanismos imunológicos e processos de doenças infecciosas que ocorrem nas vias aéreas pulmonares 1 , 2 .
Para estudar o padrão celular inflamatório em modelos de doença respiratória, o BAL deve ser seguido pela contagem de células absoluta e diferencial. Além do número absoluto de células, os números de células relativos são também de interesse. Por exemplo, modelos de reparo e câncer mostram very pequeno para não BAL contagem de células aumenta. Neste modelo, a avaliação da composição celular é útil. Usando coloração de células combinada com microscopia de luz, diferentes tipos de células, tais como eosinófilos, neutrófilos, macrófagos e linfócitos, podem ser identificadas com base na morfologia 25, 26, 27, 28, 29, 30. A citometria de fluxo pode ser usado para as avaliações específicas, tal como para identificar diferentes fenótipos de células T 7, 31. Para além da identificação das diferentes populações de células de infiltração, a composição não-celular do pulmão pode ser investigado utilizando BAL. Métodos tais como ELISA, imunotransferência, matriz citocina grânulo, imuno-histoquímica, e reacção em cadeia da polimerase quantitativa são realizadas no fluido de BAL a determinar citocinas, crescimentoFatores inflamatórios e outros componentes inflamatórios. Para determinar o dano pulmonar, os níveis de proteína total e lactato desidrogenase no fluido BAL também podem ser medidos 32 , 33 .
Com o desenvolvimento de novas ferramentas de diagnóstico, a caracterização genômica e proteômica de componentes BAL será possível no futuro próximo. A combinação de capacidades computacionais em expansão e tecnologias de expressão génica de alto rendimento tornará possível definir perfis de expressão de genes específicos para vários estados de doença. A realização destas técnicas em fluidos BAL pode fornecer padrões de expressão de genes e proteínas para identificar as moléculas importantes envolvidas nas diferentes fases das doenças pulmonares.
A principal limitação dos dados obtidos a partir do fluido BAL é a falta de comparabilidade entre os diferentes ensaios de pesquisa 3 , 9 . Existe um elevado grau deVariabilidade na técnica de lavagem eo processamento subsequente do fluido BAL. Para poder comparar cada ensaio BAL, é necessário padronizar o tipo de fluido de lavagem que é instilado, o local de instilação ea fração que deve ser analisada quanto à composição celular e não celular. Existem diferenças significativas no número de fracções de lavagem entre diferentes ensaios, variando de um a 14 vezes 34 , 35 , 36 . Esta diferença pode ter um impacto no número total estimado de células nos pulmões. É importante saber qual a fração de fluido BAL contém a maioria das células. Song et ai. Mostraram que aproximadamente 70% do número total de células foram recuperadas na fração um a três 22 . No entanto, outros relatórios sugeriram que a segunda lavagem continha mais células do que a primeira 37 , 38 . Podemos concluir a partir desses estudos que uma lavagem com apenas uma fração não representa todo o pulmão, levando a má interpretação dos resultados.
A composição não-celular do fluido BAL contém informações valiosas sobre o estado de saúde do pulmão 33 , 39 , 40 . Variações na diluição do fluido BAL contribuem para a diferença na quantificação da fração solúvel e, conseqüentemente, para as diferenças nos resultados entre os ensaios. Song et ai. Comparou os níveis de proteína e lactato desidrogenase de cada fracção de lavagem e concluiu que a primeira fracção de lavagem continha duas a três vezes mais do que a segunda fracção.
Para obter uma amostra BAL representativa para análise, algumas considerações técnicas são cruciais. Um deles é realizar anestesia adequada. É muito importante verificar a referência do péLex do rato para assegurar sedação terminal. Isto não é apenas importante por razões éticas, mas também porque é difícil colocar e reter o cateter na posição correcta se o rato não for adequadamente anestesiado.
Uma segunda consideração técnica importante é a posição do cateter na traquéia. Quando o cateter é inserido muito profundo, pode danificar a estrutura pulmonar. A extremidade distal do cateter não deve atingir os pulmões durante o procedimento BAL. O cateter também deve ser estabilizado e amarrado com um fio de algodão. Se o cateter não está estabilizado, a solução salina injetada pode fluir para cima na cavidade nasal em vez de para dentro dos pulmões. Durante a injecção ea aspiração da solução salina, é importante manter o cateter estável.
Os dados obtidos a partir do fluido BAL devem representar o pulmão murino inteiro. Portanto, é importante incutir um volume adequado de tampão salino ( ie3 mL, dividido em 3 aluotas de 1 mL de cada vez). Não existe uma relação linear entre o rendimento de células e o rendimento de fluido BAL. É importante recolher a solução suavemente enquanto massageia o tórax do mouse. Se as forças de cisalhamento são demasiado forte, a viabilidade, a função e estrutura de células dentro do fluido das vias aéreas e LBA pode ser comprometida. Se o fluido aspirado não é visível na seringa, cuidadosamente mover o cateter mais profunda ou superior na traqueia.
atenção especial deve ser dada aos aspectos específicos de processamento e análise BAL. Isto vai maximizar a informação retida a partir de amostras de BAL. Depois de BAL, as células estão em um meio salino pobre em nutrientes. É, portanto, muito importante para processar as amostras dentro de 1 h após a amostragem BAL. Se o armazenamento prolongado é necessário, é necessária a utilização de um meio suplementado com nutrientes.
Para preservar a viabilidade das células, os tubos evitar que promovem a aderência das células à superfície. Evite ceNtrifugação de suspensões de células a velocidades que são susceptíveis de comprometer a integridade celular ou para evitar uma ressuspensão uniforme das células BAL recuperadas. As células que contêm fluido BAL devem ser centrifugadas a 400 xg e 4 ° C durante 7 min. É importante ter em mente que as suspensões celulares devem ser mantidas a 4 ° C durante o processamento.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
HVE é um assistente de pesquisa no Departamento de biomédica Biologia Molecular da Universidade de Ghent. ERJ é suportado por UniVacFlu, número de concessão 607690. KR é suportado pela CE-FP7 FLUNIVAC projeto.
Materiais
| Name | Company | Catalog Number | Comments |
| Hanks' Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 14175-129 | |
| ethyleendiaminetetra acetic acid (EDTA) | Sigma-Aldrich | E6511 | irritating |
| 23 G x 1 1/4 needle | Henke Sass Wolf | 4710006030 | size: 0.60 x 30 mm |
| 26 G x 1/2 needle | Henke Sass Wolf | 4710004512 | size: 0.45 x 12 mm |
| plastic tubing | BD medical technology | 427411 | Polyethylene Tubing, I.D. 0.58 mm (0.023") O.D. 0.965 mm (0.38") 30.5 m (100') |
| sodium pentobarbital | Kela NV | 514 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | PBS without Ca2+ Mg2+ or phenol red; sterile filtered |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | nonpyrogenic and nontoxic |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Surgical scissors | Fine Science Tools GmbH | 91460-11 | |
| centrifuge tube 50 mL | TH.Geyer | 7696705 | Free from Rnase/Dnase/endotoxin |
| centrifuge tube 15 mL | TH.Geyer | 7696702 | Free from Rnase/Dnase/endotoxin |
| microcentrifuge tube 1.5 mL | Sigma-Aldrich | 0030 120.094 | polypropylene |
| Microcentrifuge | Sigma-Aldrich | 5415R | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| Ammonium-Chloride-Potassium (ACK) lysing buffer | Lonza | 10-548E | sterile-filtered |
| live/dead - efluor 506 | ebioscience | 65-0866-18 | fixable viability dye |
| CD11c-PE-cy7 | eBiosciences | 25-0114-81 | |
| SiglecF-PE | BD Pharmingen | 552126 | |
| MHCII-APCefluor780 | Biolegend | 107628 | |
| CD3-PE-cy5 | VWR | 55-0031-U100 | |
| CD19-PE-cy5 | eBiosciences | 15-0193-83 | |
| CD11b-V450 | BD Pharmingen | 560455 | |
| Ly6G-AF700 | Biolegend | 127621 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| anti-CD16/CD32 | BD Pharmingen | 553142 | |
| 96-well 340 µl storage plate plate | Falcon | 353263 | V-bottom, natural polypropylene |
| flow cytometer | BD Biosciences | ||
| catheter | BD Biosciences | 393202 |
Referências
- Stankunas, K., et al. Conditional protein alleles using knockin mice and a chemical inducer of dimerization. Mol Cell. 12 (6), 1615-1624 (2003).
- Hunninghake, G. W., Gadek, J. E., Kawanami, O., Ferrans, V. J., Crystal, R. G. Inflammatory and immune processes in the human lung in health and disease: evaluation by bronchoalveolar lavage. Am J Pathol. 97 (1), 149-206 (1979).
- Gee, J. B., Fick, R. B. Bronchoalveolar lavage. Thorax. 35 (1), 1-8 (1980).
- Tornling, G., et al. Hyaluronic acid in bronchoalveolar lavage in rats exposed to quartz. Br J Ind Med. 44 (7), 443-445 (1987).
- Henderson, R. F. Use of bronchoalveolar lavage to detect respiratory tract toxicity of inhaled material. Exp Toxicol Pathol. 57, 155-159 (2005).
- Morris, A., et al. Longitudinal analysis of the lung microbiota of cynomolgous macaques during long-term SHIV infection. Microbiome. 4 (1), 38 (2016).
- Naessens, T., et al. GM-CSF treatment prevents respiratory syncytial virus-induced pulmonary exacerbation responses in postallergic mice by stimulating alveolar macrophage maturation. J Allergy Clin Immunol. 137 (3), 700-709 (2016).
- Chockalingam, A., Duraiswamy, R., Jagadeesan, M. Bronchoalveolar lavage cellular analyses in conjunction with high-resolution computed tomography imaging as a diagnostic intervention for patients with suspected interstitial lung disease. Lung India. 33 (3), 287-291 (2016).
- Crystal, R. G., Reynolds, H. Y., Kalica, A. R. Bronchoalveolar lavage. The report of an international conference. Chest. 90 (1), 122-131 (1986).
- Baughman, R. P. The uncertainties of bronchoalveolar lavage. Eur Respir J. 10 (9), 1940-1942 (1997).
- Singletary, M. L., et al. Modification of a common BAL technique to enhance sample diagnostic value. J Am Assoc Lab Anim Sci. 47 (5), 47-51 (2008).
- Angus, D. W., Baker, J. A., Mason, R., Martin, I. J. The potential influence of CO2, as an agent for euthanasia, on the pharmacokinetics of basic compounds in rodents. Drug Metab Dispos. 36 (2), 375-379 (2008).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. J Vis Exp. (97), (2015).
- Rubio-Navarro, A., et al. Phenotypic Characterization of Macrophages from Rat Kidney by Flow Cytometry. J Vis Exp. (116), (2016).
- Butcher, M. J., Herre, M., Ley, K., Galkina, E. Flow cytometry analysis of immune cells within murine aortas. J Vis Exp. (53), (2011).
- Noto, A., Ngauv, P., Trautmann, L. Cell-based flow cytometry assay to measure cytotoxic activity. J Vis Exp. (82), e51105 (2013).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Database, J. S. E. The ELISA method. J Vis Exp. , (2016).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Wunderlich, M. L., Dodge, M. E., Dhawan, R. K., Shek, W. R. Multiplexed fluorometric immunoassay testing methodology and troubleshooting. J Vis Exp. (58), (2011).
- Song, J. A., et al. Standardization of bronchoalveolar lavage method based on suction frequency number and lavage fraction number using rats. Toxicol Res. 26 (3), 203-208 (2010).
- Seliger, C., et al. A rapid high-precision flow cytometry based technique for total white blood cell counting in chickens. Vet Immunol Immunopathol. 145 (1-2), 86-99 (2012).
- Daniele, R. P., Elias, J. A., Epstein, P. E., Rossman, M. D. Bronchoalveolar lavage: role in the pathogenesis, diagnosis, and management of interstitial lung disease. Ann Intern Med. 102 (1), 93-108 (1985).
- Delayre-Orthez, C., Becker, J., de Blay, F., Frossard, N., Pons, F. Exposure to endotoxins during sensitization prevents further endotoxin-induced exacerbation of airway inflammation in a mouse model of allergic asthma. Int Arch Allergy Immunol. 138 (4), 298-304 (2005).
- Delayre-Orthez, C., et al. PPARalpha downregulates airway inflammation induced by lipopolysaccharide in the mouse. Respir Res. 6, 91 (2005).
- Delayre-Orthez, C., de Blay, F., Frossard, N., Pons, F. Dose-dependent effects of endotoxins on allergen sensitization and challenge in the mouse. Clin Exp Allergy. 34 (11), 1789-1795 (2004).
- Hachet-Haas, M., et al. Small neutralizing molecules to inhibit actions of the chemokine CXCL12. J Biol Chem. 283 (34), 23189-23199 (2008).
- Ble, F. X., et al. Activation of the lung S1P(1) receptor reduces allergen-induced plasma leakage in mice. Br J Pharmacol. 158 (5), 1295-1301 (2009).
- Ble, F. X., et al. Allergen-induced lung inflammation in actively sensitized mice assessed with MR imaging. Radiology. 248 (3), 834-843 (2008).
- Reber, L. L., et al. A dissociated glucocorticoid receptor modulator reduces airway hyperresponsiveness and inflammation in a mouse model of asthma. J Immunol. 188 (7), 3478-3487 (2012).
- Drent, M., Cobben, N. A., Henderson, R. F., Wouters, E. F., van Dieijen-Visser, M. Usefulness of lactate dehydrogenase and its isoenzymes as indicators of lung damage or inflammation. Eur Respir J. 9 (8), 1736-1742 (1996).
- Henderson, R. F. Use of bronchoalveolar lavage to detect lung damage. Environ Health Perspect. 56, 115-129 (1984).
- Forget, G., et al. An adherent cell perifusion technique to study the overall and sequential response of rat alveolar macrophages to toxic substances. Environ Health Perspect. 51, 131-140 (1983).
- Sung, J. H., et al. Recovery from welding-fume-exposure-induced lung fibrosis and pulmonary function changes in sprague dawley rats. Toxicol Sci. 82 (2), 608-613 (2004).
- Majetschak, M., Sorell, L. T., Patricelli, T., Seitz, D. H., Knoferl, M. W. Detection and possible role of proteasomes in the bronchoalveolar space of the injured lung. Physiol Res. 58 (3), 363-372 (2009).
- Rehn, B., Bruch, J., Zou, T., Hobusch, G. Recovery of rat alveolar macrophages by bronchoalveolar lavage under normal and activated conditions. Environ Health Perspect. 97, 11-16 (1992).
- Kelly, C. A., Ward, C., Stenton, S. C., Hendrick, D. J., Walters, E. H. Assessment of pulmonary macrophage and neutrophil function in sequential bronchoalveolar lavage aspirates in sarcoidosis. Thorax. 43 (10), 787-791 (1988).
- Eklund, A., Tornling, G., Blaschke, E., Curstedt, T. Extracellular matrix components in bronchoalveolar lavage fluid in quartz exposed rats. Br J Ind Med. 48 (11), 776-782 (1991).
- Olsen, G. N., Harris, J. O., Castle, J. R., Waldman, R. H., Karmgard, H. J. Alpha-1-antitrypsin content in the serum, alveolar macrophages, and alveolar lavage fluid of smoking and nonsmoking normal subjects. J Clin Invest. 55 (2), 427-430 (1975).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados