Method Article
炎症性細胞の浸潤を分析するための肺胞の気管支肺胞洗浄
要約
肺の健康状態は、肺の細気管支に存在する免疫細胞のタイプおよび数によって反映される。私たちは、気管支肺胞洗浄技術を説明し、非接着性細胞およびマウスの下気道からの可溶性因子の単離および研究を可能にする。
要約
気管支肺胞洗浄(BAL)は、進行中の病状についての洞察を得るために、 エクスビボで肺内腔の細胞および無細胞含有量を検査するために使用される実験手順である。
ここでは、特別な道具や器具を必要とせずに、マウスの肺でBALを行うための簡単で効率的な方法が記載されている。 BAL液は、最終的に麻酔したマウスの気管にカテーテルを挿入することによって単離され、そこを介して生理食塩水が細気管支に注入される。点滴した液体を静かに引っ込めて、BAL液体回収を最大にし、せん断力を最小にする。この技術は、気道内およびBAL液中の細胞の生存能力、機能および構造を保存することを可能にする。
多くの技術を適用して、肺の疾患状態をさらに理解することができる。ここで、異なるタイプの免疫細胞の同定および列挙のために一般的に使用される技術は、ここで、フローサイトメトリーは、蛍光標識された細胞表面特異的マーカーの選択パネルと組み合わされる。ここに示したBAL手順は、マウス肺内の感染因子、液体成分、または吸入された粒子の分析にも使用できます。
概要
気道には、炎症、病原体の侵入、または悪性形質転換を引き起こす可能性のある多数の傷害に遭遇する。肺内腔を覆う上皮細胞は、哺乳類の体の主要な障壁の1つを形成する。肺胞マクロファージとともに、環境脅威が気道を介して全身系に侵入するのを防ぎます。そのような脅威の例には、有機および無機の化学物質、細菌、およびウイルスが含まれる。同様に、特定の免疫化または治療的介入を、肺を標的とするように設計することができる。これらの全ての場合において、誘発された応答の精巧な分析は、呼吸器系内で起こる生物学的プロセスを理解し、介入し、または防止するために重要である。
気管支肺胞洗浄(BAL)は、そのような反応を分析するための非常に貴重な方法です。結果のサンプルには、炎症反応、免疫機構、および感染症の進行に関する重要な情報が含まれていますそれは、肺気道1,2において生じ得ます。 BALを使用することで、浸潤細胞を研究することが可能です。これは、多くの死者や粘着性の細胞を用いて、「汚れた」細胞集団を与える消化肺、とは対照的です。 BALは、終末細気管支内に生理食塩水を導入し、続いて、この溶液を回収することによって行われます。検索された溶液は、その後、定量化および表現型常駐肺および浸潤炎症細胞を分析するために使用することができます。この方法は、しばしば、喘息、慢性閉塞性肺疾患(COPD)、および感染性疾患モデルとして、気道の疾患モデルにおける細胞流入を研究するために適用されます。離れた細胞組成物から、肺気道の分子組成物は、BAL液に反映されます。これを分析するために、酵素結合免疫吸着アッセイ(ELISA)、免疫ブロット、およびサイトカインビーズアレイによって複数のサイトカインの同時分析をすることができサイトカインおよびケモカインの存在を評価するために実施した。
BALは、炎症性呼吸器疾患動物モデルにおける炎症細胞の流入を研究するための十分に確立された方法である。変化した細胞流入( 例えば、増加したレベルのリンパ球、好酸球、または好中球)の観察は、疾患へのより良い洞察をもたらし、治療介入の性能を評価するための客観的パラメータであり得る。
BAL細胞分析の正確で再現性のある解釈は、BALが正しく行われ、採取された流体が適切に処理され、処理されることを必要とする。用語「気管支洗浄」は、80年以上前にStitt 3によって導入されました。 1961年、Myrvikはウサギ肺の洗浄液から肺胞マクロファージを得た3 。 BALは現在、マウスモデルの肺を分析し監視するために一般的に使用される方法ですが、科学文献4、5で標準化されたBAL手順の報告はまだ再ではありません。さらに、おそらく技術3、6、7、8、9、10、11を用いた研究室があるようにBALを行うために多くの方法があります。 BALから得られたデータは、全体のマウスの肺を表し、肺の一部ではないことだけが重要です。変動のこの種の解釈と異なる治験間の結果の比較を複雑にします。
ここで、基本的な安価で、かつ再現BAL手順は、マウスの気道内腔に存在する細胞と可溶性画分の収集を可能にすることが記載されています。要するに、カテーテルは、露出した気管Oに配置されますfa最終麻酔したマウス。注射器をカテーテルに接続し、エチレンジアミン四酢酸(EDTA)を含有する緩衝食塩水を肺に導入する。肺内腔は、プランジャーを用いて生理食塩水を穏やかに繰り返し洗うことによってサンプリングされる。このステップ中に加えられる負圧は、気道の崩壊を防ぐために最小限である。収集後、得られたBALをさらに処理して、フローサイトメトリーによって細胞を列挙し、同定しなければならない。
プロトコル
この研究に記載されているすべての動物実験は、全国的(ベルギーの法律14/08/1986および22/12/2003、ベルギーの勅令06/04/2010)および欧州の法律(EU指令2010/63 / EUおよび86 / 609 / EEC)。マウスおよびすべての動物プロトコールに関するすべての実験は、ゲント大学の倫理委員会(許可番号LA1400091およびEC2016-027)によって承認された。
1.準備
- 洗浄液
- 100μMエチレンジアミン四酢酸(EDTA)を含む平衡塩類溶液を調製する。
注:BAL液中のタンパク質レベルを測定するには、プロテアーゼ阻害剤を添加してBAL液中のプロテアーゼ活性を防ぐことが推奨されます。
- 100μMエチレンジアミン四酢酸(EDTA)を含む平衡塩類溶液を調製する。
- カテーテル
- 透明プラスチックポリエチレン21Gチューブ(内径:0.58mm、外径:0.965mm、長さ:0.5cm)に23G針を挿入してカテーテルを作製する。プレマイドカテーテルも使用することができる。
- 麻酔エリック
- 末期麻酔薬、好ましくは呼吸停止を引き起こすもの( 例えば、リン酸緩衝化生理食塩水(PBS)中のペントバルビタールナトリウム(> 100mg / kg)溶液などのバルビツレート)を準備する。
注:吸入麻酔はBAL液量に影響を与える可能性があるため、吸入麻酔の代わりに注射麻酔を使用することをお勧めします。例えば、CO 2は、血液のpHに影響を及ぼし、結果的に異なる化合物12の再分布に影響を及ぼす。
- 末期麻酔薬、好ましくは呼吸停止を引き起こすもの( 例えば、リン酸緩衝化生理食塩水(PBS)中のペントバルビタールナトリウム(> 100mg / kg)溶液などのバルビツレート)を準備する。
- 塩化アンモニウム - カリウム(ACK)赤血球溶解緩衝液
- 100μMのEDTAを含む1LのH 2 O中に8.29gのNH 4 Clおよび1gのKHCO 3を溶解することによってACK溶解緩衝液を調製する;赤血球溶解緩衝液はまた、外部供給源から購入することもできる。
2.気管支肺胞洗浄(BAL)の実施
- 気管にカテーテルを導入する
- 致死量の短時間作用性バルビツール酸麻酔剤を26Gの針を用いて腹腔内注射することによりマウスを安楽死させる。適切な致死麻酔を確認するには、足の反射をチェックするために鉗子でマウスの後ろ足をはさみます。
- 外科用プレート上の動物をその背中に置き、四肢を固定することによってマウスを固定する。
- 滅菌するために首に70%エタノールをスプレーします。メスを使用して気管の近くの首の皮膚に切開を作る。
- 皮膚を開いて唾液腺を露出させる。ピンチャーを使って胸骨弓筋を露出させて唾液腺を分ける。気管を露出させるためにピンチャーを使用して気管の周りの筋肉を切開する。
- 気管の下に綿棒をピンチャーで置きます。
- 2本の軟骨リングの間にある露出した気管の中央を26Gの針で慎重に穿刺する。気管に損傷を与えないように注意してください。
- 気管に約0.5cmのカテーテルを挿入します。カテーテルが確実にこれは、肺の構造物の損傷につながることができますようTERは、あまりにも遠くダウン気管に挿入されていません。
- ステップ2.1.5に配置された木綿糸を用いてカテーテルの周囲に気管を結ぶことにより、カテーテルを安定させます。カテーテルが十分に結び付けられていない場合、注入された平衡塩溶液の代わりにダウン肺への気道の上部に向かって流れることができます。
- 洗浄液を収集
- 100μMEDTA滅菌平衡塩類溶液の1mLで1 mLシリンジをロードします。
- カテーテルに1mLのシリンジを接続し、穏やかに肺に塩/ EDTA溶液を注入します。
- マウスの胸部をマッサージしながら溶液を穏やかに吸引します。吸引液を注射器に表示されていない場合は、慎重にさらに少しダウンしているか、気管までカテーテルを挿入します。
- 針から注射器を除去し、氷上に置いた15 mLチューブに回収洗浄液を移します。通常、700から900µ BALのLは、注入溶液1mLから回収されます。
- 二回以上2.2.4 - を繰り返して、2.2.1を繰り返します。
注:目的は、非細胞コンテンツを分析することであるならば、それは感度に問題がある時にプールされたサンプルを集中することをお勧めします。
3. BAL液の細胞および非細胞コンポーネントの収集
- 遠心分離機400×gで、4℃で7分間の洗浄液。
- 上清を収集し、すぐにさらなる分析( 例えば、ELISA)のためにそれを使用するか、または-80℃で凍結します。肺の細胞流入を分析するために、細胞ペレットを保管してください。
- ACK溶解緩衝液200μLで細胞ペレットを再懸濁。
注:完全な白血球細胞を維持しながら、このステップでは、赤血球の溶解を確実にします。 - RTで2分間インキュベートします。
注:赤血球溶解による変動を減らすために、このステップはより長く2分間行ってはいけません。 - ACK溶解緩衝液を希釈するために冷PBSを1ml加えます。
- 400×gで4℃で7分間遠心します。上清を捨て、下流分析(下記参照)のためのPBSの十分な容積中で細胞を再懸濁します。
注:PBSのボリュームが実行される下流の研究に依存しています。
フローサイトメトリーによるBAL液中の異なる細胞型の4分析
注:一つの可能性は、フローサイトメトリーを行うことにより、BAL液の絶対的および相対的細胞組成を分析することです。本稿の目的は、BALの技術を詳しく説明することです。フローサイトメトリーは、独自の専門的な技術です。フローサイトメトリー法13、14、15、16、17上の専門論文を読むことが推奨されます。フルオロフォアトンに結合する抗体帽子は、使用される特定の細胞型(単数または複数)に特異的な表面抗原を( 表1参照 )を認識する。ゲーティング戦略を用いることにより、BALの細胞画分においてT細胞、マクロファージ、樹状細胞、B細胞、好酸球、および好中球を同定することが可能です。
| 抗原 | セルタイプ |
| 分化3のクラスター(CD3) | T細胞上に発現 |
| 分化11cのクラスタ(のCD11c) | ほとんどの樹状細胞上の、だけでなく、単球、マクロファージ、好中球、および一部のB細胞に高発現。 |
| 分化11B(のCD11b)のクラスタ | 単球、好中球、ナチュラルキラー細胞、顆粒球およびマクロファージを含む多くの白血球の表面に発現。 |
| SiglecF | A肺胞マクロファージおよび好酸球を含む。 |
| MHCII | 通常、樹状細胞、単核食細胞およびB細胞のような抗原提示細胞上にのみ見出される。 |
| CD19 | Bリンパ球抗原 |
| Ly-6G | 単球、顆粒球および好中球のマーカー |
表1:免疫細胞表面抗原の選択。この表は、異なる細胞型を特徴付けるために使用される表面エピトープのリストを提供する。特定の細胞タイプを確実に定義するには、いくつかのマーカーの組み合わせが必要です。
| サンプル | ||||
| チューブ | 細胞に添加される抗原 - フルオロフォア | 抗体ストック濃度(mg / mL) | 抗体希釈 | 総量(μL) |
| 固定可能な生存能力染料 | 0.2 | 1/1000 | 50 | |
| CD11c | 0.2 | 1/800 | 50 | |
| シグレックF | 0.2 | 1/100 | 50 | |
| サンプルX | MHCII | 0.2 | 1/200 | 50 |
| CD3 | 0.2 | 1/200 | 50 | |
| CD19 | 0.2 | 1/200 | 50 | |
| CD11b | 0.2 | 1/200 | 50 | |
| Ly6G | 0.2 | 1/200 | 50 | |
| 電圧制御 | ||||
| チューブ | 細胞に添加する抗原蛍光団 | 抗体ストック濃度(mg / mL) | 抗体希釈 | トータルボリューム(μL) |
| 非染色細胞 | / | / | / | 50 |
| シングル染色された細胞 | 修正可能生存可能性色素 | 0.2 | 1/1000 | 50 |
| シングル染色された細胞 | CD11c | 0.2 | 1/800 | 50 |
| シングル染色された細胞 | SiglecF | 0.2 | 1/100 | 50 |
| シングル染色された細胞 | MHCII | 0.2 | 1/200 | 50 |
| シングル染色された細胞 | CD3 | 00.2 | 1/200 | 50 |
| シングル染色された細胞 | CD19 | 0.2 | 1/200 | 50 |
| シングル染色された細胞 | CD11bを | 0.2 | 1/200 | 50 |
| シングル染色された細胞 | Ly6G | 0.2 | 1/200 | 50 |
| 報酬コントロール | ||||
| チューブ | 抗原-フルオロフォアはビーズに追加します | 抗体ストック濃度(mg / mL) | 抗体希釈 | トータルボリューム(μL) |
| 染色されていないビーズ | / | / | / | 200 |
| シングルステンドビーズ | CD11c | 0.2 | 1/2000 | 200 |
| シングルステンドビーズ | SiglecF | 0.2 | 1/2000 | 200 |
| シングルステンドビーズ | MHCII | 0.2 | 1/200 | 200 |
| シングルステンドビーズ | CD3 | 0.2 | 1/2000 | 200 |
| シングルステンドビーズ | CD19 | 0.2 | 1/2000 | 200 |
| シングルステンドビーズ | CD11bを | 0.2 | 1/400 | 200 |
| シングルステンドビーズ | Ly6G | 0.2 | 1/200 | 200 |
コントロールの表2のリストが含まれます。この表は、得られた結果の正確な解釈のために必要なすべてのコントロールを示します。
- 細胞表面染色
注:それはIMPOですフローサイトメトリー分析のために、すべての重要なコントロールを含めることrtant。チューブ3組を( 表2を参照)に必要とされる:(1)サンプルを含むチューブ。 (2)単一の染色を行うために、各抗体 - フルオロフォアのためのBAL細胞とチューブ。これは、フローサイトメーター上の各チャンネルの電圧の決意を可能にします。単一の汚れを作るために、各抗体 - フルオロフォアのためのビーズと、(3)チューブ。これは、補償行列を決定することです。- ( 表2を参照)は、適切な希釈でPBS中の抗体およびFcブロック(抗CD16 / CD32)のミックスを作ります。実験前に各抗体の最適な希釈率を決定する必要があります。
- サンプルのための抗体混合物の50μLで細胞を再懸濁し、重要なコントロールに適切に希釈した抗体の50μLを追加します。
注:染色は、96ウェルU字状のプレートで行うことができます。これは、簡単に汚れボリュームAを削減することが可能となりますNDサンプルを大量に実行します。 - 4℃で暗所で30分間インキュベートします。
- 400×gで4℃で7分間遠心します。上清を捨てます。
- 200μLの最終容量までPBS中で細胞を再懸濁します。
注:この最終容量は、フローサイトメーターは、アクセスすることができ、最小限のボリュームに依存します。これは、マシン間で若干異なることができます。また、読み取りボリュームは、細胞および/またはサンプルは、フローサイトメーターで実行するのに要する時間の数によって異なります。 - フローサイトメトリー分析のためのサンプルとコントロールを使用してください。
注:異なる細胞集団の絶対細胞数を決定するために、計数ビーズが添加されるべきです。測定直前に各サンプルにビーズの数が同じ(25,000ビーズを±)を追加します。フォワード使用および側方散乱によって、計数ビーズ( 図1参照 )、フローサイトメトリーによって同定することができます。続いて、試料中の細胞の絶対数は、thを比較することによって計算することができます。ビーズ事象と細胞事象との比。次の式を使用できます。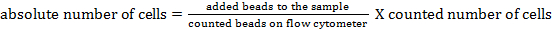
- フローサイトメトリー分析
注:フローサイトメトリー分析は、染色プロトコールの完了直後に行う必要があります。シグナル検出用の適切なレーザーとフィルターを備えたフローサイトメーターを使用する必要があります。 表3は、この原稿で説明した研究に必要なレーザーとフィルターの概要を示しています。フローサイトメトリー分析の詳細については、Adan et al。 18 。- デブリとダブレットを除いて、前方散乱とサイド散乱に基づいて1次ゲートを設定します( 図1参照)。
- 単一染色された細胞とビーズの助けを借りて、スペクトル重なりの電圧と補償を調整します。
注:これらの設定は各フローサイトメーターごとに異なり、すべての実験の前に確認する必要があります。 Fまたは正確な流れ解析を行うためには、前方および側方散乱電圧が重要である。正確な前方散乱および側方散乱は、分析された細胞の同定および確認に役立ち得る。これらの電圧を測定するには、染色されていないサンプルを先に実行する必要があります。 - 表面抗原の蛍光ゲートを設定し( 図1参照)、サンプルを分析します。
| レーザタイプ | フィルタ設定 | |
| 505 LP | 525/50 | |
| 青色(488nm) | 550 LP | 575/26 |
| 100mW | 670 LP | 685/35 |
| 750 LP | 780/60 | |
| バイオレット405nm | 450/50 | |
| 100mW | ||
| 赤色633nm | 660/20 | |
| 70mW | 750 LP | 780/60 |
表3:本研究で使用したフローサイトメーターのレーザーおよびフィルターの概要。
結果
3×1mLの緩衝塩溶液でBALを行った後、2〜3mLの容量を回収する必要があります。このBAL液をさらに分析して、細胞および非細胞含有量を特徴付けることができる。サイトカインおよびケモカインの存在を調べるために、ELISA19、イムノブロット20 、およびサイトカインビーズアレイ21による複数のサイトカインの同時分析を行うことができる。さらに、この液体のアルブミンおよび総タンパク質含量を測定することができる22 。
一例として、この原稿は、フローサイトメトリーによるBAL液の細胞内容物の分析方法を説明している。分析したBAL液を、リポ多糖を気管内に点滴注入してから24時間後に、雌Balb / cAnNCrlマウス(7週齢)から採取した。フルオロフォアに結合した以下の抗体、wCD11c、SiglecF、MHCII、CD3ε、CD19、Ly6g、およびCD11b( 表1および表の表を参照 )を同定するために用いられた。定着可能な生存性染料も使用した。異なる細胞集団( 図1 )の表面上の抗原の差次的発現に基づくゲーティング戦略を用いることにより、マクロファージ、樹状細胞、B細胞、T細胞、好中球および好酸球を同定することが可能であった。
第1に、デブリおよびダブレットは、前方散乱パラメータおよびサイド散乱パラメータに基づいてゲートアウトされた。生存能力色素は、生存細胞上のゲーティングを促進した。次に、CD11c高細胞およびCD11c低細胞が同定された。 CD11c高集団において、マクロファージおよび樹状細胞は、MHCIIおよびSiglecF発現にそれぞれ基づいて同定された。 CD11c低集団では、T細胞およびB細胞は、それぞれCD3εおよびCD19発現に基づいて同定された。第一にCD11bおよびLy-6Gマーカー発現に基づいて、残りの細胞集団、好中球および好酸球がそれぞれ同定された。
ビーズ事象の細胞事象に対する比を比較することによって、異なる細胞集団の絶対細胞数を決定するためにビーズを計数した23 。これらの計数ビーズは、その前方および側方散乱特性に基づいて同定された( 図1 )。 表4は、5μgのリポ多糖で24時間刺激したナイーブマウスおよびマウスのBAL液中の様々な細胞集団の絶対細胞数の概要を示す。
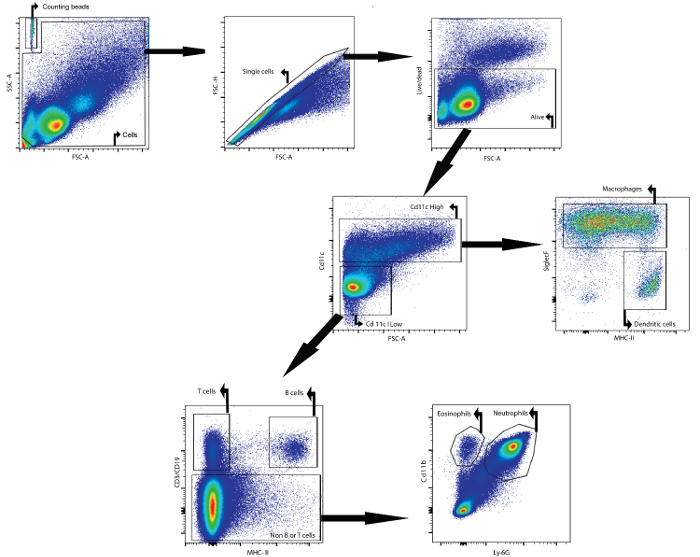
図1:マクロファージ、樹状細胞、T細胞、B細胞、好中球および好酸球のフローサイトメトリー検出のためのゲーティング戦略inはBAL液。 BAL細胞を記載BALプロトコルを用いて単離しました。細胞を24時間リポポリサッカライドの気管内注入後のマウスから単離しました。カウントビーズおよび細胞を、前方および側方散乱特性に基づいて同定しました。セルのゲートに、単一細胞は前方および側方散乱用いて同定しました。この最後の人口では、生きていた細胞が同定されました。 CD11c high細胞およびCD11c low細胞は、同定されました。 CD11cの高い集団において、マクロファージや樹状細胞は、それぞれ、MHCIIとSiglecF表現に基づいて同定しました。 CD11cの低い集団において、T細胞およびB細胞は、それぞれ、CD3εおよびCD19発現に基づいて同定しました。残りの細胞集団において、好中球及び好酸球は、それぞれ、CD11bおよびLY-6Gの発現に基づいて同定しました。 ご覧になるにはこちらをクリックしてください。この図のより大きなバージョン。
| 細胞集団 | ナイーブマウスの絶対数 | LPS刺激マウスにおける細胞の絶対数 |
| マクロファージ | 79,612 | 25,439 |
| 樹状細胞 | 495 | 671 |
| T細胞 | 45,271 | 28,089 |
| B細胞 | 4,164 | 2,926 |
| 好中球 | 632 | 566,716 |
| 好酸球 | 3,483 | 4,332 |
表4:担当者ナイーブおよびLPS刺激マウスのBAL液に関するフローサイトメトリー分析の結果。
ディスカッション
BALは、感染症や薬物に反応して細胞学的および生化学的情報を取得するために有用な技術です。当初、BALは、ホスゲンの毒性3苦しんでいるヒト患者における過剰な粘液産生を管理するために使用されました。今日、技術は、肺の病因、診断、および疾患3、24の治療管理を調べるために、ヒトにおいて使用されます。実験動物では、BALは、一般的肺気道1,2に起こる炎症反応、免疫機構、及び感染性疾患プロセスを監視するために使用されます。
呼吸器疾患モデルにおける炎症性細胞のパターンを研究するために、BALは、絶対および差動細胞計数によって従わなければなりません。絶対細胞数に加えて、相対的細胞数もまた重要です。たとえば、修理や癌モデルは、Vを示し、無BAL細胞数の増加に小さなERY。このモデルでは、細胞組成の評価が便利です。光学顕微鏡と組み合わせて細胞染色を用いて、例えば好酸球、好中球、マクロファージ、およびリンパ球などの異なる細胞型は、形態25、26、27、28、29、30に基づいて同定することができます。フローサイトメトリー、31は異なるT細胞表現型7を識別するためのような、特定の評価のために使用することができます。異なる浸潤細胞集団の識別に加えて、肺の非細胞性組成物は、BALを使用して調べることができます。例えばELISA、免疫ブロット、サイトカインビーズアレイ、免疫組織化学、および定量的ポリメラーゼ連鎖反応のような方法は、サイトカインを決定するために、BAL液上で実施される、成長因子、および他の炎症性の構成要素。肺損傷を決定するために、BAL液中の総タンパク質および乳酸デヒドロゲナーゼのレベルは、32、33を測定することができます。
新しい診断ツールの開発では、BAL部品のゲノムおよびプロテオミクス特性評価は、近い将来に可能になります。計算能力と高スループット遺伝子発現技術を拡張するの組み合わせは、種々の疾患状態のための特定の遺伝子発現プロファイルを定義することが可能になります。 BAL液にこれらの技術を実行すること肺疾患の異なる段階に関与する重要な分子を同定するための遺伝子およびタンパク質の発現パターンを提供することができます。
BAL液から得られたデータの主な制限は、異なる研究試験3,9との間の比較可能性の欠如です。度が高いです洗浄技術およびBAL液のその後の処理の変動。各BALトライアルを比較できるようにするために、滴下される洗浄液の種類、注入部位、および細胞性および非細胞組成について分析されるべき部分を標準化する必要があります。異なる試験間の洗浄画分の数に有意な差は36、35、1 14倍から34に変化があります。この違いは、肺の中の推定総細胞数に影響を与える可能性があります。 BAL液画分は、細胞の大部分が含まれているかを知ることが重要です。 Song ら。細胞の総数の約70%は、3つの22分画いずれかで取得されたことを示しました。しかし、他の報告は、第二の洗浄は、38最初の37以上の細胞を含んでいたことを示唆しました。我々はこれらの研究から、1つの画分の洗浄が肺全体を代表するものではなく、結果を誤って解釈すると結論づけることができる。
BAL液の非細胞性組成物は、肺の健康状態に関する貴重な情報を含む33,39,40。 BAL液の希釈における変化は、可溶性画分の定量化の差異に寄与し、結果として試験間の結果の差に寄与する。 Song et al。各洗浄画分のタンパク質および乳酸脱水素酵素レベルを比較し、第1の洗浄画分が第2の画分よりも2〜3倍多く含有すると結論した。
分析のための代表的なBALサンプルを取得するには、いくつかの技術的な考慮が不可欠です。そのうちの1つは、適切な麻酔を行うことです。足のリファレンスを確認することは非常に重要ですターミナル鎮静を確実にするために、マウスのLEX。これは、だけでなく、倫理的な理由のために重要ですが、また置いて、マウスが正常に麻酔をされていない場合は、正しい位置にカテーテルを保持することは困難であるため。
第二の重要な技術的配慮は、気管内カテーテルの位置です。カテーテルがあまりにも深く挿入されると、それは肺の構造に損傷を与えることができます。カテーテルの先端部は、BAL手順の間に肺に到達していなければなりません。カテーテルはまた、安定化し、木綿糸で縛っする必要があります。カテーテルが安定しない場合は、注入された生理食塩水の代わりにダウン肺への鼻腔内に上向きに流れることができます。生理食塩水の注入と吸引中には、安定したカテーテルを保持することが重要です。
BAL液から得られたデータは、全体のマウスの肺を表している必要があります。したがって、それは生理食塩水緩衝液の十分な量を植え付けることが重要である( つまり、各1mLの3つのアリコートに分割し3ミリリットル)。細胞収量およびBAL流体収量の間には線形関係がありません。マウスの胸部をマッサージしながら溶液を穏やかに収集することが重要です。剪断力が強すぎる場合には、気道およびBAL液中の細胞の生存率、機能、および構造が損なわれる可能性があります。吸引流体がシリンジ内に表示されていない場合は、慎重に気管に深くカテーテル以上を移動します。
特別な通知は、BALの処理および分析の特定の側面に与えられるべきです。これは、BALサンプルから保持された情報を最大化します。 BAL後、細胞は、栄養不足、生理食塩水媒体にあります。 BALのサンプリング後1時間以内にサンプルを処理することが非常に重要です。長期保存が必要な場合は、栄養補給培地の使用が必要です。
細胞生存率を維持するために、表面への細胞付着を促進する管を避けます。 CEを避けます細胞の完全性を危うくする可能性のある速度での細胞懸濁液の遠心分離、または回収されたBAL細胞の均一な再懸濁を妨げる。 BAL液体含有細胞は、400 xgおよび4℃で7分間遠心分離する必要があります。処理中は4℃で細胞懸濁液を保持する必要があることを覚えておくことが重要です。
開示事項
著者は何も開示することはありません。
謝辞
LVHはゲント大学の生物医学生物学科の研究助手です。 ERJはUniVacFlu、グラント番号607690でサポートされています。KRはEC-FP7プロジェクトFLUNIVACでサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Hanks' Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 14175-129 | |
| ethyleendiaminetetra acetic acid (EDTA) | Sigma-Aldrich | E6511 | irritating |
| 23 G x 1 1/4 needle | Henke Sass Wolf | 4710006030 | size: 0.60 x 30 mm |
| 26 G x 1/2 needle | Henke Sass Wolf | 4710004512 | size: 0.45 x 12 mm |
| plastic tubing | BD medical technology | 427411 | Polyethylene Tubing, I.D. 0.58 mm (0.023") O.D. 0.965 mm (0.38") 30.5 m (100') |
| sodium pentobarbital | Kela NV | 514 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | PBS without Ca2+ Mg2+ or phenol red; sterile filtered |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | nonpyrogenic and nontoxic |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Surgical scissors | Fine Science Tools GmbH | 91460-11 | |
| centrifuge tube 50 mL | TH.Geyer | 7696705 | Free from Rnase/Dnase/endotoxin |
| centrifuge tube 15 mL | TH.Geyer | 7696702 | Free from Rnase/Dnase/endotoxin |
| microcentrifuge tube 1.5 mL | Sigma-Aldrich | 0030 120.094 | polypropylene |
| Microcentrifuge | Sigma-Aldrich | 5415R | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| Ammonium-Chloride-Potassium (ACK) lysing buffer | Lonza | 10-548E | sterile-filtered |
| live/dead - efluor 506 | ebioscience | 65-0866-18 | fixable viability dye |
| CD11c-PE-cy7 | eBiosciences | 25-0114-81 | |
| SiglecF-PE | BD Pharmingen | 552126 | |
| MHCII-APCefluor780 | Biolegend | 107628 | |
| CD3-PE-cy5 | VWR | 55-0031-U100 | |
| CD19-PE-cy5 | eBiosciences | 15-0193-83 | |
| CD11b-V450 | BD Pharmingen | 560455 | |
| Ly6G-AF700 | Biolegend | 127621 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| anti-CD16/CD32 | BD Pharmingen | 553142 | |
| 96-well 340 µl storage plate plate | Falcon | 353263 | V-bottom, natural polypropylene |
| flow cytometer | BD Biosciences | ||
| catheter | BD Biosciences | 393202 |
参考文献
- Stankunas, K., et al. Conditional protein alleles using knockin mice and a chemical inducer of dimerization. Mol Cell. 12 (6), 1615-1624 (2003).
- Hunninghake, G. W., Gadek, J. E., Kawanami, O., Ferrans, V. J., Crystal, R. G. Inflammatory and immune processes in the human lung in health and disease: evaluation by bronchoalveolar lavage. Am J Pathol. 97 (1), 149-206 (1979).
- Gee, J. B., Fick, R. B. Bronchoalveolar lavage. Thorax. 35 (1), 1-8 (1980).
- Tornling, G., et al. Hyaluronic acid in bronchoalveolar lavage in rats exposed to quartz. Br J Ind Med. 44 (7), 443-445 (1987).
- Henderson, R. F. Use of bronchoalveolar lavage to detect respiratory tract toxicity of inhaled material. Exp Toxicol Pathol. 57, 155-159 (2005).
- Morris, A., et al. Longitudinal analysis of the lung microbiota of cynomolgous macaques during long-term SHIV infection. Microbiome. 4 (1), 38 (2016).
- Naessens, T., et al. GM-CSF treatment prevents respiratory syncytial virus-induced pulmonary exacerbation responses in postallergic mice by stimulating alveolar macrophage maturation. J Allergy Clin Immunol. 137 (3), 700-709 (2016).
- Chockalingam, A., Duraiswamy, R., Jagadeesan, M. Bronchoalveolar lavage cellular analyses in conjunction with high-resolution computed tomography imaging as a diagnostic intervention for patients with suspected interstitial lung disease. Lung India. 33 (3), 287-291 (2016).
- Crystal, R. G., Reynolds, H. Y., Kalica, A. R. Bronchoalveolar lavage. The report of an international conference. Chest. 90 (1), 122-131 (1986).
- Baughman, R. P. The uncertainties of bronchoalveolar lavage. Eur Respir J. 10 (9), 1940-1942 (1997).
- Singletary, M. L., et al. Modification of a common BAL technique to enhance sample diagnostic value. J Am Assoc Lab Anim Sci. 47 (5), 47-51 (2008).
- Angus, D. W., Baker, J. A., Mason, R., Martin, I. J. The potential influence of CO2, as an agent for euthanasia, on the pharmacokinetics of basic compounds in rodents. Drug Metab Dispos. 36 (2), 375-379 (2008).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. J Vis Exp. (97), (2015).
- Rubio-Navarro, A., et al. Phenotypic Characterization of Macrophages from Rat Kidney by Flow Cytometry. J Vis Exp. (116), (2016).
- Butcher, M. J., Herre, M., Ley, K., Galkina, E. Flow cytometry analysis of immune cells within murine aortas. J Vis Exp. (53), (2011).
- Noto, A., Ngauv, P., Trautmann, L. Cell-based flow cytometry assay to measure cytotoxic activity. J Vis Exp. (82), e51105 (2013).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Database, J. S. E. The ELISA method. J Vis Exp. , (2016).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Wunderlich, M. L., Dodge, M. E., Dhawan, R. K., Shek, W. R. Multiplexed fluorometric immunoassay testing methodology and troubleshooting. J Vis Exp. (58), (2011).
- Song, J. A., et al. Standardization of bronchoalveolar lavage method based on suction frequency number and lavage fraction number using rats. Toxicol Res. 26 (3), 203-208 (2010).
- Seliger, C., et al. A rapid high-precision flow cytometry based technique for total white blood cell counting in chickens. Vet Immunol Immunopathol. 145 (1-2), 86-99 (2012).
- Daniele, R. P., Elias, J. A., Epstein, P. E., Rossman, M. D. Bronchoalveolar lavage: role in the pathogenesis, diagnosis, and management of interstitial lung disease. Ann Intern Med. 102 (1), 93-108 (1985).
- Delayre-Orthez, C., Becker, J., de Blay, F., Frossard, N., Pons, F. Exposure to endotoxins during sensitization prevents further endotoxin-induced exacerbation of airway inflammation in a mouse model of allergic asthma. Int Arch Allergy Immunol. 138 (4), 298-304 (2005).
- Delayre-Orthez, C., et al. PPARalpha downregulates airway inflammation induced by lipopolysaccharide in the mouse. Respir Res. 6, 91 (2005).
- Delayre-Orthez, C., de Blay, F., Frossard, N., Pons, F. Dose-dependent effects of endotoxins on allergen sensitization and challenge in the mouse. Clin Exp Allergy. 34 (11), 1789-1795 (2004).
- Hachet-Haas, M., et al. Small neutralizing molecules to inhibit actions of the chemokine CXCL12. J Biol Chem. 283 (34), 23189-23199 (2008).
- Ble, F. X., et al. Activation of the lung S1P(1) receptor reduces allergen-induced plasma leakage in mice. Br J Pharmacol. 158 (5), 1295-1301 (2009).
- Ble, F. X., et al. Allergen-induced lung inflammation in actively sensitized mice assessed with MR imaging. Radiology. 248 (3), 834-843 (2008).
- Reber, L. L., et al. A dissociated glucocorticoid receptor modulator reduces airway hyperresponsiveness and inflammation in a mouse model of asthma. J Immunol. 188 (7), 3478-3487 (2012).
- Drent, M., Cobben, N. A., Henderson, R. F., Wouters, E. F., van Dieijen-Visser, M. Usefulness of lactate dehydrogenase and its isoenzymes as indicators of lung damage or inflammation. Eur Respir J. 9 (8), 1736-1742 (1996).
- Henderson, R. F. Use of bronchoalveolar lavage to detect lung damage. Environ Health Perspect. 56, 115-129 (1984).
- Forget, G., et al. An adherent cell perifusion technique to study the overall and sequential response of rat alveolar macrophages to toxic substances. Environ Health Perspect. 51, 131-140 (1983).
- Sung, J. H., et al. Recovery from welding-fume-exposure-induced lung fibrosis and pulmonary function changes in sprague dawley rats. Toxicol Sci. 82 (2), 608-613 (2004).
- Majetschak, M., Sorell, L. T., Patricelli, T., Seitz, D. H., Knoferl, M. W. Detection and possible role of proteasomes in the bronchoalveolar space of the injured lung. Physiol Res. 58 (3), 363-372 (2009).
- Rehn, B., Bruch, J., Zou, T., Hobusch, G. Recovery of rat alveolar macrophages by bronchoalveolar lavage under normal and activated conditions. Environ Health Perspect. 97, 11-16 (1992).
- Kelly, C. A., Ward, C., Stenton, S. C., Hendrick, D. J., Walters, E. H. Assessment of pulmonary macrophage and neutrophil function in sequential bronchoalveolar lavage aspirates in sarcoidosis. Thorax. 43 (10), 787-791 (1988).
- Eklund, A., Tornling, G., Blaschke, E., Curstedt, T. Extracellular matrix components in bronchoalveolar lavage fluid in quartz exposed rats. Br J Ind Med. 48 (11), 776-782 (1991).
- Olsen, G. N., Harris, J. O., Castle, J. R., Waldman, R. H., Karmgard, H. J. Alpha-1-antitrypsin content in the serum, alveolar macrophages, and alveolar lavage fluid of smoking and nonsmoking normal subjects. J Clin Invest. 55 (2), 427-430 (1975).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved