Method Article
Бронхоальвеолярное спазмы легких у мышей для анализа воспалительной клеточной инфильтрации
В этой статье
Резюме
Состояние здоровья легкого отражается типом и числом иммунных клеток, которые присутствуют в бронхиолах легких. Мы описываем метод бронхоальвеолярного лаважа, который позволяет изолировать и исследовать неадгезивные клетки и растворимые факторы из нижних дыхательных путей мышей.
Аннотация
Bronchoalveolar Lavage (BAL) - экспериментальная процедура, которая используется для исследования клеточного и бесклеточного содержимого просвета легких ex vivo, чтобы получить представление о текущем состоянии болезни.
Здесь описывается простой и эффективный метод выполнения БАЛ на легких мыши без использования специальных инструментов или оборудования. Жидкость БАЛ выделяют путем введения катетера в трахею мышей с терминальной анестезией, через которые в бронхиолы вводят солевой раствор. Приложенная жидкость мягко убирается, чтобы максимизировать извлечение флюида BAL и минимизировать усилия сдвига. Этот метод позволяет сохранить жизнеспособность, функцию и структуру клеток в дыхательных путях и БАЛ.
Для получения более глубокого понимания состояния болезни легких могут применяться многочисленные методики. В этом случае широко используемым методом идентификации и подсчета различных типов иммунных клеток являетсяГде проточная цитометрия комбинируется с панелью выбора флуоресцентно меченных клеточных поверхностно-специфических маркеров. Представленная здесь процедура BAL также может быть использована для анализа инфекционных агентов, жидких компонентов или ингаляционных частиц в легких мыши.
Введение
Воздушные пути встречаются многочисленные оскорбления, которые могут привести к воспалению, инвазии патогенов или злокачественные трансформации. Эпителиальные клетки, которые выстилают просвет легких, образуют один из главных барьеров тела млекопитающих. Вместе с альвеолярными макрофагами они предотвращают проникновение экологических угроз в системную систему через дыхательные пути. Примеры таких угроз включают органические и неорганические химикаты, бактерии и вирусы. Аналогичным образом, могут быть разработаны специальные иммунизации или терапевтические вмешательства, направленные на легкие. Во всех этих случаях тщательный анализ вызванного ответа важен для понимания, вмешательства или предотвращения биологических процессов, происходящих в дыхательной системе.
Бронхоальвеолярный лаваж (БАЛ) является бесценным методом для анализа таких ответов, поскольку полученные в результате образцы содержат важную информацию о воспалительных реакциях, иммунных механизмах и прогрессировании инфекционных заболеванийЧто может произойти в легочных дыхательных путях 1 , 2 . Используя БАЛ, можно изучать инфильтрирующие клетки. Это контрастирует с переваренными легкими, которые дают «грязнее» клеточную популяцию, со многими мертвыми и липкими клетками. БАЛ выполняют путем введения солевого раствора в конечные бронхиолы и последующего восстановления этого раствора. Полученное решение можно затем использовать для количественной оценки и фенотипического анализа резидентных легких и инфильтрирующих воспалительных клеток. Этот метод часто применяется для изучения клеточного притока в моделях заболеваний дыхательных путей, таких как астма, хроническая обструктивная болезнь легких (ХОБЛ) и модели инфекционных заболеваний. Помимо клеточного состава, молекулярный состав легочных дыхательных путей также отражается в жидкости БАЛ. Для анализа этого фермент-связанный иммуносорбентный анализ (ELISA), иммуноблот и одновременный анализ нескольких цитокинов с помощью массива цитокинов могут бытьпроводится для оценки наличия цитокинов и хемокинов.
БАЛ является хорошо признанным методом для изучения притока воспалительных клеток в воспалительных моделях животных респираторных болезней. Наблюдение измененного клеточного притока (например, повышенные уровни лимфоцитов, эозинофилы, нейтрофилов или) может привести к более глубокому пониманию болезни и может быть объективным параметр для оценки эффективности терапевтического вмешательства.
Точная и воспроизводимая интерпретация BAL клеточного анализа требует, чтобы БАЛ выполнена правильно, и что собранные жидкости и обрабатываются должным образом. Термин «бронхиальная промывание» была введена более восьмидесяти лет назад Ститтой 3. В 1961 году Myrvik получены альвеолярных макрофагов из промывной жидкости кролика легких 3. BAL теперь широко используемый метод для анализа и мониторинга легких в модели мыши, однакоRe по-прежнему не представляет собой стандартную процедуру БАЛ в научной литературе 4 , 5 . Кроме того, существует, вероятно, так много способов выполнить БАЛ, поскольку существуют исследовательские лаборатории, использующие технику 3 , 6 , 7 , 8 , 9 , 10 , 11 . Важно, что данные, полученные из БАЛ, представляют собой целое мышечное легкое, а не только часть легкого. Такая вариативность затрудняет интерпретацию и сравнение результатов между различными испытаниями.
Здесь описана базовая, недорогая и воспроизводимая процедура BAL, которая позволяет собирать клеточную и растворимую фракцию, присутствующую в просвете дыхательных путей мыши. Короче говоря, катетер помещают в открытую трахею oFa - терминально обезболиваемая мышь. С катетером соединен шприц, и в легкие вводится буферный солевой раствор, содержащий этилендиаминтетрауксусную кислоту (ЭДТА). Пробу легкого отбирают путем мягкой повторной промывки солевого раствора с помощью плунжера. Отрицательное давление, прилагаемое на этом этапе, минимально, чтобы предотвратить обрушение дыхательных путей. После сбора полученная БАЛ должна быть обработана далее для перечисления и идентификации клеток методом проточной цитометрии.
протокол
Все эксперименты на животных, описанные в этом исследовании, проводились в соответствии с национальным законодательством (бельгийский закон 14/08/1986 и 22/12/2003, Королевский указ Бельгии 06/04/2010) и европейским законодательством (директивы ЕС 2010/63 / ЕС и 86 / 609 / ЕЕС). Все эксперименты на мышах и всех животных протоколах были одобрены комитетом по этике университета Гента (номера LA1400091 и EC2016-027).
1. Подготовка
- Жидкая жидкость
- Приготовить сбалансированный солевой раствор с 100 мкМ этилендиаминтетрауксусной кислотой (ЭДТА).
ПРИМЕЧАНИЕ. Для измерения уровня белка в жидкости БАЛ рекомендуется добавлять ингибиторы протеазы, чтобы предотвратить активность протеазы в жидкости БАЛ.
- Приготовить сбалансированный солевой раствор с 100 мкМ этилендиаминтетрауксусной кислотой (ЭДТА).
- Катетер
- Сделайте катетер, вставив иглу 23 G в прозрачную пластиковую полиэтиленовую трубку 21 G (внутренний диаметр: 0,58 мм, наружный диаметр: 0,965 мм и длина: 0,5 см). Также могут быть использованы предварительно подготовленные катетеры.
- Anesthпоэтика
- Подготовьте терминальный анестетик, предпочтительно тот, который вызывает остановку дыхания ( например, барбитурат, такой как раствор пентобарбитала натрия (> 100 мг / кг) в фосфатно-буферном солевом растворе (PBS)).
ПРИМЕЧАНИЕ. Рекомендуется использовать инъекционную анестезию вместо ингаляционной анестезии, так как вдыхаемая анестезия может влиять на содержание БАЛ. CO 2 , например, оказывает влияние на pH крови и, следовательно, на перераспределение различных соединений 12 .
- Подготовьте терминальный анестетик, предпочтительно тот, который вызывает остановку дыхания ( например, барбитурат, такой как раствор пентобарбитала натрия (> 100 мг / кг) в фосфатно-буферном солевом растворе (PBS)).
- Буфер лизиса эритроцитов аммония-хлорид-калий (ACK)
- Подготовьте ACK-лизисный буфер, растворяя 8,29 г NH 4 Cl и 1 г KHCO 3 в 1 л H 2 O со 100 мкМ ЭДТА; Эритроцит эритроцитов также можно приобрести у внешнего источника.
2. Выполнение бронхоальвеолярного лаважа (BAL)
- Введение катетера в трахею
- Усыпите мышь путем внутрибрюшинной инъекции смертельной дозы анестетика барбитурата короткого действия с использованием иглы 26 G. Чтобы подтвердить правильную смертельную анестезию, зажмите заднюю лапу мыши пинцетом, чтобы проверить рефлекс стопы.
- Поместите животное на спину на хирургическую пластину и зафиксируйте мышь, придавив конечности.
- Спрей 70% этанола на шее для дезинфекции. Сделайте разрез в области шеи возле трахеи с помощью скальпеля.
- Откройте кожу, чтобы обнажить слюнные железы. Отделите слюнные железы, используя щипцы, чтобы обнажить стерниоидную мышцу. Вставьте мышцу вокруг трахеи, используя щипцы, чтобы обнажить трахею.
- Поместите хлопковую нить под трахею с помощью клещей.
- Тщательно проколоть середину обнаженной трахеи между двумя кольцами хряща иглой 26 G. Будьте осторожны, чтобы не повредить трахею.
- Вставьте катетер около 0,5 см в трахею. Убедитесь, что катеTer не вставляется слишком глубоко в трахею, так как это может привести к повреждению структуры легких.
- Стабилизируйте катетер, завязывая трахею вокруг катетера, используя хлопковую нить, установленную на этапе 2.1.5. Если катетер недостаточно завязан, вводимый сбалансированный солевой раствор может течь в верхнюю часть дыхательного тракта, а не вниз в легкие.
- Соберите промывную жидкость
- Загрузите шприц объемом 1 мл 1 мл стерильного сбалансированного солевого раствора со 100 мкМ ЭДТА.
- Подключите шприц объемом 1 мл к катетеру и аккуратно введите раствор соли / ЭДТА в легкие.
- Аспирируйте раствор мягко, массируя грудную клетку мыши. Если аспирационная жидкость не видна в шприце, осторожно вставьте катетер немного дальше или вверх по трахее.
- Снимите шприц с иглы и перенесите восстановленную промывочную жидкость в 15 мл пробирку, помещенную на лед. Обычно, 700 - 900 &# 181; L БАЛ выделяют из 1 мл инъецированного раствора.
- Повторите шаги 2.2.1 - 2.2.4 два раза.
ПРИМЕЧАНИЕ. Если целью является анализ не клеточного содержимого, рекомендуется сосредоточить собранные образцы, когда есть проблемы с чувствительностью.
3. Сбор клеточных и неклеточных компонентов БАЛ-жидкости
- Центрифугируйте промывную жидкость в течение 7 минут при 400 xg и 4 ° C.
- Собирают супернатант и немедленно используют его для дальнейшего анализа ( например, ELISA) или замораживают при -80 ° C. Держите клеточный осадок, чтобы проанализировать клеточный приток в легких.
- Ресуспендируют осадок клеток в 200 мкл ACK лизирующего буфера.
ПРИМЕЧАНИЕ: Этот этап обеспечивает лизис эритроцитов, сохраняя при этом белые кровяные клетки неповрежденными. - Инкубируйте в течение 2 мин при комнатной температуре.
ПРИМЕЧАНИЕ. Чтобы уменьшить вариацию, вызванную лизисами эритроцитов, этот шаг не должен выполняться более 2 мин. - Добавить 1 мл холодного PBS для разбавления ACK лизирующего буфера.
- Центрифуга в течение 7 минут при 400 xg и 4 ° C. Отбросьте супернатант и повторно суспендируйте клетки в адекватном объеме PBS для последующего анализа (см. Ниже).
ПРИМЕЧАНИЕ. Объем PBS зависит от последующего исследования, которое будет выполняться.
4. Анализ различных типов клеток в жидкости BAL с помощью проточной цитометрии
ПРИМЕЧАНИЕ. Одна из возможностей заключается в анализе абсолютного и относительного клеточного состава жидкости БАЛ путем проведения проточной цитометрии. Цель этой статьи - разработать технику BAL. Проточная цитометрия является специализированной методикой сама по себе. Рекомендуется читать специализированные статьи по методу проточной цитометрии 13 , 14 , 15 , 16 , 17 . Антитела, связанные с флуорофором tшлю распознают поверхностные антигены (таблица 1) , специфические для конкретного типа клеток (ов) используются. При использовании стратегии стробирования, можно определить Т-клетки, макрофаги, дендритные клетки, В-клетки, эозинофилы, нейтрофилы и в клеточной фракции BAL.
| антиген | Тип клетки |
| Кластер дифференцировки 3 (CD3) | Выраженный на Т-клетках |
| Кластер дифференцировки 11с (CD11c) | Высокая экспрессия на большинстве дендритных клеток, но и на моноциты, макрофаги, нейтрофилы и некоторых В-клеток. |
| Кластер дифференцировки 11b (CD11b) | Экспрессируется на поверхности многих лейкоцитов, включая моноциты, нейтрофилы, естественные клетки-киллеры, гранулоциты и макрофаги. |
| SiglecF | lveolar макрофаги и эозинофилы. |
| MHCII | Обычно встречаются только на антигенпрезентирующих клетках, таких как дендритные клетки, мононуклеарных фагоцитов и В-клеток. |
| CD19 | В-лимфоцитов антиген |
| Ly-6G | Маркер для моноцитов, гранулоцитов и нейтрофилов |
Таблица 1: Выбор иммунных антигенов клеточной поверхности. В этой таблице приведен список поверхностных эпитопов, используемых для характеристики различных типов клеток. Комбинации нескольких маркеров должны будут надежно определить конкретный тип клеток.
| образцы | ||||
| туба | Антиген-флуорофором , которые будут добавлены к клеткам | Концентрация запаса антител (мг / мл) | Разведение антител | Общий объем (мкл) |
| Фиксируемая жизнеспособность красителя | 0.2 | 1/1000 | 50 | |
| CD11c | 0.2 | 1/800 | 50 | |
| SiglecF | 0.2 | 1/100 | 50 | |
| Образец X | MHCII | 0.2 | 1/200 | 50 |
| CD3 | 0.2 | 1/200 | 50 | |
| CD19 | 0.2 | 1/200 | 50 | |
| CD11b | 0.2 | 1/200 | 50 | |
| Ly6G | 0.2 | 1/200 | 50 | |
| Управление напряжением | ||||
| туба | Антиген-флуорофором , которые будут добавлены к клеткам | Концентрация антител запаса (мг / мл) | Антитело разведение | Общий объем (мкл) |
| Неокрашенные клетки | / | / | / | 50 |
| Одиночные окрашенные клетки | Fixable жизнеспособность красителя | 0.2 | 1/1000 | 50 |
| Одиночные окрашенные клетки | CD11c | 0.2 | 1/800 | 50 |
| Одиночные окрашенные клетки | SiglecF | 0.2 | 1/100 | 50 |
| Одиночные окрашенные клетки | MHCII | 0.2 | 1/200 | 50 |
| Одиночные окрашенные клетки | CD3 | 00,2 | 1/200 | 50 |
| Одиночные окрашенные клетки | CD19 | 0.2 | 1/200 | 50 |
| Одиночные окрашенные клетки | CD11b | 0.2 | 1/200 | 50 |
| Одиночные окрашенные клетки | Ly6G | 0.2 | 1/200 | 50 |
| Элементы управления компенсацией | ||||
| туба | Антиген-флуорофор, добавляемый в шарики | Концентрация запаса антител (мг / мл) | Разведение антител | Общий объем (мкл) |
| Непрозрачные бусы | / | / | / | 200 |
| Одноцветные бусины | CD11c | 0.2 | 1/2000 | 200 |
| Одиночные окрашенные бусины | SiglecF | 0.2 | 1/2000 | 200 |
| Одиночные окрашенные бусины | MHCII | 0.2 | 1/200 | 200 |
| Одиночные окрашенные бусины | CD3 | 0.2 | 1/2000 | 200 |
| Одиночные окрашенные бусины | CD19 | 0.2 | 1/2000 | 200 |
| Одиночные окрашенные бусины | CD11b | 0.2 | 1/400 | 200 |
| Одиночные окрашенные бусины | Ly6G | 0.2 | 1/200 | 200 |
Таблица 2. Перечень элементов управления должны быть включены. В этой таблице представлены все необходимые элементы управления для точной интерпретации полученных результатов.
- Поверхность Окрашивание клеток
Примечание: Это ImpoRtant, чтобы включить все критические контролы для анализа проточной цитометрии. Требуются три набора трубок (см. Таблицу 2 ): (1) пробирки, содержащие образцы; (2) пробирки с клетками BAL для каждого антитела-флуорофора для получения единичных пятен; Это позволяет определять напряжения для каждого канала на проточном цитометре; И (3) пробирки с шариками для каждого антитела-флуорофора для получения единичных пятен; Это необходимо для определения матрицы компенсации.- Произведите смешивание антител и Fc-блока (анти-CD16 / CD32) в PBS в соответствующих разведениях (см. Таблицу 2 ). Необходимо определить оптимальное рабочее разбавление для каждого антитела перед экспериментом.
- Ресуспендируют клетки в 50 мкл смеси антител для образца и добавляют 50 мкл соответственно разбавленного антитела к критическим контрольным образцам.
ПРИМЕЧАНИЕ. Окрашивание может быть выполнено в 96-луночном, u-образном пластине. Это позволяет легко уменьшить объем пятен aго запуск значительного количества образцов. - Инкубируют в течение 30 мин в темноте при 4 ° С.
- Центрифуга в течение 7 мин при 400 мкг и 4 ° С. Жидкость над осадком сливают.
- Повторное приостановить клетки в PBS до конечного объема 200 мкл.
Примечание: Этот конечный объем зависит от минимального объема цитометр потока может получить доступ. Это может немного отличаться между машинами. Кроме того, объем считывания зависит от числа клеток и / или времени, когда образец будет принимать для запуска в проточном цитометре. - Используйте образцы и элементы управления для анализа проточной цитометрии.
Примечание: Для определения абсолютного количества клеток различных клеточных популяций, счетные шарики должны быть добавлены. Добавьте такое же количество шариков (± 25000) шариков для каждого образца непосредственно перед измерением. При использовании вперед и боковое рассеивание, считая шарики могут быть идентифицированы с помощью проточной цитометрии (см рисунок 1). Впоследствии, абсолютное количество клеток в образце можно рассчитать путем сравнения тысE отношение бортовых событий к событиям ячеек. Можно использовать следующую формулу: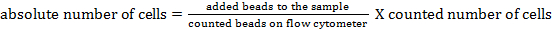
- Проточный цитометрический анализ
ПРИМЕЧАНИЕ: проточный цитометрический анализ следует проводить сразу же после завершения протокола окрашивания. Необходимо использовать проточный цитометр с соответствующими лазерами и фильтрами для обнаружения сигнала. В таблице 3 представлен обзор лазеров и фильтров, необходимых для исследования, описанного в этой рукописи. Для получения дополнительной информации о проточном цитометрическом анализе см. Adan et al. 18 .- Настройте первичные ворота на основе прямого и бокового разброса, исключая мусор и дублеты (см . Рис. 1 ).
- Отрегулируйте напряжение и компенсацию спектрального перекрытия с помощью однокрасочных клеток и шариков.
ПРИМЕЧАНИЕ. Эти настройки различны для каждого проточного цитометра, и их необходимо проверять перед каждым экспериментом. FИли правильного анализа потока, напряжения в прямом и боковом рассеянии являются критическими. Правильный прямой и боковой разброс может помочь в идентификации и подтверждении идентичности анализируемых клеток. Чтобы определить эти напряжения, сначала следует запустить образец без окраски. - Настройте флуоресцентные вентили для поверхностного антигена (см . Рис. 1 ) и проанализируйте образцы.
| Тип лазера | Настройка фильтра | |
| 505 LP | 525/50 | |
| Голубой (488 нм) | 550 LP | 575/26 |
| 100 мВт | 670 л.с. | 685/35 |
| 750 LP | 780/60 | |
| Фиолетовый 405 нм | 450/50 | |
| 100 мВт | ||
| красный 633 нм | 660/20 | |
| 70 мВт | 750 Л.П. | 780/60 |
Таблица 3: Обзор лазеров и фильтры проточного цитометра , используемых в данном исследовании.
Результаты
После проведения БАЛ с 3х1 мл буферного солевого раствора необходимо восстановить объем между 2 и 3 мл. Эта жидкость БАЛ может быть дополнительно проанализирована для характеристики клеточного и неклеточного содержимого. Для исследования присутствия цитокинов и хемокинов могут быть выполнены ELISA 19 , иммуноблот 20 и одновременный анализ множественных цитокинов матрицей 21 цитокиновых гранул. Кроме того, альбумин и общее содержание белка в этой жидкости могут быть определены 22 .
В качестве примера, эта рукопись описывает, как анализировать клеточный состав жидкости БАЛ методом проточной цитометрии. Анализируемую жидкость БАЛ собирали у самок мышей Balb / cAnNCrl (возраст: 7 недель) через 24 ч после интратрахеальной инфильтрации липополисахаридом. Следующие антитела, связанные с флуорофором, wКоторые используются для идентификации различных типов клеток: CD11c, SiglecF, MHCII, CD3ε, CD19, Ly6g и CD11b (см. Таблицу 1 и таблицу материалов ). Также применялся фиксируемый жизнеспособный краситель. Используя стратегию стробирования, основанную на дифференциальной экспрессии антигенов на поверхностях различных популяций клеток ( рис. 1 ), можно было идентифицировать макрофаги, дендритные клетки, В-клетки, Т-клетки, нейтрофилы и эозинофилы.
Во-первых, обломки и дублеты были отфильтрованы по параметрам прямого и бокового рассеяния. Жизнеспособный краситель облегчал стробирование на живых клетках. Затем идентифицировали высокие клетки CD11c и низкие клетки CD11c. В CD11c с высокой популяцией идентифицировали макрофаги и дендритные клетки на основе экспрессии MHCII и SiglecF, соответственно. В CD11c с низкой популяцией Т-клетки и В-клетки были идентифицированы на основе CD3ε и экспрессии CD19, соответственно. ВОстальная клеточная популяция, нейтрофилы и эозинофилы были идентифицированы на основе экспрессии CD11b и Ly-6G маркера, соответственно.
Подсчет шариков добавляли для определения абсолютных чисел клеток разных популяций клеток путем сравнения отношения событий шарика к событиям ячейки 23 . Эти счетные бусины были идентифицированы на основе их свойств прямого и бокового рассеивания ( рис. 1 ). В таблице 4 приведен обзор абсолютных чисел клеток разных популяций клеток в жидкости БАЛ наивной мыши и мыши, которую стимулировали в течение 24 ч с помощью 5 мкг липополисахарида.
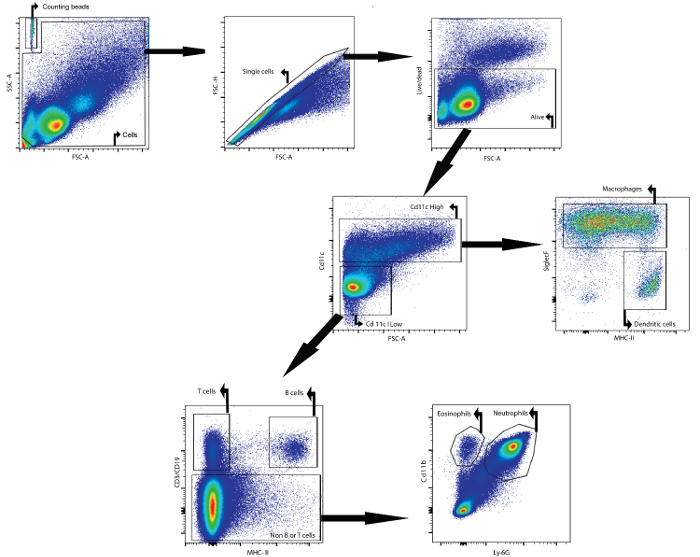
Рисунок 1: Стратегия стробирования для проточной цитометрической детекции макрофагов, дендритных клеток, Т-клеток, В-клеток, нейтрофилов и эозинофиловN BAL Fluid. Клетки BAL выделяли с использованием описанного BAL-протокола. Клетки выделяли из мышей через 24 ч после интратрахеальной инстилляции липополисахарида. Подсчет шариков и ячеек был определен по свойствам прямого и бокового рассеяния. В клеточном вороте отдельные клетки идентифицировали с использованием прямого и бокового разброса. В этой последней популяции были идентифицированы клетки, которые были живыми. Затем идентифицировали высокие клетки CD11c и CD11c с низкими клетками. В CD11c с высокой популяцией идентифицировали макрофаги и дендритные клетки на основе экспрессии MHCII и SiglecF, соответственно. В CD11c с низкой популяцией Т-клетки и В-клетки были идентифицированы на основе CD3ε и экспрессии CD19, соответственно. В оставшейся популяции клеток нейтрофилы и эозинофилы были идентифицированы на основе экспрессии CD11b и Ly-6G, соответственно. Нажмите здесь, чтобы посмотретьБолее крупная версия этого рисунка.
| Клеточная популяция | Абсолютное число клеток у наивных мышей | Абсолютное число клеток у LPS-стимулированных мышей |
| макрофаги | 79612 | 25439 |
| Дендритные клетки | 495 | 671 |
| Т-клетки | 45271 | 28089 |
| В-клетки | 4164 | 2926 |
| нейтрофилы | 632 | 566716 |
| эозинофилы | 3483 | 4332 |
Таблица 4: ПредставлениеРезультаты анализа проточной цитометрии на BAL-жидкости наивных и LPS-стимулированных мышей.
Обсуждение
БАЛ является полезным методом получения цитологической и биохимической информации в ответ на инфекции или наркотики. Первоначально БАЛ использовался для управления чрезмерным выделением слизи у пациентов, страдающих токсичностью фосгена 3 . В настоящее время этот метод используется у людей для исследования патогенеза, диагностики и лечения заболеваний легких 3 , 24 . В лабораторных животных БАЛ обычно используется для мониторинга воспалительных реакций, иммунных механизмов и инфекционных процессов, которые происходят в легочных дыхательных путях 1 , 2 .
Для изучения воспалительного клеточного узора в моделях респираторных заболеваний БАЛ должен сопровождаться абсолютным и дифференциальным подсчетом клеток. В дополнение к абсолютному номеру ячейки также интересны относительные номера ячеек. Например, модели ремонта и рака показывают vКоличество клеток в клетках BAL увеличивается незначительно. В этой модели полезно оценить клеточный состав. Используя окраску клеток в сочетании с световой микроскопией, на основе морфологии 25 , 26 , 27 , 28 , 29 , 30 можно идентифицировать различные типы клеток, такие как эозинофилы, нейтрофилы, макрофаги и лимфоциты. Проточная цитометрия может использоваться для конкретных оценок, например для идентификации различных фенотипов Т-клеток 7 , 31 . В дополнение к идентификации различных популяций инфильтрирующих клеток, неклеточный состав легких можно исследовать с использованием БАЛ. Методы, такие как ELISA, иммуноблот, массив бусинок цитокинов, иммуногистохимия и количественная полимеразная цепная реакция выполняются на БАЛ-жидкости для определения цитокинов, ростаФакторов и других воспалительных компонентов. Для определения повреждения легких можно также измерить уровни общего белка и лактатдегидрогеназы в жидкости БАЛ 32 , 33 .
С развитием новых диагностических инструментов геномная и протеомная характеристика компонентов БАЛ станет возможной в ближайшем будущем. Сочетание расширяющихся вычислительных возможностей и высокопроизводительных технологий экспрессии генов позволит определить профили экспрессии определенных генов для различных болезненных состояний. Выполнение этих методик на БАЛ может обеспечить образцы экспрессии генов и белков, чтобы идентифицировать важные молекулы, вовлеченные в различные фазы легочных заболеваний.
Основным ограничением данных, полученных из жидкости БАЛ, является отсутствие сопоставимости между различными исследованиями 3 , 9 . Существует высокая степеньИзменчивость в технике лаважа и последующая обработка БАЛА. Чтобы иметь возможность сравнивать каждую пробу BAL, необходимо, чтобы стандартизировать тип промывной жидкости, который привил, сайт инстилляции, и фракцию, которая должна быть проанализирована для клеточного и не клеточного состава. Существует значительные различия в количестве лаважа фракций между различными испытаниями, колеблется от одного до 14 раз 34, 35, 36. Эта разница может оказать влияние на ожидаемую величину общего числа клеток в легких. Важно знать, какая BAL фракция жидкости содержит большинство клеток. Песни и др. показал , что примерно 70% от общего числа клеток были получены во фракции одного до трех 22. Тем не менее, другие сообщения о том , что второе промывание содержал больше клеток , чем первый 37, 38 . Мы можем сделать вывод из этих исследований, что промывание только одна фракции не представляет все легких, что приводит к неправильной интерпретации результатов.
Неклеточный состав жидкости BAL содержит ценную информацию о состоянии здоровья легких 33, 39, 40. Изменения в разведении БАЛА способствует разнице в квантификации растворимой фракции и, следовательно, к различиям в результатах между испытаниями. Песни и др. по сравнению с белками и лактата дегидрогеназы уровни каждой промывной фракции и пришли к выводу, что первая промывание фракция содержала два-три раза больше, чем во второй фракции.
Для того, чтобы получить репрезентативную выборку BAL для анализа, некоторые технические соображения имеют решающее значение. Один из них заключается в проведении надлежащего обезболивания. Это очень важно, чтобы проверить футовый рефЛекс мыши для обеспечения терминала седации. Это важно не только по этическим соображениям, но и потому, что трудно установить и сохранить катетер в правильном положении, если мышь не правильно наркозом.
Второй важный фактор является техническим положением катетера в трахее. Когда катетер вставлен слишком глубоко, это может привести к повреждению структуры легких. Дистальный конец катетера не должен достигать легких во время процедуры BAL. Катетер также должен быть стабилизирован и обвязывается с хлопчатобумажной нитью. Если катетер не стабилизируется, вводят физиологический раствор может течь вверх в полость носа, а не в легких. Во время инъекции и аспирации солевого раствора, важно, чтобы держать катетер устойчивым.
Данные, полученные из БАЛА должен представлять все мышиные легких. Поэтому важно , чтобы привить адекватный объем солевого буфера (т.е.3 мл, разделяли на 3 аликвоты по 1 мл каждый). Между выходом клеток и выходом жидкости BAL нет линейной зависимости. Важно аккуратно собирать раствор, массируя грудную клетку мыши. Если сдвигающие силы слишком сильны, жизнеспособность, функция и структура клеток в дыхательных путях и жидкости БАЛ могут быть скомпрометированы. Если аспирированная жидкость не видна в шприце, осторожно перемещайте катетер глубже или выше в трахее.
Особое внимание следует уделить конкретным аспектам обработки и анализа БАЛ. Это позволит максимизировать информацию, сохраненную в образцах BAL. После БАЛ клетки находятся в среде с низким содержанием питательных веществ в солевом растворе. Поэтому очень важно обрабатывать образцы в течение 1 часа после отбора проб БАЛ. Если требуется длительное хранение, требуется использование питательной среды.
Чтобы сохранить жизнеспособность клеток, избегайте труб, которые способствуют прилипанию клеток к поверхности. Избегать centrifugation клеточных суспензий на скоростях, которые могут поставить под угрозу целостности клеток или для предотвращения взмучивания равномерного считываемых клеток БАЛА. BAL жидкости, содержащей клетки должны быть центрифугировали при 400 х г и 4 ° С в течение 7 мин. Важно иметь в виду, что клеточные суспензии следует проводить при температуре 4 ° С во время обработки.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
LVH является научным сотрудником на кафедре биомедицинской молекулярной биологии университета Гента. ERJ поддерживается UniVacFlu, номер гранта 607690. KR поддерживается проектом EC-FP7 FLUNIVAC.
Материалы
| Name | Company | Catalog Number | Comments |
| Hanks' Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 14175-129 | |
| ethyleendiaminetetra acetic acid (EDTA) | Sigma-Aldrich | E6511 | irritating |
| 23 G x 1 1/4 needle | Henke Sass Wolf | 4710006030 | size: 0.60 x 30 mm |
| 26 G x 1/2 needle | Henke Sass Wolf | 4710004512 | size: 0.45 x 12 mm |
| plastic tubing | BD medical technology | 427411 | Polyethylene Tubing, I.D. 0.58 mm (0.023") O.D. 0.965 mm (0.38") 30.5 m (100') |
| sodium pentobarbital | Kela NV | 514 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | PBS without Ca2+ Mg2+ or phenol red; sterile filtered |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | nonpyrogenic and nontoxic |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Surgical scissors | Fine Science Tools GmbH | 91460-11 | |
| centrifuge tube 50 mL | TH.Geyer | 7696705 | Free from Rnase/Dnase/endotoxin |
| centrifuge tube 15 mL | TH.Geyer | 7696702 | Free from Rnase/Dnase/endotoxin |
| microcentrifuge tube 1.5 mL | Sigma-Aldrich | 0030 120.094 | polypropylene |
| Microcentrifuge | Sigma-Aldrich | 5415R | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| Ammonium-Chloride-Potassium (ACK) lysing buffer | Lonza | 10-548E | sterile-filtered |
| live/dead - efluor 506 | ebioscience | 65-0866-18 | fixable viability dye |
| CD11c-PE-cy7 | eBiosciences | 25-0114-81 | |
| SiglecF-PE | BD Pharmingen | 552126 | |
| MHCII-APCefluor780 | Biolegend | 107628 | |
| CD3-PE-cy5 | VWR | 55-0031-U100 | |
| CD19-PE-cy5 | eBiosciences | 15-0193-83 | |
| CD11b-V450 | BD Pharmingen | 560455 | |
| Ly6G-AF700 | Biolegend | 127621 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| anti-CD16/CD32 | BD Pharmingen | 553142 | |
| 96-well 340 µl storage plate plate | Falcon | 353263 | V-bottom, natural polypropylene |
| flow cytometer | BD Biosciences | ||
| catheter | BD Biosciences | 393202 |
Ссылки
- Stankunas, K., et al. Conditional protein alleles using knockin mice and a chemical inducer of dimerization. Mol Cell. 12 (6), 1615-1624 (2003).
- Hunninghake, G. W., Gadek, J. E., Kawanami, O., Ferrans, V. J., Crystal, R. G. Inflammatory and immune processes in the human lung in health and disease: evaluation by bronchoalveolar lavage. Am J Pathol. 97 (1), 149-206 (1979).
- Gee, J. B., Fick, R. B. Bronchoalveolar lavage. Thorax. 35 (1), 1-8 (1980).
- Tornling, G., et al. Hyaluronic acid in bronchoalveolar lavage in rats exposed to quartz. Br J Ind Med. 44 (7), 443-445 (1987).
- Henderson, R. F. Use of bronchoalveolar lavage to detect respiratory tract toxicity of inhaled material. Exp Toxicol Pathol. 57, 155-159 (2005).
- Morris, A., et al. Longitudinal analysis of the lung microbiota of cynomolgous macaques during long-term SHIV infection. Microbiome. 4 (1), 38 (2016).
- Naessens, T., et al. GM-CSF treatment prevents respiratory syncytial virus-induced pulmonary exacerbation responses in postallergic mice by stimulating alveolar macrophage maturation. J Allergy Clin Immunol. 137 (3), 700-709 (2016).
- Chockalingam, A., Duraiswamy, R., Jagadeesan, M. Bronchoalveolar lavage cellular analyses in conjunction with high-resolution computed tomography imaging as a diagnostic intervention for patients with suspected interstitial lung disease. Lung India. 33 (3), 287-291 (2016).
- Crystal, R. G., Reynolds, H. Y., Kalica, A. R. Bronchoalveolar lavage. The report of an international conference. Chest. 90 (1), 122-131 (1986).
- Baughman, R. P. The uncertainties of bronchoalveolar lavage. Eur Respir J. 10 (9), 1940-1942 (1997).
- Singletary, M. L., et al. Modification of a common BAL technique to enhance sample diagnostic value. J Am Assoc Lab Anim Sci. 47 (5), 47-51 (2008).
- Angus, D. W., Baker, J. A., Mason, R., Martin, I. J. The potential influence of CO2, as an agent for euthanasia, on the pharmacokinetics of basic compounds in rodents. Drug Metab Dispos. 36 (2), 375-379 (2008).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. J Vis Exp. (97), (2015).
- Rubio-Navarro, A., et al. Phenotypic Characterization of Macrophages from Rat Kidney by Flow Cytometry. J Vis Exp. (116), (2016).
- Butcher, M. J., Herre, M., Ley, K., Galkina, E. Flow cytometry analysis of immune cells within murine aortas. J Vis Exp. (53), (2011).
- Noto, A., Ngauv, P., Trautmann, L. Cell-based flow cytometry assay to measure cytotoxic activity. J Vis Exp. (82), e51105 (2013).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Database, J. S. E. The ELISA method. J Vis Exp. , (2016).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Wunderlich, M. L., Dodge, M. E., Dhawan, R. K., Shek, W. R. Multiplexed fluorometric immunoassay testing methodology and troubleshooting. J Vis Exp. (58), (2011).
- Song, J. A., et al. Standardization of bronchoalveolar lavage method based on suction frequency number and lavage fraction number using rats. Toxicol Res. 26 (3), 203-208 (2010).
- Seliger, C., et al. A rapid high-precision flow cytometry based technique for total white blood cell counting in chickens. Vet Immunol Immunopathol. 145 (1-2), 86-99 (2012).
- Daniele, R. P., Elias, J. A., Epstein, P. E., Rossman, M. D. Bronchoalveolar lavage: role in the pathogenesis, diagnosis, and management of interstitial lung disease. Ann Intern Med. 102 (1), 93-108 (1985).
- Delayre-Orthez, C., Becker, J., de Blay, F., Frossard, N., Pons, F. Exposure to endotoxins during sensitization prevents further endotoxin-induced exacerbation of airway inflammation in a mouse model of allergic asthma. Int Arch Allergy Immunol. 138 (4), 298-304 (2005).
- Delayre-Orthez, C., et al. PPARalpha downregulates airway inflammation induced by lipopolysaccharide in the mouse. Respir Res. 6, 91 (2005).
- Delayre-Orthez, C., de Blay, F., Frossard, N., Pons, F. Dose-dependent effects of endotoxins on allergen sensitization and challenge in the mouse. Clin Exp Allergy. 34 (11), 1789-1795 (2004).
- Hachet-Haas, M., et al. Small neutralizing molecules to inhibit actions of the chemokine CXCL12. J Biol Chem. 283 (34), 23189-23199 (2008).
- Ble, F. X., et al. Activation of the lung S1P(1) receptor reduces allergen-induced plasma leakage in mice. Br J Pharmacol. 158 (5), 1295-1301 (2009).
- Ble, F. X., et al. Allergen-induced lung inflammation in actively sensitized mice assessed with MR imaging. Radiology. 248 (3), 834-843 (2008).
- Reber, L. L., et al. A dissociated glucocorticoid receptor modulator reduces airway hyperresponsiveness and inflammation in a mouse model of asthma. J Immunol. 188 (7), 3478-3487 (2012).
- Drent, M., Cobben, N. A., Henderson, R. F., Wouters, E. F., van Dieijen-Visser, M. Usefulness of lactate dehydrogenase and its isoenzymes as indicators of lung damage or inflammation. Eur Respir J. 9 (8), 1736-1742 (1996).
- Henderson, R. F. Use of bronchoalveolar lavage to detect lung damage. Environ Health Perspect. 56, 115-129 (1984).
- Forget, G., et al. An adherent cell perifusion technique to study the overall and sequential response of rat alveolar macrophages to toxic substances. Environ Health Perspect. 51, 131-140 (1983).
- Sung, J. H., et al. Recovery from welding-fume-exposure-induced lung fibrosis and pulmonary function changes in sprague dawley rats. Toxicol Sci. 82 (2), 608-613 (2004).
- Majetschak, M., Sorell, L. T., Patricelli, T., Seitz, D. H., Knoferl, M. W. Detection and possible role of proteasomes in the bronchoalveolar space of the injured lung. Physiol Res. 58 (3), 363-372 (2009).
- Rehn, B., Bruch, J., Zou, T., Hobusch, G. Recovery of rat alveolar macrophages by bronchoalveolar lavage under normal and activated conditions. Environ Health Perspect. 97, 11-16 (1992).
- Kelly, C. A., Ward, C., Stenton, S. C., Hendrick, D. J., Walters, E. H. Assessment of pulmonary macrophage and neutrophil function in sequential bronchoalveolar lavage aspirates in sarcoidosis. Thorax. 43 (10), 787-791 (1988).
- Eklund, A., Tornling, G., Blaschke, E., Curstedt, T. Extracellular matrix components in bronchoalveolar lavage fluid in quartz exposed rats. Br J Ind Med. 48 (11), 776-782 (1991).
- Olsen, G. N., Harris, J. O., Castle, J. R., Waldman, R. H., Karmgard, H. J. Alpha-1-antitrypsin content in the serum, alveolar macrophages, and alveolar lavage fluid of smoking and nonsmoking normal subjects. J Clin Invest. 55 (2), 427-430 (1975).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены