Method Article
Etiqueta-libre la proyección de imagen de solo proteínas secretada desde las células viven por medio de la iSCAT microscopía
En este artículo
Resumen
Presentamos un protocolo para la detección óptica en tiempo real de las proteínas solo como se secretan de las células vivas. Esto se basa en Microscopia interferométrica dispersión (iSCAT), que puede ser aplicada a una variedad de configuraciones y sistemas biológicos diferentes.
Resumen
Demostramos la microscopia interferométrica dispersión (iSCAT), un método capaz de detectar proteínas sin etiqueta solo secretadas de las células vivas individuales en tiempo real. En este protocolo, cubrimos los pasos fundamentales para realizar un microscopio iSCAT y complementarlo con otros canales de imágenes para monitorear la viabilidad de una célula bajo estudio. A continuación, utilizamos el método de detección en tiempo real de solo proteínas como son secretadas de una célula viva que nos muestran con una línea de células B inmortalizada (Laz388). Se discuten las medidas necesarias relativas a la preparación del microscopio y muestra, así como el análisis de los datos registrados. El protocolo video demuestra que eso microscopia iSCAT ofrece un método sencillo para estudiar la secreción a nivel de una sola molécula.
Introducción
Proteínas secretadas juegan un papel importante en varios procesos fisiológicos1. Debido a esto, ellos rutinariamente se estudian como un conjunto colectivo (Proteómica) o como entidades individuales2,3. Proteómica tradicionalmente investiga el conjunto de proteínas presentes en un sistema biológico en particular por ejemplo, los análisis enzima-ligado del inmunosorbente (ELISA), citometría de flujo o espectrometría de masas en4,5, 6. Solo proteínas, por el contrario, son generalmente detectadas usando una variedad de técnicas que se basan en la fluorescencia7,8, plasmónica9,10o criogénico electrónica11 Microscopias. Todas estas técnicas utilizan instrumentos complejos, etiquetado o ambos y con frecuencia carecen de información dinámica que sólo entregan información a largo plazo sobre el sistema bajo estudio.
Aquí usamos iSCAT12,13 microscopia para proteínas secretoras individuales del sentido segundo resolución temporal14. Lo importante, la técnica detecta la débil señal dispersa intrínseca a cada proteína12,14. La cantidad de luz que esparce una bioparticle pequeña escala con su polarizabilidad. Suponiendo que la forma de una proteína se puede aproximar por una dispersión efectiva esfera14,15,16y que diferentes proteínas tienen índices de refracción muy similares, la señal de medición puede ser directamente conectado con el peso molecular (MW) de la proteína. La calibración empírica iSCAT contraste versus peso molecular por medidas de referencia permite distinguir las proteínas de diferentes tamaños. iSCAT experimentos pueden ser fácilmente complementados por microscopia de fluorescencia17,18, immunosorbent reactivos, así como las etiquetas fluorescentes o dispersión para permitir una detección específica de alguna proteína de interés14 , 17 , 19.
En principio, iSCAT funciona amplificando la débil luz dispersada de una proteína mediante interferometría mezclado con una onda de referencia secundario. La intensidad detectada (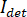 ) en un iSCAT microscopio es descrito por
) en un iSCAT microscopio es descrito por
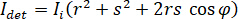
donde 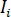 es la intensidad incidente,
es la intensidad incidente,  es un coeficiente para la contribución de la onda de la referencia,
es un coeficiente para la contribución de la onda de la referencia,  significa la fuerza de dispersión de la nano-objeto de estudio, y
significa la fuerza de dispersión de la nano-objeto de estudio, y 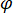 es el desplazamiento de fase entre los dispersos y de referencia olas de14. Ya sea la transmitida o reflejada detrás luz del incidente se utiliza normalmente como una onda de la referencia, donde en cada caso
es el desplazamiento de fase entre los dispersos y de referencia olas de14. Ya sea la transmitida o reflejada detrás luz del incidente se utiliza normalmente como una onda de la referencia, donde en cada caso 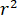 representa la transmisividad o reflectividad de la cámara de muestra, respectivamente. El término
representa la transmisividad o reflectividad de la cámara de muestra, respectivamente. El término 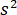 es proporcional a la sección de dispersión de la proteína y puede ser descuidado en comparación con el término cruzado. Lo,
es proporcional a la sección de dispersión de la proteína y puede ser descuidado en comparación con el término cruzado. Lo, 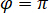 para interferencia destructiva completa, se da la luz detectada por
para interferencia destructiva completa, se da la luz detectada por 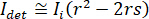 donde
donde 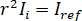 es la intensidad de referencia y
es la intensidad de referencia y 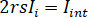 es la intensidad de interferencia.
es la intensidad de interferencia.
iSCAT microscopia ofrece un excelente método para estudiar los procesos biológicos a nivel de una sola molécula. Por ejemplo, investigamos las células Laz388, un virus de Epstein - Barr (EBV) transformado linfocito B célula línea20,21 — como segregan proteínas como los anticuerpos de IgG16. Sin embargo, el método es general y puede aplicarse a una variedad de otros sistemas biológicos. iSCAT es inherentemente inespecífica y puede detectar cualquier proteína o nanopartículas o puede ser extendido con métodos de funcionalización de superficies comunes para la detección de la específica o multiplexado. Su sencillez y capacidad para ser combinado con otras técnicas ópticas, tales como microscopía de fluorescencia, hacen iSCAT una valiosa herramienta complementaria en biología de la célula.
Protocolo
PRECAUCIÓN: Lea todas las hojas de datos de seguridad del material (MSDS) antes de utilizar cualquier producto químico, observar todas las prácticas de seguridad apropiadas y usar equipo de protección personal (anteojos de seguridad láser, protección ocular, guantes, batas de laboratorio) según sea necesario.
1. construcción de la iSCAT microscopio16,18
Nota: El microscopio de la iSCAT típicamente consiste en una configuración modificada microscopio invertido. En Resumen, un láser se enfoca sobre el plano focal detrás de un objetivo de alta apertura numérica (NA) y un lente de proyección de imagen se utiliza para enfocar la luz detrás-dispersada de la partícula en un chip de cámara. En general, este amplio campo microscopio puede construido desde cero o basada en un microscopio invertido existente. Este protocolo cubre los pasos esenciales para realizar la configuración, mientras que es posible realizar cambios en el hardware utilizado. Una descripción más detallada de la Asamblea de un microscopio de la iSCAT puede encontrarse en la obra de Arroyo et al. 18.
PRECAUCIÓN: Un microscopio iSCAT implica una clase IIIB a fuente de luz láser clase IV. Protección de ojo apropiada es necesario cuando el montaje y alineación de la óptica del microscopio. Durante el montaje de microscopio, asegúrese de que la trayectoria del rayo laser permanece recta y no se desvía como se agregan nuevos componentes ópticos.
-
Establecer el camino de la iluminación del microscopio.
- Utilizando una mesa óptica amortiguada y un bloque de metal rígido, construir un microscopio muestra etapa18 que incorpora un objetivo de alta apertura numérica (NA) (100 X / 1.46 NA) y una unidad de traducción que permite traducción lateral muestra como cambio de enfoque posición para el objetivo.
Nota: Funcionamiento de un microscopio de la iSCAT en el límite de detección de proteínas individuales es altamente susceptible a las vibraciones externas. Una etapa de piezo centrosimétricas que soporta la muestra de todos los lados se recomienda limitar las excitaciones acústicas de la muestra que de lo contrario comprometería la estabilidad lateral y focal. La figura 1 muestra una etapa de muestra adecuado, incluyendo la unidad de traducción de piezo y el objetivo. Además, se recomienda que se utilizan montajes masivos y estables para todos los componentes ópticos en los siguientes pasos. Dichos componentes están disponibles de proveedores óptica comercial. - Use un lente de camiseta 50 cm distancia focal (lente de campo amplio) y a 45° (vertical) acoplamiento espejo para enfocar la luz de un láser de diodo en nm de longitud de onda 445 sobre el plano focal detrás del objetivo. Esto crea un haz colimado en el foco delantero del objetivo y se convertirá en la fuente de iluminación de la iSCAT. Si es necesario, filtrar el láser espacial antes de la lente de 50 cm por 30 μm del agujero de alfiler o fibra del solo modo.
- Aplicar una gota de aceite de inmersión el objetivo y colocar un cubreobjetos de cristal en el plano de la muestra de la platina del microscopio. Esto resultará en un rayo que se refleja hacia abajo a través del imagen objetivo.
Nota: La reflexión surge de la interfase aire-vidrio en la superficie del cubreobjetos muestra y servirá como base para la viga de referencia de la iSCAT. Polvo en la superficie del cubreobjetos o suciedad residual dará lugar a fuentes puntuales de dispersión, que ayuda en el correcto enfoque del imagen objetivo en los próximos pasos.
PRECAUCIÓN: La mayoría de la luz láser transmite a través de cubreobjetos y viaja hacia arriba desde el objetivo. Colocar un difusor especular opaco (por ej., una tarjeta de papel) sobre el cubreobjetos para minimizar el riesgo de lesiones debidas a la luz del láser.
- Utilizando una mesa óptica amortiguada y un bloque de metal rígido, construir un microscopio muestra etapa18 que incorpora un objetivo de alta apertura numérica (NA) (100 X / 1.46 NA) y una unidad de traducción que permite traducción lateral muestra como cambio de enfoque posición para el objetivo.

Figura 1: etapa de muestra iSCAT. La fotografía muestra el bloque de aluminio que se monta la unidad de traducción de piezo (negro) así como el centrado 100 x objetivo. La etapa de 3-eje piezoeléctrico permite un posicionamiento preciso de la muestra en el plano focal del objetivo. Enfoque grueso se realiza haciendo girar un tubo roscado en el que el objetivo es montar (no representado). El bloque se coloca sobre la mesa óptica con cuatro pedestales de acero sobre el espejo de acoplamiento de 45°. Haga clic aquí para ver una versión más grande de esta figura.
-
Establecer la ruta de la imagen del microscopio.
- Introducir un antireflejos (AR)-revestido divisor de viga (reflexión del 70%, 30% transmisión) a un ángulo de 45° en relación con el haz incidente y aproximadamente 10 cm después de la lente de campo amplio. Punto de la capa de AR hacia la fuente del láser. Esto transmite el haz incidente y refleja la referencia y dispersos rayos con un ángulo de 90° para el haz incidente.
Nota: Divisores de viga revestida de AR o cuña se recomiendan como efectos fantasma y franja significativa pueden ocurrir cuando se utiliza División de cubos o divisores de viga plana sin recubrimiento de la viga. Vea la discusión para más detalles. Si lo desea, cualquier rayo reflejado no deseado derivados de la parte posterior del divisor de viga puede ser bloqueado por el uso de un diafragma de iris. - Un divisor de viga gruesa presentará un desplazamiento significativo de la viga para que el láser no puede entrar el objetivo directamente ya. Si es necesario, vuelva a alinear la trayectoria del haz laser antes del divisor de viga para asegurar la correcta propagación a través del objetivo.
Nota: El divisor de viga puede también añadirse antes de la lente de campo amplia y la platina del microscopio se coloca (en el paso 1.1.2.), para que el rayo no se desplazará más adelante. - En este punto, centran el imagen brazo del interferómetro y asegúrese de que el plano de la muestra y la cámara son parfocal. Coloque una cóncava f = lente-45 cm en la posición de 5 cm después de la lente de campo amplio en la trayectoria del haz incidente. Esto resultará en un haz colimado, entrar en la abertura posterior del objetivo.
- Con una pantalla colocada en el brazo reflejado del interferómetro, mover el objetivo en la dirección vertical para encontrar la posición focal gruesa. El objetivo está en foco cuando la viga golpea la pantalla es colimada.
Nota: La figura 2 muestra un esquema de este proceso. - Eliminar tanto el f =-45 cm de la lente y la pantalla cuando finalice el enfoque grueso.
Nota: En lugar de utilizar una lente de longitud focal negativa, la lente de campo amplio sí mismo puede ser colocada sobre un soporte móvil y desplazada fuera de la trayectoria de viga para este paso. Sin embargo, para lograr la configuración más estable del microscopio, se recomienda para mantener la lente de campo amplio en una posición fija. - Añadir un segundo f = lente de camiseta de 50 cm la luz dispersada y colimar la luz reflejada sobre el sensor de una cámara CMOS. Asegúrese de que la lente se coloca a 50 cm desde el plano focal detrás del objetivo con el fin de volver a colimar el haz de referencia y enfocar la luz dispersada.
- Lugar la CMOS chip 50 cm de distancia de la f = lente de 50 cm y colocar la viga directamente sobre el medio de la viruta.
Nota: Los siguientes parámetros se utilizan típicamente para la proyección de imagen. La potencia de salida del láser (longitud de onda 445 nm) se establece en 100 mW. Agujero de alfiler y viga splitter atenuar la luz transmitida para que el poder efectivo en el objetivo es aproximadamente 9 mW. El diámetro de la viga en la posición de la muestra asciende a 6 μm. Con la lente de proyección de imagen usada, la ampliación efectiva del sistema es x unos 300. El tamaño de la imagen sobre el chip CMOS se encuentra a 128 × 128 píxeles dentro del área iluminado, dando por resultado un campo de visión de aproximadamente 5 × 5 μm2. La figura 3 muestra un esquema del microscopio iSCAT completamente montado.
- Introducir un antireflejos (AR)-revestido divisor de viga (reflexión del 70%, 30% transmisión) a un ángulo de 45° en relación con el haz incidente y aproximadamente 10 cm después de la lente de campo amplio. Punto de la capa de AR hacia la fuente del láser. Esto transmite el haz incidente y refleja la referencia y dispersos rayos con un ángulo de 90° para el haz incidente.
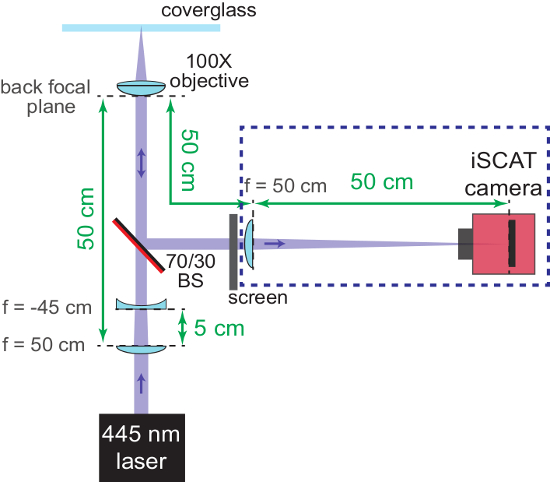
Figura 2: enfoque grueso del microscopio iSCAT. El esquema muestra la disposición de la óptica para ayudar a que el sistema en foco. La parte posterior recubiertos de AR del divisor de viga (70/30 BS) está marcado en rojo. Distancias importantes son siempre en verde. Se denota la longitud focal (f) de las lentes utilizadas. Componentes en la caja punteada azul se añaden en pasos 1.2.6 - 1.2.7. La lente cóncava (solía volver a colimar el haz convergente de iSCAT) y la pantalla se quitan más adelante. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: microscopio iSCAT. El esquema muestra el microscopio iSCAT totalmente montado. La parte posterior recubiertos de AR del divisor de viga (70/30 BS) está marcado en rojo. Distancias importantes son siempre en verde. Se denota la longitud focal (f) de las lentes utilizadas. Haga clic aquí para ver una versión más grande de esta figura.
-
Establecer canales adicionales de imagen.
Nota: Esta sección agrega otro camino imágenes al microscopio que permite la observación de una amplia zona que rodea el láser iSCAT mediante microscopía de campo brillante y para monitorear la viabilidad celular mediante microscopía de fluorescencia.- La salida de una fuente de luz LED (aproximadamente 500 nm < λ < 580 nm) en un largo trabajo objetivo de NA distancia 20 X / 0.4 e instalar componentes mecánicos por encima de la cámara de muestras que permiten enfoque y posicionamiento lateral de la salida del LED en la muestra.
- Asegúrese de que el LED de salida del espectro cubre la gama de la excitación del marcador de la muerte de la célula (yoduro de propidio (PI)) y no interfiere con su fluorescencia (λ > 600 nm). Utilice filtros ópticos si es necesario.
- Mover el objetivo superior lateralmente para que la parte superior (gran campo) y baja (iSCAT) objetivos son colineales. Esto se determina colocando una pantalla bajo el objetivo inferior y maximizando la intensidad de luz transmitida del LED en la pantalla. Coloque un λ = 550 espejo dicroico corto paso nm (SPDM) dividir la transmisión LED luz de la trayectoria del laser iSCAT.
- Este rayo se dividió en dos canales con un divisor de viga transmisivo de reflective/92% 8% (BS). La ruta de 92% es el canal de la fluorescencia y la ruta de acceso de 8% se utiliza para la proyección de imagen de campo claro.
- Imagen del canal de campo brillante en una cámara CMOS con una f = objetivo doblete acromático de 5 cm.
- Imagen del canal de la fluorescencia en una cámara CMOS separado usando una f = 5 cm doblete acromático lentes y un λ = 600 nm largo-filtro para bloquear la luz de excitación. Figura 4a muestra un esquema del microscopio completamente montado incluyendo todos los canales de proyección de imagen.
- La salida de una fuente de luz LED (aproximadamente 500 nm < λ < 580 nm) en un largo trabajo objetivo de NA distancia 20 X / 0.4 e instalar componentes mecánicos por encima de la cámara de muestras que permiten enfoque y posicionamiento lateral de la salida del LED en la muestra.

Figura 4: microscopía iSCAT de proteínas secretadas por las células. (a) esquema del microscopio descrito en el protocolo. Vea la sección 1 para obtener más información. Abreviaturas: LED, diodo emisor de luz; SPF, filtro corto; OBJ, objetivo; SPDM, espejo dicroico de paso corto; BS, divisor de viga; LPF, filtro largo; BF, brillante-campo; Fluor, fluorescencia; C1-C3, cámara de 1-3. (b) campo brillante imagen de un solo Laz388 célula de aproximadamente 4 μm de la iSCAT campo de visión (representado por un cuadrado blanco). Imagen tomada con cámara C3, barra de escala: 10 μm. (c) fluorescencia imagen de la misma región se muestra en (b) con la posición de la celda marcada por un círculo blanco. La ausencia de fluorescencia indica que la célula sea viable. Imagen tomada con cámara C2, barra de escala: 10 μm. (d) materia prima iSCAT cámara instantánea de la imagen con el tiempo de exposición de 80 μs. Imagen tomada con cámara C1. (e) iSCAT imagen de la misma región después de la sustracción de fondo espacio-temporal como se describe en la sección de discusión. La imagen fue integrada 1000 secuencial crudo fotogramas (d) con un tiempo final marco de 400 ms y revela la rugosidad de la superficie del cubreobjetos de vidrio. (f) imagen de iSCAT diferencial correspondiente que muestra el evento de unión de 2 proteínas sobre el cubreobjetos. La imagen fue construida por restar dos imágenes consecutivas de filtrado (e). Barras de escala en (d), (e) y (f): 1 μm. Esta figura ha sido adaptada de McDonald ' s, M.P. et al. 16. copyright 2018 American Chemical Society. Haga clic aquí para ver una versión más grande de esta figura.
-
Configurar la computadora y software.
- Conectar todas las cámaras fotográficas a una computadora. Instalar paquetes de controladores respectivos y obtener/escribir software para su control.
Nota: El hardware adecuado es necesario para la adquisición de alta velocidad. Como mínimo, se recomiendan un procesador multi-core, 16 GB de RAM, una tarjeta del capturador de marco y un disco de estado sólido para almacenamiento de datos. - Observar la imagen de la iSCAT en el CMOS de la cámara y asegúrese de que esté en foco por encontrar una partícula de polvo o suciedad residual en el vidrio cubreobjetos. Verificar que la imagen de la partícula es que un punto circular simétrico extensión función (PSF).
Nota: La razón principal para una PSF no circular simétrico es que el rayo láser no entra en el objetivo derecho pero en un pequeño ángulo respecto al eje óptico. Esto se corrige ajustando el ángulo y la posición del haz incidente con el espejo de acoplamiento de 45°. - Compare las imágenes de la cámara de campo brillante y los canales de fluorescencia. Asegúrese de que ambos están en foco y mostrar la misma área. Compruebe que la posición del láser iSCAT es aproximadamente en el centro de la imagen y tomar nota de su posición para futuras referencias. Consulte la Figura 4b, 4f para imágenes de la típica cámara.
Nota: Utilice una muestra de células o perlas fluorescentes para encontrar el foco de los dos canales. Quite temporalmente el filtro de la fluorescencia largo para ajustar el sistema. El foco de proyección de imagen convencional de las células debe ser ligeramente más alta que el plano focal de la iSCAT. Para compensar esto sin mover el objetivo, desplazar las cámaras desde sus posiciones en el foco de los dos respectivos f = lentes de 5 cm. - Configure los parámetros de cámara necesarios. Utilizar una velocidad de fotogramas fijos y desactivar herramientas de aumento y corrección de software.
Nota: Los siguientes parámetros son utilizados: iSCAT se cambia a los 5000 marcos por segundo (fps) con un tiempo de exposición de 80 μs. Como se mencionó anteriormente, el tamaño de la imagen es de 128 × 128 píxeles. Las cámaras de campo claro y fluorescencia funcionan a tamaño de fotograma completo (1280 × 1024 píxeles). Proyección de imagen del brillante-campo se lleva a cabo con un tiempo de exposición de 20 ms. La fluorescencia se cambia al tiempo de exposición de ms de 750 y 5 fotogramas consecutivos se acumulan para formar una imagen final. Se adquieren imágenes de campo brillante y fluorescencia a intervalos fijos de tiempo de s 20.
- Conectar todas las cámaras fotográficas a una computadora. Instalar paquetes de controladores respectivos y obtener/escribir software para su control.
2. preparación del experimento
-
Preparar el medio de la microscopia común.
- Añadir 25 mL de tampón HEPES (1 mol/L) a 975 mL de Medio RPMI 1640 para llegar una final 1 L de solución HEPES de 25 mmol/L. Alternativamente, utilizando un medio buffer HEPES ya incluido.
Nota: HEPES se utiliza para mantener el pH del medio durante la medición en condiciones ambientales (por ejemplo, fuera una incubadora y sin CO2 fuente constante). - Tomar una alícuota de la solución que necesita para un experimento y deje que se caliente hasta la temperatura ambiente. 2 mL del medio es suficiente. Guardar la solución restante a 4 ° C.
- Añadir 25 mL de tampón HEPES (1 mol/L) a 975 mL de Medio RPMI 1640 para llegar una final 1 L de solución HEPES de 25 mmol/L. Alternativamente, utilizando un medio buffer HEPES ya incluido.
-
Preparar la cubeta de microscopio.
Nota: Los pasos siguientes describen el procedimiento para un sostenedor de la muestra a la medida que consiste en una placa base de aluminio y un plato de la cubeta de acrílico que corrige el cubreobjetos y parejas para el posicionador 3D piezoeléctrico. También pueden utilizarse platos de cultivo estériles comercialmente disponibles con fondo de vidrio.
Nota: La figura 5 muestra fotografías de lo portamuestras a la medida.- Tomar un cubreobjetos microscopio nuevo y enjuagar con agua desionizada (agua desionizada) y etanol. Secar el portaobjetos con nitrógeno o aire comprimido.
- Limpie el cubreobjetos en un ambiente de plasma de oxígeno (0,3 mbar presión de gas) durante 10 min a potencia 500 W. Esto elimina todas las impurezas orgánicas de la superficie.
- Limpie el plato de la cubeta de acrílico sumergiéndolo en 0,2 mol/L de solución de NaOH durante aproximadamente 10 minutos enjuague con agua desionizada.
- Montar el portamuestras y cubrirlo con un plástico de Petri hasta que se necesite en el experimento.

Figura 5: sostenedor de la muestra medida. (a) muestra los componentes de soporte: (1) plato de la cubeta de acrílico; (2) placa base de aluminio; (3) tornillos de sujeción; (4) silicona junta tórica; (5) cubreobjetos. (b) totalmente montado portamuestras. Haga clic aquí para ver una versión más grande de esta figura.
-
Preparar el microscopio.
- Activar el láser de iluminación iSCAT, la fluorescencia/brillante campo de la iluminación LED, cámaras y el computadora y software de adquisición. Bloquear el rayo láser en una posición ante el objetivo.
- Garantizar que el 100 X 1.46 objetivo de NA es limpio. Si no, use limpieza toallitas y etanol para limpiar el objetivo con arreglo a las pautas del fabricante.
- Aplique una gota de aceite de inmersión en el objetivo del microscopio.
- Tomar el portamuestras (montado en la sección 2.2) y montar con cuidado en la etapa de piezo del microscopio iSCAT para que el cubreobjetos de la muestra se centra en el objetivo del microscopio. Ser atento y cuidadoso para no dañar la lente del objetivo. Fijar la unidad para el posicionador piezoeléctrico con tornillos asegurando al mismo tiempo que el fabricante especifica par máximo no se exceda.
- Añadir 1 mL de medio de microscopía común (preparado en la sección 2.1.) en la cubeta.
- Añadir 2 gotas de colorante de yoduro de propidio al medio como una célula muerte marcador16,22.
- Desbloquear el láser y que el sistema en foco. En primer lugar, verifique que el objetivo quede a la distancia correcta del cubreobjetos repitiendo los pasos 1.2.3. -1.2.5. (Figura 2). Luego, afinar el enfoque con el eje z de la etapa de piezo.
- Confirmar que todos los ajustes para las fuentes de luz, cámaras y software están ajustados correctamente. Esto incluye parámetros como la energía del laser LED intensidad, velocidades de fotogramas de la cámara, tiempos de exposición de la cámara y software ahorrar caminos.
Nota: Guardar videos a velocidades de fotogramas alta puede producir tamaños de archivo grandes. Asegurar suficiente espacio de disco libre en el equipo. - Bloquear otra vez el rayo láser. El microscopio está listo para un experimento.
-
Preparación de las células.
Nota: Laz388 las células20 son cultivadas en Medio RPMI 1640 suplementado con 10% de suero fetal de ternero (FCS), aminoácidos, piruvato y antibióticos. Las células se incubaron a 37 ° C y 5% CO2 split y proporcionadas de medio fresco cada 2-3 días23.- Tome el frasco de cultivo celular de la incubadora y aspirar medio que contiene aproximadamente 1 x 106 células. Para determinar el volumen correcto, cuantificar la concentración de la cultura de célula por medio de un hemocitómetro.
- Mezcle la solución de celular con 10 mL de Medio RPMI 1640 a temperatura ambiente y centrifugar la muestra a 300 x g por 7 min.
- Con cuidado Extraiga y descarte el sobrenadante asegurando que el pellet de células concentradas sigue siendo imperturbado.
- Repita los pasos del 2.4.2. – 2.4.3. con el sedimento concentrado de células.
- Resuspenda las células en medio de la microscopia común de 0,5 mL (preparado en la sección 2.1.) y utilizarlos inmediatamente en un experimento.
3. iSCAT microscopía de células secretoras de
- Asegúrese de que el rayo láser está bloqueado para impedir que las células están directamente expuestas a la luz laser de la iSCAT.
- Inyectar las células en la cubeta de muestra.
- Inyectar aproximadamente 3 μl de la muestra de células (preparado en la sección 2.4.) ligeramente fuera del centro en la cubeta de muestra. Toque suavemente la punta de la pipeta para el cubreobjetos e inyecte lentamente la solución de la célula. Permitir que las células sobre cubreobjetos.
Nota: Use pipetas de pequeño volumen (10 μl) o puntas de gel-carga largas y flexibles. - Asegúrese de que la densidad de las células está por debajo de aproximadamente 1 célula por 500 mm² para que sola célula mediciones no están influenciadas por múltiples células en la zona que rodea el láser iSCAT.
- Si el número de células es demasiado baja, repita paso 3.2.1. hasta que esté disponible un número suficiente.
- Si la cobertura de las células es demasiado densa, use una inyección de aproximadamente 20 μl de medio de microscopia adicional para dispersar las células en el cubreobjetos.
- Inyectar aproximadamente 3 μl de la muestra de células (preparado en la sección 2.4.) ligeramente fuera del centro en la cubeta de muestra. Toque suavemente la punta de la pipeta para el cubreobjetos e inyecte lentamente la solución de la célula. Permitir que las células sobre cubreobjetos.
- Usando al posicionador de piezo, mover la muestra lateralmente para colocar un celular cerca (aproximadamente 10 μm) para el campo de visión de la iSCAT. Asegúrese de que la célula no entra el iSCAT campo de visión como la exposición directa a la luz de láser 445 nm podría ser perjudicial para la célula.
- Utilice imágenes de campo claro y fluorescencia para localizar y verificar la viabilidad de la célula25.
Nota: Una célula viable tiene una forma redonda en la imagen de campo claro y no es fluorescente, mientras que la muerte celular está indicada por las señales de fluorescencia fuerte derivados de la presencia de yoduro de propidio dentro de la célula22. - Desbloquear el láser iSCAT y asegurar que la superficie del cubreobjetos aún está en foco. Adjuntar la tabla de aislamiento para minimizar la deriva y Acoplador acústico del entorno ambiental.
Nota: Este último se logra con pesadas cortinas ópticas o paneles de acrílico que rodea la mesa óptica. - Iniciar la medición con la adquisición de imágenes de las cámaras iSCAT, campo claro y fluorescencia. Automatizar y controlar el proceso a través del software para maximizar la eficiencia experimental. Revise periódicamente la viabilidad de la célula y el foco del sistema.
Nota: Dependiendo de la intensidad del laser, componentes ópticos y ajustes de tiempo de exposición de la cámara, el láser iSCAT podría interferir con la cámara de fluorescencia. Si se observa este comportamiento, considera encofrado el láser iSCAT temporalmente durante la adquisición de imágenes de fluorescencia.
4. Análisis de datos
Nota: Los datos experimentales están inherentemente ruidosos y iSCAT imágenes no son diferentes. Hay varias fuentes de ruido en una medida típica iSCAT, incluyendo distorsiones del frente de onda en la fuente de luz incidente, la rugosidad de la superficie del cubreobjetos y ruido de la cámara. La siguiente sección presenta algunas maneras en que estas fuentes de ruido son remediadas mediante procesamiento posterior. Además, inestabilidades laterales mecánicas de la instalación conducen a datos ruidosos y deben abordarse en consecuencia, como se describe en la sección de discusión. Los análisis descritos se realizan con scripts personalizados de MATLAB.
- Minimizar el ruido de la cámara de filtrado de los datos en bruto con un filtro de Fourier bidimensional que excluye a frecuencias espaciales altas. El tamaño del filtro necesita ser ajustado para adaptarse a la configuración experimental específica (determinada principalmente por la apertura numérica del sistema).
Nota: Características de la imagen con frecuencias espaciales más altas que el sistema óptico se originan de fuentes extrañas (como ruido de lectura de cámara) y se pueden descuidar. - Convertir las imágenes de cámara raw cuentas iSCAT contraste.
Nota: La señal detectada por la cámara es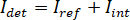 . iSCAT contraste se define como
. iSCAT contraste se define como 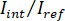 que
que 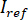 es la intensidad de la luz de la referencia, en este caso la parte reflejada por el cubreobjetos, y
es la intensidad de la luz de la referencia, en este caso la parte reflejada por el cubreobjetos, y 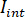 es la interferencia entre
es la interferencia entre 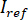 y la intensidad dispersada (
y la intensidad dispersada (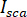 ).
).- Separar la señal en
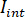 y
y 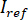 al computar la media temporal de Marcos particular en que las partículas de interés no están presentes. La imagen resultante proporciona la señal de referencia
al computar la media temporal de Marcos particular en que las partículas de interés no están presentes. La imagen resultante proporciona la señal de referencia 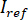 .
.
Nota: Como alternativa, un paso de sustracción de fondo activo puede realizarse como se describe en la siguiente discusión. - Calcular el contraste según
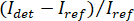 12,14,16.
12,14,16.
- Separar la señal en
- Crear una imagen diferencial balanceo restando cada fotograma consecutivo de su sucesor.
Nota: Las señales de Residual de la rugosidad de la superficie del cubreobjetos y las distorsiones del frente de onda se quitan con eficacia en este paso ya que son constantes dentro de fotogramas consecutivos. El diferencial de balanceo elimina estas señales residuales, dejando solo los enlaces de proteínas que se producen de un fotograma al siguiente. Esta sustracción del fondo dinámico es beneficiosa ya que no es sensible a largo plazo muestra derivas. - Aplicar un algoritmo de búsqueda de pico para detectar e índice partículas individuales para cada marco y determinar su contraste específico y su posición.
- Utilizar la información recopilada en el paso 4.4 para crear histogramas de eventos de enlace de la proteína y sus contrastes extraídos se relaciona con la masa de proteína a través de una curva de calibración compilada de proteína conocidas muestras14,24.
Resultados
En la figura 4ase muestra un esquema de un microscopio de la iSCAT. Representante de campo claro, fluorescencia y iSCAT crudas imágenes se muestran en la Figura 4b, 4Cy 4D, respectivamente16. Figura 4e y 4f mostrarán los resultados de eliminación de fondo y puesto diferencial procesamiento; dos proteínas adsorbidas son visibles como manchas de difracción limitada en figura 4f. La figura 6 muestra un histograma de las proteínas detectadas en el transcurso de 125 s. Estos datos se obtuvieron mediante la aplicación de un algoritmo de búsqueda de pico a las imágenes para contar los eventos de enlace y catalogar su contraste16. Se detectaron un total de 503 proteínas.
Especie próxima, secretada es identificado por comparación con mediciones de referencia llevadas a cabo en soluciones de proteínas purificadas, o a través de mediciones adicionales con superficies de vidrio funcionalizados14,16. Los datos de la iSCAT, así, visualizan directamente dinámica de secreción celular en subsegundos escala16. Por ejemplo, anteriormente hemos encontrado que los anticuerpos IgG son una fracción importante del secretoma de Laz388 y se liberan de la célula a una velocidad de aprox. 100 moléculas por segundo16. Además, otras partículas que abarcan una gama de 100 kDa - 1000 kDa son secretadas por las células16. El método descrito puede ser más empleadas por ejemplo, para investigar el gradiente de la concentración espacial de las secreciones que rodea una célula16, o para determinar la dinámica temporal de la lisis celular16.
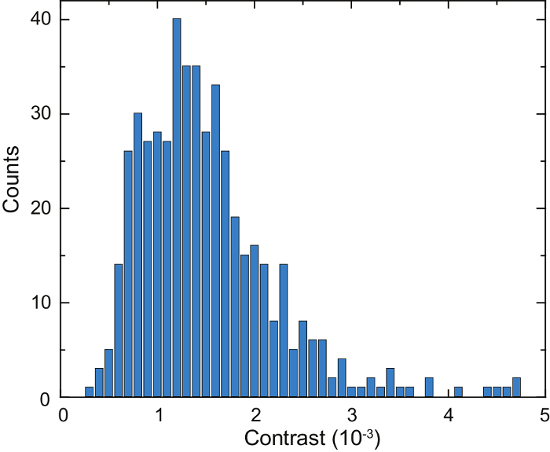
Figura 6: cuantificación de proteínas secretadas por una célula Laz388. El histograma muestra las proteínas detectadas durante un periodo de contraste s. 125 valores se acumulan en cubos de 1 x 10-4 contraste (barras azules). Un total de 503 proteínas individuales fueron contados durante esta medición. El experimento se repitió 10 veces con resultados similares. Esta figura ha sido adaptada de McDonald ' s, M.P. et al. 16. copyright 2018 American Chemical Society. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Uno de los aspectos más importantes para la obtención de datos útiles iSCAT es la habilidad para encontrar la posición focal en la superficie del cubreobjetos y, además, a mantener esta posición por largos períodos de tiempo. No hacerlo resultará en ampliado PSFs, iSCAT débiles señales y artefactos asociados a la deriva en el análisis de la dinámica. Resulta que encontrar el plano focal en un cubreobjetos limpio, pelado superficie no es tarea fácil como características superficiales no son visibles contra el fondo de viga de gran referencia (ver figura 4 d).
ISCAT crudas imágenes son a menudo oscurecidas por las señales de fondo que surgen de las impurezas de frente de onda en la fuente de excitación y pueden dificultar la capacidad de encontrar el plano de proyección de imagen correcto. Resta de activo frente de onda es una forma útil para eludir esta cuestión y posteriormente controlar el foco de la iSCAT durante una medida16. Una manera de lograrlo es a través de la modulación espacial muestra. En Resumen, un generador de funciones aplica una onda cuadrada de 50Hz al puerto de control externo de la etapa de piezoeléctrica, lo que resulta en una modulación espacial muestra a la frecuencia aplicada (amplitud de 290 nm). Adquisiciones de cámara sincrónica se activan de la misma fuente y, cuando se combinan a través del bloqueo de principios, dan como resultado una imagen compensada de frente de onda14,16. La imagen resultante muestra típicamente la rugosidad de la superficie del cubreobjetos (Figura 4e). Pequeñas características que queda en el vidrio después de la limpieza pueden utilizarse para poner el microscopio en foco. Parámetros utilizados para esta etapa de sustracción de fondo activo pueden cambiarse según la velocidad de fotogramas, tiempo de exposición o hardware.
Como se mencionó anteriormente, se recomienda el uso de un divisor de haz de alta calidad en la configuración de la iSCAT (paso 1.2.1.), como de artefactos como fantasma o interferencias derivadas de divisores de viga plana fina que influyen en la imagen y perturbar la medición. La figura 7 muestra una comparación entre un divisor de haz de alta calidad y baja calidad. Ambas imágenes raw iSCAT muestran la misma área en el cubreobjetos con algunas partículas residuales. La misma configuración de la iSCAT fue utilizada para capturar ambas imágenes, sólo el divisor de viga fue intercambiado. La Figura 7a muestra la imagen formada en la cámara por medio de una más gruesa (5 mm), divisor de haz cubierto AR y cuña. Debido al diseño de la cuña, el rayo reflejado de la superficie posterior del divisor de haz es el paralelo a la reflexión de la superficie frontal y no entra en el objetivo. No hay artefactos de interferencia se producen. Figura 7b muestra el mismo campo de vista en la muestra, pero esta vez se utilizó un divisor de viga plana más fino (1 mm). Los dos reflejos de las superficies frontales y posterior del divisor de viga son paralelos y propagan a la cámara. Artefactos de interferencia son claramente visibles.
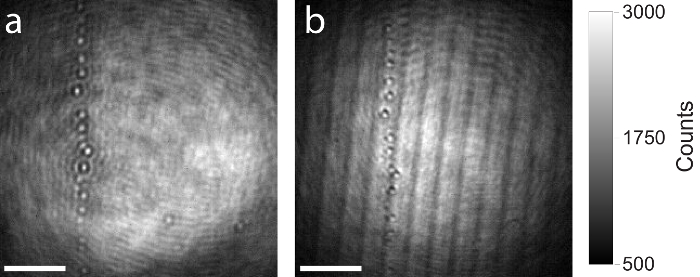
Figura 7: comparación de imágenes de la iSCAT produjo con divisores de haz de alta y baja calidad. (a) resultando iSCAT cruda imagen por medio de un divisor de viga de espesor recubierto de AR y cuña de 5 mm. (b) resultando iSCAT cruda imagen de la misma zona por el uso de un divisor de viga plana gruesa 1 mm. Ambos divisores de viga tienen la misma relación de división (reflexión del 50%, 50% de transmisión). Artefactos de interferencia de reflexiones de Fresnel se observan claramente en la imagen con el divisor de viga plana gruesa de 1 mm. Barras de escala: 2 μm. haga clic aquí para ver una versión más grande de esta figura.
En este protocolo se describe un esquema de iluminación de gran campo para iSCAT ya que es rápido, fácil de realizar y permite la detección paralela sobre un área grande14. Otro enfoque común es utilizar deflectores de acusto-óptica (AODs) y una viga confocal de la exploración a través de la muestra12,17. Este enfoque evita la necesidad de frentes de onda de alta calidad pero es más experimental complejo convencional proyección de imagen de gran campo. Además, la velocidad de iluminación confocal está limitada por la de AODs. Dependiendo de los parámetros experimentales deseados, ya sea esquemas confocal o gran campo de iluminación, en principio, se pueden utilizar para detectar solo proteínas segregadas de las células vivas.
Como se explica en el protocolo, es imperativo para reducir al mínimo las fluctuaciones mecánicas laterales en la etapa de muestra del microscopio. Incluso nanómetros desviaciones en la posición de la muestra pueden conducir a variaciones en los marcos de cámara consecutivos e inducir significativos ruidos extraños en la imagen diferencial. Por lo tanto se recomienda utilizar una platina del microscopio mecánicamente estable y una mesa óptica amortiguada (paso 1.1.1.) y realizar la configuración con paneles o cortinas ópticos durante un experimento (paso 3.5.).
También podría considerarse un esquema de estabilización foco activo para mediciones a largo plazo. En este enfoque, un segundo láser es incorporado en el microscopio en un arreglo de reflexión interna total (TIR) y posteriormente reflejado en un fotodiodo de cuadrante. Cambios en el enfoque del sistema se traducen en desplazamientos laterales TIR del laser de la mancha en el diodo del cuadrante, que luego puede utilizarse un lazo de regeneración activa para controlar el eje z del piezo etapa26. Así se eliminan los efectos a largo plazo de la deriva vertical.
Varias modificaciones y extensiones pueden aplicarse a la técnica presentada a necesidades experimentales específicas de dirección. Por ejemplo, incubadoras de etapa del microscopio comerciales están disponibles que podrían incorporarse fácilmente en el microscopio de la iSCAT para la proyección de imagen a largo plazo de las células. También se pueden implementar otras técnicas para complementar iSCAT la proyección de imagen, tales como confocal o TIR de Microscopías de fluorescencia17. Para adaptar el sistema bajo estudio, iSCAT secreción las mediciones pueden realizarse en otros medios celulares como DMEM o DPBS, sin embargo, el indicador de pH rojo de fenol debe evitarse ya que puede perturbar el experimento de debido a la absorción de la luz laser. Además, los suplementos como suero fetal de ternero (FCS) o lisado de la plaqueta humana (hPL) contienen proteínas que pueden interferir con la detección de la iSCAT. Dependiendo de la sensibilidad deseada del experimento, estos suplementos deben ser excluidos del medio de la microscopia.
iSCAT depende de la capacidad de un analito a la luz de dispersión — una propiedad que es intrínseca a todas las proteínas y por lo tanto es inherentemente inespecífica. Sin embargo, algún grado de especificidad es posible como iSCAT señales escala linealmente con proteína total14,27,28. Esto permite la calibración de un sistema de la iSCAT con muestras estándar de proteínas, como albúmina sérica bovina (BSA) y fibrinógeno14,27,28. De hecho, hace muy poco, joven et al. 28 han extendido el trabajo de Piliarik & Sandoghdar14 y han demostrado que iSCAT puede utilizarse para determinar el peso molecular de proteínas tan pequeños como estreptavidina (53 kDa) con una resolución total de 19 kDa y una precisión de cerca de 5 kDa. Varios enfoques convencionales pueden complementar otros iSCAT proporcionando un nivel de especificidad. Como un ejemplo, los análisis enzima-ligado del inmunosorbente (ELISA) y otras modificaciones de superficie, restringen proteínas vinculantes eventos para que sólo la proteína de la blanco es detectan16.
En este protocolo, hemos descrito cómo iSCAT microscopia se puede utilizar para investigar secreciones celulares a nivel de proteína solo con subsegundos resolución temporal16. La técnica es general y puede aplicarse en cualquier microscopio comercial o de fabricación casera. En contraste con los enfoques de una sola molécula de la fluorescencia, el método no sufre de fotoblanqueo o intermitente efectos pero alcanza sensibilidad de solo proteína. Estas características hacen iSCAT una poderosa herramienta en el campo de biodetección y microscopía. Futuras aplicaciones se centrarán en dilucidar las complejas interacciones celulares como respuesta inmunológica a un estímulo o la comunicación celular.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la sociedad Max Planck, una Cátedra de Alejandro de Humboldt y la Deutsche Forschungsgemeinschaft (CRC 1181). Agradecemos a Stefanie Schaffer en Universitätsklinikum Erlangen células Laz388 y para las discusiones útiles. Agradecemos a Simone Ihloff y Maksim Schwab en MPL para soporte técnico.
Materiales
| Name | Company | Catalog Number | Comments |
| Item/Device | |||
| 100x / 1.46 NA objective | Zeiss | 420792-9800-000 | alpha Plan Apochromat oil immersion |
| 20x / 0.4 NA objective | Leica | 566049 | N Plan |
| Piezo Stage | PI | P-517k020 | 3-axis stage with 100x100x10µm range |
| Diode laser (445 nm) | Lasertack | PD-01236 | |
| Optics/Optomechanics | Thorlabs/Newport | - | lenses, mirrors, posts, mounts |
| Pinhole | Thorlabs | P30H | |
| LED light source | Thorlabs | MCWHL5 | |
| Shortpass filter (580 nm) | Omega Optical | 580SP | to modify the spectrum of the LED for fluorescence excitation |
| Longpass filter (500 nm) | Thorlabs | FEL0500 | to modify the spectrum of the LED for fluorescence excitation |
| 70R/30T beam splitter | Newport | 20Q20BS.1 | |
| Economy beam splitter | Thorlabs | EBS1 | used for the comparison of fringe effects |
| Wedged plate beam splitter | Thorlabs | BSW26 | used for the comparison of fringe effects |
| Shortpass dichroic mirror (550 nm) | Edmund Optics | 66249 | |
| 8R/92T beam splitter | Thorlabs | BP108 | |
| CMOS camera | Photonfocus | MV1-D1024E-160-CL | for iSCAT aquisition |
| CMOS cameras | Mightex | SCE-B013-U | for bright field / fluorescence aquisition |
| Longpass filter (600 nm) | Thorlabs | FELH0600 | |
| Computer | Fujitsu Siemens | - | Core i7 Processor, 16 GB RAM, SSD |
| Acquisition Software | LabVIEW | - | LabVIEW 2016 Suite |
| Analysis Software | Matlab | - | Matlab 2014 Suite |
| Plasma Cleaner | Diener | Diener pico | |
| Incubator | Binder | Model CB | |
| Centrifuge | Eppendorf | 5810R | |
| Reagent/Material | |||
| RPMI 1640 medium | Gibco | 11835063 | without phenol red |
| HEPES Buffer Solution (1M) | Sigma Aldrich | 59205C | |
| Cover slides | Marienfeld | 107052 | |
| Glass bottom culture dishes | ibidi | 81158 | |
| Fluorescent Microspheres | Invitrogen | F8821 | used for calibration |
| Immersol immersion oil | Zeiss | 444960 | |
| Propidium iodide stain | Invitrogen | R37108 | |
| Small pipette tips | Eppendorf | 30075005 | |
| Flexible pipette tips | Eppendorf | 5242956003 | |
| Ethanol, 99.8% | Fisher Scientific | E/0650DF/15 | |
| Sodium hydroxide, pellets | Sigma Aldrich | 221465 | for preparing 0.2M NaOH solution |
Referencias
- Hathout, Y. Approaches to the study of the cell secretome. Expert Review of Proteomics. 4 (2), 239-248 (2007).
- Pandey, A., Mann, M. Proteomics to study genes and genomes. Nature. 405 (6788), 837-846 (2000).
- Makridakis, M., Vlahou, A. Secretome proteomics for discovery of cancer biomarkers. Journal of Proteomics. 73 (12), 2291-2305 (2010).
- Bantscheff, M., Schirle, M., Sweetman, G., Rick, J., Kuster, B. Quantitative mass spectrometry in proteomics: a critical review. Analytical and Bioanalytical Chemistry. 389 (4), 1017-1031 (2007).
- MacBeath, G. Protein microarrays and proteomics. Nature Genetics. 32, 526-532 (2002).
- Seder, R. A., Darrah, P. A., Roederer, M. T-cell quality in memory and protection: implications for vaccine design. Nature Reviews Immunology. 8 (4), 247-258 (2008).
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Borisov, S. M., Wolfbeis, O. S. Optical biosensors. Chemical Reviews. 108 (2), 423-461 (2008).
- Dantham, V. R., Holler, S., Barbre, C., Keng, D., Kolchenko, V., Arnold, S. Label-Free Detection of Single Protein Using a Nanoplasmonic-Photonic Hybrid Microcavity. Nano Letters. 13 (7), 3347-3351 (2013).
- Zijlstra, P., Paulo, P. M. R., Orrit, M. Optical detection of single non-absorbing molecules using the surface plasmon resonance of a gold nanorod. Nature Nanotechnology. 7 (6), 379-382 (2012).
- Rickgauer, J. P., Grigorieff, N., Denk, W. Single-protein detection in crowded molecular environments in cryo-EM images. eLife. 6, e25648 (2017).
- Lindfors, K., Kalkbrenner, T., Stoller, P., Sandoghdar, V. Detection and Spectroscopy of Gold Nanoparticles Using Supercontinuum White Light Confocal Microscopy. Physical Review Letters. 93 (3), 037401 (2004).
- Jacobsen, V., Stoller, P., Brunner, C., Vogel, V., Sandoghdar, V. Interferometric optical detection and tracking of very small gold nanoparticles at a water-glass interface. Optics Express. 14 (1), 405 (2006).
- Piliarik, M., Sandoghdar, V. Direct optical sensing of single unlabelled proteins and super-resolution imaging of their binding sites. Nature Communications. 5, 4495 (2014).
- Roux, K. H. Immunoglobulin Structure and Function as Revealed by Electron Microscopy. International Archives of Allergy and Immunology. 120 (2), 85-99 (1999).
- McDonald, M. P., et al. Visualizing Single-Cell Secretion Dynamics with Single-Protein Sensitivity. Nano Letters. 18 (1), 513-519 (2018).
- Kukura, P., Ewers, H., Müller, C., Renn, A., Helenius, A., Sandoghdar, V. High-speed nanoscopic tracking of the position and orientation of a single virus. Nature Methods. 6 (12), 923-927 (2009).
- Ortega Arroyo, J., Cole, D., Kukura, P. Interferometric scattering microscopy and its combination with single-molecule fluorescence imaging. Nature Protocols. 11 (4), 617-633 (2016).
- Spindler, S., et al. Visualization of lipids and proteins at high spatial and temporal resolution via interferometric scattering (iSCAT) microscopy. Journal of Physics D: Applied Physics. 49 (27), 274002 (2016).
- Lazarus, H., et al. Characterization of a unique cell line (LAZ 221) from human acute lymphocytic ("null" cell) leukemia. Cancer Research. 38 (5), 1362-1367 (1978).
- Mackensen, A., et al. Evidence for in situ amplification of cytotoxic T-lymphocytes with antitumor activity in a human regressive melanoma. Cancer Research. 53 (15), 3569-3573 (1993).
- Crowley, L. C., Scott, A. P., Marfell, B. J., Boughaba, J. A., Chojnowski, G., Waterhouse, N. J. Measuring cell death by propidium iodide uptake and flow cytometry. Cold Spring Harbor Protocols. 2016 (7), 647-651 (2016).
- Freshney, R. I. Primary Culture. Culture of Animal Cells. , (2005).
- Dahmardeh, M., et al. . Unpublished data. , (2018).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. American Journal of Pathology. 146 (1), 3-15 (1995).
- Bellve, K., Standley, C., Lifshitz, L., Fogarty, K. Design and Implementation of 3D Focus Stabilization for Fluorescence Microscopy. Biophysical Journal. 106 (2), 606a (2014).
- Liebel, M., Hugall, J. T., Van Hulst, N. F. Ultrasensitive Label-Free Nanosensing and High-Speed Tracking of Single Proteins. Nano Letters. 17 (2), 1277-1281 (2017).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados