Method Article
Label-Free Imaging d’unique protéines sécrétée par les cellules vivant via iSCAT microscopie
Dans cet article
Résumé
Nous présentons un protocole pour la détection optique en temps réel des protéines sans étiquette simples car elles sont sécrétées par les cellules vivantes. Celle-ci repose sur la microscopie interférométrique diffusion (iSCAT), qui peut être appliquée à une variété de configurations et différents systèmes biologiques.
Résumé
Nous démontrons microscope interférométrique diffusion (iSCAT), une méthode permettant de détecter des protéines sans étiquette unique sécrétées par les cellules de vie individuel en temps réel. Dans ce protocole, nous couvrons les étapes fondamentales pour réaliser un microscope iSCAT et le compléter avec des chaînes supplémentaires d’imagerie pour surveiller la viabilité d’une cellule à l’étude. Suite à cela, nous utilisons la méthode de détection en temps réel des protéines simples car elles sont sécrétées par une cellule vivante qui nous démontrent avec une lignée de B-cellules immortalisée (Laz388). Les auteurs discutent des mesures nécessaires concernant la préparation du microscope et l’échantillon ainsi que l’analyse des données enregistrées. Le protocole vidéo montre que la microscopie iSCAT offre une méthode simple pour étudier la sécrétion à l’échelle de la molécule unique.
Introduction
Protéines sécrétées jouent un rôle important dans divers processus physiologiques1. Pour cette raison, ils sont systématiquement étudiés comme un ensemble collectif (protéomique) ou comme des entités individuelles2,3. Protéomique étudie traditionnellement l’ensemble des protéines présentes dans un système biologique particulier par p. ex., les dosages immuno-enzymatique (ELISA), cytométrie de flux ou spectrométrie de masse4,5, 6. Protéines simples, en revanche, sont détectés en général en utilisant une variété de techniques qui reposent sur la fluorescence7,8, plasmonique9,10ou électrons cryogéniques11 microscopies. Toutes ces techniques utilisent des instruments complexes, étiquetage ou les deux et manquent souvent d’informations dynamique car ils offrent uniquement des informations à long terme sur le système à l’étude.
Ici, nous utilisons iSCAT12,13 microscopie à protéines sécrétoires individuelles de sens avec la seconde résolution temporelle14. Ce qui est important, la technique détecte le signal épars faiblesse intrinsèque à chaque protéine12,14. La quantité de lumière qui disperse un bioparticle petite échelles avec sa polarisabilité. En supposant que la forme d’une protéine peut être approchée par une dispersion efficace sphère14,15,16et que différente protéines ont des indices de réfraction très similaires, le signal mesuré peut être directement connecté à la masse moléculaire (mm) de la protéine. L’étalonnage empirique d’iSCAT contraste par rapport à la masse moléculaire de mesures de référence permet de distinguer les protéines de différentes tailles. iSCAT expériences peuvent facilement être complétés par microscopie de fluorescence17,18, immuno réactifs, ainsi que les étiquettes fluorescentes ou diffusion pour permettre une détection spécifique d’une protéine d’intérêt14 , 17 , 19.
En principe, iSCAT fonctionne en amplifiant la faible lumière de la protéine via interférométrique de mélange avec une vague référence secondaire. L’intensité détectée (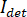 ) dans un iSCAT microscope est décrite par
) dans un iSCAT microscope est décrite par
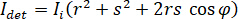
où 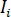 est l’intensité incidente,
est l’intensité incidente,  est un coefficient pour la contribution de l’onde de référence,
est un coefficient pour la contribution de l’onde de référence,  signifie la force de diffusion de la nano-objet à l’étude, et
signifie la force de diffusion de la nano-objet à l’étude, et 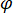 est le déphasage entre l’épars et de référence 14de vagues. Soit la transmise ou réfléchie arrière lumière incidente est généralement utilisée comme une onde de référence, où, dans chaque cas
est le déphasage entre l’épars et de référence 14de vagues. Soit la transmise ou réfléchie arrière lumière incidente est généralement utilisée comme une onde de référence, où, dans chaque cas 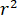 représente la transmissivité ou la réflectivité de la chambre de l’échantillon, respectivement. Le terme
représente la transmissivité ou la réflectivité de la chambre de l’échantillon, respectivement. Le terme 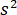 est proportionnelle à la section transversale de diffusion de la protéine et peut être négligé par rapport à l’expression de croix. Ainsi,
est proportionnelle à la section transversale de diffusion de la protéine et peut être négligé par rapport à l’expression de croix. Ainsi, 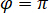 pour interférence destructive complète, la lumière détectée est donnée par
pour interférence destructive complète, la lumière détectée est donnée par 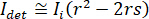 où
où 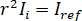 est l’intensité de référence et
est l’intensité de référence et 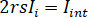 est l’intensité de l’interférence.
est l’intensité de l’interférence.
la microscopie iSCAT offre une excellente méthode pour l’étude des processus biologiques à l’échelle de la molécule unique. À titre d’exemple, nous étudions les cellules Laz388 — un virus Epstein - Barr (EBV) transformé lymphocyte B cell line20,21 — comme ils sécrètent des protéines telles que les IgG anticorps16. Toutefois, la méthode est générale et peut être appliquée à une variété d’autres systèmes biologiques. iSCAT est intrinsèquement imprécis et peut détecter n’importe quelle protéine ou nanoparticules ou il peut être étendu avec les méthodes courantes de fonctionnalisation de surface pour la détection spécifique ou multiplexée. Sa simplicité et sa capacité à combiner avec d’autres techniques optiques, telles que la microscopie de fluorescence, faire un outil complémentaire précieux iSCAT en biologie cellulaire.
Protocole
ATTENTION : Veuillez lire toutes les fiches signalétiques (FS) avant d’utiliser tout produit chimique, observer toutes les pratiques de sécurité qui s’imposent et porter l’équipement de protection individuelle (lunettes de protection laser, lunettes de protection, gants, sarraus) selon les besoins.
1. construire l’iSCAT Microscope16,18
Remarque : Le microscope iSCAT se compose généralement d’un programme d’installation mis à jour le microscope inversé. En bref, un laser se concentre sur le plan arrière focal d’un objectif à grande ouverture numérique (NA) et une lentille d’imagerie est utilisée pour concentrer la lumière arrière diffusée par la particule sur une puce de la caméra. En général, ce microscope à champ large peut être construit à partir de zéro ou basé sur un microscope inversé existant. Ce protocole porte sur les étapes essentielles pour réaliser l’installation, alors que des changements dans le matériel usagé sont possibles. On trouvera une description plus détaillée de l’Assemblée d’un microscope iSCAT dans le œuvre de Arroyo et al. 18.
ATTENTION : Un microscope iSCAT implique une classe IIIB de la source de lumière laser classe IV. Une protection oculaire appropriée est nécessaire lors du montage et alignement de l’optique du statif. Au cours de l’Assemblée de microscope, assurez-vous que le chemin d’accès du faisceau laser reste droite et n’est pas dévié comme nouveaux composants optiques sont ajoutés.
-
Mettre en place le chemin de l’illumination du microscope.
- En utilisant une table optique amortie et un bloc de métal rigide, construire un microscope échantillon étape18 qui intègre un objectif de forte ouverture numérique (NA) (100 X / 1.46 NA) et une unité de traduction permettant la traduction échantillon latérales ainsi que changement d’orientation position de l’objectif.
Remarque : Le fonctionnement d’un microscope iSCAT à la limite de détection de protéines simples est très sensible aux vibrations extérieures. Une étape de piezo centrosymétriques qui prend en charge l’échantillon de tous les côtés est recommandée pour limiter les excitations acoustiques de l’échantillon qui serait compromettre la stabilité latérale et focale. La figure 1 illustre une scène échantillon approprié, y compris l’unité de traduction piezo et l’objectif. En outre, il est recommandé que les montures massives et stables sont utilisés pour tous les composants optiques discutés dans les étapes suivantes. Ces composants sont facilement disponibles auprès de fournisseurs de l’optique commerciale. - Utiliser une lentille de singulet de focale de 50 cm (objectif grand-angulaire) et à 45° (vertical) couplage des miroirs pour concentrer la lumière d’un laser diode à longueur d’onde 445 nm sur le plan arrière focal de l’objectif. Cela crée un faisceau collimaté au foyer avant de l’objectif et va devenir la source d’illumination iSCAT. Si nécessaire, filtrer le laser dans l’espace avant l’objectif de 50 cm par 30 µm sténopé ou monomode.
- Appliquer une goutte d’huile à immersion à l’objectif et placer une lamelle de verre dans le plan de l’échantillon de la platine du microscope. Cela se traduira par une poutre qui reflète vers le bas à travers l’objectif d’imagerie.
Remarque : La réflexion découle de l’interface air-verre sur la surface supérieure de la lamelle d’échantillon et servira de base pour le faisceau de référence iSCAT. La saleté résiduelle ou la poussière sur la surface de la lamelle donnera lieu à la diffusion des sources ponctuelles, qui l’aide dans la mise au point correcte de l’objectif d’imagerie dans les prochaines étapes.
ATTENTION : La majorité de la lumière laser transmet par l’intermédiaire de la lamelle couvre-objet et se déplace vers le haut de l’objectif. Placez un diffuseur spéculaire opaque (e.g., une carte de papier) au-dessus de la lamelle couvre-objet pour minimiser le risque de blessures causées par la lumière laser.
- En utilisant une table optique amortie et un bloc de métal rigide, construire un microscope échantillon étape18 qui intègre un objectif de forte ouverture numérique (NA) (100 X / 1.46 NA) et une unité de traduction permettant la traduction échantillon latérales ainsi que changement d’orientation position de l’objectif.

Figure 1 : scène d’échantillon iSCAT. La photographie montre le bloc d’aluminium massif sur lequel l’unité de traduction piezo (noir) est montée ainsi que les 100 centré x objectif. L’étape 3-axe piézo-électrique permet un positionnement précis de l’échantillon dans le plan focal de l’objectif. Grosse mise au point est effectuée en tournant un tube fileté sur laquelle l’objectif est monté (non représenté). Le bloc est placé sur la table optique avec quatre caissons en acier au-dessus du miroir de couplage de 45°. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
-
Configurer le chemin d’accès d’imagerie du microscope.
- Introduire un antireflet (AR)-enduit de séparateur de faisceau (réflexion de 70 %, 30 % de transmission) à un angle de 45° par rapport au faisceau incident et environ 10 cm après l’objectif grand-angulaire. Point le revêtement AR vers la source de laser. Cela transmet le faisceau incident et reflète la référence et dispersés de poutres à un angle de 90° vers le faisceau incident.
NOTE : Séparateurs de faisceau de revêtement antireflet ou coincé sont recommandés comme des effets significatifs d’images fantômes et la frange peuvent se produire lorsque vous utilisez le faisceau fendage de cubes ou séparateurs de faisceau plane non couché. Voir la Discussion pour plus de détails. Si vous le souhaitez, n’importe quel faisceau réfléchi indésirable découlant de la partie arrière de la séparateur de faisceau peut être bloquée par l’utilisation d’un diaphragme à iris. - Un séparateur de faisceau épais présentera un déplacement important faisceau de sorte que le laser ne peut pas entrer dans l’objectif directement plus. Si nécessaire, réaligner la marche des rayons laser avant le séparateur de faisceau pour assurer la bonne propagation à travers l’objectif.
Remarque : Le séparateur de faisceau pourrait aussi figurer devant l’objectif de champ large et la platine du microscope est positionnée (à l’étape 1.1.2.), afin que le faisceau ne sera pas déplacé plus tard. - À ce stade, le bras d’imagerie de l’interféromètre de l’accent et s’assurer que le plan de l’échantillon et la caméra sont parfocale. Placez un concave f = lentille-45 cm à la mesure 5 cm après l’objectif grand-angulaire dans le chemin du faisceau incident. Cela se traduira par un faisceau collimaté entrant dans l’ouverture arrière de l’objectif.
- Avec un écran placé dans le bras réfléchi de l’interféromètre, placer l’objectif dans le sens vertical pour trouver la position focale grosse. L’objectif est mise au point lorsque le faisceau frappe l’écran est collimaté.
Remarque : La Figure 2 montre un schéma de ce processus. - Enlever le deux f = lentille-45 cm et l’écran lorsque la mise au point grossière est terminée.
Remarque : Au lieu d’utiliser une lentille de distance focale négative, l’objectif grand-angulaire lui-même peut être placé sur un support mobile et déplacé hors de la trajectoire du faisceau pour cette étape. Toutefois, pour parvenir à la configuration de microscope plus stable, il est recommandé de tenir l’objectif grand-angulaire dans une position fixe. - Ajouter un deuxième f = 50 cm singulet lentilles pour concentrer la lumière dispersée et à collimater la lumière reflétée sur le capteur d’une caméra CMOS. Veiller à ce que la lentille est placée à 50 cm du plan arrière focal de l’objectif afin de re-collimater le faisceau de référence et de concentrer la lumière diffusée.
- Place le CMOS chip 50 cm de distance de la f = lentille 50 cm et de positionner le faisceau directement sur le milieu de la puce.
Remarque : Les paramètres suivants sont généralement utilisés pour l’imagerie. La puissance du laser (longueur d’onde 445 nm) est définie sur 100 mW. Sténopé et faisceau répartiteur atténue la lumière transmise, afin que la puissance apparente en entrant dans l’objectif est d’environ 9 mW. Le diamètre du faisceau à la position de l’échantillon s’élève à 6 µm. Avec l’objectif d’imagerie utilisé, le grossissement efficace du système est d’environ 300 x. La taille de l’image sur la puce CMOS a la valeur 128 × 128 pixels dans la zone éclairée, résultant en un champ de vision d’environ 5 × 5 µm2. La figure 3 montre un schéma du microscope iSCAT entièrement assemblé.
- Introduire un antireflet (AR)-enduit de séparateur de faisceau (réflexion de 70 %, 30 % de transmission) à un angle de 45° par rapport au faisceau incident et environ 10 cm après l’objectif grand-angulaire. Point le revêtement AR vers la source de laser. Cela transmet le faisceau incident et reflète la référence et dispersés de poutres à un angle de 90° vers le faisceau incident.
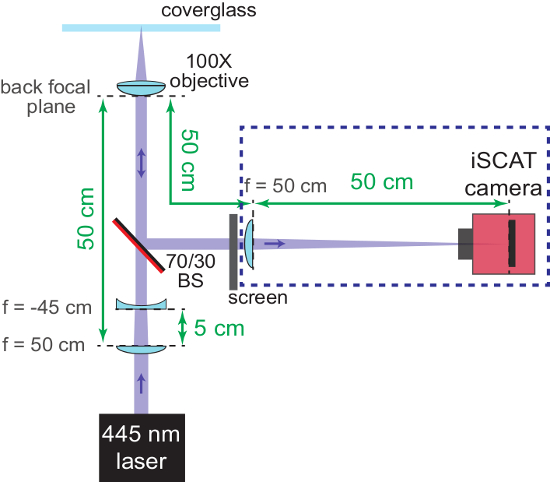
Figure 2 : grossière mise au point du microscope iSCAT. Le schéma montre l’arrangement des éléments optiques pour aider à mettre le système au point. Revêtement antireflet de la face arrière du séparateur de faisceau (70/30 BS) est marquée en rouge. Les distances importantes sont fournies en vert. La longueur focale (f) des lentilles utilisées sont indiquée. Composants dans la boîte bleue en pointillés sont ajoutés en étapes 1.2.6 - 1.2.7. La lentille concave (utilisé pour re-collimater le faisceau iSCAT convergents) et l’écran sont enlevées plus tard. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : microscope iSCAT. Le schéma montre le microscope iSCAT complètement assemblé. Revêtement antireflet de la face arrière du séparateur de faisceau (70/30 BS) est marquée en rouge. Les distances importantes sont fournies en vert. La longueur focale (f) des lentilles utilisées sont indiquée. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
-
Mettre en place des canaux supplémentaires d’imagerie.
Remarque : Cette section ajoute un autre chemin d’imagerie pour le microscope qui permet l’observation d’une vaste zone entourant le laser iSCAT via au microscope à fond clair et pour contrôler la viabilité des cellules par l’intermédiaire de la microscopie de fluorescence.- La sortie d’une source lumineuse de LED (environ 500 nm < λ < 580 nm) dans un long travail objectif NA distance 20 X / 0.4 et installer des composants mécaniques au-dessus de la chambre de mesure permettant la mise au point et de positionnement latéral de la sortie de LED sur le échantillon.
- Assurez-vous que la LED sortie de spectre couvre la gamme de l’excitation du marqueur de mort cellulaire (iodure de propidium (PI)) et n’interfère pas avec la fluorescence (λ > 600 nm). Si nécessaire, utilisez les filtres optiques.
- Se déplacer latéralement l’objectif supérieur afin que l’empeigne (grand champ) et inférieur (iSCAT) objectifs sont colinéaires. Ceci est déterminé en plaçant un écran sous l’objectif inférieur et en maximisant l’intensité de la lumière LED transmise sur l’écran. Placer un λ = 550 nm court passage miroir dichroïque (SPDM) de scinder la LED de transmise lumineuse de la voie de laser iSCAT.
- Diviser ce faisceau en deux canaux avec un séparateur de faisceau transmissif de reflective/92% de 8 % (BS). Le chemin d’accès de 92 % est le canal de fluorescence et le chemin de 8 % est utilisé pour l’imagerie champ lumineux.
- Image du canal lumineux-zone sur une caméra CMOS avec une f = objectif doublet achromatique de 5 cm.
- L’image de la chaîne de fluorescence sur une caméra CMOS distincte à l’aide d’un f = objectif doublet achromatique de 5 cm et un λ = 600 nm long-pass filter pour bloquer la lumière d’excitation. Figure 4 a montre une représentation schématique du microscope entièrement assemblé, y compris toutes les voies d’imagerie.
- La sortie d’une source lumineuse de LED (environ 500 nm < λ < 580 nm) dans un long travail objectif NA distance 20 X / 0.4 et installer des composants mécaniques au-dessus de la chambre de mesure permettant la mise au point et de positionnement latéral de la sortie de LED sur le échantillon.

Figure 4 : iSCAT microscopie des protéines sécrétées par les cellules individuelles. (a) schéma du microscope décrit dans le protocole. Voir section 1 pour plus d’informations. Abréviations : LED, diodes électroluminescentes ; SPF, court-filtre ; obj, objectif ; SPDM, miroir dichroïque de passes courtes ; BS, séparateur de faisceau ; LPF, filtre passe-longue ; BF, lumineux-zone ; fluor, fluorescence ; C1-C3, caméra 1-3. (b) Bright-champ image d’un seul Laz388 de cellules environ 4 µm loin du champ de vision d’iSCAT (représenté par un carré blanc). Image prise par la caméra C3, barre d’échelle : 10 µm. (c) Fluorescence image de la même région (b) montre la position de la cellule marquée par un cercle blanc. L’absence de fluorescence indique que la cellule n’est viable. Image prise par la caméra C2, barre d’échelle : 10 µm. (d) Raw iSCAT caméra image capture instantanée avec temps d’exposition de 80 µs. Image prise par la caméra C1. image d’iSCAT (e) de la même région après soustraction de contexte spatio-temporel comme décrit dans la section « discussion ». L’image a été intégré sur 1000 séquentielle trames brutes (d) avec un temps de l’image finale de 400 ms et révèle la rugosité de la lamelle de verre. (f) correspondant iSCAT différentielle image qui affiche l’événement de liaison de 2 protéines sur la lamelle couvre-objet. L’image a été construite en soustrayant deux images consécutives de filtré (e). Échelle des barres (d), (e) et (f) : 1 µm. Ce chiffre a été adapté de McDonald, M.P. et al. 16. copyright 2018 American Chemical Society. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
-
Configurer l’ordinateur et le logiciel.
- Connecter tous les appareils photo à un ordinateur. Installer les packages de pilotes respectifs et obtenir/écriture logiciel pour leur contrôle.
Remarque : Un matériel adapté est nécessaire pour les acquisitions à grande vitesse. Au minimum, un processeur multi-core, 16 Go de RAM, une carte de grabber de châssis et un disque SSD pour le stockage de données sont recommandés. - Surveiller l’image iSCAT la caméra CMOS et veiller à ce que c’est au point de trouver une particule de poussière ou de saleté résiduelle sur la lamelle de verre. Vérifiez que l’image de la particule est qu'un point circulairement symétrique fonction (PSF) d’étalement.
NOTE : La raison principale pour un PSF circulairement non symétrique est que le faisceau laser n’entre pas dans l’objectif, tout droit, mais à un petit angle par rapport à l’axe optique. C’est corrigé en ajustant l’angle et la position du faisceau incident avec le miroir de couplage de 45°. - Comparez les images de la caméra du vif-champ et les canaux de fluorescence. Veiller à ce que les deux sont en discussion et affichent la même zone. Vérifier que la position du laser iSCAT est environ dans le centre de l’image et prendre note de sa position pour référence ultérieure. Voir Figure 4 b – 4f pour des images de caméra typique.
Remarque : Utilisez un échantillon cellulaire ou perles fluorescentes pour trouver l’accent des deux canaux. Retirer temporairement le filtre long-col de fluorescence pour régler le système. La mise au point pour l’imagerie conventionnelle des cellules doit être légèrement supérieure à celle du plan focal iSCAT. Pour compenser cela sans bouger l’objectif, déplacer les caméras postées dans le foyer de la f respectifs deux = lentilles de 5 cm. - Définissez les paramètres de caméra nécessaires. Utiliser une fréquence d’images fixes et désactiver les outils gain et correction des logiciels.
Remarque : Les paramètres suivants sont utilisés : la caméra iSCAT est définie sur 5000 images par seconde (fps) avec un temps d’exposition de 80 µs. Comme mentionné ci-dessus, la taille de l’image est de 128 × 128 pixels. Caméras de fluorescence et lumineux-terrain exploité à taille d’image complète (1280 × 1024 pixels). Bright-champ imagerie est réalisée avec un temps de pose de 20 ms. La caméra à fluorescence est définie pour la durée d’exposition de 750 ms et 5 images consécutives sont accumulent pour former une image finale. Bright-champ et la fluorescence des images sont acquises à intervalles de temps s 20 fixes.
- Connecter tous les appareils photo à un ordinateur. Installer les packages de pilotes respectifs et obtenir/écriture logiciel pour leur contrôle.
2. préparation de l’expérience
-
Préparer le milieu de la microscopie stock.
- Ajouter 25 mL de Solution tampon HEPES (1 mol/L) à 975 mL du milieu RPMI 1640 pour obtenir une finale 1 L de solution HEPES 25 mmol/L. Sinon, utilisez un milieu tampon HEPES déjà inclus.
NOTE : HEPES est utilisé pour maintenir la valeur du pH du milieu pendant une mesure en conditions ambiantes (p. ex., en dehors d’un incubateur et sans l’apport constant de2 CO). - Prélever une partie aliquote de la solution nécessaire pour une expérience et laissez-le chauffer jusqu'à la température ambiante. 2 mL de milieu est suffisante. Garder le reste de la solution stock à 4 ° C.
- Ajouter 25 mL de Solution tampon HEPES (1 mol/L) à 975 mL du milieu RPMI 1640 pour obtenir une finale 1 L de solution HEPES 25 mmol/L. Sinon, utilisez un milieu tampon HEPES déjà inclus.
-
Préparer la cupule de microscope.
Remarque : Les étapes suivantes décrivent la procédure pour un porte-échantillon sur mesure consistant en une plaque de base en aluminium et un plat de cuve acrylique qui corrige la lamelle couvre-objet et il les couples sur le positionneur 3D piézoélectrique. Disponible dans le commerce de Pétri stérile avec un fond de verre peut également être utilisé.
NOTE : La Figure 5 illustre de photographies du porte-échantillon sur mesure.- Prenez une nouvelle lamelle de microscope et rincer à l’eau désionisée (DI-eau) et d’éthanol. Sécher à l’air la diapositive avec azote ou air comprimé.
- Nettoyer la lamelle dans une atmosphère de plasma d’oxygène (pression de gaz de 0,3 mbar) pendant 10 min à 500 W RF power. Cela supprime toutes les impuretés organiques de la surface.
- Nettoyer le plat de la cuve acrylique en l’immergeant dans 0,2 mol/L de solution de NaOH pendant environ 10 min. rincer avec l’eau distillée.
- Assembler le porte-échantillon et couvrir avec un plastique de Petri stérile jusqu'à ce que nécessaire dans l’expérience.

Figure 5 : porte-échantillon Custom-Built. (a) échantillon de composants du titulaire : (1) plat de cuve acrylique ; (2) plaque de base en aluminium ; (3) vis de maintien ; (4) silicone joint torique ; (5) couvre-objet. (b) sans démontage porte-échantillon. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
-
Préparer le microscope.
- Allumer le laser d’illumination iSCAT, l’éclairement lumineux-champ/fluorescence LED, appareils photo et l’ordinateur/logiciel d’acquisition. Bloquer le faisceau laser vers une position devant l’objectif.
- Veiller à ce que le 100 X / 1.46 objectif NA est propre. Si ce n’est pas le cas, utiliser de l’éthanol et lingettes de nettoyage pour lentilles pour nettoyer l’objectif conformément aux instructions du fabricant.
- Appliquez une goutte d’huile à immersion sur l’objectif de microscope.
- Prendre le porte-échantillon (assemblé à la section 2.2) et le monter avec soin sur la scène de piezo du microscope iSCAT afin que la lamelle d’échantillon est centrée sur l’objectif de microscope. Être attentif et prudent éviter d’endommager la lentille de l’objectif. Fixer l’appareil sur le positionneur piézoélectrique avec les vis de pouce tout en s’assurant que le constructeur spécifié couple maximal n’est pas dépassé.
- Ajouter 1 mL de milieu de microscopie stock (préparée à la section 2.1.) dans la cupule.
- Ajouter 2 gouttes de l’iodure de propidium au milieu comme une cellule mort marqueur16,22.
- Débloquer le laser et mettre le système au point. Tout d’abord, vérifiez que l’objectif soit positionné à la bonne distance de la lamelle couvre-objet en répétant les étapes 1.2.3. – 1.2.5. (Figure 2). Puis, affiner la mise au point avec l’axe z de la scène de piezo.
- Confirmez que tous les paramètres pour les sources lumineuses, des caméras et logiciels sont correctement définies. Cela inclut les paramètres tels que la puissance du laser, LED intensité, taux de trame de caméra, temps d’exposition de caméra ou logiciel enregistrer les chemins d’accès.
Remarque : Enregistrer des vidéos au taux de rafraîchissement élevé peut produire des tailles de fichier volumineux. S’assurer que suffisamment d’espace libre sur le disque sur l’ordinateur. - Bloquer à nouveau le faisceau laser. Le microscope est maintenant prêt pour une expérience.
-
Préparer les cellules.
Remarque : Laz388 cellules20 sont cultivées dans un milieu RPMI 1640 additionné de 10 % de sérum de veau foetal (FCS), acides aminés, le pyruvate et antibiotiques. Les cellules sont incubées à 37 ° C et 5 % de CO2 diviser et sont fournis avec un milieu frais chaque 2 ou 3 jours à23.- Prenez le flacon de culture cellulaire de l’incubateur et aspirer le milieu contenant environ 1 x 106 cellules. Pour déterminer le volume correct, quantifier la concentration de la culture cellulaire par l’utilisation d’un hémocytomètre.
- Mélanger la solution de la cellule avec 10 mL de milieu RPMI 1640 à température ambiante et centrifuger l’échantillon à 300 g pendant 7 min.
- Soigneusement extrait et éliminer le liquide surnageant tout en veillant à ce que le culot de cellules concentrées reste inchangée.
- Répétez les étapes 2.4.2. – 2.4.3. avec la pastille concentrée de cellules.
- Remettre en suspension les cellules dans 0,5 mL de milieu de microscopie stock (préparée à la section 2.1.) et de les utiliser immédiatement dans une expérience.
3. iSCAT microscopie des cellules sécrétrices
- Veiller à ce que le faisceau laser est bloqué pour empêcher les cellules d’être directement exposés à la lumière de laser iSCAT.
- Injecter les cellules dans la cupule de l’échantillon.
- Injecter environ 3 µL de l’échantillon de cellules (préparés au point 2.4.) légèrement décentré dans la cupule de l’échantillon. Toucher doucement l’embout de la pipette à la lamelle et injecter lentement la solution de la cellule. Laissez les cellules à s’installer sur la lamelle couvre-objet.
Remarque : Utiliser des pointes de pipette de petit volume (10 µL) ou conseils de gel-chargement longs et flexibles. - Veiller à ce que la densité des cellules est inférieure à environ 1 cellule par 500 µm² afin que les mesures unicellulaires ne sont pas influencés par plusieurs cellules dans la zone qui entoure le laser iSCAT.
- Si le nombre de cellules est trop faible, répéter étape 3.2.1. jusqu'à ce qu’un nombre suffisant soit disponible.
- Si la couverture des cellules est trop dense, utiliser une injection d’environ 20 µL de milieu de microscopie supplémentaires pour disperser les cellules dans l’ensemble de la lamelle.
- Injecter environ 3 µL de l’échantillon de cellules (préparés au point 2.4.) légèrement décentré dans la cupule de l’échantillon. Toucher doucement l’embout de la pipette à la lamelle et injecter lentement la solution de la cellule. Laissez les cellules à s’installer sur la lamelle couvre-objet.
- En utilisant le positionneur piezo, déplacez l’échantillon latéralement sur la position d’une cellule proche (environ 10 µm) pour le champ de vision d’iSCAT. Veiller à ce que la cellule n’entre pas dans le champ de vision d’iSCAT comme une exposition directe à la lumière de laser 445 nm peut être nocive pour la cellule.
- Images lumineuses-champ et fluorescence permet de localiser et vérifier la viabilité de la cellule25.
Remarque : Une cellule viable a une forme ronde à l’image du champ lumineux et n’est pas fluorescente, alors que la mort cellulaire est indiquée par des signaux de forte fluorescence découlant de la présence de l’iodure de propidium à l’intérieur de la cellule22. - Débloquer le laser iSCAT et veiller à ce que la surface de la lamelle couvre-objet est toujours au point. Joindre la table isolation pour réduire la dérive et couplage acoustique de l’environnement ambiant.
NOTE : Ce dernier est réalisé avec lourds rideaux optique ou de panneaux en acrylique qui entourent la table optique. - Démarrer la mesure par l’acquisition des images des caméras iSCAT, lumineux-zone et fluorescence. Automatiser et de contrôler le processus grâce à des logiciels pour maximiser l’efficacité expérimentale. Vérifier périodiquement la viabilité de la cellule et la mise au point du système.
Remarque : Selon l’intensité du laser, composants optiques et réglages de temps d’exposition de la caméra, le laser iSCAT risquent d’interférer avec la caméra à fluorescence. Si ce comportement est observé, envisager de coffrage le laser iSCAT temporairement au cours de l’acquisition d’image de fluorescence.
4. analyse des données
Remarque : Les données expérimentales sont intrinsèquement bruyantes et iSCAT images ne sont pas différents. Il existe plusieurs sources de bruit dans une mesure iSCAT typique, y compris distorsions de front d’onde dans la source de lumière incidente, la rugosité de la surface de la lamelle couvre-objet et le bruit de l’appareil photo. La section ci-dessous présente quelques façons dont ces sources de bruit sont corrigées par l’intermédiaire de post-traitement. En outre, latérales instabilités mécaniques de l’installation entraîner données bruitées et doivent être abordées en conséquence, tel que décrit dans la section discussion ci-dessous. Les analyses décrites sont réalisées avec des scripts MATLAB personnalisés.
- Minimiser le bruit de l’appareil photo en filtrant les données brutes d’un filtre de Fourier bidimensionnel qui exclut les hautes fréquences spatiales. La taille du filtre doit être ajustée pour s’adapter à la configuration expérimentale spécifique (principalement déterminée par l’ouverture numérique du système).
Remarque : Les caractéristiques dans l’image avec des fréquences spatiales plus élevées que le système optique proviennent de sources externes (tels que le bruit de lecture de caméra) et peuvent être négligés. - Convertir les images de caméra raw comtes iSCAT contraste.
NOTE : Le signal détecté par la caméra est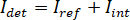 . iSCAT contraste est défini comme
. iSCAT contraste est défini comme 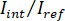 où
où 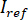 est l’intensité de la lumière de la référence, dans ce cas la partie reflétée par la lamelle, et
est l’intensité de la lumière de la référence, dans ce cas la partie reflétée par la lamelle, et 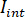 est l’interférence entre
est l’interférence entre 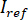 et l’intensité diffusée (
et l’intensité diffusée (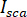 ).
).- Séparer le signal en
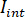 et
et 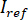 en calculant la moyenne temporelle des cadres spécifique dans lequel les particules d’intérêt ne sont pas présents. L’image résultante donne le signal de référence
en calculant la moyenne temporelle des cadres spécifique dans lequel les particules d’intérêt ne sont pas présents. L’image résultante donne le signal de référence 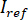 .
.
Remarque : Vous pouvez également une étape de soustraction de fond peut-être être effectuée comme indiqué dans l’exposé qui suit. - Calculer le contraste selon
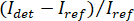 12,14,16.
12,14,16.
- Séparer le signal en
- Créer une image différentielle roulement en soustrayant chaque image consécutive de son successeur.
NOTE : Résiduelle des signaux de la rugosité de la lamelle et wavefront distorsions sont efficacement supprimées dans cette étape car ils sont constants dans les images consécutives. Le différentiel de roulement supprime ces signaux résiduelle, laissant uniquement les liaisons protéiques qui se produisent d’une image à l’autre. Cette soustraction de fond dynamique est bénéfique car il n’est pas sensible aux dérives d’échantillon à long terme. - Appliquer un algorithme de recherche de pointe pour détecter et les particules unique pour chaque image, déterminer leur contraste spécifique et leur position.
- Utiliser l’information recueillie à l’étape 4.4 pour créer des histogrammes des événements de liaison de protéine et concernent leurs contrastes extraites de la masse des protéines dans une courbe d’étalonnage compilée à partir de14,échantillons protéiques connus24.
Résultats
Une représentation schématique d’un microscope iSCAT est montrée dans la Figure 4 a. Lumineux-zone représentative, de fluorescence et images brutes iSCAT sont indiquées dans la Figure 4 b, 4Cet 4D, respectivement16. Figure 4e et 4f montrent les résultats de la suppression de l’arrière-plan et post-traitement différentiel ; deux protéines adsorbés sont visibles sous forme de taches de diffraction-limited dans Figure 4f. La figure 6 montre un histogramme des protéines détectées au cours des 125 s. Ces données ont été obtenues en appliquant un algorithme de recherche de pointe sur les images saisies à compter des liaison des événements et leur contraste16de catalogue. Le nombre total de 503 protéines ont été détecté.
Ensuite, sécrétées espèces sont identifiées par comparaison avec des mesures de référence effectuées sur les solutions de la protéine purifiée, ou par le biais de mesures supplémentaires avec verre fonctionnalisés surfaces14,16. Ainsi, les données iSCAT, visualiser directement entre dynamique de sécrétion cellulaire sur une échelle de subsecond16. À titre d’exemple, nous avons constaté précédemment que les anticorps IgG sont une fraction importante de la secretome Laz388 et sont libérés par la cellule à un taux d’environ 100 molécules par seconde16. En outre, les autres particules qui couvrent un éventail de 100 kDa - 1000 kDa sont sécrétées par les cellules16. La méthode décrite peut être encore employé par exemple, pour enquêter sur le gradient de concentration spatial des sécrétions qui entoure une cellule16, ou de déterminer la dynamique temporelle de lyse cellulaire16.
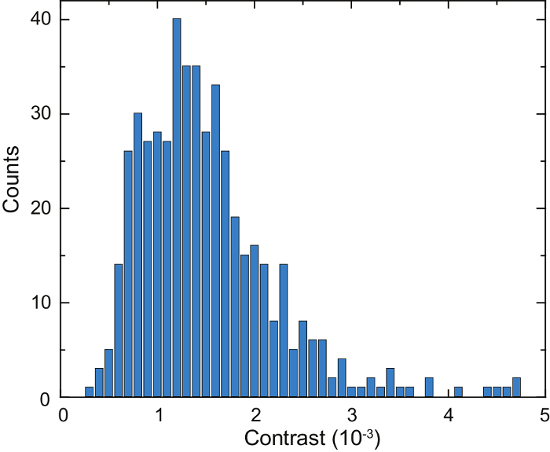
Figure 6 : Quantification des protéines sécrétées par une seule cellule de Laz388. L’histogramme montre protéines détectées pendant une période de temps de 125 contraste s. valeurs sont cumulées dans 1 x 10-4 bacs de contraste (barres bleues). Un total de 503 protéines individuelles ont été dénombrées au cours de cette mesure. L’expérience a été répétée 10 fois avec des résultats similaires. Ce chiffre a été adapté de McDonald, M.P. et al. 16. copyright 2018 American Chemical Society. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Un des aspects plus cruciaux pour obtenir des données iSCAT utile est la possibilité de trouver la bonne position focale à la surface de la lamelle couvre-objet et, en outre, à occuper ce poste pendant de longues périodes de temps. Faute de quoi se traduira par PSF élargie, signaux faibles iSCAT et artefacts associés à la dérive dans les analyses de la dynamique. Il s’avère que trouver le plan focal sur un lamelle couvre-objet propre et surface n’est pas une tâche facile comme caractéristiques de la surface ne sont pas visibles sur l’arrière-plan de faisceau de référence importante (voir Figure 4 d).
Images RAW iSCAT sont souvent masqués par des signaux de fond qui découlent de front d’onde impuretés dans la source d’excitation et peuvent nuire à sa capacité à trouver le bon plan d’imagerie. Soustraction de front d’onde active est un moyen utile pour contourner ce problème et par la suite surveiller l’accent iSCAT pendant une mesure16. Une façon d’y parvenir est par le biais de modulation spatiale échantillon. En bref, un générateur de fonctions s’applique une onde carrée de 50 Hz pour le port de contrôle externe de la scène de piezo, résultant en une modulation de l’échantillonnage spatial à la fréquence appliquée (amplitude de 290 nm). Acquisitions de caméra synchrone découlent de la même source et, lorsqu’il est combiné par le biais de lock-in principes, aboutir à une compensation de wavefront image14,16. L’image résultante indique généralement la rugosité de la lamelle (Figure 4e). Petits éléments restant sur le verre après que nettoyage peuvent être utilisés pour donner le focus au microscope. Paramètres utilisés pour cette étape de soustraction de fond peuvent être changés selon la cadence, durée d’exposition ou matériels.
Comme mentionné ci-dessus, l’utilisation d’un séparateur de faisceau de haute qualité dans les paramètres iSCAT (étape 1.2.1.) est recommandée, comme l’imagerie d’objets comme les images fantômes ou interférence résultant de séparateurs de faisceau planaire mince influencera l’image et perturber la mesure. La figure 7 montre une comparaison entre un séparateur de faisceau de faible qualité et de haute qualité. Les deux images raw iSCAT montrent la même zone sur la lamelle couvre-objet contenant des particules résiduelles. La même configuration iSCAT a été utilisée pour capturer les deux images, le séparateur de faisceau seulement ont été échangé. Figure 7 a montre l’image formée sur la caméra par l’utilisation d’une plus épaisse (5 mm), séparateur de faisceau revêtement antireflet et coincé. Grâce à la conception coincée, le faisceau réfléchi de la surface arrière de la séparateur de faisceau est antiparallèle à la réflexion résultant de la surface frontale et ne pénètre pas dans l’objectif. Sans artefacts interférences se produisent. Figure 7 b montre le même champ de vision sur l’échantillon, mais cette fois un séparateur de faisceau planaire (1 mm) plus mince a été utilisé. Les deux réflexions des surfaces avant et arrière entre le séparateur de faisceau sont parallèles et se propagent à la caméra. Objets d’interférence sont clairement visibles.
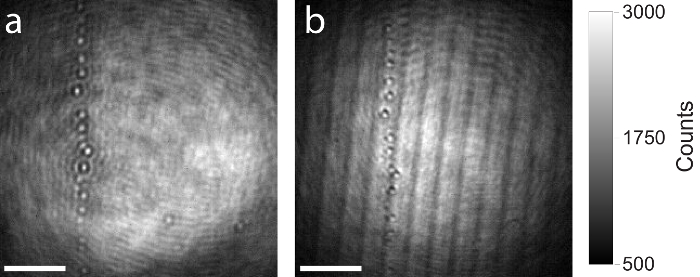
Figure 7 : comparaison d’images iSCAT produites avec séparateurs de faisceau haute et basse-qualité. (a) résultant iSCAT raw image par l’utilisation d’un séparateur de faisceau épais revêtement antireflet et coincé de 5 mm. (b) résultant iSCAT raw image de la même région par l’utilisation d’un séparateur de faisceau planaire épaisse de 1 mm. Les deux séparateurs de faisceau ont le même rapport de fractionnement (réflexion de 50 %, 50 % de transmission). Objets d’interférence dus aux réflexions de Fresnel sont clairement observés dans l’image produite avec le séparateur de faisceau planaire épaisse de 1 mm. Barreaux de l’échelle : 2 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Dans ce protocole, nous décrivons un schéma d’éclairage grand-angulaire pour iSCAT car il est rapide, facile à réaliser et permet de détection parallèles sur une vaste zone14. Une autre approche courante consiste à utiliser des déflecteurs acousto-optique (ces OD) et balayez un faisceau confocal sur l’échantillon12,17. Cette approche évite la nécessité d’une réentrée de haute qualité, mais est plus expérimentalement complexe que l’imagerie grand champ conventionnel. En outre, la vitesse d’éclairement confocal est limitée par celle de ces OD. Selon les paramètres expérimentaux souhaités, soit régimes d’éclairement confocale ou grand champ peuvent, en principe, être utilisés pour détecter les protéines simples sécrétées par les cellules vivantes.
Tel que discuté dans tout le protocole, il est impératif de réduire au minimum les fluctuations mécaniques latérales dans le stade de l’échantillon du microscope. Même nanomètre déviations dans la position de l’échantillon peuvent conduisent à des variations dans les trames consécutives caméra et provoquer des bruits significatifs dans l’image différentielle. Il est donc recommandé d’utiliser une platine du microscope mécaniquement stable et une amorti table optique (étape 1.1.1.) et pour couvrir l’installation avec des panneaux ou rideaux optique pendant une expérience (étape 3.5.).
Un régime de stabilisation du foyer actif sont également envisageables pour les mesures à long terme. Dans cette approche, un deuxième laser est incorporé dans le microscope dans un arrangement de réflexion totale interne (TIR) et ensuite projeté sur une photodiode quadrant. Changements dans focus du système se traduisent les déplacements latéraux du laser TIR spot sur la diode de quadrant, qui peut ensuite servir dans une boucle de rétroaction active pour contrôler l’axe z du piezo étape26. Les effets de la dérive verticale à long terme sont ainsi éliminées.
Plusieurs modifications et extensions peuvent être appliquées à la technique présentée pour répondre aux besoins spécifiques expérimentales. Par exemple, les incubateurs de stade commercial microscope sont disponibles qui pourraient facilement être incorporées dans le microscope iSCAT pour l’imagerie à long terme des cellules. Autres techniques peuvent également être implémentées pour compléter iSCAT d’imagerie, telles que confocale ou TIR fluorescence microscopies17. Pour adapter le système à l’étude, la sécrétion iSCAT mesures peuvent être effectuées sur d’autres supports de cellules comme DMEM ou SPD, toutefois, le rouge de phénol indicateur pH il faut éviter car elle peut perturber l’expérience due à l’absorption de la lumière laser. En outre, suppléments comme sérum de veau foetal (FCS) ou humain lysat de plaquettes (hPL) contiennent des protéines qui peuvent interférer avec la détection iSCAT. Fonction de la sensibilité désirée de l’expérience, ces suppléments devraient être exclues de la moyen de la microscopie.
iSCAT s’appuie sur la capacité de l’analyte à la lumière de nuages de points XY — une propriété qui fait partie intégrante de toutes les protéines — et n’est donc par nature non spécifique. Néanmoins, une certaine spécificité est possible comme échelle de signaux iSCAT linéairement avec la protéine masse14,27,28. Cela permet l’étalonnage d’un système d’iSCAT en utilisant des échantillons de protéine standard, tels que l’albumine sérique bovine (BSA) et fibrinogène14,27,28. En effet, très récemment, Young et al. 28 ont étendu sur les travaux de Piliarik & Sandoghdar14 et ont montré qu’iSCAT peut être utilisé pour déterminer le poids moléculaire des protéines aussi petits que streptavidine (53 kDa) avec une résolution massive de 19 kDa et une précision d’environ 5 kDa. Plusieurs approches conventionnelles peuvent compléter encore iSCAT en fournissant un niveau supplémentaire de spécificité. Comme un exemple, dosages immuno-enzymatiques (ELISA), et/ou autres modifications de surface, restreignent protéine liant les événements afin que seule la protéine-cible est détecté16.
Dans ce protocole, nous décrit comment les iSCAT microscopie peut être utilisée pour étudier des sécrétions cellulaires au niveau de la seule protéine avec résolution temporelle de subsecond16. La technique est générale et peut être exécutée sur n’importe quel microscope commercial ou maison construite. Contrairement aux approches de la fluorescence des molécules simples, la méthode ne souffre pas de photoblanchiment ou clignotement des effets, mais il atteint sensibilité unique-protéine. Ces caractéristiques font d’iSCAT un outil puissant dans le domaine des biocapteurs et microscopie. Les applications futures porteront sur élucider les interactions cellulaires complexes tels que la réponse immunologique à un stimulus ou de la communication cellulaire.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la Société Max Planck, un poste de professeur Alexander-von-Humboldt et la Deutsche Forschungsgemeinschaft (CRC 1181). Nous remercions Stefanie Schaffer Universitätsklinikum Erlangen pour fournir les cellules Laz388 et des discussions fructueuses. Nous remercions Simone Ihloff et Maksim Schwab à MPL pour le support technique.
matériels
| Name | Company | Catalog Number | Comments |
| Item/Device | |||
| 100x / 1.46 NA objective | Zeiss | 420792-9800-000 | alpha Plan Apochromat oil immersion |
| 20x / 0.4 NA objective | Leica | 566049 | N Plan |
| Piezo Stage | PI | P-517k020 | 3-axis stage with 100x100x10µm range |
| Diode laser (445 nm) | Lasertack | PD-01236 | |
| Optics/Optomechanics | Thorlabs/Newport | - | lenses, mirrors, posts, mounts |
| Pinhole | Thorlabs | P30H | |
| LED light source | Thorlabs | MCWHL5 | |
| Shortpass filter (580 nm) | Omega Optical | 580SP | to modify the spectrum of the LED for fluorescence excitation |
| Longpass filter (500 nm) | Thorlabs | FEL0500 | to modify the spectrum of the LED for fluorescence excitation |
| 70R/30T beam splitter | Newport | 20Q20BS.1 | |
| Economy beam splitter | Thorlabs | EBS1 | used for the comparison of fringe effects |
| Wedged plate beam splitter | Thorlabs | BSW26 | used for the comparison of fringe effects |
| Shortpass dichroic mirror (550 nm) | Edmund Optics | 66249 | |
| 8R/92T beam splitter | Thorlabs | BP108 | |
| CMOS camera | Photonfocus | MV1-D1024E-160-CL | for iSCAT aquisition |
| CMOS cameras | Mightex | SCE-B013-U | for bright field / fluorescence aquisition |
| Longpass filter (600 nm) | Thorlabs | FELH0600 | |
| Computer | Fujitsu Siemens | - | Core i7 Processor, 16 GB RAM, SSD |
| Acquisition Software | LabVIEW | - | LabVIEW 2016 Suite |
| Analysis Software | Matlab | - | Matlab 2014 Suite |
| Plasma Cleaner | Diener | Diener pico | |
| Incubator | Binder | Model CB | |
| Centrifuge | Eppendorf | 5810R | |
| Reagent/Material | |||
| RPMI 1640 medium | Gibco | 11835063 | without phenol red |
| HEPES Buffer Solution (1M) | Sigma Aldrich | 59205C | |
| Cover slides | Marienfeld | 107052 | |
| Glass bottom culture dishes | ibidi | 81158 | |
| Fluorescent Microspheres | Invitrogen | F8821 | used for calibration |
| Immersol immersion oil | Zeiss | 444960 | |
| Propidium iodide stain | Invitrogen | R37108 | |
| Small pipette tips | Eppendorf | 30075005 | |
| Flexible pipette tips | Eppendorf | 5242956003 | |
| Ethanol, 99.8% | Fisher Scientific | E/0650DF/15 | |
| Sodium hydroxide, pellets | Sigma Aldrich | 221465 | for preparing 0.2M NaOH solution |
Références
- Hathout, Y. Approaches to the study of the cell secretome. Expert Review of Proteomics. 4 (2), 239-248 (2007).
- Pandey, A., Mann, M. Proteomics to study genes and genomes. Nature. 405 (6788), 837-846 (2000).
- Makridakis, M., Vlahou, A. Secretome proteomics for discovery of cancer biomarkers. Journal of Proteomics. 73 (12), 2291-2305 (2010).
- Bantscheff, M., Schirle, M., Sweetman, G., Rick, J., Kuster, B. Quantitative mass spectrometry in proteomics: a critical review. Analytical and Bioanalytical Chemistry. 389 (4), 1017-1031 (2007).
- MacBeath, G. Protein microarrays and proteomics. Nature Genetics. 32, 526-532 (2002).
- Seder, R. A., Darrah, P. A., Roederer, M. T-cell quality in memory and protection: implications for vaccine design. Nature Reviews Immunology. 8 (4), 247-258 (2008).
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Borisov, S. M., Wolfbeis, O. S. Optical biosensors. Chemical Reviews. 108 (2), 423-461 (2008).
- Dantham, V. R., Holler, S., Barbre, C., Keng, D., Kolchenko, V., Arnold, S. Label-Free Detection of Single Protein Using a Nanoplasmonic-Photonic Hybrid Microcavity. Nano Letters. 13 (7), 3347-3351 (2013).
- Zijlstra, P., Paulo, P. M. R., Orrit, M. Optical detection of single non-absorbing molecules using the surface plasmon resonance of a gold nanorod. Nature Nanotechnology. 7 (6), 379-382 (2012).
- Rickgauer, J. P., Grigorieff, N., Denk, W. Single-protein detection in crowded molecular environments in cryo-EM images. eLife. 6, e25648 (2017).
- Lindfors, K., Kalkbrenner, T., Stoller, P., Sandoghdar, V. Detection and Spectroscopy of Gold Nanoparticles Using Supercontinuum White Light Confocal Microscopy. Physical Review Letters. 93 (3), 037401 (2004).
- Jacobsen, V., Stoller, P., Brunner, C., Vogel, V., Sandoghdar, V. Interferometric optical detection and tracking of very small gold nanoparticles at a water-glass interface. Optics Express. 14 (1), 405 (2006).
- Piliarik, M., Sandoghdar, V. Direct optical sensing of single unlabelled proteins and super-resolution imaging of their binding sites. Nature Communications. 5, 4495 (2014).
- Roux, K. H. Immunoglobulin Structure and Function as Revealed by Electron Microscopy. International Archives of Allergy and Immunology. 120 (2), 85-99 (1999).
- McDonald, M. P., et al. Visualizing Single-Cell Secretion Dynamics with Single-Protein Sensitivity. Nano Letters. 18 (1), 513-519 (2018).
- Kukura, P., Ewers, H., Müller, C., Renn, A., Helenius, A., Sandoghdar, V. High-speed nanoscopic tracking of the position and orientation of a single virus. Nature Methods. 6 (12), 923-927 (2009).
- Ortega Arroyo, J., Cole, D., Kukura, P. Interferometric scattering microscopy and its combination with single-molecule fluorescence imaging. Nature Protocols. 11 (4), 617-633 (2016).
- Spindler, S., et al. Visualization of lipids and proteins at high spatial and temporal resolution via interferometric scattering (iSCAT) microscopy. Journal of Physics D: Applied Physics. 49 (27), 274002 (2016).
- Lazarus, H., et al. Characterization of a unique cell line (LAZ 221) from human acute lymphocytic ("null" cell) leukemia. Cancer Research. 38 (5), 1362-1367 (1978).
- Mackensen, A., et al. Evidence for in situ amplification of cytotoxic T-lymphocytes with antitumor activity in a human regressive melanoma. Cancer Research. 53 (15), 3569-3573 (1993).
- Crowley, L. C., Scott, A. P., Marfell, B. J., Boughaba, J. A., Chojnowski, G., Waterhouse, N. J. Measuring cell death by propidium iodide uptake and flow cytometry. Cold Spring Harbor Protocols. 2016 (7), 647-651 (2016).
- Freshney, R. I. Primary Culture. Culture of Animal Cells. , (2005).
- Dahmardeh, M., et al. . Unpublished data. , (2018).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. American Journal of Pathology. 146 (1), 3-15 (1995).
- Bellve, K., Standley, C., Lifshitz, L., Fogarty, K. Design and Implementation of 3D Focus Stabilization for Fluorescence Microscopy. Biophysical Journal. 106 (2), 606a (2014).
- Liebel, M., Hugall, J. T., Van Hulst, N. F. Ultrasensitive Label-Free Nanosensing and High-Speed Tracking of Single Proteins. Nano Letters. 17 (2), 1277-1281 (2017).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon