Method Article
Etiqueta-Free Imaging de único proteínas secretadas de células vivas através de iSCAT microscopia
Neste Artigo
Resumo
Apresentamos um protocolo para a detecção óptica em tempo real de proteínas sem rótulo única, como eles são secretados de células vivas. Isto é baseado em microscopia de dispersão interferométricas (iSCAT), que pode ser aplicada a uma variedade de diferentes sistemas biológicos e configurações.
Resumo
Demonstramos a microscopia de dispersão interferométricas (iSCAT), um método capaz de detectar proteínas sem rótulo única, secretadas das células de vida individual em tempo real. Neste protocolo, cobrimos as etapas fundamentais para realizar um microscópio iSCAT e complementá-lo com canais de imagem adicionais para monitorar a viabilidade de uma célula em estudo. Em seguida, usamos o método de detecção em tempo real de proteínas simples como eles são secretados a partir de uma célula viva que demonstramos com uma linha de células B imortalizada (Laz388). Medidas necessárias relativas à preparação do microscópio e da amostra, bem como a análise dos dados registados são discutidas. O protocolo de vídeo demonstra que microscopia iSCAT oferece um método simples para estudar a secreção ao nível único-molécula.
Introdução
Secretada as proteínas desempenham um papel significativo em vários processos fisiológicos1. Por causa disso, eles são rotineiramente estudados como um conjunto coletivo (proteómica) ou como entidades individuais,2,3. Proteomics tradicionalmente investiga todo o conjunto de proteínas presentes em um determinado sistema biológico por meio de citometria de fluxo, por exemplo, os ensaios imunoenzimático (ELISA) ou espectrometria de massa4,5, 6. Proteínas simples, por outro lado, geralmente são detectadas usando uma variedade de técnicas que se baseiam em fluorescência7,8, plasmonics9,10ou elétron criogênico11 microscopies. Todas essas técnicas usam instrumentos complexos, rotulagem ou ambos e muitas vezes faltam informação dinâmica como eles só entregam informações a longo prazo sobre o sistema sob estudo.
Aqui usamos o iSCAT12,13 microscopia de proteínas secretoras individuais de sentido com resolução temporal de subsegundos14. Importante, a técnica detecta o sinal fraco dispersado intrínseco para cada proteína12,14. A quantidade de luz que dispersa a uma bioparticle pequena escalas com sua polarização. Supondo-se que a forma de uma proteína pode ser aproximada por uma dispersão efetiva esfera14,15,16e que diferentes proteínas têm índices de refracção muito semelhantes, o sinal medido pode ser diretamente ligado ao peso molecular (MW) da proteína. A calibração empírica de contraste iSCAT contra peso molecular por medições de referência permite distinguir as proteínas de diferentes tamanhos. iSCAT experimentos prontamente podem ser complementados por microscopia de fluorescência17,18, imunoabsorção reagentes, bem como etiquetas fluorescentes ou espalhamento para permitir uma detecção específica de qualquer proteína de interesse14 , 17 , 19.
Em princípio, iSCAT funciona amplificando a luz espalhada fraco de uma proteína via interferométricas mistura com uma onda de referência secundário. A intensidade detectada (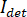 ) em um iSCAT microscópio é descrito por
) em um iSCAT microscópio é descrito por
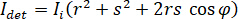
onde 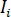 a intensidade incidente,
a intensidade incidente,  é um coeficiente para a contribuição da onda de referência,
é um coeficiente para a contribuição da onda de referência,  significa a força de dispersão do nano-objeto sob estudo, e
significa a força de dispersão do nano-objeto sob estudo, e 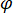 é a mudança de fase entre os dispersos e de referência ondas de14. Ou o transmitida ou refletida de volta luz incidente é normalmente usado como uma onda de referência, onde em cada caso
é a mudança de fase entre os dispersos e de referência ondas de14. Ou o transmitida ou refletida de volta luz incidente é normalmente usado como uma onda de referência, onde em cada caso 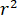 esclarece a transmissividade ou refletividade da câmara de amostra, respectivamente. O termo
esclarece a transmissividade ou refletividade da câmara de amostra, respectivamente. O termo 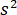 é proporcional a proteína espalhamento de seção transversal e pode ser negligenciada em comparação com o termo Cruz. Definindo assim,
é proporcional a proteína espalhamento de seção transversal e pode ser negligenciada em comparação com o termo Cruz. Definindo assim, 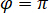 para completa interferência destrutiva, a luz detectada é dado por
para completa interferência destrutiva, a luz detectada é dado por 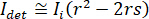 onde
onde 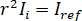 é a intensidade de referência e
é a intensidade de referência e 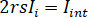 a intensidade de interferência.
a intensidade de interferência.
microscopia iSCAT oferece um excelente método para estudar processos biológicos a nível único-molécula. Como exemplo, investigamos as células Laz388 — um vírus Epstein - Barr (EBV) transformado linfócitos B célula linha20,21 — como eles secretam proteínas tais como IgG anticorpos16. No entanto, o método é geral e pode ser aplicado a uma variedade de outros sistemas biológicos. iSCAT é inerentemente inespecífica e pode detectar qualquer proteína ou nanopartículas ou ele pode ser estendido com comuns métodos de superfície functionalization para detecção específica ou multiplexado. Sua simplicidade e capacidade de ser combinada com outras técnicas ópticas, tais como a microscopia de fluorescência, fazem iSCAT uma ferramenta complementar valiosa na biologia celular.
Protocolo
Atenção: Por favor, Leia todas as fichas de dados de segurança (MSDS) antes de usar quaisquer produtos químicos, observar todas as práticas de segurança adequadas e usar equipamento de proteção pessoal (óculos de segurança do laser, óculos de proteção, luvas, batas) conforme necessário.
1. construção do microscópio16,18 iSCAT
Nota: O microscópio de iSCAT normalmente consiste de uma configuração modificada microscópio invertido. Em breve, um laser é focado para o avião voltar focal de um objectivo de alta abertura numérica (NA) e uma lente de imagem é usado para concentrar a luz de volta-difusa da partícula em uma microplaqueta de câmera. Em geral, este microscópio de campo amplo pode ser construído do zero ou com base em um existente microscópio invertido. Este protocolo abrange as etapas essenciais para realizar a instalação, enquanto as alterações no hardware usado são possíveis. Uma descrição mais detalhada do assembly de um microscópio de iSCAT pode ser encontrada no trabalho de Arroyo et al . 18.
Cuidado: Um microscópio iSCAT envolve uma classe IIIB para fonte de luz laser classe IV. Proteção ocular adequada é necessária quando a montagem e o alinhamento da óptica do microscópio. Durante a montagem do microscópio, certifique-se de que o caminho do feixe de laser permanece em linha reta e não é desviado como novos componentes ópticos são adicionados.
-
Configure o caminho da iluminação do microscópio.
- Usando uma tabela de óptica amortecida e um bloco de metal rígido, construir um microscópio amostra palco18 que incorpora um objetivo elevado abertura numérica (NA) (100 X / 1.46 nd) e uma unidade de tradução que permite a tradução de amostra lateral, bem como a mudança de foco posição para o objetivo.
Nota: A operação de um microscópio de iSCAT no limite de detecção de proteínas única é altamente suscetível a vibrações externas. Um palco de piezo centrossimétricas que ofereça suporte a amostra de todos os lados é aconselhável limitar excitações acústicas da amostra que caso contrário comprometeria a estabilidade lateral e focal. A Figura 1 mostra um estágio de amostra adequado, incluindo a unidade de tradução piezo e o objetivo. Além disso, é recomendável que montagens maciças e estáveis são usadas para todos os componentes ópticos discutidos nas etapas seguintes. Tais componentes estão prontamente disponíveis de fornecedores comerciais de óptica. - Use uma lente de singlete 50cm comprimento focal (lente de campo amplo) e a 45° (vertical) espelho para concentrar a luz de um laser de diodo no comprimento de onda 445 nm para o avião voltar focal do objectivo de acoplamento. Isto cria um feixe colimado em foco para a frente do objetivo e se tornará a fonte de iluminação iSCAT. Se necessário, filtre o laser espacialmente antes da lente 50 cm via 30 µm pinhole ou fibra monomodo.
- Aplique uma gota de óleo de imersão para o objectivo e coloque uma lamela de vidro no plano amostra da fase de microscópio. Isso resultará em um feixe que reflete para baixo com o objectivo de imagem.
Nota: A reflexão surge a partir da interface ar-vidro na superfície superior da amostra lamela e servirá como base para o feixe de referência iSCAT. Residual sujeira ou poeira na superfície da lamela dará origem a dispersão difusas, que auxiliam a correta focalização do objectivo de imagem nas próximas etapas.
Atenção: A maioria da luz do laser transmite através da lamela e viaja para cima do objectivo. Coloque um difusor opaco especular (ex., um cartão de papel) acima a lamela para minimizar o risco de lesões devido a luz do laser.
- Usando uma tabela de óptica amortecida e um bloco de metal rígido, construir um microscópio amostra palco18 que incorpora um objetivo elevado abertura numérica (NA) (100 X / 1.46 nd) e uma unidade de tradução que permite a tradução de amostra lateral, bem como a mudança de foco posição para o objetivo.

Figura 1: fase de amostra iSCAT. A fotografia mostra o bloco de alumínio maciço em que a unidade de tradução piezo (preto) é montada assim como o centrado 100 x objetivo. Fase 3-eixo piezo permite um posicionamento preciso da amostra no plano focal do objectivo. Com foco grosso é realizado girando um tubo rosqueado no qual o objetivo é montado (não representado). O bloco é posicionado na mesa óptica com quatro pedestais de aço acima do espelho de acoplamento de 45°. Clique aqui para ver uma versão maior desta figura.
-
Configure o caminho da imagem latente do microscópio.
- Introduzir um antireflection (AR)-revestido divisor de feixe (reflexão de 70%, 30% de transmissão) em um ângulo de 45° em relação ao feixe incidente e cerca de 10 cm atrás da lente de campo amplo. O revestimento de AR em direção a fonte de laser de ponto. Isto transmite o feixe incidente e reflete a referência e espalhadas feixes em um ângulo de 90° para o feixe incidente.
Nota: Divisores de feixe AR-revestido e/ou emperrar são recomendados como efeitos significativos de fantasmas e franja podem ocorrer ao usar o feixe dividindo cubos, ou divisores de feixe planar sem revestimento. Consulte a discussão para mais detalhes. Se desejar, qualquer feixe reflectido indesejável decorrentes da parte posterior do divisor de feixe pode ser bloqueado pelo uso de um diafragma de íris. - Um divisor de feixe grosso introduzirá um deslocamento significativo do feixe para que o laser não pode entrar o objetivo mais direto. Se necessário, Realinhe o caminho do feixe de laser antes do divisor de feixe para garantir a correta propagação através do objetivo.
Nota: O divisor de feixe também pode ser adicionado antes da lente de campo grande e a fase de microscópio está posicionada (na etapa 1.1.2.), para que o feixe não será deslocado mais tarde. - Neste momento, concentrar-se no braço da imagem latente do interferômetro e certifique-se de que o plano de amostra e a câmera estão focagem de pares. Coloque um côncavo f = lente-45 cm em uma posição de 5 cm atrás da lente de campo amplo no caminho do feixe incidente. Isso resultará em um feixe colimado entrando a abertura traseira do objectivo.
- Com uma tela colocada no braço refletido o interferômetro, mova o objetivo no sentido vertical para encontrar a posição focal grosseira. O objetivo está em foco quando bater a tela o feixe é colimado.
Nota: A Figura 2 mostra um esquema deste processo. - Remova ambos o f = lente-45 cm e a tela quando focagem grosseira é completa.
Nota: Em vez de usar uma lente de distância focal negativa, a própria lente de campo amplo pode ser colocado sobre um monte de móvel e deslocado fora do caminho do feixe para esta etapa. No entanto, para obter a configuração mais estável do microscópio, é aconselhável segurar a lente de campo amplo em uma posição fixa. - Adicionar um segundo f = 50 cm singlet lente para focar a luz dispersa e Desbloqueem a luz refletida sobre o sensor de uma câmera do CMOS. Certifique-se de que a lente é colocada a 50 cm do plano focal volta do objectivo a fim de re-Desbloqueem o feixe de referência e concentrar a luz espalhada.
- Lugar do CMOS chip de 50 cm da f = 50 cm lente e posicionar o feixe diretamente para o meio do chip.
Nota: Os seguintes parâmetros são normalmente usados para tratamento de imagens. A potência de saída do laser (comprimento de onda 445 nm) é definida como 100 mW. Pinhole e feixe divisor de atenuar a transmissão da luz, para que o poder eficaz entrando o objectivo é de cerca de 9 mW. O diâmetro do feixe na posição de amostra equivale a 6 µm. Com a lente de imagem usada, a ampliação efetiva do sistema é cerca de 300 x. O tamanho da imagem no chip CMOS é definido como 128 × 128 pixels dentro da área iluminada, resultando em um campo de visão de aproximadamente 5 × 5 µm2. A Figura 3 mostra um esquema do microscópio iSCAT totalmente montado.
- Introduzir um antireflection (AR)-revestido divisor de feixe (reflexão de 70%, 30% de transmissão) em um ângulo de 45° em relação ao feixe incidente e cerca de 10 cm atrás da lente de campo amplo. O revestimento de AR em direção a fonte de laser de ponto. Isto transmite o feixe incidente e reflete a referência e espalhadas feixes em um ângulo de 90° para o feixe incidente.
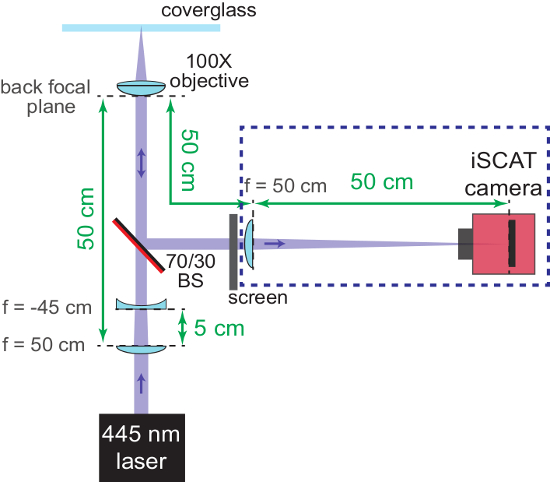
Figura 2: focagem grosseira do microscópio iSCAT. O diagrama esquemático mostra o arranjo da óptica para ajudar a trazer o sistema em foco. AR-revestido parte de trás do divisor de feixe (70/30 BS) está marcado em vermelho. Importante as distâncias são fornecidas em verde. As distâncias focais (f) das lentes utilizadas são denotadas. Componentes na caixa tracejada azul são adicionados em etapas 1.2.6 - 1.2.7. A lente côncava (usado para re-Desbloqueem o feixe convergentes de iSCAT) e a tela são removidos mais tarde. Clique aqui para ver uma versão maior desta figura.

Figura 3: microscópio iSCAT. O diagrama esquemático mostra o microscópio de iSCAT completamente montado. AR-revestido parte de trás do divisor de feixe (70/30 BS) está marcado em vermelho. Importante as distâncias são fornecidas em verde. As distâncias focais (f) das lentes utilizadas são denotadas. Clique aqui para ver uma versão maior desta figura.
-
Configure canais de imagem adicionais.
Nota: Esta seção adiciona outro caminho de imagem para o microscópio que permite a observação de uma grande área em torno do laser de iSCAT através de microscopia de campo claro e para monitorar a viabilidade celular através de microscopia de fluorescência.- Casal a saída de uma fonte de luz LED (aproximadamente 500 nm < λ < 580 nm) em um longo trabalho objetivo de distância 20 X / 0,4 at e instalar componentes mecânicos acima da câmara de amostra que permitem a focagem e posicionamento lateral da saída de LED para o amostra.
- Certifique-se de que saída o LED do espectro abrange a gama de excitação do marcador de morte celular (iodeto de propidium (PI)) e não interfere com sua fluorescência (λ > 600 nm). Se necessário, use filtros ópticos.
- Mova o objetivo superior lateralmente para o superior (campo amplo) e inferior (iSCAT) objectivos são colineares. Isso é determinado pela colocação de uma tela no âmbito do objectivo inferior e maximizando a intensidade da luz transmitida de LED na tela. Coloque um λ = 550 nm curto-pass espelho dicroico (SPDM) para dividir o transmitida LED luz do caminho do laser iSCAT.
- Dividi esse feixe em dois canais com um divisor de feixe transmissivo de reflective/92% de 8% (BS). O caminho de 92% é o canal de fluorescência e o caminho de 8% é usado para a imagem latente do brilhante-campo.
- Imagem do canal brilhante-campo para uma câmera CMOS usando um f = 5cm dubleto acromático lente.
- Imagem do canal de fluorescência para uma câmera CMOS separado usando um f = 5cm dubleto acromático lente e um λ = 600 nm filtro de passa-tempo para bloquear a luz de excitação. A figura 4a mostra um esquema do microscópio montado inteiramente incluindo todos os canais de imagem.
- Casal a saída de uma fonte de luz LED (aproximadamente 500 nm < λ < 580 nm) em um longo trabalho objetivo de distância 20 X / 0,4 at e instalar componentes mecânicos acima da câmara de amostra que permitem a focagem e posicionamento lateral da saída de LED para o amostra.

Figura 4: microscopia iSCAT das proteínas secretadas pelas células únicas. (a) esquemático do microscópio descrito no protocolo. See Secção 1 para obter mais informações. Abreviaturas: LED, diodo emissor de luz; SPF, filtro passa-curto; obj, objetivo; SPDM, espelho dicroico curto-pass; BS, divisor de feixe; LPF, filtro de passa-tempo; BF, brilhante-campo; fluor, fluorescência; C1-C3, câmera 1-3. (b) Bright-campo imagem de um único Laz388 celular cerca de 4 µm longe o iSCAT campo de visão (representado por um quadrado branco). Imagem tirada pela câmera C3, barra de escala: 10 µm. (c) fluorescência imagem da mesma região mostrada em (b) com a posição da célula, marcado por um círculo branco. A ausência de fluorescência indica que a célula é viável. Imagem tirada pela câmera C2, barra de escala: 10 µm. (d) iSCAT Raw câmera instantâneo da imagem com o tempo de exposição 80 µs. Imagem tirada pela câmera C1. imagem de iSCAT (e) da mesma região após subtracção de fundo spatiotemporal conforme descrito na seção de discussão. A imagem foi integrada ao longo de 1000 sequencial cru quadros (d) com um tempo de quadro final de 400 ms e revela a aspereza de superfície da lamela de vidro. (f) correspondente diferencial iSCAT imagem que mostra o evento de ligação de 2 proteínas no sentido da lamela. A imagem foi calculada subtraindo-se duas imagens consecutivas de filtrado (e). Dimensionamento de barras em (d), (e) e (f): 1 µm. Esta figura foi adaptada da McDonald ' s, M.P. et al . 16. copyright 2018 American Chemical Society. Clique aqui para ver uma versão maior desta figura.
-
Configure o computador e o software.
- Conecte todas as câmeras para um computador. Instalar pacotes de driver respectivos e obter/gravação software para seu controle.
Nota: O hardware adequado é necessário para aquisições de alta velocidade. No mínimo, um processador multi-core, 16 GB de RAM, placa de apanhando um quadro e um disco de estado sólido para o armazenamento de dados são recomendados. - Observar a imagem iSCAT da câmera CMOS e certifique-se de que está em foco, encontrando uma partícula de poeira ou sujeira residual sobre a lamela de vidro. Verifique se a imagem da partícula é que um ponto circular simétrico espalhar função (PSF).
Nota: A principal razão para uma não-circular simétrica PSF é que o feixe de laser não entra o objetivo direto, mas em um pequeno ângulo em relação ao eixo óptico. Isto é corrigido ajustando o ângulo e a posição do feixe incidente com o espelho de acoplamento de 45°. - Compare as imagens da câmera de campo brilhante e os canais de fluorescência. Certifique-se que ambos estão em foco e exibir a mesma área. Verifique se a posição do laser iSCAT é aproximadamente no centro da imagem e tomar nota da sua posição para referência posterior. Ver figura 4b – 4f para imagens de câmera típica.
Nota: Use uma amostra de células ou grânulos fluorescentes para encontrar o foco dos dois canais. Remova temporariamente o filtro de passa-tempo de fluorescência para ajustar o sistema. O foco para a imagem latente convencional das células precisa ser ligeiramente maior do que o plano focal de iSCAT. Para compensar isto sem mover o objectivo, deslocar as câmeras de suas posições no foco da dois respectivos f = lentes de 5 cm. - Defina os parâmetros da câmera necessário. Usar uma taxa de quadros fixos e desativar ferramentas de ganho e correção de software.
Nota: Os parâmetros seguintes são utilizados: A câmara de iSCAT é definida como 5000 quadros por segundo (fps) com um tempo de exposição de 80 µs. Como mencionado acima, o tamanho da imagem é de 128 x 128 pixels. Tanto brilhante-campo e fluorescência câmeras operam no tamanho de quadro completo (1280 × 1024 pixels). Imagem de Bright-campo é realizada com um tempo de exposição de 20 ms. A câmera de fluorescência é definida como o tempo de exposição de 750 ms e 5 quadros consecutivos são acumulados para formar uma imagem final. Bright-campo e fluorescência imagens são adquiridas em intervalos de tempo fixos 20 s.
- Conecte todas as câmeras para um computador. Instalar pacotes de driver respectivos e obter/gravação software para seu controle.
2. preparação do experimento
-
Preparar o meio de microscopia de estoque.
- Adicionar 25 mL de solução-tampão HEPES (1 mol/L) para 975 mL de meio RPMI 1640 para obter um final 1 L de solução HEPES 25 mmol/L. Como alternativa, use um meio de tampão com HEPES já incluídos.
Nota: HEPES é usado para manter o valor de pH do meio durante uma medição em condições ambientais (por exemplo, fora uma incubadora e sem constante fornecimento de CO2 ). - Tomar uma alíquota da solução necessária para um experimento e deixá-lo aquecido até a temperatura ambiente. 2 mL do meio é suficiente. Manter o restante da solução estoque a 4 ° C.
- Adicionar 25 mL de solução-tampão HEPES (1 mol/L) para 975 mL de meio RPMI 1640 para obter um final 1 L de solução HEPES 25 mmol/L. Como alternativa, use um meio de tampão com HEPES já incluídos.
-
Prepare a cubeta do microscópio.
Nota: As seguintes etapas descrevem o procedimento para um porta-amostras Custom-Built consistindo de uma chapa de alumínio e um prato de acrílico cubeta que corrige a lamela e casais, o posicionador 3D piezoelétrico. Pratos de cultura estéreis comercialmente disponíveis com um fundo de vidro também podem ser usados.
Nota: A Figura 5 mostra fotografias do porta-amostras custom-built.- Pegue uma lamela de microscopia novas e enxágue com água deionizada (DI-água) e etanol. Ar seco o slide com nitrogênio ou ar pressurizado.
- Limpe a lamela em uma atmosfera de plasma de oxigênio (pressão de gás de 0,3 mbar) durante 10 minutos a potência de RF W 500. Isso remove todas as impurezas orgânicas da superfície.
- Limpe o prato acrílico cubeta por imersão em 0,2 mol/L de solução de NaOH para aproximadamente 10 min. Enxágue com água.
- Montar o porta-amostras e cubra-o com um plástico de Petri até necessários no experimento.

Figura 5: porta-amostras custom-built. (a) componentes do titular da amostra: (1) prato acrílico cubeta; (2) placa base de alumínio; (3) segurando os parafusos; (4) silicone-o-Ring; (5) lamela. (b) totalmente montado titular da amostra. Clique aqui para ver uma versão maior desta figura.
-
Prepare o microscópio.
- Liga o laser de iluminação de iSCAT, a-campo/fluorescência brilhante iluminação LED, câmeras e o computador/software de aquisição. Bloquear o feixe de laser em uma posição antes do objetivo.
- Assegurar que os 100 X / 1.46 objectivo at é limpo. Se não, use toalhetes e etanol de limpeza da lente para limpar o objetivo em conformidade com as orientações do fabricante.
- Aplique uma gota de óleo de imersão sobre o objetivo do microscópio.
- Levar o porta-amostras (montado na seção 2.2) e montá-lo cuidadosamente no palco do microscópio iSCAT piezo para que a lamela de amostra é centralizada sobre o objectivo do microscópio. Estar atento e cuidado para não danificar a lente objetiva. Fixe a unidade para o posicionador piezoelétrico com parafusos, garantindo que o fabricante especificado torque máximo não seja excedido.
- Adicione 1 mL de meio de microscopia de estoque (preparado no ponto 2.1.) para a cubeta.
- Adicione 2 gotas de mancha de iodeto de propidium ao meio como uma célula morte marcador16,22.
- Desbloquear o laser e colocar o sistema em foco. Primeiro, verifique se que o objectivo é posicionado à distância correta da lamela, repetindo as etapas 1.2.3. -1.2.5. (Figura 2). Em seguida, ajuste o foco com o eixo z da fase de piezo.
- Confirme que todas as configurações para as fontes de luz, câmeras e software estão definidas corretamente. Isso inclui parâmetros tais como o poder do laser, LED intensidade, taxas de quadro de câmera, tempos de exposição da câmera ou software salvar caminhos.
Nota: Salvar vídeos em altas taxas de quadros pode produzir tamanhos de arquivo grande. Certifique-se de suficiente espaço livre em disco no computador. - Bloquear o feixe de laser novamente. O microscópio está agora pronto para uma experiência.
-
Prepare as células.
Nota: Laz388 células20 são cultivadas em meio RPMI 1640, suplementado com 10% de soro fetal bezerro (FCS), aminoácidos, piruvato e antibióticos. As células são incubadas a 37 ° C e 5% de CO2 e são divididas e fornecidas com meio fresco a cada 2-3 dias23.- Pegue o frasco de cultura celular de incubadora e aspire o meio contendo aproximadamente 1 x 106 células. Para determinar o volume correto, quantificar a concentração da cultura de pilha pelo uso de um hemocytometer.
- Misturar a solução de celular com 10 mL de meio RPMI 1640 à temperatura ambiente e centrifugar a amostra a 300 x g, durante 7 min.
- Cuidadosamente, extrair e descartar o sobrenadante, garantindo que o pellet de células concentrados permanece intacto.
- Repita os passos de 2.4.2. -2.4.3. com o sedimento concentrado de células.
- Ressuspender as células em 0,5 mL de meio de microscopia de estoque (preparada no ponto 2.1.) e imediatamente usá-los em um experimento.
3. iSCAT microscopia das células secretoras
- Certifique-se de que o feixe de laser é bloqueado para impedir que as células sendo expostos diretamente à luz do laser iSCAT.
- Injete as células a cubeta de amostra.
- Injete a cubeta de amostra, cerca de 3 µ l da amostra celular (preparado na secção 2.4.) ligeiramente fora do centro. Tocar suavemente a ponta da pipeta para a lamela e injetar lentamente a solução da célula. Permitir que as células para resolver sobre a lamela.
Nota: Utilize pontas de pipetas de pequeno volume (10 µ l) ou dicas de gel de carregamento longas e flexíveis. - Certifique-se de que a densidade de células é abaixo de aproximadamente 1 célula por 500 µm² para que medições de célula única não são influenciadas por várias células na área circundante do laser iSCAT.
- Se o número de células é muito baixa, repita etapa 3.2.1. até que um número suficiente está disponível.
- Se a cobertura das células é muito densa, use uma injeção de cerca de 20 µ l de meio de microscopia adicionais para dispersar as células através da lamela.
- Injete a cubeta de amostra, cerca de 3 µ l da amostra celular (preparado na secção 2.4.) ligeiramente fora do centro. Tocar suavemente a ponta da pipeta para a lamela e injetar lentamente a solução da célula. Permitir que as células para resolver sobre a lamela.
- Usando o posicionador de piezo, mova a amostra lateralmente para posicionar uma célula perto (aproximadamente 10 µm) para o iSCAT campo de visão. Certifique-se de que a célula não entra o iSCAT campo de visão como exposição direta à luz 445 nm do laser pode ser prejudicial para a célula.
- Use imagens brilhantes-campo e fluorescência para localizar e verificar a viabilidade de25 célula.
Nota: Uma célula viável tem um formato redondo na imagem brilhante-campo e não fluorescente, Considerando que a morte celular é indicada pelos sinais de forte fluorescência decorrentes da presença de iodeto de propidium dentro da célula,22. - Desbloquear o feixe de laser de iSCAT e certifique-se de que a superfície de lamela ainda está em foco. Coloque a tabela de isolamento para minimizar a deriva e acoplamento acústico do ambiente entorno.
Nota: Este último é realizado com pesadas cortinas ópticas ou painéis acrílicos em torno da mesa óptica. - Inicie a medição através da aquisição de imagens das câmeras iSCAT, brilhante-campo e fluorescência. Automatizar e controlar o processo através do software para maximizar a eficiência experimental. Verifique periodicamente a viabilidade da célula e o foco do sistema.
Nota: Dependendo da intensidade do laser, componentes ópticos e as configurações de tempo de exposição da câmera, o laser de iSCAT pode interferir com a câmera de fluorescência. Se esse comportamento é observado, considere a cofragem o laser iSCAT temporariamente durante aquisições de imagem de fluorescência.
4. análise de dados
Nota: Dados experimentais são inerentemente barulhentos, e imagens de iSCAT não são diferentes. Existem várias fontes de ruído em uma medição de iSCAT típica, incluindo wavefront distorções na fonte de luz incidente, rugosidade da superfície da lamela e ruído da câmera. A seção a seguir apresenta algumas maneiras em que estas fontes de ruído são corrigidas através de pós-processamento. Adicionalmente, instabilidades mecânicas laterais da instalação do levam a dados ruidosos e devem ser tratadas da mesma forma, conforme descrito na seção de discussão abaixo. As análises descritas são realizadas com scripts personalizados do MATLAB.
- Minimize o ruído da câmera filtrando os dados brutos com um filtro de Fourier bidimensional que exclui alta frequência espacial. O tamanho do filtro deve estar ajustado a configuração experimental específica (determinada principalmente pela abertura numérica do sistema).
Nota: Características da imagem com frequências espaciais mais altas do que o sistema óptico se originam de fontes externas (tais como o ruído de leitura fora da câmera) e podem ser negligenciadas. - Converta as imagens de câmera raw contagens de contraste iSCAT.
Nota: O sinal detectado pela câmera é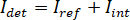 . iSCAT contraste é definido como
. iSCAT contraste é definido como 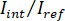 onde
onde 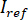 é a intensidade da luz a referência, neste caso, a parte refletida por lamela, e
é a intensidade da luz a referência, neste caso, a parte refletida por lamela, e 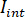 é a interferência entre
é a interferência entre 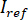 e a intensidade dispersa (
e a intensidade dispersa (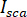 ).
).- Separar o sinal em
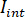 e
e 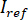 calculando a média temporal de quadros particulares em que as partículas de interesse não estão presentes. A imagem resultante fornece o sinal de referência
calculando a média temporal de quadros particulares em que as partículas de interesse não estão presentes. A imagem resultante fornece o sinal de referência 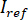 .
.
Nota: Como alternativa, um passo de subtração de fundo ativo pode ser realizado conforme descrito na discussão abaixo. - Calcular o contraste de acordo com
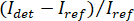 12,14,16.
12,14,16.
- Separar o sinal em
- Crie uma imagem diferencial rolamento subtraindo cada quadro consecutivo de seu sucessor.
Nota: Residual sinais desde a aspereza de superfície da lamela e wavefront distorções são efetivamente removidas nesta etapa como eles são constantes dentro de frames consecutivos. O rolamento diferencial remove esses sinais residuais, deixando apenas as ligações de proteínas que ocorrem de um quadro para outro. Esta subtração de fundo dinâmico é benéfica porque não é sensível às trações de amostra a longo prazo. - Aplica um algoritmo de busca de pico para detectar e partículas única para cada quadro de índice e determinar seu contraste específico e posição.
- Use as informações coletadas na etapa 4.4 para criar histogramas de eventos de ligação de proteínas e seus contrastes extraídos se relacionar massa de proteínas através de uma curva de calibração, compilada a partir de amostras de proteínas conhecidas14,24.
Resultados
Um diagrama esquemático de um microscópio de iSCAT é mostrado na figura 4a. Representante de campo claro, fluorescência e cru iSCAT imagens são mostradas na figura 4b, 4Ce 4D, respectivamente16. Figura 4e e 4f mostram os resultados de remoção de fundo e diferencial pós-processamento; duas proteínas adsorvidas são visíveis como pontos de difração limitada na Figura 4f. A Figura 6 mostra um histograma das proteínas detectadas ao longo de 125 s. Estes dados foram obtidos através da aplicação de um algoritmo de busca de pico para as imagens capturadas para contar os eventos de vinculação e catalogar seus contraste16. Um número total de 503 proteínas foram detectado.
Espécie próxima, secretada é identificado por comparação com medições de referência realizadas em soluções de proteína purificada, ou através de medições adicionais com superfícies de vidro funcionalizados14,16. Os dados de iSCAT, assim, Visualizar diretamente dinâmica celular secreção em uma escala de subsegundo16. Por exemplo, anteriormente encontramos que os anticorpos IgG são uma fração importante do secretome Laz388 e são liberados da célula a uma taxa de ca. 100 moléculas por segundo16. Além disso, outras partículas, abrangendo uma gama de 100 kDa - 1000 kDa são secretadas por células16. O método descrito pode ser mais independentes , por exemplo, para investigar o gradiente de concentração espacial das secreções que cercam uma célula16, ou para determinar a dinâmica temporal da lise celular16.
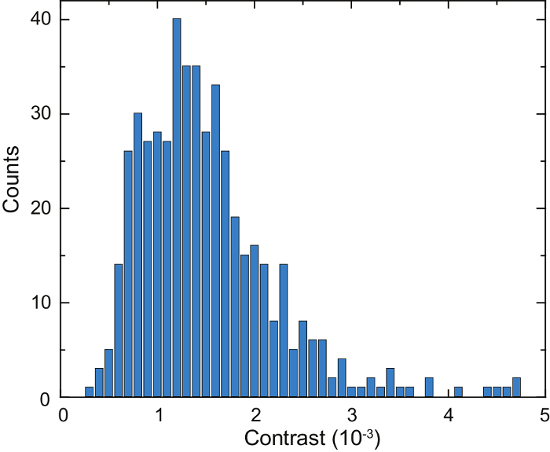
Figura 6: quantificação das proteínas secretadas por uma única célula de Laz388. O histograma mostra proteínas detectadas durante um período de tempo de 125 s. contraste valores são acumulados em tulhas de contraste 1 x 10-4 (barras azuis). Um total de 503 proteínas individuais foram contados durante essa medida. O experimento foi repetido 10 vezes, com resultados semelhantes. Esta figura foi adaptada da McDonald ' s, M.P. et al . 16. copyright 2018 American Chemical Society. Clique aqui para ver uma versão maior desta figura.
Discussão
Um dos aspectos mais cruciais para a obtenção de dados de iSCAT útil é a capacidade de encontrar a posição correcta de focal na superfície da lamela e, além disso, para manter esta posição por longos períodos de tempo. Falha ao fazer isso resultará em PSFs ampliou, iSCAT fracos sinais e artefatos associados deriva em análises de dinâmica. Acontece que encontrar o plano focal em uma lamela limpa, nu superfície não é uma tarefa fácil como características de superfície não são visíveis no contexto do feixe grande referência (ver Figura 4-d).
ISCAT-prima imagens são frequentemente obscurecidas por sinais de fundo que surgem a partir da wavefront impurezas na fonte de excitação e podem prejudicar a capacidade de encontrar o avião de imagem correto. Subtração de wavefront ativo é uma maneira útil para contornar este problema e posteriormente monitorar o foco de iSCAT durante uma medição16. Uma maneira de conseguir isso é através de modulação espacial da amostra. Em breve, um gerador de função se aplica a uma onda quadrada de 50 Hz à porta de controle externo do palco piezo, resultando em uma modulação espacial amostra na frequência aplicada (amplitude de 290 nm). Aquisições de câmera síncronas são acionadas da mesma fonte e, quando combinados através de bloqueio-em princípios, resultam em uma compensação de wavefront imagem14,16. A imagem resultante normalmente mostra a aspereza de superfície da lamela (Figura 4e). Pequenos recursos restantes no vidro, após a limpeza podem ser usados para trazer o microscópio em foco. Parâmetros usados para esta etapa de subtração de fundo ativo podem ser alterados de acordo com a taxa de quadros, tempo de exposição ou hardware.
Como mencionado acima, recomenda-se o uso de um divisor de feixe de alta qualidade na configuração do iSCAT (passo 1.2.1.), como de imagem artefatos como fantasmas ou interferências decorrentes de divisores de feixe fino planar irão influenciar a imagem e perturbar a medição. A Figura 7 mostra uma comparação entre um divisor de feixe de alta qualidade e baixa qualidade. Ambas as imagens raw iSCAT mostram a mesma área na lamela contendo algumas partículas residuais. A mesma configuração de iSCAT foi usada para capturar as duas imagens, foi trocado apenas o divisor de feixe. Figura 7a mostra a imagem formada na câmara pelo uso de um mais grosso (5mm), divisor de feixe AR-revestido e comido. Devido ao projeto vendendores, da superfície traseira do divisor de feixe, o feixe reflectido é antiparalelo para a reflexão resultantes da superfície frontal e não está entrando o objetivo. Não há artefatos de interferência ocorrem. Figura 7b mostra o mesmo campo de visão sobre a amostra, mas desta vez um divisor de feixe planar mais fino (1 mm) foi usado. As duas reflexões das superfícies frontais e traseiras do divisor de feixe são paralelas e se propagam para a câmera. Artefatos de interferência são claramente visíveis.
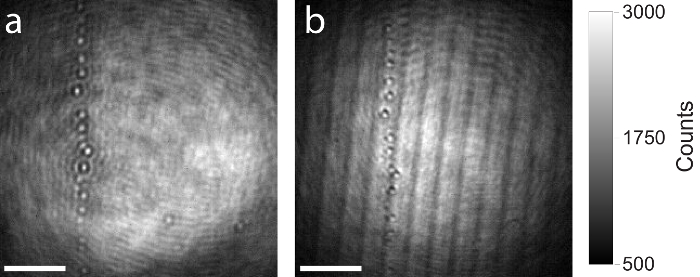
Figura 7: comparação de imagens de iSCAT produzidos com divisores de feixe de alta e baixa-qualidade. (a) resultante iSCAT crua imagem pelo uso de um divisor de feixe grosso, AR-revestido e vendendores de 5 mm. (b) resultando cru iSCAT imagem da mesma área pelo uso de um divisor de feixe planar espessura de 1 mm. Ambos os divisores de feixe têm a mesma proporção de divisão (reflexão de 50%, 50% de transmissão). Artefatos de interferências decorrentes de reflexões de Fresnel são claramente observados na imagem produzida com o divisor de feixe planar espessura de 1 mm. Escala de barras: 2 µm. clique aqui para ver uma versão maior desta figura.
Neste protocolo, descrevemos um esquema de iluminação de campo amplo para iSCAT... como ele é rápido, fácil de perceber e permite a detecção paralela sobre uma grande área de14. Outra abordagem comum é usar defletores Acusto-óptica (AODs) e um feixe confocal de varredura ao longo da amostra de12,17. Essa abordagem evita a necessidade de alta qualidade wavefronts mas é experimentalmente mais complexa do que a convencional de imagem de campo amplo. Além disso, a velocidade de iluminação confocal é limitada pelo de nível. Dependendo dos parâmetros experimentais desejados, ou esquemas de iluminação confocal ou campo amplo podem, em princípio, ser utilizadas para detectar proteínas única secretadas de células vivas.
Conforme discutido em todo o protocolo, é imperativo minimizar flutuações mecânicas laterais na fase de amostra do microscópio. Mesmo nanômetros desvios na posição da amostra podem conduzir a variações nos quadros consecutivos de câmera e induzir ruído externos significativos na imagem diferencial. Portanto, é recomendável usar um palco de microscópio mecanicamente estável e uma tabela de óptica amortecida (etapa 1.1.1.) e para cobrir a instalação com cortinas ópticas ou painéis durante um experimento (passo 3.5.).
Um esquema de estabilização do foco ativo também pode ser considerado para medições de longo prazo. Nessa abordagem, um segundo laser é incorporado ao microscópio em um arranjo de reflexão interna total (TIR) e posteriormente fotografado para um fotodíodo de quadrante. Mudanças no foco do sistema traduzem em deslocamentos laterais do laser TIR no diodo quadrante, o que pode ser usado em um loop de feedback activo para controlar o eixo z de piezo palco26local. Efeitos a longo prazo da tração vertical, portanto, são eliminados.
Várias modificações e extensões podem ser aplicadas para a técnica apresentada para enfrentar as necessidades experimentais específicos. Por exemplo, incubadoras de nível microscópio comercial estão disponíveis que pode facilmente ser incorporada o microscópio de iSCAT para a imagem latente a longo prazo das células. Outras técnicas também podem ser implementadas para complementar a iSCAT de imagem, tais como confocal ou TIR fluorescência microscopies17. Para adaptar o sistema sob estudo, secreção de iSCAT podem ser efectuadas medições em outros meios de célula como DMEM ou DPBS, no entanto, o vermelho de fenol do indicador de pH devem ser evitado como isso pode perturbar o experimento devido à absorção da luz do laser. Além disso, suplementos como soro fetal bezerro (FCS) ou plaquetária humana lisada (hPL) contêm proteínas que podem interferir com a deteção de iSCAT. Dependendo da sensibilidade desejada do experimento, estes suplementos devem ser excluídos do meio de microscopia.
iSCAT baseia-se na capacidade de uma substância a analisar à luz de dispersão — uma propriedade que é intrínseca a todas as proteínas — e, portanto, é inerentemente inespecífica. Não obstante, algum grau de especificidade é possível como iSCAT sinais escala linearmente com a proteína em massa14,,27,28. Isto permite a calibração de um sistema de iSCAT usando amostras de padrão da proteína, como albumina de soro bovino (BSA) e fibrinogênio14,,27,28. Na verdade, muito recentemente, a jovem et al 28 estenderam-se no trabalho de Piliarik & Sandoghdar14 e mostraram que iSCAT pode ser usado para determinar o peso molecular das proteínas tão pequenas quanto streptavidin (53 kDa) com uma resolução em massa de 19 kDa e uma precisão de cerca de 5 kDa. Várias abordagens convencionais mais podem complementar iSCAT, fornecendo um nível extra de especificidade. Como um exemplo, ensaios imunoenzimático (ELISA), e/ou outras modificações de superfície, restringir a eventos de ligação de proteínas para que somente a proteína alvo é detectado16.
Neste protocolo, descrevemos como microscopia iSCAT pode ser usada para investigar as secreções celulares a nível de proteína única com resolução temporal de subsegundo16. A técnica é geral e pode ser implementada em qualquer microscópio comercial ou construídos em casa. Em contraste com as abordagens de único-molécula fluorescência, o método não sofre fotobranqueamento ou piscar efeitos mas ainda atinge a sensibilidade single-proteína. Estas características fazem de iSCAT, uma ferramenta poderosa no campo da microscopia e biosensing. As aplicações futuras incidirá na elucidação de complexas interacções celulares tais como a resposta imunológica a um estímulo ou a comunicação celular.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi apoiado pela sociedade Max Planck, um cargo de professor de Alexander-von-Humboldt e a Deutsche Forschungsgemeinschaft (CRC 1181). Agradecemos a Stefanie Schaffer em Universitätsklinikum Erlangen para fornecer células Laz388 e para debates úteis. Agradecemos a Simone Ihloff e Maksim Schwab em MPL para suporte técnico.
Materiais
| Name | Company | Catalog Number | Comments |
| Item/Device | |||
| 100x / 1.46 NA objective | Zeiss | 420792-9800-000 | alpha Plan Apochromat oil immersion |
| 20x / 0.4 NA objective | Leica | 566049 | N Plan |
| Piezo Stage | PI | P-517k020 | 3-axis stage with 100x100x10µm range |
| Diode laser (445 nm) | Lasertack | PD-01236 | |
| Optics/Optomechanics | Thorlabs/Newport | - | lenses, mirrors, posts, mounts |
| Pinhole | Thorlabs | P30H | |
| LED light source | Thorlabs | MCWHL5 | |
| Shortpass filter (580 nm) | Omega Optical | 580SP | to modify the spectrum of the LED for fluorescence excitation |
| Longpass filter (500 nm) | Thorlabs | FEL0500 | to modify the spectrum of the LED for fluorescence excitation |
| 70R/30T beam splitter | Newport | 20Q20BS.1 | |
| Economy beam splitter | Thorlabs | EBS1 | used for the comparison of fringe effects |
| Wedged plate beam splitter | Thorlabs | BSW26 | used for the comparison of fringe effects |
| Shortpass dichroic mirror (550 nm) | Edmund Optics | 66249 | |
| 8R/92T beam splitter | Thorlabs | BP108 | |
| CMOS camera | Photonfocus | MV1-D1024E-160-CL | for iSCAT aquisition |
| CMOS cameras | Mightex | SCE-B013-U | for bright field / fluorescence aquisition |
| Longpass filter (600 nm) | Thorlabs | FELH0600 | |
| Computer | Fujitsu Siemens | - | Core i7 Processor, 16 GB RAM, SSD |
| Acquisition Software | LabVIEW | - | LabVIEW 2016 Suite |
| Analysis Software | Matlab | - | Matlab 2014 Suite |
| Plasma Cleaner | Diener | Diener pico | |
| Incubator | Binder | Model CB | |
| Centrifuge | Eppendorf | 5810R | |
| Reagent/Material | |||
| RPMI 1640 medium | Gibco | 11835063 | without phenol red |
| HEPES Buffer Solution (1M) | Sigma Aldrich | 59205C | |
| Cover slides | Marienfeld | 107052 | |
| Glass bottom culture dishes | ibidi | 81158 | |
| Fluorescent Microspheres | Invitrogen | F8821 | used for calibration |
| Immersol immersion oil | Zeiss | 444960 | |
| Propidium iodide stain | Invitrogen | R37108 | |
| Small pipette tips | Eppendorf | 30075005 | |
| Flexible pipette tips | Eppendorf | 5242956003 | |
| Ethanol, 99.8% | Fisher Scientific | E/0650DF/15 | |
| Sodium hydroxide, pellets | Sigma Aldrich | 221465 | for preparing 0.2M NaOH solution |
Referências
- Hathout, Y. Approaches to the study of the cell secretome. Expert Review of Proteomics. 4 (2), 239-248 (2007).
- Pandey, A., Mann, M. Proteomics to study genes and genomes. Nature. 405 (6788), 837-846 (2000).
- Makridakis, M., Vlahou, A. Secretome proteomics for discovery of cancer biomarkers. Journal of Proteomics. 73 (12), 2291-2305 (2010).
- Bantscheff, M., Schirle, M., Sweetman, G., Rick, J., Kuster, B. Quantitative mass spectrometry in proteomics: a critical review. Analytical and Bioanalytical Chemistry. 389 (4), 1017-1031 (2007).
- MacBeath, G. Protein microarrays and proteomics. Nature Genetics. 32, 526-532 (2002).
- Seder, R. A., Darrah, P. A., Roederer, M. T-cell quality in memory and protection: implications for vaccine design. Nature Reviews Immunology. 8 (4), 247-258 (2008).
- Moerner, W. E., Fromm, D. P. Methods of single-molecule fluorescence spectroscopy and microscopy. Review of Scientific Instruments. 74 (8), 3597-3619 (2003).
- Borisov, S. M., Wolfbeis, O. S. Optical biosensors. Chemical Reviews. 108 (2), 423-461 (2008).
- Dantham, V. R., Holler, S., Barbre, C., Keng, D., Kolchenko, V., Arnold, S. Label-Free Detection of Single Protein Using a Nanoplasmonic-Photonic Hybrid Microcavity. Nano Letters. 13 (7), 3347-3351 (2013).
- Zijlstra, P., Paulo, P. M. R., Orrit, M. Optical detection of single non-absorbing molecules using the surface plasmon resonance of a gold nanorod. Nature Nanotechnology. 7 (6), 379-382 (2012).
- Rickgauer, J. P., Grigorieff, N., Denk, W. Single-protein detection in crowded molecular environments in cryo-EM images. eLife. 6, e25648 (2017).
- Lindfors, K., Kalkbrenner, T., Stoller, P., Sandoghdar, V. Detection and Spectroscopy of Gold Nanoparticles Using Supercontinuum White Light Confocal Microscopy. Physical Review Letters. 93 (3), 037401 (2004).
- Jacobsen, V., Stoller, P., Brunner, C., Vogel, V., Sandoghdar, V. Interferometric optical detection and tracking of very small gold nanoparticles at a water-glass interface. Optics Express. 14 (1), 405 (2006).
- Piliarik, M., Sandoghdar, V. Direct optical sensing of single unlabelled proteins and super-resolution imaging of their binding sites. Nature Communications. 5, 4495 (2014).
- Roux, K. H. Immunoglobulin Structure and Function as Revealed by Electron Microscopy. International Archives of Allergy and Immunology. 120 (2), 85-99 (1999).
- McDonald, M. P., et al. Visualizing Single-Cell Secretion Dynamics with Single-Protein Sensitivity. Nano Letters. 18 (1), 513-519 (2018).
- Kukura, P., Ewers, H., Müller, C., Renn, A., Helenius, A., Sandoghdar, V. High-speed nanoscopic tracking of the position and orientation of a single virus. Nature Methods. 6 (12), 923-927 (2009).
- Ortega Arroyo, J., Cole, D., Kukura, P. Interferometric scattering microscopy and its combination with single-molecule fluorescence imaging. Nature Protocols. 11 (4), 617-633 (2016).
- Spindler, S., et al. Visualization of lipids and proteins at high spatial and temporal resolution via interferometric scattering (iSCAT) microscopy. Journal of Physics D: Applied Physics. 49 (27), 274002 (2016).
- Lazarus, H., et al. Characterization of a unique cell line (LAZ 221) from human acute lymphocytic ("null" cell) leukemia. Cancer Research. 38 (5), 1362-1367 (1978).
- Mackensen, A., et al. Evidence for in situ amplification of cytotoxic T-lymphocytes with antitumor activity in a human regressive melanoma. Cancer Research. 53 (15), 3569-3573 (1993).
- Crowley, L. C., Scott, A. P., Marfell, B. J., Boughaba, J. A., Chojnowski, G., Waterhouse, N. J. Measuring cell death by propidium iodide uptake and flow cytometry. Cold Spring Harbor Protocols. 2016 (7), 647-651 (2016).
- Freshney, R. I. Primary Culture. Culture of Animal Cells. , (2005).
- Dahmardeh, M., et al. . Unpublished data. , (2018).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. American Journal of Pathology. 146 (1), 3-15 (1995).
- Bellve, K., Standley, C., Lifshitz, L., Fogarty, K. Design and Implementation of 3D Focus Stabilization for Fluorescence Microscopy. Biophysical Journal. 106 (2), 606a (2014).
- Liebel, M., Hugall, J. T., Van Hulst, N. F. Ultrasensitive Label-Free Nanosensing and High-Speed Tracking of Single Proteins. Nano Letters. 17 (2), 1277-1281 (2017).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados